Признаки дисбактериоза у грудничков на смешанном вскармливании: Дисбактериоз у детей — причины, симптомы, диагностика и лечение дисбактериоза кишечника у ребенка в Москве в детской клинике «СМ-Доктор»
Дисбактериоз у ребенка | Официальный сайт Huggies®
- Что такое дисбактериоз
- Дисбактериоз у детей: причины возникновения
- Дисбактериоз у ребенка: симптомы
- Лечение дисбактериоза у детей
- Немедикаментозное лечение дисбактериоза
Содержание:
Если у ребенка болит живот или плохо переваривается пища, врач часто ставит диагноз «дисбактериоз». Отечественные педиатры давно и успешно лечат детей от дисбактериоза, в то время как на западе такого слова не знают вовсе. Что же это за заболевание, как диагностировать и чем лечить дисбактериоз у ребенка?
Что такое дисбактериоз
Современные педиатры все чаще говорят, что дисбактериоз — это не болезнь, а состояние любых слизистых оболочек, при котором нарушен баланс микрофлоры. Чаще всего встречается дисбактериоз кишечника у детей — уменьшение полезной микрофлоры и размножение патогенных организмов.
Дисбактериоз у детей до года — очень распространенное явление.
Помимо полезных бактерий в кишечнике ребенка живут и условно-патогенные организмы (стафилококк, энтерококк и другие), которые в незначительном количестве не опасны, но размножаясь, могут вызывать признаки дисбактериоза у детей: тошноту, вздутие и боль в животе и так далее.
Дисбактериоз у детей: причины возникновения
Незрелость желудочно-кишечного тракта
Дисбактериоз у месячного ребенка чаще всего обусловлен несформированностью микрофлоры слизистых оболочек желудка и кишечника. Работа ЖКТ новорожденного еще только налаживается, и полезных бактерий для стабильной работы кишечника может не хватать.
Неправильное питание
Несоответствующее возрасту питание (частая смена смесей или слишком ранний ввод прикорма), а также употребление в пищу аллергенов (например, молочных продуктов при непереносимости лактозы) может способствовать развитию дисбактериоза.
Дисбактериоз после антибиотиков у ребенка
Если ребенок принимал антибиотики, естественная микрофлора его кишечника нарушается, так как антибиотики убивают любые бактерии, не разбирая, болезнетворные они или полезные.
Кишечные инфекции
Если функциональное нарушение пищеварения у грудного ребенка чаще всего вызвано незрелостью ЖКТ или погрешностями в питании, то дисбактериоз у ребенка 2 лет может быть следствием вирусной инфекции (ротавируса, дизентерии, сальмонеллеза), в результате которой в кишечник попали болезнетворные микробы.
Неблагоприятная экология
На состояние желудка и кишечника влияет и окружающая среда: загрязненный промышленными выхлопами воздух, химические отравления, недостаточно чистая питьевая вода могут спровоцировать развитие дисбактериоза.
Еще до обращения к врачу родители обычно понимают, что у ребенка дисбактериоз кишечника. Симптомы у детей проявляются довольно ярко и причиняют дискомфорт, особенно новорожденным и грудным малышам.
Дисбактериоз у ребенка: симптомы
Боли, чувство тяжести и вздутия в области живота, метеоризм;
расстройство стула: запоры или поносы;
остатки непереваренной пищи, слизь или крупинки в кале;
обильные срыгивания, отрыжка, а иногда и рвота;
шелушение и покраснение кожи, высыпания и опрелости, атопический дерматит;
выпадение волос, ломкость ногтей, кровоточивость десен;
неприятный запах изо рта;
белый или серый налет на языке;
темный налет на зубах;
плохой аппетит.
Многие заболевания ЖКТ имеют такие же симптомы, как симптомы дисбактериоза у детей. Лечение же должно быть различным, поэтому так важно правильно поставить диагноз.
Лечение дисбактериоза у детей
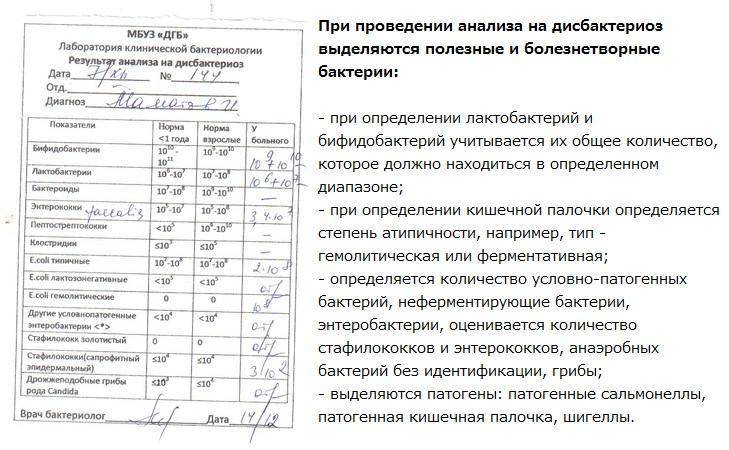
Для определения качественного и количественного состава микрофлоры кишечника необходимо сдать копрологический, биохимический и бактериологический анализ кала. В зависимости от того, какая условно-патогенная флора и в каких количествах будет обнаружена, врач-гастроэнтеролог подберет лечение.
В зависимости от того, какая условно-патогенная флора и в каких количествах будет обнаружена, врач-гастроэнтеролог подберет лечение.
Для борьбы с дисбактериозом применяются:
бактериофаги — препараты, уничтожающие бактерии-возбудители дисбактериоза;
пробиотики — препараты на основе живых микроорганизмов, позволяющие искусственно заселить кишечник полезной флорой;
пребиотики — неперевариваемые вещества (лактулоза, клетчатка), стимулирующие двигательную функцию кишечника;
пищеварительные ферменты — вещества, помогающие расщеплять и переваривать пищу.
При выборе препаратов учитывается и причина, вызвавшая дисбактериоз. Если виной расстройству кишечника — антибиотики, лечение будет одно, если аллергическая настроенность организма — другое.
Не выбирайте препараты для лечения микрофлоры кишечника самостоятельно. В аптеках их сейчас множество («Аципол», «Линекс», «Бифидумбактерин», «Бифиформ Малыш» и др. ) и фармацевт обязательно посоветует вам что-нибудь, но неправильно подобранный препарат и неверная дозировка могут еще больше нарушить микрофлору кишечника.
) и фармацевт обязательно посоветует вам что-нибудь, но неправильно подобранный препарат и неверная дозировка могут еще больше нарушить микрофлору кишечника.
Немедикаментозное лечение дисбактериоза
Заселяя кишечник ребенка полезной флорой, не забывайте и об основных принципах питания:
Сохраняйте грудное вскармливание
Дисбактериоз у грудных детей бывает реже, чем у детей на искусственном вскармливании, так как грудное молоко — источник полезных лактобактерий. Если сохранение или восстановление грудного вскармливания невозможно, применяйте лечебные смеси.
Придерживайтесь диеты
Если ребенок уже не питается грудным молоком, позаботьтесь о его диете: исключите из рациона сырые овощи, фрукты, белый хлеб, бобовые, молочные и другие продукты, повышающие газообразование. Основу рациона должны составлять крупы, нежирное мясо, кисломолочные продукты, из фруктов допускаются бананы и печеные яблоки.
Соблюдайте режим дня
При лечении дисбактериоза очень важно создать для ребенка спокойные и комфортные условия, исключить стрессы и уделить внимание здоровому сну, прогулкам, физической активности на свежем воздухе.
Сдать анализ на дисбактериоз у грудничка в СПб
Родители грудных детей часто встречаются с диагнозом «дисбактериоз кишечника». Что же означает диагноз «дисбактериоз», и какие анализы могут его выявить?
Дисбактериоз кишечника – это нарушение равновесного состояния кишечной микрофлоры. Считается, что при этом полезные бактерии, способствующие пищеварению, погибают, а патогенные (болезнетворные) размножаются. При этом дисбактериоз не является болезнью (этот диагноз отсутствует и в международных, и в отечественных классификациях болезней). Скорее, это состояние, которое может являться следствием некоторых заболеваний (энтериты, колиты), приема антибиотиков. У грудных детей с неустоявшейся кишечной микрофлорой симптомы дисбактериоза могут также возникать при смене питания, введения новых продуктов в рацион малыша или матери (при грудном вскармливании).
Как выявить дисбактериоз
Обычно для того, чтобы определить состояние кишечной микрофлоры, берут анализ на дисбактериоз у грудничка. Он делается не меньше недели и включает в себя копрограмму (анализ непереваренных остатков) и бактериальный посев, выявляющий патогенную и нормальную микрофлору. Также применяется ПЦР-диагностика, исследование продуктов обмена веществ бактерий и метод хромато-масс-спектрометрии. При этом все эти методы обладают погрешностью, ведь точно определить состав кишечной микрофлоры можно, только взяв пробу непосредственно из тонкого кишечника.
Он делается не меньше недели и включает в себя копрограмму (анализ непереваренных остатков) и бактериальный посев, выявляющий патогенную и нормальную микрофлору. Также применяется ПЦР-диагностика, исследование продуктов обмена веществ бактерий и метод хромато-масс-спектрометрии. При этом все эти методы обладают погрешностью, ведь точно определить состав кишечной микрофлоры можно, только взяв пробу непосредственно из тонкого кишечника.
Как правильно собрать биоматериал для анализа на дисбактериоз у детей
Для этого анализа необходимо собрать кал ребенка. Объем пробы не менее 10-15 мл, моча в кал попасть не должна. Кал должен быть свежим: его необходимо сдать в лабораторию в течение 2-3 часов после дефекации. При этом опорожнение кишечника должно быть естественным, его нельзя стимулировать специальными средствами.
- сдавать анализ на дисбактериоз у детей через 2-3 недели после отмены антибиотиков, а также пробиотиков и пребиотиков;
- после отмены других лекарственных препаратов должна пройти 1 неделя;
- несколько дней перед сбором кала не вводить в рацион ребенка новых продуктов, если ребенок на искусственном вскармливании – не менять смесь.

- не применять ректальные препараты.
При соблюдении этих правил анализ на дисбактериоз у грудничка будет наиболее информативным.
Что покажет анализ на дисбактериоз у детей
Исследование кала покажет соотношение разных штаммов бактерий нормальной микрофлоры кишечника, а также наличие патогенных бактерий (сальмонеллы, грибы рода Кандида, клостридии и др.). При выявлении этих микроорганизмов нужно будет начать лечение.
Если в результате анализа кала на дисбактериоз у детей будет выявлено нарушение баланса кишечной микрофлоры, задача врача – избрать правильную тактику для устранения симптомов этого состояния. Обычно лечение начинается с устранения причины дисбактериоза, далее назначается симптоматическая терапия.
В сети клиник «Медицентр» Вы можете сдать анализ на дисбактериоз у своего ребенка, результат вы получите в течение нескольких дней.
Наши клиники в Санкт-Петербурге
Медицентр Юго-ЗападПр.
 Маршала Жукова 28к2
Маршала Жукова 28к2Кировский район
- Автово
- Проспект Ветеранов
- Ленинский проспект
Получить подробную информацию и записаться на прием Вы можете по телефону +7 (812) 640-55-25
Диагностика и коррекция дисбактериоза у детей | Мухина Ю.Г.
Значение микробиоценоза кишечника
Наиболее сложным биотопом микробиоценоза является кишечная кооперация, представленная различными популяциями микроорганизмов. Микробиоценоз кишечника — очень важная система организма, выполняющая или регулирующая многочисленные его функции по поддержанию гомеостаза.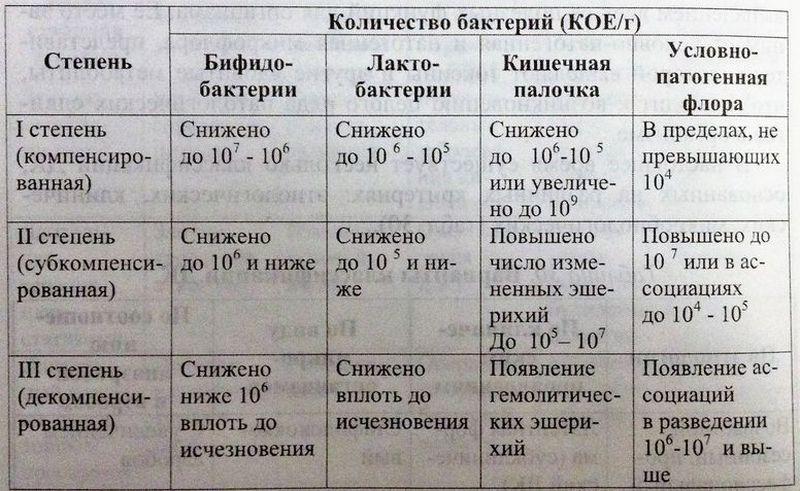
| ФУНКЦИИ НОРМАЛЬНОЙ МИКРОФЛОРЫ КИШЕЧНИКА:
o обеспечение колонизационной резистентности |
Одной из важнейших функций нормальной микрофлоры является обеспечение колонизационной резистентности, которая предотвращает заселение организма посторонними микробами. При снижении колонизационной резистентности происходит увеличение числа и спектра патогенных бактерий, возникает возможность развития инфекционного процесса. Интересно, что колонизационная способность микроорганизмов, (в частности, лактобактерий) строго специфична в отношении конкретного индивидуума. Исследования на добровольцах показывают, что аутомикроорганизмы обеспечивают очень быстрое восстановление нормального состояния микрофлоры кишечника.

Слизистая кишечника покрыта биопленкой, внутри которой устойчивость бактерий к неблагоприятным воздействиям обеспечивают клеточный муцин и бактериальный полисахарид, заключающие матрикс микроколонии бактерий и простейших. Неиммобилизованные бактерии имеют устойчивость во много раз ниже, чем при колонизационной резистентности.
| У детей, находившихся на искусственном вскармливании, аутофлора кишечника чаще вызывает эндогенные инфекционные процессы |
Хорошо известна иммуномодулирующая функция микрофлоры кишечника. Становление иммунного ответа формируется в первые часы неонатального периода под влиянием микрофлоры. При отсутствии микроорганизмов происходит уменьшение глубины крипт слизистой кишки, снижение высоты ворсин, истончение собственной пластины, уменьшение пейеровых бляшек. При их участии выделяются лизоцим и другие адъювантно-активные соединения, которые стимулируют иммунную систему организма.

Микроорганизмами осуществляются физиологические, биохимические процессы в желудочно-кишечном тракте (ЖКТ) по перевариванию и всасыванию пищи. Метаболизм белков, углеводов, жиров, продукция витаминов, гормонов, ряда биологических аминов поддерживают функциональные возможности всего организма и, в частности, ЖКТ. Моторная функция кишечника регулируется также микробной флорой, которая осуществляется через ряд механизмов: образование и ингибирование субстанций типа брадикинина; продукция простагландинов бактериального происхождения; изменение метаболизма желчных кислот с образованием метаболитов, ускоряющих моторику. Образующиеся в процессе жизнедеятельности микроорганизмов амины — гистамин, брадикинин — регулируют сфинктерную деятельность ЖКТ.
| Разнообразные неблагоприятные воздействия вызывают изменения иммунного ответа и поэтому могут влиять на качественные и количественные характеристики нормальной флоры кишечника |
Детоксикационная деятельность кишечной микробной флоры осуществляет защиту от ксенобиотиков: пестицидов, аминов, солей тяжелых металлов, многих лекарственных средств, нитратов и пр.
 Известен ряд бактерий, имеющих высокую активность нитратредуктазы (пропионибактерии, пептококки, вейлонеллы, грамотрицательные энтеробактерии и другие), которые предотвращают развитие метгемоглобинемии при высоком содержании нитратов. Особенно это важно у детей раннего детского возраста, имеющих высокую долю фетального гемоглобина.
Известен ряд бактерий, имеющих высокую активность нитратредуктазы (пропионибактерии, пептококки, вейлонеллы, грамотрицательные энтеробактерии и другие), которые предотвращают развитие метгемоглобинемии при высоком содержании нитратов. Особенно это важно у детей раннего детского возраста, имеющих высокую долю фетального гемоглобина.Метаболические детоксикационные процессы протекают с участием преимущественно реакций гидролиза и восстановления, с биотрансформацией, приводящей к образованию нетоксических продуктов и ускорению элиминации.
Формирование микробиоценоза у детей
Становление микробного биоценоза ребенка начинается с первых этапов жизни. Во время родов при заглатывании происходит поступление микрофлоры родовых путей матери и колонизация вагинальной флоры в пищеварительной системе ребенка. В настоящее время отработаны рекомендации по коррекции вагинальной флоры беременной женщины в последнем триместре беременности с помощью бактерийного препарата желемик, представляющего собой лиофилизированные живые лактобактерии, выделенные из влагалища здоровых женщин. Колонизация кишечника ребенка микрофлорой матери обеспечивает предупреждение развития дисбактериозов у новорожденного.
Колонизация кишечника ребенка микрофлорой матери обеспечивает предупреждение развития дисбактериозов у новорожденного.
| Приизмене ияхмикрофлор кишечни анеобхо им коррекцияпита иясучетоммотори и,секре орныхизме ений,фермент ойактивности пищева ительного трактаидоп л ительн мвведениемвитаминн -минераль ы комплексов |
После рождения происходит колонизация кишечника микробами матери, а также персонала и окружающей среды, которые в основном представлены аэробами и факультативно — анаэробами. Если ребенок прикладывается к груди в сроки от 12 до 24 ч после рождения, то бифидофлора выявляется лишь у половины детей, более позднее прикладывание детей дает заселение бифидобактериями только у каждого 3-4-го ребенка. Начиная с 4-го дня жизни, в толстой кишке новорожденного определяются лактобактерии, эшерихии, стрептококки, стафилококки.
 Отмечено, что кишечная палочка и стрептококки создают условия для появления и колонизации облигатных анаэробов. К концу первой недели жизни возрастает титр лактобактерий, эшерихий, бифидобактерий, появляются бактероиды, клостридии, анаэробные кокки.
Отмечено, что кишечная палочка и стрептококки создают условия для появления и колонизации облигатных анаэробов. К концу первой недели жизни возрастает титр лактобактерий, эшерихий, бифидобактерий, появляются бактероиды, клостридии, анаэробные кокки.Флора ребенка первого года жизни находится в прямой зависимости от характера вскармливания. Дети, получающие естественное вскармливание, имеют виды бифидумбактерий: B. bifidum и B. breve, а на искусственном — биовар в B. longum. После одного года жизни доминирующими становятся B. breve, B. adolscentis, B. longum, B. infantis. У взрослых чаще присутствует B.bifidum серовар а, B. adolscentis, B. longum. Лактобактерии определяют в более высоком титре при искусственном вскармливании. Клостридии превышают уровень 106 КОЕ/г исследуемого материала при использовании искусственных смесей. Нередко можно обнаружить у этих детей C. dificile и C. perfringens, способных вырабатывать энтеротоксины. Повышение уровня клостридий может происходить у более старших детей при использовании несбалансированной диеты со значительным увеличением содержания мясных продуктов.
dificile и C. perfringens, способных вырабатывать энтеротоксины. Повышение уровня клостридий может происходить у более старших детей при использовании несбалансированной диеты со значительным увеличением содержания мясных продуктов.
Просмотреть [ _Т а б л и ц у_ ]
У детей, получающих искусственное вскармливание, чаще и в более высоких титрах появляются бактероиды и вейлонеллы. При избыточном количестве последних может отмечаться повышенное газообразование, развитие диспепсических проявлений. В зависимости от характера питания находится и факультативно-анаэробная флора. Пациенты, находящиеся на искусственном вскармливании чаще заболевают энтеритами, которые обусловлены эндогенными эшерихиями, или кишечными палочками с измененными свойствами (лактозонегативные и гемолизинпродуцирующие). Другие бактерии: клебсиеллы, протеи, морганеллы, энтеробактер, цитробактер, серрации являются условно-патогенными; при снижении резистентности организма они могут приобретать патогенные свойства, вызывать воспалительный процесс и диарею.
Непатогенные стафилококки (S. epidermidis) колонизируют кишечник детей с первых дней жизни. Иногда присутствуют в небольших концентрациях стафилококки с патогенными свойствами. Однако возможно развитие инфекционного процесса при передаче от носителей к ребенку нозокомиальных штаммов. Эти штаммы отличаются устойчивостью к антибактериальным препаратам и могут вызывать тяжелые воспалительные поражения кишечника и даже септический процесс.
| Результат комплексного лечения зависит от эффективности терапевтической тактики основного заболевания, адекватности выбора комплекса препаратов с учетом микробиологических изменений и особенностей организма ребенка |
Роль стрептококков в формировании оптимального уровня колонизационной резистентности достаточно велика. При естественном вскармливании уровень стрептококков сохраняется постоянным, а при искусственном вскармливании может значительно превышать норму.
 Однако при сниженном количестве облигатной микрофлоры у детей усиленный рост энтерококков способствует формированию эндогенного инфекционного процесса.
Однако при сниженном количестве облигатной микрофлоры у детей усиленный рост энтерококков способствует формированию эндогенного инфекционного процесса.Таким образом, естественное вскармливание ребенка, начатое сразу после его рождения, формирует более благоприятную флору пищеварительного тракта, которая способна к колонизационной резистентности и обеспечивает адекватные процессы пищеварения. Искусственное вскармливание может являться одной из причин изменений микроэкологии ребенка с последующим участием эндогенной флоры в формировании инфекционных, аллергических, иммунопатологических процессов.
Микроорганизмы колонизируют просвет пищеварительного тракта, а также поверхность слизистых оболочек. В связи с этим разделяют мукозную микрофлору и полостную микрофлору. При ряде патологических состояний очень важно учитывать состав каждого пула. В настоящее время разрабатываются и внедряются методы раздельной оценки флоры пищеварительного тракта.
Клинические проявления дисбиоза появляются значительно позже, чем микробиологические изменения. Они очень неспецифичны, однако возможен ряд симптомов, которые формируются из-за нарушения процессов, происходящих при участии определенных бактерий.
Они очень неспецифичны, однако возможен ряд симптомов, которые формируются из-за нарушения процессов, происходящих при участии определенных бактерий.
Состав кишечной микрофлоры
Бифидобактерии — грамположительные палочки, строгие анаэробы — в толстой кишке детей составляют около 95% популяции бактерий. Являясь сахаролитическими микробами, выделяют большое количество кислых продуктов. Образующаяся молочная, уксусная кислоты способствуют усилению всасывания ионов кальция, железа, витамина D. Продукция ими лизоцима, бактериоцинов, спиртов и высокая антагонистическая активность по отношению к патогенным бактериям препятствуют проникновению микробов в верхние отделы ЖКТ и другие органы. Отмечена высокая способность у бифидобактерий к синтезу аминокислот, белков, многих витаминов группы В, которые затем всасываются в кишечнике. Поэтому при стойких, тяжелых нарушениях функций бифидобактерий может развиваться комплекс белково-витаминно-минеральной недостаточности. При снижении уровня бифидобактерий транслокация условно-патогенных микробов в верхние отделы кишечника может вызывать их избыточный рост с более тяжелыми проявлениями синдрома нарушенного всасывания.
Лактобактерии включают 44 вида, но основными являются L. acidophilus, L. casei, L. plantarum, L. fermentum. Подавление гнилостных и гноеродных микробов и антибактериальная активность лактобактерий связаны с выработкой молочной кислоты, спирта и лизоцима, продуктов с высокой антибиотической активностью, интерферонов, интерлейкина 1, ряда других. Исчезновение лактобактерий приводит к сдвигу реакции среды в щелочную сторону, резко снижая утилизацию кишечником биологически активных соединений. Интересен факт, что люди, использующие строгую вегетарианскую диету, имеют очень высокое содержание лактобактерий.
Доказана важная роль эубактерий, которые представляют собой анаэробные грамположительные неспорообразующие палочки, в трансформации холестерола в копростанол. В связи с этим положением требует внимания педиатров ряд работ зарубежных исследователей по использованию функционального питания, обогащенного соответствующими микроорганизмами для снижения уровня холестерола у пациентов. Однако следует помнить, что эубактерии могут участвовать в развитии воспаления ротовой полости, формировании гнойных процессов в плевре и легких и инфекционного эндокардита.
Однако следует помнить, что эубактерии могут участвовать в развитии воспаления ротовой полости, формировании гнойных процессов в плевре и легких и инфекционного эндокардита.
Клостридии также принимают участие в деконъюгации желчных кислот, многие поддерживают колонизационную резистентность, подавляют рост патогенных клостридий. Clostridium difficile и C. perfrigens способны вырабатывать энтеротоксины. Микробные пептидные токсины оказывают провоспалительный эффект, вызывают хемотаксис нейтрофилов, выделяют сериновые протеазы, окислители, формируют хроническое воспаление. При их участии происходит местная и системная сенсибилизация антигенами энтеральной системы, пищевая сенсибилизация. Так, развитие псевдомембранозного колита, обусловленного C. difficile (Рис. 1), связано с применением ряда антибиотиков, подавляющих нормальную микрофлору и резким снижением количества нетоксигенных клостридий.
Бактероиды являются еще недостаточно изученными представителями микрофлоры, известна их определенная роль в расщеплении желчных кислот. Среди них B. fragilis обладает рядом факторов, обусловливающих патогенность: способность секретировать лактамазу, энтеротоксин, гиалуронидазу, гепариназу, фибролизин, нейраминидазу. Имеются указания, что 10% случаев диарей вызываются энтеротоксигенными штаммами B. fragilis, особенно часто диарея, обусловленная бактероидами, наблюдается у детей дошкольного возраста.
Среди них B. fragilis обладает рядом факторов, обусловливающих патогенность: способность секретировать лактамазу, энтеротоксин, гиалуронидазу, гепариназу, фибролизин, нейраминидазу. Имеются указания, что 10% случаев диарей вызываются энтеротоксигенными штаммами B. fragilis, особенно часто диарея, обусловленная бактероидами, наблюдается у детей дошкольного возраста.
Целый ряд видов фузобактерий способны секретировать гемолизины, гемагглютинины и факторы агрегации тромбоцитов. Поэтому при тяжелых септицемиях, связанных с ростом фузобактерий, могут возникать тромбоэмболии, имеющие соответствующую клиническую характеристику.
Вейлонеллы способны к восстановлению нитратов. При избыточном размножении в кишечнике вейлонелл отмечается повышенное газообразование, могут возникать выраженные диспепсические расстройства.
Некоторые штаммы эшерихий продуцируют колицины, которые тормозят рост энтеропатогенных штаммов кишечной палочки. Эти свойства обусловлены в первую очередь механизмом синтеза секреторных иммуноглобулинов в кишечнике. Эшерихии принимают участие в синтезе витамина К, обеспечивая гемостатические процессы. Однако следует указать на способность формирования госпитальных штаммов эшерихий с множественной резистентностью к антибактериальным средствам, что является причиной развития госпитальной инфекции.
Эшерихии принимают участие в синтезе витамина К, обеспечивая гемостатические процессы. Однако следует указать на способность формирования госпитальных штаммов эшерихий с множественной резистентностью к антибактериальным средствам, что является причиной развития госпитальной инфекции.
Цитробактер, энтеробактер, протеи, клебсиеллы и другие при снижении иммунологической резистентности организма также могут приводить к изменению функции кишечника, формированию воспалительных процессов в различных органах в результате воздействия микробных пептидных токсинов.
Иммунная реактивность организма
Самые разнообразные неблагоприятные воздействия на ребенка: стрессы, физические и психоэмоциональные нагрузки, несбалансированное питание, экологическое неблагополучие и многие патологические состояния вызывают изменения иммунного ответа и поэтому могут влиять на качественные и количественные характеристики нормальной флоры кишечника. В случае развития дисбактериоза кишечника у больного ребенка могут выявляться клинические состояния, которые связаны со снижением колонизационной резистентности, расстройствами пищеварения и трофическими нарушениями, нарушением детоксицирующей функции кишечной микрофлоры и изменениями иммунного ответа.
Диагностика и оценка тяжести кишечного дисбактериоза
В зависимости от степени выраженности клинических проявлений и особенностей микробиологических изменений выделяют 3 степени дисбактериоза: компенсированная, субкомпенсированная и декомпенсированная. Однако в оценке степеней дисбактериоза нет единой точки зрения, так как часто используются разные клинико-лабораторные критерии. Клинические проявления дисбактериоза кишечника в значительной степени определяются локализацией изменений. Дисбактериоз тонкой кишки — синдром избыточного бактериального роста (обсеменения), чаще характеризуется диареей и формированием синдрома нарушенного кишечного всасывания с самыми разнообразными отклонениями в гомеостазе. Дисбактериоз толстой кишки может не иметь клинических проявлений. В ряде случаев описывают связь запоров с нарушениями микрофлоры. Может формироваться тяжелое заболевание — псевдомембранозный колит.
Лабораторная диагностика дисбактериоза чаще всего базируется на микробиологическом анализе фекалий.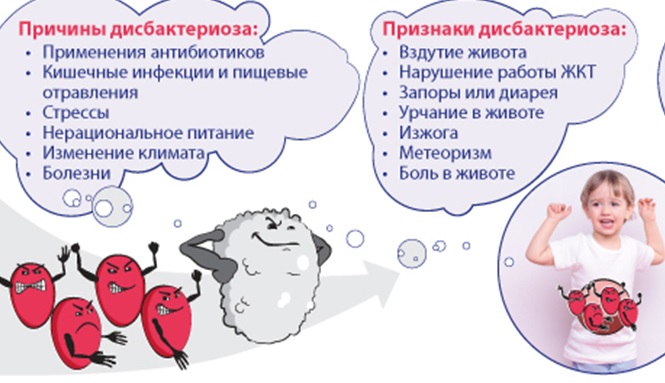 Микробиологическими критериями служат снижение бифидолактобактерий, снижение или увеличение эшерихий, появление штаммов с измененными свойствами, повышение количества кокков, обнаружение условно-патогенных грамотрицательных палочек, а также грибов и клостридий более 103 КОЕ/л. В анализах возможны различные сочетания указанных сдвигов.
Микробиологическими критериями служат снижение бифидолактобактерий, снижение или увеличение эшерихий, появление штаммов с измененными свойствами, повышение количества кокков, обнаружение условно-патогенных грамотрицательных палочек, а также грибов и клостридий более 103 КОЕ/л. В анализах возможны различные сочетания указанных сдвигов.
В настоящее время применяется также газожидкостная хроматография. Хроматографический метод позволяет оценить химические соединения, связанные с жизнедеятельностью нормальной микрофлоры.
Оценка копрологии выявляет бродильную и гнилостную диспепсию, нарушения расщепления и всасывания пищевых ингредиентов.
В ряде случаев целесообразно определение ЛПС-О-антигена, уровня энтеротоксинов.
Коррекция микрофлоры
Лечебные программы по восстановлению нарушенной микрофлоры должны строиться с учетом возможных факторов, приводящих к ее изменению. Имея в своем арсенале широкий спектр различных препаратов, для выбора конкретных лекарств врач должен проанализировать индивидуальные изменения в организме ребенка с учетом преморбидного фона, возраста, характера вскармливания, аллергических реакций, перенесенных кишечных инфекций, а также препаратов, используемых для терапии основного заболевания.
Питание
Адекватное, соответствующее возрасту ребенка, сбалансированное питание при нормальном функционировании органов и систем предотвращает развитие дисбиозов. При изменениях микрофлоры необходима коррекция питания с учетом моторики, секреторных изменений ЖКТ, ферментативной активности пищеварительного тракта и дополнительным введением витаминно-минеральных комплексов. В настоящее время широкое распространение получает так называемое функциональное питание. При функциональном питании употребляются готовые пищевые продукты, в которые добавляют биопрепараты, антиоксиданты, каротиноиды, ферменты и другие субстраты. Для детей раннего возраста широко применяются адаптированные смеси, обогащенные представителями микрофлоры, — (Малютка), (Биолакт адаптированный), (Бифидок), (Бифилин), (Бифидолакт), (Бифилайф), (Виталакт) и ряд других. Во многих случаях оправдывает себя применение сухой смеси (Лактофидус), содержащий бифидобактерии и стрептококки, (НАН) с бифидобактериями. Для выхаживания детей в неонатальном периоде разработано функциональное питание в виде лиофилизированного грудного молока, обогащенного Bifidobacterium bifidum.
Для выхаживания детей в неонатальном периоде разработано функциональное питание в виде лиофилизированного грудного молока, обогащенного Bifidobacterium bifidum.
Большое значение для коррекции микрофлоры кишечника имеют пищевые волокна. Они являются естественными энтеросорбентами и влияют на состав микробоценоза. Микробная флора использует пищевые волокна в качестве субстрата для жизнедеятельности, однако следует помнить, что продукты их метаболизма могут оказывать как физиологическое, так и токсическое действие.
Пищевые волокна (пектины, лигнины, целлюлоза, гемицеллюлоза) содержатся в большом количестве в отрубях, морской капусте, яблоках, моркови, красной рябине и других овощах и фруктах; поступая в толстую кишку, они подвергаются воздействию глюкозидаз. Глюкоза является субстратом для многих анаэробных бактерий. Велика роль и других образующихся метаболитов, среди них молочная кислота, другие короткоцепочечные монокарбоновые кислоты, которые ингибируют патогенную флору и являются субстратом для восстановления кишечного эпителия. Пропионовая кислота регулирует микроциркуляцию толстой кишки через сосудистые сфинктеры, бутират участвует в пролиферации и дифференцировке эпителия кишечника. Пищевые волокна существенно снижают уровень эндогенного гистамина и других биологических аминов, которые реализуют аллергические проявления при болезнях пищеварительной системы. Хорошо зарекомендовали себя препараты лактулозы. Для лечения дисбиозов широко используется нормазе. Препарат высоко эффективен при наличии запоров и аллергического компонента.
Пропионовая кислота регулирует микроциркуляцию толстой кишки через сосудистые сфинктеры, бутират участвует в пролиферации и дифференцировке эпителия кишечника. Пищевые волокна существенно снижают уровень эндогенного гистамина и других биологических аминов, которые реализуют аллергические проявления при болезнях пищеварительной системы. Хорошо зарекомендовали себя препараты лактулозы. Для лечения дисбиозов широко используется нормазе. Препарат высоко эффективен при наличии запоров и аллергического компонента.
Ферментные препараты
Для улучшения расщепления и всасывания пищевых ингредиентов могут использоваться ферментные препараты на основе панкреатина, а в сложных случаях — микротаблетированные ферменты, которые могут предотвращать гнилостные процессы. В последнее время с хорошим эффектом применяются комбинированные препараты вобензим, флагензим. Они особенно эффективны в комплексной терапии дисбиозов кишечника, сопровождающихся нарушениями кишечного всасывания и аллергическими проявлениями у детей.
Энтеросорбенты
Применение энтеросорбентов особенно важно в условиях возрастания полирезистентности микробов к антибактериальным средствам. Сорбенты обладают высокой сорбирующей активностью по отношению к экзо- и эндотоксинам, метаболитам бактерий, желчным кислотам, а также самим бактериям и вирусам. Применяются сорбенты на основе гранулированных активированных углей: карболен, микросорб П, активированный уголь СКН, энтеросорбент СКН, карболонг и ряд других. Энтеросорбент смекта, представляющий собой микропластины диоктаэдра кремния и алюминия также нашел свое применение в педиатрической практике. Этот препарат способствует улучшению свойств слизи ЖКТ, повышению резистентности слизистой оболочки , имеет цитопротективное действие. С хорошим терапевтическим эффектом применяются новые сорбенты — СУМС1 и альгисорб (альгинат кальция), они быстро выводят различные метаболиты, нормализуют показатели микрофлоры. СУМС1 представляет собой углеродоминеральный сорбент в виде гранул и порошка. Альгисорб изготавливается из морских водорослей — ламинарий, не влияет на обмен кальция, калия, железа, микроэлементов, поэтому может применяться в течении длительного времени. Он хорошо восстанавливает многие адаптационные механизмы.
СУМС1 представляет собой углеродоминеральный сорбент в виде гранул и порошка. Альгисорб изготавливается из морских водорослей — ламинарий, не влияет на обмен кальция, калия, железа, микроэлементов, поэтому может применяться в течении длительного времени. Он хорошо восстанавливает многие адаптационные механизмы.
Бактерийные препараты
Широкое распространение получили бактерийные препараты на основе живых микроорганизмов, представителей нормальной микрофлоры — пробиотики (см. таблицу). В настоящее время появилось новое понятие — биотерапевтические агенты (БТА), представляющие собой препараты микроорганизмов, на основе штаммов лактобифидобактерий. Бифидумбактерин, лактобактерин, кисломолочный бифидумбактерин относятся к категории БТА. Для этих препаратов характерна способность выживать в кислой среде, эффективно прикрепляться к эпителиоцитам, осуществлять колонизацию слизистой, продуцировать антимикробные субстанции, стимулировать иммунную систему, предупреждать избыточный рост и размножение патогенных микроорганизмов, восстанавливать нормальную микрофлору.
В ряде препаратов имеется сочетание микроорганизмов: бификол (бифидо-колибактерии), бифиформ (бифидум-энтерококк), бифоцит (бифидум-лактобактерии), линекс (три штамма лактобактерий), кисломолочный бифилакт. Имеются также комплексные препараты: бифидумбактерин-форте (с косточковым сорбентом), бифилиз (с лизоцимом), нутролин В (с витаминами группы В), кипацид (с иммуноглобулином). В настоящее время появляются рекомбинантные препараты (субалин).
Имеются разные точки зрения на применение бактерийных препаратов, содержащих аэробные спорообразующие бактерии — бактисубтил, споробактерин и др. Существуют указания, что искусственное введение в кишечник этих бактерий в больших количествах и излишнее размножение бацилл в нехарактерной для них экологической нише, сопровождающееся распространением бацилл за пределы кишечника, на фоне снижения количества облигатной флоры может увеличивать степень дисбиотических нарушений, ухудшать состояние пациента. B. cereus синтезируют гемолизины, способные разрушать эритроциты. Препарат споробактерин содержит бациллы, продуцирующие протеолитические ферменты, фибринолизины. Штаммы, содержащиеся в споробактерине, из-за высокой протеолитической активности проникают через слизистую оболочку в кровь, лимфу, достигают лимфатических узлов, селезенки, печени. По сути эти штаммы обладают свойствами, характерными для патогенных микроорганизмов. Можно согласиться с мнением ряда авторов, что широкое применение указанных препаратов мало обосновано и должны быть строгие показания для их использования.
B. cereus синтезируют гемолизины, способные разрушать эритроциты. Препарат споробактерин содержит бациллы, продуцирующие протеолитические ферменты, фибринолизины. Штаммы, содержащиеся в споробактерине, из-за высокой протеолитической активности проникают через слизистую оболочку в кровь, лимфу, достигают лимфатических узлов, селезенки, печени. По сути эти штаммы обладают свойствами, характерными для патогенных микроорганизмов. Можно согласиться с мнением ряда авторов, что широкое применение указанных препаратов мало обосновано и должны быть строгие показания для их использования.
В настоящее время при неэффективности коммерческих бактерийных препаратов в силу слабой их приживляемости в кишечнике больного могут использоваться аутоштаммы бифидо- и лактобактерий. Они могут длительно сохранять свою активность в лиофилизированном состоянии или в холодильнике при температуре -20оС. Особенно рекомендуется коррекция микрофлоры с помощью аутоштаммов у больных, требующих применения цитостатиков, глюкокортикоидов, антибиотиков, лучевой терапии.
Отработано применение донорских штаммов бифидо- и лактобактерий матери для ребенка через 2 ч после кесарева сечения с целью предотвращения патологической колонизации кишечника и формирования нормальной микрофлоры.
Также используются препараты пробиотики, состоящие из пищевых добавок, селективно стимулирующих рост нормальной флоры. Достаточно широко используются лизоцим, лактулоза, хилак-форте.
В случаях дисбактериоза 2-3-й степени необходимо назначать средства, обладающие селективной антибактериальной активностью. Различные фаги часто бывают эффективны в лечении дисбактериозов. В настоящее время используют стафилококковый, клебсиеллезный, пиобактериофаг, интестибактериофаг, синегнойный и другие фаги.
В некоторых случаях, при низкой чувствительности к фагам могут использоваться антибактериальные препараты: фуразолидон, хлорофилипт, метронидазол, нифуроксазид, интетрикс, а также антибиотики и группа антигрибковые средства, среди последних следует указать кетоконазол, флюконазол, натамицин.
Комплексная терапия может включать иммуномодулирующие средства, в том числе витамины, стабилизаторы клеточных мембран, микроэлементы.
Результат лечения зависит от эффективности терапии основного заболевания, адекватности выбора комплекса препаратов с учетом не только микробиологических изменений, но и особенностей организма ребенка.
Литература
1. Бабушкин Н.В. Применение препарата (Хилак-форте) в комплексном лечении дисбактериоза кишечника. Рос. журн. гастроэнтерол., гепатол., колопроктол. 1997; 5: 96-7.
2. Запруднов А.М., Мазанкова Л.Н. Микробная флора кишечника и пробиотики. М. 1999.
3. Куваева И.Б., Ладодо К.С. Микроэкологические и иммунные нарушения у детей. М. 1991.
4. Коровина Н.А., Вихерева В.Н., Захарова И.Н. и др. Профилактика и коррекция нарушений микробиоциноза кишечника у детей раннего возраста. М. 1996.
5. Коршунов В.М., Смеянов В.В., Ефимов Б.А. Рациональные подходы к проблеме коррекции микрофлоры кишечника. Вестн. РАМН. 1996; 2: 60-5.
Коршунов В.М., Смеянов В.В., Ефимов Б.А. Рациональные подходы к проблеме коррекции микрофлоры кишечника. Вестн. РАМН. 1996; 2: 60-5.
6. Коршунов В.М., Володин Н.Н., Ефимов Б.А. и др. Микроэкология желудочно-кишечного тракта. Коррекция микрофлоры при дисбактериозах кишечника. М. 1999.
8. Парфенов А.И. Микробная флора кишечника и дисбактериоз. Рус. мед. журн. 1998; 6 (18): 1170-3.
9. Шендеров Б.А., Манвелова М.А. Функциональное питание и пробиотики: микроэкологические аспекты. М. 1997.
10. Щеплягина Л.А., Римарчук Г.В., Борисова О.И. и др. Организация медицинского наблюдения за детьми в районах экологического неблагополучия. (Лекция). М. 1998; 25-35.
.
Дисбактериоз влагалища — цены на лечение, симптомы и диагностика дисбактериоза влагалища в «СМ-Клиника»
Лечением данного заболевания занимается ГинекологНужна дополнительная информация?
Спасибо за обращение.
Ваша заявка принята. Наш специалист свяжется с Вами в ближайшее время
Уважаемый пациент, по всем заявкам, оставленным с 22.00 до 07.00 мы с Вами свяжемся до 12.00 следующего дня. Если ваш вопрос срочный, пожалуйста, позвоните в наш круглосуточный контактный центр
(495) 777-48-49
Нужна дополнительная информация?
Не нашли ответ на свой вопрос?
Оставьте заявку и наши специалистыпроконсультируют Вас. Спасибо за обращение.
Ваша заявка принята. Наш специалист свяжется с Вами в ближайшее время
Уважаемый пациент, по всем заявкам, оставленным с 22.00 до 07.00 мы с Вами свяжемся до 12.00 следующего дня. Если ваш вопрос срочный, пожалуйста, позвоните в наш круглосуточный контактный центр
(495) 777-48-49
Спасибо за обращение.
Ваша заявка принята.
Наш специалист свяжется с Вами в ближайшее время
 Этим заболеванием в той или иной степени страдает большая часть женщин. Чаще всего проявления его незначительны, но иногда дисбиоз влагалища приводит к очень серьезным проблемам.
Этим заболеванием в той или иной степени страдает большая часть женщин. Чаще всего проявления его незначительны, но иногда дисбиоз влагалища приводит к очень серьезным проблемам. Вагинальный дисбиоз, или дисбактериоз влагалища — это наиболее точный термин, он как раз и переводится как нарушение микрофлоры влагалища.Частными случаями дисбоза влагалища являются бактериальный вагиноз (гарднереллеза) и кандидоз («молочница»). В первом случае нарушение микрофлоры влагалища связано с чрезмерным размножением бактерии гарднерелла (Gardnerella vaginalis), во втором с преобладанием грибов рода Кандида. Однако традиционно женщины, да и многие врачи называют «молочницей» любые выделения из влагалища, толком не разобравшись в их природе.
В норме во влагалище у женщины обитает так называемая нормальная микрофлора. Она состоит примерно на 90% из лактобактерий (так называемых палочек Дедерляйна), чуть меньше чем на 10% — из бифидобактерий, и меньше 1% составляют так называемые «ключевые клетки влагалища». К ним относятся гарднерелла, мобилункус, грибы рода кандида, лептотрикс и некоторые другие бактерии.Нормальная микрофлора находится в постоянном равновесии между собой и с окружающей средой. Она не допускает появление никакой другой инфекции, и не допускает изменение соотношения возбудителей, живущих во влагалище в норме.
К ним относятся гарднерелла, мобилункус, грибы рода кандида, лептотрикс и некоторые другие бактерии.Нормальная микрофлора находится в постоянном равновесии между собой и с окружающей средой. Она не допускает появление никакой другой инфекции, и не допускает изменение соотношения возбудителей, живущих во влагалище в норме.
При нарушении микрофлоры изменяется равновесие между бактериями-нормальными обитателями влагалища. При этом снижается количество лакто- и бифидобактерий и увеличивается количество какого-то другого возбудителя. Этим другим возбудителем может быть одна из ключевых клеток (тогда развиваются гарднереллез, кандидоз и т.д.), может быть одна из половых инфекций (трихомониаз, хламидиоз), или же может быть любой сапрофитный возбудитель (кишечная палочка, протей, стрептококки, стафилококки и т.д.).
Если у Вас наблюдаются подобные симптомы, советуем записаться на прием к врачу. Своевременная консультация предупредит негативные последствия для вашего здоровья. Телефон для записи +7 (495) 292-39-72
Телефон для записи +7 (495) 292-39-72
Симптомы
дисбактериоза влагалищаПри развитии дисбиоза появляются выделения из влагалища беловато-желтоватой окраски с неприятным запахом. Больше никакими симптомами дисбактериоз влагалища сам по себе не проявляется, все остальные симптомы (зуд, нарушения мочеиспускания, боли) связаны уже с его осложнениями.
Причины нарушения микрофлоры влагалищаПричин дисбиоза влагалища существует великое множество. Едва ли не любое воздействие на организм женщины может привести к нарушению микрофлоры. Перечислим лишь некоторые факторы.
- переохлаждение организма. Как однократное сильное переохлаждение, так и постоянное замерзание. Все это ведет к снижению общего и местного иммунитета, что сказывается и на вагинальной микрофлоре.
- изменения и нарушения гормонального фона. Сюда можно отнести нерегулярную половую жизнь, беременность, роды, аборты, любые виды нарушений цикла, половое созревание, предклимакс и климакс и т.
 д.
д. - смена климатической зоны. Случаются обострения дисбиоза влагалища во время поездок в теплые страны.
- стрессы, как однократный сильный стресс, так и хроническая стрессовая ситуация.
- беспорядочная половая жизнь, большое количество половых партнеров, пренебрежение средствами контрацепции.
- любые инфекционно-воспалительные заболевания органов малого таза.
- инфекции передающиеся половым путем.
- лечение антибиотиками, особенно продолжительное или многократное.
- заболевания кишечника, хронические проблемы со стулом, дисбактериоз кишечника. Микрофлора влагалища очень тесно связана с микрофлорой кишечника.
- неправильное использование тампонов при месячных. Тампоны следует менять строго каждые 2 часа и днем, и ночью. Это достаточно неудобно, но иначе во влагалище создаются хорошие условия для роста инфекции.
 Иммунная система поддерживает нормальную микрофлору, и помогает ей восстанавливаться в случае незначительного нарушения. Однако всех этих факторов так много, встречаются они так часто, что в большинстве случаев дисбактериоз влагалища у женщины все-таки развивается. Нахождение во влагалище большого количества патогенных бактерий рано или поздно вызовет воспаление стенки влагалища и воспаление шейки матки — тех органов, с которыми они находятся в постоянном контакте. Это проявляется резким увеличением количества выделений из влагалища, появлением неприятных ощущений в половых органах (зуд, резь, жжение, боль) и болей во время полового акта. Одним из первых симптомов воспаления нередко становится отсутствие достаточного количества смазки во время полового акта.
Иммунная система поддерживает нормальную микрофлору, и помогает ей восстанавливаться в случае незначительного нарушения. Однако всех этих факторов так много, встречаются они так часто, что в большинстве случаев дисбактериоз влагалища у женщины все-таки развивается. Нахождение во влагалище большого количества патогенных бактерий рано или поздно вызовет воспаление стенки влагалища и воспаление шейки матки — тех органов, с которыми они находятся в постоянном контакте. Это проявляется резким увеличением количества выделений из влагалища, появлением неприятных ощущений в половых органах (зуд, резь, жжение, боль) и болей во время полового акта. Одним из первых симптомов воспаления нередко становится отсутствие достаточного количества смазки во время полового акта.
Кроме того, бактерии из влагалища постоянно инфицируют матку, что может привести к развитию эндометрита, и придатки матки, с перспективой развития аднексита. Также при дисбиозе влагалища идет постоянное инфицирование мочеиспускательного канала и мочевого пузыря, что может привести к появлению симптомов уретрита и цистита.
Диагностика
дисбактериоза влагалища
В «СМ-Клиника» проводится полноценная диагностика нарушений микрофлоры влагалища, которая помимо обычного осмотра, включает в себя лабораторные анализы:
- общий мазок на флору,
- ПЦР-диагностика половых инфекций,
- посев выделений из влагалища,
- специальное исследование микрофлоры влагалища.
Мазок дает общее представление о состоянии микрофлоры влагалища и позволяет выявить степень нарушения и выраженности воспалительного процесса. Диагностика половых инфекций и посев позволяют выяснить, за счет каких именно возбудителей произошло нарушение микрофлоры, а также определить чувствительность бактерий к антибиотикам. Без этих анализов никогда нельзя начинать антибактериальную терапию.
Лечение
дисбактериоза влагалища В «СМ-Клиника» применяется комплексный подход к лечению дисбактериоза влагалища, включающий в себя несколько этапов:- устранение или подавление бактерий, находящихся во влагалище.

- население нормальной микрофлоры влагалища.
- восстановление иммунитета стенки влагалища с тем, чтобы она снова взяла под свой контроль вагинальную микрофлору.
Подавление нарушенной микрофлоры
Если дисбиоз влагалища связан с половой инфекцией, то задачей лечения является полное устранение возбудителя заболевания, передающегося половым путем (ЗППП) из организма женщины. В этом случае лечение обязательно включает в себя курс антибактериальной терапии, одновременно или после которой проводятся все прочие мероприятия.Если речь о половых инфекциях не идет, то прием антибиотиков не является обязательным компонентом лечения. Как правило, в этом случае используется или очень короткий курс антибактериальной терапии (3-5 дней), либо лечения антибиотиками вовсе не проводится.
Значительно эффективнее бывает применение местных процедур. Они позволяют сочетать в себе одновременно все задачи лечения — и подавление патогенной флоры, и население нормальных обитателей влагалища, и местную иммунокоррекцию. Применение антисептиков при местных процедурах значительно более эффективно, нежели использование антибиотиков. Спектр действия антисептиков шире, а резистентности (невосприимчивости) к ним у бактерий практически никогда не возникает.
Применение антисептиков при местных процедурах значительно более эффективно, нежели использование антибиотиков. Спектр действия антисептиков шире, а резистентности (невосприимчивости) к ним у бактерий практически никогда не возникает.
Население нормальной микрофлоры влагалища
Это самая главная часть лечения. Все остальные мероприятия проводятся лишь для того, чтобы создать условия для приживления и роста нормальной флоры. Население нормальной микрофлоры влагалища проводится большей частью во второй стадии курса, когда обитавший во влагалище возбудитель максимально подавлен. Для этого применяются массивные дозы эубиотиков (препаратов, содержащие живые бактерии) как общего, так и местного действия.
Применение для восстановления микрофлоры влагалища одних лишь эубиотиков неоправданно и как правило бесполезно. Пока во влагалище женщины живет в большом количестве, скажем, кишечная палочка, женщина может съесть килограмм лактобактерий, но ни одна из них не приживется во влагалище. Обязательно нужно сначала подавить ту бактерию (или бактерии), которые вызвали заболевание, а лишь потом населять нормальную микрофлору влагалища.
Обязательно нужно сначала подавить ту бактерию (или бактерии), которые вызвали заболевание, а лишь потом населять нормальную микрофлору влагалища.
Восстановление иммунитета стенки влагалища
Иммунная система вагинальной стенки контролирует микрофлору влагалища, не позволяя расти другим бактериям. Нарушение микрофлоры влагалища всегда связано со снижением иммунитета его стенки. Поэтому местная иммунокоррекция обязательно должна являться частью лечения, иначе все прочие мероприятия окажутся неэффективными.
В простых случаях для иммунокоррекции можно ограничиться применением местных иммуномодуляторов. При запущенных формах заболевания восстановление иммунитета требует более серьезных мероприятий, а иногда в очень сложных ситуациях курс иммуномодулирующей терапии следует проводить перед всем остальным лечением.
Как правило лечение дисбиоза влагалища занимает 3 недели. Перед этим пациентка тщательно обследуется, при необходимости обследуется и ее половой партнер. После лечения проводится контрольный осмотр и делаются контрольные анализы. Если никаких симптомов болезни не обнаруживается, то лечение можно считать оконченным и в дальнейшем лишь заниматься профилактикой дисбиоза влагалища.
После лечения проводится контрольный осмотр и делаются контрольные анализы. Если никаких симптомов болезни не обнаруживается, то лечение можно считать оконченным и в дальнейшем лишь заниматься профилактикой дисбиоза влагалища.
Профилактика нарушения микрофлоры влагалища Всем пациенткам, прошедшим курс восстановления микрофлоры влагалища, желательнопосещать клинику каждые 3 месяца в течение 1 года после лечения. Во время этих посещений женщина рассказывает о своем состоянии, проводится осмотр, при необходимости берутся анализы. Это позволяет оценить состояние микрофлоры влагалища, проследить изменения по сравнению с моментом окончания лечения.
Если обнаруживается тенденция к нарушению микрофлоры, то проводится небольшой профилактический курс лечения. Восстановить микрофлору влагалища на начальных этапах ее нарушения достаточно просто.
Если в течение первого года после лечения никаких проблем не отмечается, дальнейшие наблюдения проводятся реже, раз в полгода-год. Такая схема позволяет оценить и проконтролировать тенденции к рецидиву заболевания и не допустить его развития вновь.
Такая схема позволяет оценить и проконтролировать тенденции к рецидиву заболевания и не допустить его развития вновь. Наши преимущества:
Более 22 ведущих гинекологов
Все специалисты
в одной клинике
Передовое медицинское оборудование
Гарантия качества обслуживания
Хотите, мы Вам перезвоним?
Спасибо за обращение.Ваша заявка принята. Наш специалист свяжется с Вами в ближайшее время
Уважаемый пациент, по всем заявкам, оставленным с 22.00 до 07.00 мы с Вами свяжемся до 12.00 следующего дня. Если ваш вопрос срочный, пожалуйста, позвоните в наш круглосуточный контактный центр
(495) 777-48-49
ФОРМИРОВАНИЕ МИКРОБИОЦЕНОЗА КИШЕЧНИКА У ДЕТЕЙ, НАХОДЯЩИХСЯ НА ЕСТЕСТВЕННОМ И ИСКУССТВЕННОМ ВСКАРМЛИВАНИИ | Захарова
1. Куваева И.Б. Обмен веществ организма и кишечная флора. М.: Медицина. 1976. 248 с.
Куваева И.Б. Обмен веществ организма и кишечная флора. М.: Медицина. 1976. 248 с.
2. Коровина Н.А., Вихирева З.Н., Захарова И.Н. и др. Профилактика и лечение дисбактериоза кишечника у детей раннего возраста. М. 1995.
3. Polonovsky M., Lespagnol A. Nouvelles acquisitions surles composes glucidiques du lait de femme. Bull. Soc. Chim. Biol. 1933; 15: 320–349.
4. Mountzouris K., McCartney A., Gibson G. Intestinal microflora of human infants and current trends for its nutritional modulation. Br. J. Nutr. 2002; 87: 405–420.
5. Morrow A., Ruiz–Palacios G., Altaye M. et al. Human milk oligosaccharides are associated with protection against diarrhea in breastfed infants. J. Pediatr. 2004; 145: 297–303.
2004; 145: 297–303.
6. Jiang X., Huang P., Zhong W. et al. Human milk contains elements that block binding of noroviruses to human histo–blood group antigensin saliva. J. Infect. Dis. 2004; 190: 1850–1859.
7. Crane J., Azar S., Stam A., Newborg D. Oligosaccharides from human milk block binding and activity of the Escherichia coli heatstable enterotoxin (STa) in T84 intestinal cells. J. Nutr. 1994; 124: 2358–2364.
8. Украинцев С.Е., Нетребенко О.К. Роль пищевых волокон и пребиотиков в обеспечении комфортного пищеварения. Nestle News. Бюллетень. 2007; 23.
9. Martin R., Olivares M., Marin M. et al. Probiotic potential of 3 lactobacilli strains isolated from breast milk. J. Hum. Lact. 2005; 21: 8–17.
Lact. 2005; 21: 8–17.
10. Gronlund M., Gueimonde M., Laitinen K. et al. Maternal breast-milk and intestinal bifidobacteria guide the compositional development of the Bifidobacterium microbiota in infants at risk of allergic disease. Clin. Exp. Allergy. 2007; 37 (12): 1764–1772.
11. Куваева И. Б., Ладодо К. С. Микроэкологические и иммунные нарушения у детей. М.: Медицина. 1991. 240 с.
12. Moro G., Arslanoglu S., Stahl B. et al. A mixture of prebiotic oligosaccharides reduces the incidence of atopic dermatitis during the first six months of age. Arch. Dis. Child. 200; 91 (10): 814–819.
13. Bruzzese E., Volpicelli M., Squeglia V. et al. A formula containing galacto– and fructo–oligosaccharides prevents intestinal and extraintestinal infections: an observational study. Clin. Nutr. 2009; 28 (2): 156–161.
Clin. Nutr. 2009; 28 (2): 156–161.
14. Salminen S., Benno Y., de Vos W. Intestinal colonisation, microbiota and future probiotics? Asia Pac. J. Clin. Nutr. 2006; 15 (4): 558–562.
15. Chouraqui J., Grathwohl D., Labaune J. et al. Assessment of the safety, tolerance, and protective effect against diarrhea of infant formulas containing mixtures of probiotics or probiotics and prebiotics in a randomized controlled trial. Am. J. Clin. Nutr. 2008; 87 (5): 1365–1373.
16. Bullen C., Willis A. Resistance of the breast-fed infant to gastroenteritis. Br. Med. J. 1971; 3: 338–343.
17. Benno Y., Sawada K., Mitsooka T. The intestinal microflora of infants; composition of fecal flora in breast fed and bottlefed infants. Microbiol. Immunol. 1984; 28: 975–986.
Microbiol. Immunol. 1984; 28: 975–986.
18. Fukushima Y., Kawata Y., Hara H. et al. Effect of a probiotic formula on intestinal immunoglobulin A production in healthy children. Int. J. Food Microbiol. 1998; 42: 39–44.
О чём расскажет стул грудничка?
Молодые родители с интересом и трепетом разглядывают содержимое детского подгузника… знакомая картина? Стул часто вызывает беспокойство у мамы и действительно способен рассказать о здоровье и нездоровье малыша – нужно лишь уметь «читать между строк», то есть понимать знаки организма.
Познакомимся с нормой
Пока малыш живет и развивается в материнской утробе, в его кишечнике накапливается меконий. Он представляет собой однородную дегтеобразную массу темно-оливкового, почти черного цвета, практически без запаха. В его состав входят слущенные клетки слизистой кишечника, проглоченные малышом околоплодные воды и пр. В норме меконий начинает выделяться из кишечника крохи уже после рождения и потому называется еще первородным калом (иногда меконий выделяется внутриутробно: при неблагоприятном течении родов или в самом конце беременности кислородное голодание плода является причиной преждевременного опорожнения кишечника, в этом случае меконий попадает в околоплодные воды и окрашивает их в зеленый цвет). Стул малыша представлен меконием обычно в первые двое-трое суток, то есть до того момента, пока у мамы не прибудет большого количества молока. Иногда случается так, что после отхождения основной массы мекония, скажем, в течение первых суток, до пребывания у мамы молока стула у крохи вообще может не быть. Это связано с тем, что молозиво, которым питается малютка в первые несколько суток, усваивается организмом практически полностью, так что в кишечнике не остается шлаков – стало быть, выделяться наружу попросту нечему.
В норме меконий начинает выделяться из кишечника крохи уже после рождения и потому называется еще первородным калом (иногда меконий выделяется внутриутробно: при неблагоприятном течении родов или в самом конце беременности кислородное голодание плода является причиной преждевременного опорожнения кишечника, в этом случае меконий попадает в околоплодные воды и окрашивает их в зеленый цвет). Стул малыша представлен меконием обычно в первые двое-трое суток, то есть до того момента, пока у мамы не прибудет большого количества молока. Иногда случается так, что после отхождения основной массы мекония, скажем, в течение первых суток, до пребывания у мамы молока стула у крохи вообще может не быть. Это связано с тем, что молозиво, которым питается малютка в первые несколько суток, усваивается организмом практически полностью, так что в кишечнике не остается шлаков – стало быть, выделяться наружу попросту нечему.
После установления у мамы активной лактации стул малыша постепенно становится зрелым, как правило, проходя через стадию переходного. Переходным называют стул, который сочетаете себе черты первородного кала и зрелого стула, он имеет кашицеобразную консистенцию, желто-зеленый цвет и кислый запах. Зрелый стул отличается чистым желтым цветом, однородной кашицеобразной консистенцией (ее часто сравнивают с негустой сметаной), запахом кислого молока. Частота его тем выше, чем моложе ребенок: в первые недели после рождения опорожнение кишечника может происходить практически после каждого кормления, то есть за сутки достигать 5-8, а иногда и ю раз. Постепенно стул урежается примерно до 1-3 раз в сутки, однако существует редкий вариант нормы, когда материнское молоко настолько полно усваивается организмом малыша, что в его кишечнике почти не накапливается непереваренного остатка. В этом случае опорожнение кишечника может происходить 1 раз в несколько дней, иногда даже раз в неделю. Это связано с тем, что только достаточное наполнение толстого кишечника отходами (непереваренными остатками пищи) является сигналом к сокращениям стенок кишки, приводящим к опорожнению.
Переходным называют стул, который сочетаете себе черты первородного кала и зрелого стула, он имеет кашицеобразную консистенцию, желто-зеленый цвет и кислый запах. Зрелый стул отличается чистым желтым цветом, однородной кашицеобразной консистенцией (ее часто сравнивают с негустой сметаной), запахом кислого молока. Частота его тем выше, чем моложе ребенок: в первые недели после рождения опорожнение кишечника может происходить практически после каждого кормления, то есть за сутки достигать 5-8, а иногда и ю раз. Постепенно стул урежается примерно до 1-3 раз в сутки, однако существует редкий вариант нормы, когда материнское молоко настолько полно усваивается организмом малыша, что в его кишечнике почти не накапливается непереваренного остатка. В этом случае опорожнение кишечника может происходить 1 раз в несколько дней, иногда даже раз в неделю. Это связано с тем, что только достаточное наполнение толстого кишечника отходами (непереваренными остатками пищи) является сигналом к сокращениям стенок кишки, приводящим к опорожнению. Именно поэтому кишечник должен сначала «накопить» остатки, чтобы потом выбросить их наружу. Как правило, такая особенность усвоения материнского молока становится очевидной у малышей не ранее 1,5-3 месяцев. Оговоримся: частоту стула 1 раз в несколько дней можно считать нормой только при соблюдении трех условий: при полностью естественном вскармливании (то есть малютка не получает ничего, кроме материнского молока), возрасте не менее 1,5 месяцев и отсутствии любых признаков нездоровья – болей и вздутия в животе, дискомфорта и трудности при опорожнении кишечника, -то есть когда кроха хорошо кушает, правильно набирает в весе и его ничего не беспокоит.
Именно поэтому кишечник должен сначала «накопить» остатки, чтобы потом выбросить их наружу. Как правило, такая особенность усвоения материнского молока становится очевидной у малышей не ранее 1,5-3 месяцев. Оговоримся: частоту стула 1 раз в несколько дней можно считать нормой только при соблюдении трех условий: при полностью естественном вскармливании (то есть малютка не получает ничего, кроме материнского молока), возрасте не менее 1,5 месяцев и отсутствии любых признаков нездоровья – болей и вздутия в животе, дискомфорта и трудности при опорожнении кишечника, -то есть когда кроха хорошо кушает, правильно набирает в весе и его ничего не беспокоит.
Стул при искусственном или смешанном вскармливании может ничем не отличаться от нормального зрелого стула при грудном вскармливании или же иметь более «взрослый», гнилостный запах, более густую консистенцию и более темный, коричневатый цвет. Опорожнение кишечника при смешанном или искусственном вскармливании должно происходить не менее 1 раза в сутки, все прочее считается запором.
Теперь, когда мы познакомились с «идеальным» протеканием процесса, необходимо познакомиться и с возможными отклонениями от такового.
Зелень в стуле
Нередко бывает, что «правильный» вид стула долго не устанавливается, и кал даже на фоне активной лактации у матери долго сохраняет черты переходного, то есть имеет явный зеленоватый оттенок, иногда в нем также обнаруживается слизь. Причин для этого можно выделить несколько:
Недоедание (так называемый «голодный» стул). Часто это происходит из-за недостатка молока у матери. Факторами, усложняющими для малютки «добывание» молока из груди, могут также стать плоские и втянутые соски, тугая грудь, особенно после первых родов.
Преобладание в рационе кормящей женщины фруктов и овощей в сравнении с другими продуктами, а также употребление мамой продуктов, содержащих синтетические добавки: колбасных изделий, копченостей, всех видов консервов, соков промышленного производства, молочных продуктов с фруктовыми и другими ароматическими наполнителями.

Воспаление слизистой кишечника у малыша. Весьма частой причиной этого является перенесенная во время беременности и /или родов гипоксия (кислородное голодание) плода. Это патологическое состояние затрагивает многие ткани в организме, в том числе и слизистую кишечника, которая потом довольно долго восстанавливается. Кроме того, воспаление слизистой кишечника может быть вызвано влиянием синтетических веществ – ароматизаторов, красителей и консервантов и любых искусственных соединений, присутствующих в рационе мамы, проникающих в грудное молоко и оказывающих влияние непосредственно на слизистую кишечника. Наконец, весьма распространенной причиной кишечного воспаления является нарушение нормальной микрофлоры кишечника – другими словами, кишечный дисбактериоз (или дисбиоз), когда представителей нормальной микрофлоры становится мало, они частично заменяются на так называемые условно-патогенные микробы, то есть возбудители, которые при неблагоприятных условиях могут вызвать воспаление в кишечнике.
 В этом случае слизистая страдает в результате влияния болезнетворных микроорганизмов и продуктов их жизнедеятельности. Риск развития дисбактериоза значительно возрастает, если маме и /или малышу назначались антибактериальные препараты.
В этом случае слизистая страдает в результате влияния болезнетворных микроорганизмов и продуктов их жизнедеятельности. Риск развития дисбактериоза значительно возрастает, если маме и /или малышу назначались антибактериальные препараты.
Что делать? При наличии зелени в стуле следует в первую очередь исключить недоедание малыша. Разумеется, помимо нарушений стула при этом будут отмечаться и другие симптомы: малыш может проявлять недовольство у груди, если молоко плохо выделяется из соска, он не засыпает после кормления и /или никогда не выдерживает более 1-1,5 часов между кормлениями, у него снижена скорость набора веса и роста. При выраженном недоедании у ребенка может уменьшиться количество мочеиспусканий (в норме оно составляет не менее 6-8 за сутки), моча может быть более концентрированной (в норме она почти бесцветна и имеет лишь незначительный запах). Далее следует поступать по ситуации: при недостаточной лактации – переходить на кормления «по требованию», или «по первому крику», чаще прикладывать кроху к груди, позволять ему находиться у груди столько, сколько он захочет, давать обе груди за одно кормление, обязательно кормить грудью в течение ночи, принимать препараты, стимулирующие лактацию. Если же причина недоедания кроется в неправильной форме сосков, возможно, стоит применять во время кормления специальные накладки на соски. В любом случае при подозрении на недостаточное питание крохи лучше обратиться к педиатру, а также к консультанту по грудному вскармливанию.
Если же причина недоедания кроется в неправильной форме сосков, возможно, стоит применять во время кормления специальные накладки на соски. В любом случае при подозрении на недостаточное питание крохи лучше обратиться к педиатру, а также к консультанту по грудному вскармливанию.
Далее следует тщательно проверить мамин рацион. Безоговорочному исключению подлежат все продукты, содержащие в своем составе синтетические добавки. Не следует забывать, что зачастую причиной кишечного воспаления у грудничка могут стать и синтетические витаминные препараты, принимаемые матерью (в том числе для беременных и кормящих), поэтому необходимо исключить и их прием. Также следует позаботиться о том, чтобы количество фруктов и овощей в рационе не преобладало над остальными продуктами (эти «дары земли» содержат в своем составе большое количество кислот, избыток которых в грудном молоке может вызывать воспаление слизистой в кишечнике малютки).
Теперь, когда мы создали все возможные предпосылки для правильного питания крохи, стоит руководствоваться его самочувствием. Если малыш хорошо набирает в росте и весе, его не беспокоят боли в животе и аллергические реакции, он в целом здоров и весел, интересуется окружающим миром соответственно возрасту, тогда на единственный симптом -зеленую окраску стула – можно не обращать внимания: скорее всего, он будет отражать последствия гипоксии или наличие кишечного дисбактериоза у малыша. В человеческом организме, особенно недавно появившемся на свет, все идет по своим законам и с индивидуальной скоростью. Заселение кишечника «правильными» микробами – процесс не одного дня и даже не одной недели, поэтому даже у совершенно здоровых детей переходный стул может сохраняться до месяца и даже больше. Если это не мешает малышу нормально развиваться, можно не вмешиваться в этот процесс. Все равно еще не создано препарата от дисбактериоза лучше, чем материнское молоко. Единственное, что не мешает сделать при затянувшихся признаках дисбактериоза, – сдать материнское молоко на посев, чтобы удостовериться, что оно не содержит болезнетворных микробов (при обнаружении таковых обязательно определяют их чувствительность к антибактериальным препаратам, затем проводится лечение матери наиболее эффективными для данного случая антибиотиками – на этот период грудное вскармливание, как правило, прекращают).
Если малыш хорошо набирает в росте и весе, его не беспокоят боли в животе и аллергические реакции, он в целом здоров и весел, интересуется окружающим миром соответственно возрасту, тогда на единственный симптом -зеленую окраску стула – можно не обращать внимания: скорее всего, он будет отражать последствия гипоксии или наличие кишечного дисбактериоза у малыша. В человеческом организме, особенно недавно появившемся на свет, все идет по своим законам и с индивидуальной скоростью. Заселение кишечника «правильными» микробами – процесс не одного дня и даже не одной недели, поэтому даже у совершенно здоровых детей переходный стул может сохраняться до месяца и даже больше. Если это не мешает малышу нормально развиваться, можно не вмешиваться в этот процесс. Все равно еще не создано препарата от дисбактериоза лучше, чем материнское молоко. Единственное, что не мешает сделать при затянувшихся признаках дисбактериоза, – сдать материнское молоко на посев, чтобы удостовериться, что оно не содержит болезнетворных микробов (при обнаружении таковых обязательно определяют их чувствительность к антибактериальным препаратам, затем проводится лечение матери наиболее эффективными для данного случая антибиотиками – на этот период грудное вскармливание, как правило, прекращают).
Если же в самочувствии малыша не все благополучно (например, его мучают кишечные колики, или отмечаются кожные аллергические реакции, или же он недостаточно набирает в весе и росте), то следует сдать некоторые анализы – копрограмму и анализ кала на флору (или, как говорят, на дисбактериоз). Копрограмма покажет, как идут процессы переваривания в кишечнике, и может подтвердить наличие воспаления слизистой (о нем будут свидетельствовать повышение числа лейкоцитов в кале, резко кислая реакция, наличие скрытой крови). В анализе на флору основное внимание нужно обращать на наличие и /или количество патогенных микроорганизмов – тех, которые в норме не должны встречаться в кишечнике или количество которых не должно превышать определенные пределы. Число «дружественных» микробов может оказаться совершенно непоказательным, если кал подвергся анализу позже двух часов после сбора. Поскольку именно так и бывает в подавляющем большинстве случаев, то на количество нормальных микробов в данном анализе можно не обращать особого внимания. Обнаружение патогенных (болезнетворных) микробов (при условии, что мамино молоко было подвергнуто анализу, а мама при необходимости пролечена) служит поводом для назначения малышу специальных препаратов. Как правило, лечение проводят фагами – особыми вирусами, уничтожающими определенный вид патогенных микробов и не влияющими на флору в целом. В некоторых случаях могут быть назначены антибактериальные препараты с учетом чувствительности к ним болезнетворных бактерий. Завершают лечение препаратами, способствующими восстановлению нормальной микрофлоры.
Обнаружение патогенных (болезнетворных) микробов (при условии, что мамино молоко было подвергнуто анализу, а мама при необходимости пролечена) служит поводом для назначения малышу специальных препаратов. Как правило, лечение проводят фагами – особыми вирусами, уничтожающими определенный вид патогенных микробов и не влияющими на флору в целом. В некоторых случаях могут быть назначены антибактериальные препараты с учетом чувствительности к ним болезнетворных бактерий. Завершают лечение препаратами, способствующими восстановлению нормальной микрофлоры.
Белые комочки в стуле Иногда в кале малютки можно увидеть белые комочки, словно кто-то подмешал туда крупенистого творога. Если этот симптом отмечается на фоне нормального физического развития ребенка (тот хорошо набирает в весе и растет), то он является свидетельством некоторого переедания: в организм поступает больше питательных веществ, чем нужно ему для удовлетворения реальных потребностей (когда грудь предлагают не только для удовлетворения голода, но и любого успокоения). В этом нет ровным счетом ничего плохого, так как организм младенца отлично приспособлен к подобному «перебору»: он попросту выбрасывает лишнее в виде таких вот непереваренных белых комочков. В настоящее время, когда взят курс на кормление «по первому крику», большинство здоровых детей хотя бы время от времени имеют такую особенность стула. Если же этому симптому сопутствует недобор в весе или в росте, особенно если это отставание усугубляется, скорее всего, имеет место ферментативная недостаточность пищеварительных желез, не позволяющая правильно переваривать поступающие питательные вещества. В этом случае педиатр или гастроэнтеролог может назначить заместительную терапию ферментными препаратами.
В этом нет ровным счетом ничего плохого, так как организм младенца отлично приспособлен к подобному «перебору»: он попросту выбрасывает лишнее в виде таких вот непереваренных белых комочков. В настоящее время, когда взят курс на кормление «по первому крику», большинство здоровых детей хотя бы время от времени имеют такую особенность стула. Если же этому симптому сопутствует недобор в весе или в росте, особенно если это отставание усугубляется, скорее всего, имеет место ферментативная недостаточность пищеварительных желез, не позволяющая правильно переваривать поступающие питательные вещества. В этом случае педиатр или гастроэнтеролог может назначить заместительную терапию ферментными препаратами.
Лактазная недостаточность
Довольно часто родители могут столкнуться с тем, что стул малыша разжижен, водянистый, иногда пенится, имеет более резкий кислый запах, а в некоторых случаях и измененный цвет – горчичный или зеленоватый. На хлопчатобумажной пеленке такой кал оставляет вокруг себя зону обводнения. Нередко стул выделяется небольшими порциями даже при отхождении газов. Кислая реакция кала часто становится причиной упорных опрелостей. Такая картина наблюдается при нарушении переваривания лактозы – молочного сахара, когда по какой-то причине количество лактозы, поступающей в кишечник с маминым молоком, превышает количество фермента лактазы, необходимого для ее переваривания. Это может быть либо при избытке лактозы в молоке (наследственная предрасположенность матери, избыток свежего молока и молочных продуктов в ее рационе), либо при сниженной выработке лактазы пищеварительными железами крохи. Непереваренные углеводы «стягивают» большое количество воды в просвет кишечника, вот почему кал имеет разжиженный водянистый характер.
Нередко стул выделяется небольшими порциями даже при отхождении газов. Кислая реакция кала часто становится причиной упорных опрелостей. Такая картина наблюдается при нарушении переваривания лактозы – молочного сахара, когда по какой-то причине количество лактозы, поступающей в кишечник с маминым молоком, превышает количество фермента лактазы, необходимого для ее переваривания. Это может быть либо при избытке лактозы в молоке (наследственная предрасположенность матери, избыток свежего молока и молочных продуктов в ее рационе), либо при сниженной выработке лактазы пищеварительными железами крохи. Непереваренные углеводы «стягивают» большое количество воды в просвет кишечника, вот почему кал имеет разжиженный водянистый характер.
Нередко лактазная недостаточность сопровождается кишечным дисбактериозом: кислая реакция кишечного содержимого мешает заселению кишечника правильной флорой, а отсутствие необходимого количества полезных микроорганизмов, в свою очередь, снижает способность к перевариванию углеводов. Если это не мешает развитию малыша (как мы уже говорили, его признаками являются нормальная прибавка в росте и весе, отсутствие кишечных колик и упорных опрелостей), данное состояние вполне можно оставить без лечения. В подавляющем большинстве случаев лактазная недостаточность является преходящей проблемой и бесследно исчезает с возрастом (примерно к 9-12 месяцам активность пищеварительных желез возрастает настолько, что организм малыша без труда начинает справляться не только с кисломолочными продуктами, но и со свежим молоком). Тяжелые и пожизненные нарушения выработки лактазы практически всегда обусловлены генетически: о таком варианте наследственного заболевания следует задуматься, если ближайшие родственники в семье страдают лактазной недостаточностью во взрослом возрасте.
Если это не мешает развитию малыша (как мы уже говорили, его признаками являются нормальная прибавка в росте и весе, отсутствие кишечных колик и упорных опрелостей), данное состояние вполне можно оставить без лечения. В подавляющем большинстве случаев лактазная недостаточность является преходящей проблемой и бесследно исчезает с возрастом (примерно к 9-12 месяцам активность пищеварительных желез возрастает настолько, что организм малыша без труда начинает справляться не только с кисломолочными продуктами, но и со свежим молоком). Тяжелые и пожизненные нарушения выработки лактазы практически всегда обусловлены генетически: о таком варианте наследственного заболевания следует задуматься, если ближайшие родственники в семье страдают лактазной недостаточностью во взрослом возрасте.
Для подтверждения диагноза, помимо копроло-гического исследования, проводится анализ кала на углеводы. При подтвержденной лактазной недостаточности маме в первую очередь следует отрегулировать свой рацион: исключить свежее молоко, при неэффективности этого шага – значительно уменьшить количество кисломолочных продуктов (исключением является сыр, в котором практически отсутствует молочный сахар). Если все названные меры не имеют успеха, врач может назначить заместительную терапию лактазой.
Если все названные меры не имеют успеха, врач может назначить заместительную терапию лактазой.
Запоры
Запором считается отсутствие самостоятельного стула более суток (разумеется, кроме случаев полного усвоения молока), а также случаи, когда опорожнение кишечника затруднено и сопровождается значительным дискомфортом.
При грудном вскармливании запоры встречаются достаточно редко, и основных причин у них две: неправильное питание матери и нарушения кишечной моторики, в том числе спазм анального сфинктера.
Неправильное питание матери выражается склонностью к продуктам, богатым белками и легко перевариваемыми углеводами, недостатком в рационе пищевых волокон. Поэтому при проявлениях запора у малыша маме следует в первую очередь нормализовать свое питание: отдавать предпочтение крупам (особенно гречке, неочищенному рису, овсянке), цельнозерновому хлебу, включить в рацион отварные овощи. Некоторые продукты (персики, абрикосы, чернослив, курага, инжир, отварная свекла, свежий кефир) обладают выраженными послабляющими свойствами. Во многих случаях они позволят нормализовать не только собственный стул, но и стул малютки.
Во многих случаях они позволят нормализовать не только собственный стул, но и стул малютки.
Если подобные меры ни к чему не приводят, скорее всего, имеет место нарушение кишечной моторики (гипотония или, напротив, спазм) и /или спазм сфинктера заднего прохода. При спазме сфинктера отхождение газов из кишечника также затруднено, поэтому запору часто сопутствуют выраженные кишечные колики. К сожалению, с этими состояниями практически невозможно бороться домашними способами, так как они связаны с нарушением нервной регуляции тонуса гладких мышц и являются последствиями родовой травмы или неблагоприятного течения беременности. Если им сопутствуют другие симптомы, заставляющие вас обратиться к неврологу (возбудимость или, наоборот, заторможенность крохи, нарушения сна, метеозависимость, нарушения мышечного тонуса и др.), то лечение, назначенное им по поводу неблагополучия центральной нервной системы, часто помогает улучшить и ситуацию с запором. Если при отсутствии стула малыша беспокоят боли и /или вздутие в животе, можно попробовать поставить газоотводную трубочку, что позволит мягко простимулировать анус. При искусственном вскармливании запоры, к сожалению, встречаются намного чаще, так как переваривание молочных смесей представляет собою большую трудность для пищеварительной системы младенца. Во многих случаях нормализовать ситуацию позволяет замена половины суточного рациона малыша кисломолочной смесью (постепенно вводить кислые смеси можно после 3 недель жизни). После 4-6 месяцев жизни можно ввести в рацион малыша отвар и пюре из чернослива, которые помогают справиться с запором в большинстве случаев.
При искусственном вскармливании запоры, к сожалению, встречаются намного чаще, так как переваривание молочных смесей представляет собою большую трудность для пищеварительной системы младенца. Во многих случаях нормализовать ситуацию позволяет замена половины суточного рациона малыша кисломолочной смесью (постепенно вводить кислые смеси можно после 3 недель жизни). После 4-6 месяцев жизни можно ввести в рацион малыша отвар и пюре из чернослива, которые помогают справиться с запором в большинстве случаев.
Дисбактериоз у грудного ребенка или гадание по содержимому подгузников
Наталия Гербеда-Вильсон
Лидер Ла Лече Лиги
Август 2008г.
Очень часто родители грудничков в России сталкиваются с необходимостью сдать анализы на дисбактериоз, а потом и лечить его. Ситуация обычно развивается по следующему сценарию: у ребенка наблюдается жидкий по сравнению с детьми на искусственных заменителях грудного молока и взрослыми стул, или зеленоватый стул, или пенистый стул, и врач рекомендует сдать анализы на дисбактериоз.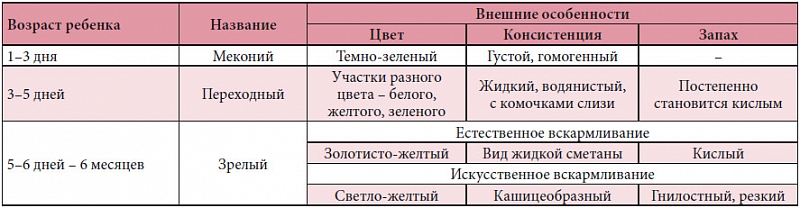 Назначенное лечение, как правило, включает в себя прием препаратов, содержащих полезные бактерии-пробиотики и дрожжи. В худшем случае, грешат на грудное молоко и рекомендуют перевести ребенка на иные виды вскармливания.
Назначенное лечение, как правило, включает в себя прием препаратов, содержащих полезные бактерии-пробиотики и дрожжи. В худшем случае, грешат на грудное молоко и рекомендуют перевести ребенка на иные виды вскармливания.
Что же такое дисбактериоз? Бывает ли он у грудных детей? Что делать, если ребенку ставят такой диагноз? Нужно ли волноваться? (Прим. автора. Тут я немного забегу вперед, чтобы успокоить всех мам. Дисбактериоз у грудных детей – неслыханная вещь!) Давайте шаг за шагом разберемся с вопросом, который поглощает умы всех мам во всех уголках планеты – содержимое подгузников ребенка и что это значит.
Содержимое кишечника и подгузников здорового грудничка
В период внутриутробного развития желудочно-кишечный тракт (ЖКТ) плода стерилен. Там нет никаких бактерий и других микроорганизмов. Когда ребенок рождается, ЖКТ заселяется, или колонизируется, бактериями, которые попадают ему в рот во время прохождения через родовые пути матери. Бактерии могут также попасть ребенку из материнского стула во время родов. Именно так создается нормальная и здоровая микрофлора кишечника. После рождения ЖКТ ребенка заселяется бактериями, которые находятся в окружающей среде, во рту и на коже матери. Это происходит во время кормления грудью, при поцелуях и прикосновениях к ребенку.
Именно так создается нормальная и здоровая микрофлора кишечника. После рождения ЖКТ ребенка заселяется бактериями, которые находятся в окружающей среде, во рту и на коже матери. Это происходит во время кормления грудью, при поцелуях и прикосновениях к ребенку.
В грудном молоке содержится бифидус-фактор, вещество, которое способствует росту бифидобактерий. Неудивительно, что бифидобактерии составляют 95-99% флоры кишечника детей на грудном вскармливании. Бифидобактерии, которые иногда называют еще пробиотиками, являются частью здоровой флоры кишечника. Да-да, это те самые пробиотики, которые обычно прописывают как лечение от дисбактериоза. Эти добрые «рыцари» способствуют пищеварению, нормальной работе иммунной системы, а также не дают разростаться потенциально патогенным бактериям, которые приводят к заболеваниям. Бифидобактерии преобладают в кишечнике у грудного ребенка до тех пор, пока грудное молоко составляет бо́льшую часть питания ребенка. Помимо этого, в кишечнике грудничка в небольших количествах могут обитать стрептококки, бактероиды, клостридии, микрококки, энтерококки и кишечная палочка (E. Coli). Все эти микроорганизмы являются нормальной флорой пищеварительного тракта ребенка на грудном вскармливании.
Coli). Все эти микроорганизмы являются нормальной флорой пищеварительного тракта ребенка на грудном вскармливании.
Сразу же после рождения ребенок начинает сосать грудь и получает молозиво, которое обладает слабительным эффектом. Это помогает быстро избавиться от первого стула новорожденного – мекония. Меконий – черный, липкий, похожий на смолу стул, без запаха. При частых прикладываниях в первые сутки, меконий выходит за первые 48 часов.
По мере прихода молока, стул новорожденного меняется с темного на более светлый. Переходный стул обычно зеленоватого цвета и жиже, чем меконий. К пятому дню жизни ребенка его стул становится желтым, похожим на горчицу или густой гороховый суп, часто зернистым, с вкраплениями, похожими на кусочки творога. Цвет стула грудного ребенка может варьироваться от желтого до желто-зеленого или желто-коричневого. Изредка стул может быть зеленым или пенистым. У стула грудных детей нет запаха или же запах неотталкивающий и слабый сладковатый или творожистый запах (что невероятно помогает менять грязные подгузники!)
В первые три дня после рождения число опорожнений кишечника должно соответствовать возрасту ребенка – в первые сутки ребенок должен опорожнить кишечник один раз, на вторые сутки – два, на третьи – три. После прихода молока грудной ребенок опорожняет кишечник минимум 3-4 раза в сутки, и количество стула довольно значительное. Большинство грудных детей опорожняют кишечник намного чаще, нередко после каждого кормления. Даже неопытная мама без труда распознает радостный залп похода в туалет у грудничка – его невозможно не услышать и пропустить.
После прихода молока грудной ребенок опорожняет кишечник минимум 3-4 раза в сутки, и количество стула довольно значительное. Большинство грудных детей опорожняют кишечник намного чаще, нередко после каждого кормления. Даже неопытная мама без труда распознает радостный залп похода в туалет у грудничка – его невозможно не услышать и пропустить.
По мере взросления, в районе 6 недель от рождения или чуть раньше, многие грудные дети переходят на более редкий режим дефекации – от раза в несколько дней до раза в неделю или даже реже. При этом отсутствуют признаки запора (сухой, твердый стул) – стул ребенка попрежнему неоформленный, пюреобразный.
Введение любой другой пищи помимо грудного молока приведет к изменению консистенции, цвета и запаха стула у грудного ребенка. Если вы начали вводить прикорм, в стуле можно будет заметить кусочки пищи, которую вы даете ребенку.
Как мы видим, нормы дефекации и стула грудных детей значительно отличаются от нормы взрослых. То, что стало бы признаком беспокойства и поводом обратиться к врачу у взрослых, является нормой у грудничков. Для сравнения, нормы детей на грудном вскармливании значительно отличаются от показателей и детей на смешанном и искусственном вскармливании. Например, флора кишечника младенца на искусственном вскармливании уже в 2 недели почти не отличается от взрослого человека. У детей на искусственном вскрамливании более редкая дефекация, а также более оформленный стул с заметным типичным запахом.
Для сравнения, нормы детей на грудном вскармливании значительно отличаются от показателей и детей на смешанном и искусственном вскармливании. Например, флора кишечника младенца на искусственном вскармливании уже в 2 недели почти не отличается от взрослого человека. У детей на искусственном вскрамливании более редкая дефекация, а также более оформленный стул с заметным типичным запахом.
Содержимое подгузника грудничка, на которое следует обратить внимание
Отклонения от нормы частоты и внешнего вида стула не всегда означает, что ребенок обязательно чем-то болен. Однако, стул ребенка может быть полезным признаком достаточности питания или симптомом аллергии. В таких случаях изменение способа кормления или устранения аллергена – все что требуется для решения проблемы.
Частый, водянистый, зеленый и/или пенистый стул может быть признаком недоедания. Нередко такой стул бывает в сочетании с медленным набором веса. Иногда такое состояние называют дисбаланс переднего и заднего молока. Ребенок высасывает много переднего молока с низким содержанием жира, которое проходит через пищеварительную систему слишком быстро и вызывает вышеуказанные симптомы. Обычно это легко разрешается изменением поведения во время кормлений, а именно увеличение продолжительности сосания у одной груди. Это позволяет малышу дососаться до жирного заднего молока, которое переваривается медленнее. Об этой проблеме можно узнать больше в статье Значение учета частоты стула новорожденного.
Ребенок высасывает много переднего молока с низким содержанием жира, которое проходит через пищеварительную систему слишком быстро и вызывает вышеуказанные симптомы. Обычно это легко разрешается изменением поведения во время кормлений, а именно увеличение продолжительности сосания у одной груди. Это позволяет малышу дососаться до жирного заднего молока, которое переваривается медленнее. Об этой проблеме можно узнать больше в статье Значение учета частоты стула новорожденного.
Если у малыша постоянно зеленый и водянистый стул, это может быть признаком аллергии. Помимо этого у ребенка может быть рвота, слизь или кровь в стуле, а также раздражительность, высыпания на коже. В этом случае особенно важно продолжать кормить грудью, т.к. отлучение от груди сопряжено с повышением риска аллергий. О том как справляться с аллергией у грудного ребенка можно узнать в статье Аллергии и семья грудного ребенка.
Если ваш малыш пачкает более 12-16 подгузников в сутки, и стул плохо пахнет и водянистый — это понос. Обычно понос у грудных детей быстро проходит сам по себе и без всяких осложнений. Причной поноса может стать инфекция, лечение антибиотиками, введение прикорма, чрезмерное потребление фруктовых соков. В случае острого поноса или поноса при приеме антибиотиков ребенка обязательно нужно как можно больше кормить грудью. В грудном молоке содержится все необходимое для предотвращения обезвоживания, а также антитела, которые помогают ребенку справится с инфекцией, и также факторы, которые позволяют восстановить нормальную флору кишечника. Американская ассоциация педиатрии рекомендует обязательно продолжать кормить ребенка грудью во время острого поноса. Исследования показывают, что прекращение кормления во время поноса увеличивает продолжительность и серьезность заболевания, а также вдвое увеличивает риск смертности. Если же причиной поноса стало введение прикорма или соки, возможно нужно отложить введение прикорма на некоторое время. Подробнее о введении прикорма написано в статье Когда вводить прикорм?
Обычно понос у грудных детей быстро проходит сам по себе и без всяких осложнений. Причной поноса может стать инфекция, лечение антибиотиками, введение прикорма, чрезмерное потребление фруктовых соков. В случае острого поноса или поноса при приеме антибиотиков ребенка обязательно нужно как можно больше кормить грудью. В грудном молоке содержится все необходимое для предотвращения обезвоживания, а также антитела, которые помогают ребенку справится с инфекцией, и также факторы, которые позволяют восстановить нормальную флору кишечника. Американская ассоциация педиатрии рекомендует обязательно продолжать кормить ребенка грудью во время острого поноса. Исследования показывают, что прекращение кормления во время поноса увеличивает продолжительность и серьезность заболевания, а также вдвое увеличивает риск смертности. Если же причиной поноса стало введение прикорма или соки, возможно нужно отложить введение прикорма на некоторое время. Подробнее о введении прикорма написано в статье Когда вводить прикорм?
Что такое дисбактериоз
Дисбактериоз (от гр. dys- «нарушение, расстройство», bacterio- «бактерии» и –sis «состояние») или дисбиоз – нарушение качественного или количественного баланса микроорганизмов в организме, в данном случае, в кишечнике. Это значит, что изменилась пропорция бактерий в кишечнике или там появились необычные для нормальной флоры микроорганизмы. Дисбактериоз часто связывают с кишечными инфекциями и лечением антибиотиками.
dys- «нарушение, расстройство», bacterio- «бактерии» и –sis «состояние») или дисбиоз – нарушение качественного или количественного баланса микроорганизмов в организме, в данном случае, в кишечнике. Это значит, что изменилась пропорция бактерий в кишечнике или там появились необычные для нормальной флоры микроорганизмы. Дисбактериоз часто связывают с кишечными инфекциями и лечением антибиотиками.
Диагностирование дисбактериоза проводится по симптомам или же анализом кала на дисбактериоз. Обозначить симптомы дисбактериоза трудно, так как это состояние не является заболеванием согласно «Международной статистической классификации болезней и проблем, связанных со здоровьем» Десятого пересмотра (МКБ-10) — документу Всемирной организации здравоохранения, который является общепринятой международной диагностической классификацией в здравоохранении.
Обычно, показанием к анализу на дисбактериоз является непроходящий в течение двух или трех суток понос. У взрослых людей и детей на искусственном вскармливании понос определяется как частый и жидкий стул. Как уже было сказано выше, для грудных детей частый, неоформленный жидкий стул является нормой, поэтому не может являться показанием для анализов. Среди других симптомов, которые служат поводом для лабораторных исследований на дисбактериоз могут быть зеленоватый стул, стул со слизью, запор (редкий стул у грудных детей часто ошибочно принимают за запор), пенистый стул, частички непереваренной пищи. Все эти симптомы не у грудных детей действительно сопровождают поносы, которые часто вызваны патогенными бактериями и требуют лечения антибиотиками. У грудных детей каждый из перечисленных признаков может являться разновидностью нормы.
Как уже было сказано выше, для грудных детей частый, неоформленный жидкий стул является нормой, поэтому не может являться показанием для анализов. Среди других симптомов, которые служат поводом для лабораторных исследований на дисбактериоз могут быть зеленоватый стул, стул со слизью, запор (редкий стул у грудных детей часто ошибочно принимают за запор), пенистый стул, частички непереваренной пищи. Все эти симптомы не у грудных детей действительно сопровождают поносы, которые часто вызваны патогенными бактериями и требуют лечения антибиотиками. У грудных детей каждый из перечисленных признаков может являться разновидностью нормы.
Насколько показательны анализы на дисбактериоз у здоровых грудных детей?
Изучение состава кишечной флоры у здорового грудного ребенка, то есть ребенка без видимых симптомов заболевания, в данном случае поноса, представляет интерес для ученых, но не для родителей или практикующих врачей. Многочисленные исследования показали, что грудное молоко защищает детей от заболеваний, даже если кишечник колонизирован патогенными микроорганизмами. Например, в грудном молоке содержатся антитела и факторы против кишечной палочки, холерного вибриона, сальмонеллы, шигеллы, ротавируса и лямблии. Это значит, что в стуле может высеваться патологический микроорганизм, но ребенок при этом не проявляет никаких симптомов заболевания.
Например, в грудном молоке содержатся антитела и факторы против кишечной палочки, холерного вибриона, сальмонеллы, шигеллы, ротавируса и лямблии. Это значит, что в стуле может высеваться патологический микроорганизм, но ребенок при этом не проявляет никаких симптомов заболевания.
Когда нужно обратится к врачу?
В крайне редких случаях грудному ребенку может понадобиться медицинская помощь.
Обратитесь к врачу, если у ребенка в первые недели жизни наблюдается
- понос (более 12 дефекаций в сутки, водянистый стул)
- рвота
- темпаратура
- летаргия
- низкий набор веса
- потеря в весе
Обратитесь к врачу с грудным ребенком любого возраста, если у ребенка появились признаки обезвоживания
- слабость
- сонливость или летаргия
- слабый плач
- кожа не разглаживается быстро, если ее ущипнуть
- отсутствие слез
- сухой рот, во рту мало или отсуствует слюна
- менее двух мокрых подгузников в сутки
- моча темная, с сильным запахом
- запавший родничок
- температура
Что нужно знать и помнить кормящей маме?
Кормление грудью является самой настоящей страховкой здоровья желудочно-кишечного тракта ребенка в течение первых лет жизни. Грудное молоко способствует росту бифидобактерий, которые препятствуют колонизации кишечника болезнетворными бактериями, а также содержит антитела и факторы, которые защищают ребенка от болезни, даже если патогенным бактериям удалось прижиться в кишечнике. Кормление грудью помогает восстановить баланс микрофлоры кишечника ребенка после лечения антибиотиками. Попросту говоря, грудным детям дисбактериоз не страшен.
Грудное молоко способствует росту бифидобактерий, которые препятствуют колонизации кишечника болезнетворными бактериями, а также содержит антитела и факторы, которые защищают ребенка от болезни, даже если патогенным бактериям удалось прижиться в кишечнике. Кормление грудью помогает восстановить баланс микрофлоры кишечника ребенка после лечения антибиотиками. Попросту говоря, грудным детям дисбактериоз не страшен.
Библиография
Lawrence, R. A. and Lawrence R.M. Breastfeeding: A Guide for the Medical Profession, 6th ed. St. Louis: Mosby, 2005.
Mohrbacher N., Stock J. Breastfeeding Answer Book, Third Revised Edition, January 2003, La Leche League International.
Mosby’s Dictionary of Medicine, Nursing & Health Professions. 7th ed. St. Louis: Mosby, 2005.
Riordan, J. and Auerbach, K. Breastfeeding and Human Lactation, 3rd ed. Boston: Jones and Barlett, 2005.
World Health Organization. International Statistical Classification of Diseases and Related Health Problems. 10th revision, version 2007. Доступ 6 августа 2008, http://www.who.int/classifications/icd/en/
10th revision, version 2007. Доступ 6 августа 2008, http://www.who.int/classifications/icd/en/
Смагин А.Ю. «Пробиотики и пребиотики у новорожденных и детей грудного возраста (обзор литературы)». Журнал интенсивная терапия 2007. Доступ 6 августа 2008, http://www.icj.ru/2007-02-03.html
Дисбактериоз кишечника новорожденных | Журнал перинатологии
Домингес-Белло М.Г., Годой-Виторино Ф., Найт Р., Блазер М.Дж. Роль микробиома в развитии человека. Кишечник. 2019; 68: 1108–14.
CAS PubMed PubMed Central Google ученый
Генсоллен Т., Айер С.С., Каспер Д.Л., Блумберг Р.С. Как колонизация микробиотой в раннем возрасте формирует иммунную систему. Наука. 2016; 352: 539–44.
CAS PubMed PubMed Central Google ученый
Ayres JS. Совместное поведение микробной толерантности в мутуализме микробиоты хозяина. Клетка. 2016; 165: 1323–31.
CAS PubMed PubMed Central Google ученый
Санчес К.К., Чен Г.Й., Шибер AMP, Редфорд С.Е., Шохирев М.Н., Леблан М. и др. Совместная метаболическая адаптация хозяина может способствовать бессимптомной инфекции и способствовать снижению вирулентности кишечного патогена. Клетка. 2018; 175: 146–58.e15.
CAS PubMed PubMed Central Google ученый
Сорбара МТ, Памер Э.Г. Межбактериальные механизмы устойчивости к колонизации и стратегии, используемые патогенами для их преодоления. Mucosal Immunol. 2019; 12: 1–9.
CAS PubMed PubMed Central Google ученый
Ко А., Бэкхед Ф. От ассоциации к причинной связи: роль микробиоты кишечника и ее функциональных продуктов в метаболизме хозяина. Mol Cell. 2020; 78: 584–96.
CAS PubMed PubMed Central Google ученый
Геверс Д., Кугатасан С., Денсон Л.А., Васкес-Баеза И., Ван Треурен В., Рен Б. и др. Микробиом, не получавший лечения при впервые возникшей болезни Крона. Клетка. Хост-микроб. 2014; 15: 382–92.
CAS PubMed PubMed Central Google ученый
Клингберг Э., Магнуссон М.К., Стрид Х., Демингер А., Шталь А., Сундин Дж. И др. Различный состав микробиоты кишечника у пациентов с анкилозирующим спондилитом связан с повышенным уровнем калпротектина.Arthritis Res Ther. 2019; 21: 248.
2019; 21: 248.
CAS PubMed PubMed Central Google ученый
Фалони Дж., Джоосенс М., Виейра-Силва С., Ван Дж., Дарзи Й., Фауст К. и др. Популяционный анализ изменчивости микробиома кишечника. Наука. 2016; 352: 560–4.
CAS PubMed PubMed Central Google ученый
Яцуненко Т.Р., Манари М.Дж., Трехан И., Домингес-Белло М.Г., Контрерас М., Магрис М. и др.Микробиом кишечника человека в зависимости от возраста и географии. Природа 2012; 486: 222–7.
CAS PubMed PubMed Central Google ученый
Биттингер К. , Чжао С., Ли И, Форд Э, Фридман Э.С., Ни Дж. И др. Бактериальная колонизация перепрограммирует метаболом кишечника новорожденных. Nat Microbiol. 2020; 5: 838–47.
, Чжао С., Ли И, Форд Э, Фридман Э.С., Ни Дж. И др. Бактериальная колонизация перепрограммирует метаболом кишечника новорожденных. Nat Microbiol. 2020; 5: 838–47.
CAS PubMed PubMed Central Google ученый
Vangay P, Ward T, Gerber JS, Knights D. Антибиотики, детский дисбактериоз и болезни. Клетка. Хост-микроб. 2015; 17: 553–64.
CAS PubMed PubMed Central Google ученый
Deshmukh HS, Liu Y, Menkiti OR, Mei J, Dai N, O’Leary CE, et al. Микробиота регулирует гомеостаз нейтрофилов и устойчивость хозяина к сепсису Escherichia coli K1 у новорожденных мышей. Nat Med. 2014; 20: 524–30.
CAS PubMed PubMed Central Google ученый
Грачи MG, Гарретт WS. Кишечник. микробиота, метаболиты и иммунитет хозяина. Nat Rev Immunol. 2016; 16: 341–52.
CAS PubMed PubMed Central Google ученый
Ольшак Т., Ан Д., Цейссиг С., Вера М.П., Рихтер Дж., Франке А. и др. Воздействие микробов в молодом возрасте оказывает стойкое влияние на функцию естественных Т-клеток-киллеров. Наука. 2012; 336: 489–93.
CAS PubMed PubMed Central Google ученый
Кокс Л.М., Яманиши С., Сон Дж., Алексеенко А.В., Леунг Дж. М., Чо И. и др. Изменение микробиоты кишечника во время критического периода развития имеет долгосрочные метаболические последствия. Клетка. 2014; 158: 705–21.
CAS PubMed PubMed Central Google ученый
Кимура И., Миямото Дж., Оуэ-Китано Р., Ватанабе К., Ямада Т., Онуки М. и др. Микробиота кишечника матери во время беременности влияет на метаболический фенотип потомства мышей.Наука. 2020; 367: eaaw8429.
CAS PubMed PubMed Central Google ученый
Гордон Х.А., Пести Л. Животное-гнотобиотическое животное как инструмент в изучении микробных взаимоотношений хозяина. Бактериол. Ред. 1971; 35: 390–429.
CAS PubMed PubMed Central Google ученый
Лучински П., МакВей Нойфельд К.А., Ориач К.С., Кларк Дж., Динан Т.Г., Крайан Дж. Ф.Выращивание в пузыре: использование стерильных животных для оценки влияния микробиоты кишечника на мозг и поведение. Int J Neuropsychopharmacol. 2016; 19: pyw020.
Int J Neuropsychopharmacol. 2016; 19: pyw020.
PubMed PubMed Central Google ученый
Уилкс М. Бактерии и раннее развитие человека. Early Hum Dev. 2007; 83: 165–70.
PubMed PubMed Central Google ученый
Гериг Дж. Л., Венкатеш С., Чанг Х. В., Хибберд М. С., Кунг В. Л., Ченг Дж. И др.Влияние продуктов, направленных на микробиоту, на животных-гнотобиотов и детей с недостаточным питанием. Наука. 2019; 365: eaau4732.
PubMed PubMed Central Google ученый
Turnbaugh PJ, Ley RE, Mahowald MA, Magrini V, Mardis ER, Gordon JI. Микробиом кишечника, связанный с ожирением, с повышенной способностью собирать энергию. Природа. 2006; 444: 1027–31.
Микробиом кишечника, связанный с ожирением, с повышенной способностью собирать энергию. Природа. 2006; 444: 1027–31.
PubMed PubMed Central Google ученый
Safari Z, Джерард П. Связь между микробиомом кишечника и неалкогольной жировой болезнью печени (НАЖБП). Клетка. Mol Life Sci. 2019; 76: 1541–58.
CAS PubMed PubMed Central Google ученый
Цзян Ц., Ли Дж., Хуанг П., Лю З., Чжао Б. Микробиота кишечника и болезнь Альцгеймера. J. Alzheimers Dis. 2017; 58: 1–15.
PubMed PubMed Central Google ученый
Lee YP, Chiu CC, Lin TJ, Hung SW, Huang WC, Chiu CF, et al. Моноколонизация мышей без микробов с помощью Bacteroides fragilis улучшает индуцированный азоксиметаном / декстрансульфатом натрия колоректальный рак, вызванный колитом. Immunopharmacol Immunotoxicol. 2019; 41: 207–13.
Моноколонизация мышей без микробов с помощью Bacteroides fragilis улучшает индуцированный азоксиметаном / декстрансульфатом натрия колоректальный рак, вызванный колитом. Immunopharmacol Immunotoxicol. 2019; 41: 207–13.
CAS PubMed PubMed Central Google ученый
Tissier H. Recherches sur la flore кишечника дез нурриссон. C R Mem Soc Biol. 1899; 51: 943.
Google ученый
Logan WR. Флора кишечника младенцев и детей раннего возраста. J Pathol. 1913; 18: 527–51.
Google ученый
Гарридо Д., Бариле Д., Миллс Д.А. Молекулярная основа обогащения бифидобактерий в желудочно-кишечном тракте младенцев. Adv Nutr. 2012; 3: 415С – 21С.
Adv Nutr. 2012; 3: 415С – 21С.
CAS PubMed PubMed Central Google ученый
Ruiz-Moyano S, Totten SM, Garrido DA, Smilowitz JT, German JB, Lebrilla CB, et al.Различия в потреблении олигосахаридов грудного молока младенческими кишечными штаммами Bifidobacterium breve. Appl Environ Microbiol. 2013; 79: 6040–9.
CAS PubMed PubMed Central Google ученый
Живкович AM, German JB, Lebrilla CB, Mills DA. Гликобиом грудного молока и его влияние на микробиоту желудочно-кишечного тракта младенцев. Proc Natl Acad Sci USA. 2011; 108 (Приложение 1): 4653–8.
CAS Google ученый
Хенрик Б.М., Хаттон А.А., Палумбо М.С., Касабури Дж., Митчелл Р.Д., Андервуд М.А. и др. Повышенный pH фекалий указывает на глубокое изменение микробиома кишечника грудного ребенка из-за сокращения бифидобактерий за последнее столетие. мСфера. 2018; 3: e00041–18.
PubMed PubMed Central Google ученый
Litvak Y, Byndloss MX, Tsolis RM, Baumler AJ. Распространение дисбиотических протеобактерий: микробный признак дисфункции эпителия.Curr Opin Microbiol. 2017; 39: 1–6.
CAS Google ученый
Милани С., Дуранти С., Боттачини Ф., Кейси Е., Туррони Ф., Махони Дж. И др. Первые микробные колонизаторы кишечника человека: состав, деятельность и последствия для здоровья микробиоты кишечника младенца. Microbiol Mol Biol Rev.2017; 81: e00036-17.
Microbiol Mol Biol Rev.2017; 81: e00036-17.
PubMed PubMed Central Google ученый
La Rosa PS, Warner BB, Zhou Y, Weinstock GM, Sodergren E, Hall-Moore CM и др. Структурированное развитие бактериальных популяций в кишечнике недоношенных детей. Proc Natl Acad Sci USA. 2014; 111: 12522–7.
Google ученый
Korpela K, Blakstad EW, Moltu SJ, Strommen K, Nakstad B, Ronnestad AE, et al. Развитие кишечной микробиоты и гестационный возраст у недоношенных новорожденных. Научный отчет 2018; 8: 2453.
PubMed PubMed Central Google ученый

Ватанен Т., Плихта Д.Р., Сомани Дж., Мунк П.К., Артур Т.Д., Холл А.Б. и др. Геномная изменчивость и штамм-специфическая функциональная адаптация микробиома кишечника человека в раннем возрасте. Nat Microbiol. 2019; 4: 470–9.
CAS Google ученый
Raman AS, Gehrig JL, Venkatesh S, Chang HW, Hibberd MC, Subramanian S, et al. Единица разреженного коваринга, которая описывает развитие здоровой и нарушенной микробиоты кишечника человека. Наука. 2019; 365: eaau4735.
PubMed PubMed Central Google ученый
Younge NE, Newgard CB, Cotten CM, Goldberg RN, Muehlbauer MJ, Bain JR, et al. Нарушение созревания микробиоты и метаболома у крайне недоношенных детей с послеродовой задержкой роста. Научный доклад 2019; 9: 8167.
Научный доклад 2019; 9: 8167.
PubMed PubMed Central Google ученый
Лю Дж, Ли Й, Фэн Й, Пан Л, Се З, Янь З и др.Структурированное прогрессирование микробиоты кишечника, связанное с некротическим энтероколитом и поздним сепсисом у недоношенных детей: проспективное исследование в отделении интенсивной терапии новорожденных в Китае. PeerJ. 2019; 7: e7310.
PubMed PubMed Central Google ученый
Галаццо Дж., Ван Бест Н., Бервоетс Л., Дапаа И.О., Савелкул PH, Хорнеф М.В. и др. Развитие микробиоты и ассоциации с режимом рождения, диетой и атопическими расстройствами в продольном анализе образцов стула, собранных с младенчества до раннего детства.Гастроэнтерология. 2020; 158: 1584–96.
CAS Google ученый
Madan JC, Hoen AG, Lundgren SN, Farzan SF, Cottingham KL, Morrison HG, et al. Связь кесарева сечения и добавления смеси с кишечным микробиомом 6-недельных младенцев. JAMA Pediatr. 2016; 170: 212–9.
PubMed PubMed Central Google ученый
Стюарт С.Дж., Аджами, штат Нью-Джерси, О’Брайен Д.Л., Хатчинсон Д.С., Смит Д.П., Вонг М.К. и др.Временное развитие микробиома кишечника в раннем детстве по данным исследования TEDDY. Природа. 2018; 562: 583–8.
CAS PubMed PubMed Central Google ученый
Combellick JL, Shin H, Shin D, Cai Y, Hagan H, Lacher C, et al. Различия в фекальной микробиоте новорожденных, рожденных дома или в больнице. Научный доклад 2018; 8: 15660.
Различия в фекальной микробиоте новорожденных, рожденных дома или в больнице. Научный доклад 2018; 8: 15660.
PubMed PubMed Central Google ученый
Savage JH, Lee-Sarwar KA, Sordillo JE, Lange NE, Zhou Y, O’Connor GT и др. Диета во время беременности и младенчества и микробиом кишечника младенца. J Pediatr. 2018; 203: 47–54.e4.
PubMed PubMed Central Google ученый
Лундгрен С.Н., Мадан Дж. К., Эмонд Дж. А., Моррисон Х. Г., Кристенсен BC, Карагас М. Р. и др. Диета матери во время беременности связана с микробиомом детского стула в зависимости от способа родов.Микробиом. 2018; 6: 109.
PubMed PubMed Central Google ученый
Williams JE, Carrothers JM, Lackey KA, Beatty NF, Brooker SL, Peterson HK, et al. Между молочным, оральным и фекальным микробиомами в диадах мать-младенец существуют сильные многомерные отношения в течение первых шести месяцев после родов. J Nutr. 2019; 149: 902–14.
PubMed PubMed Central Google ученый
Азад МБ, Конья Т., Персо Р.Р., Гутман Д.С., Чари Р.С., Филд С.Дж. и др. Влияние антибиотиков во время родов, метода родов и грудного вскармливания на микробиоту кишечника в течение первого года жизни: проспективное когортное исследование. Int J Obstet Gynaecol. 2016; 123: 983–93.
CAS Google ученый
Coker MO, Hoen AG, Dade E, Lundgren S, Li Z, Wong AD, et al. Конкретный класс антибиотиков во время родов связан с созреванием микробиоты кишечника младенца: проспективное когортное исследование.Int J Obstet Gynaecol. 2020; 127: 217–27.
Конкретный класс антибиотиков во время родов связан с созреванием микробиоты кишечника младенца: проспективное когортное исследование.Int J Obstet Gynaecol. 2020; 127: 217–27.
CAS Google ученый
Eck A, Rutten N, Singendonk MMJ, Rijkers GT, Savelkoul PHM, Meijssen CB, et al. Развитие неонатальной микробиоты и действие антибиотиков в раннем возрасте определяется двумя разными типами поселенцев. PloS ONE. 2020; 15: e0228133.
CAS PubMed PubMed Central Google ученый
Гупта Р.В., Тран Л., Норори Дж., Феррис М.Дж., Эрен А.М., Тейлор С.М. и др. Блокаторы рецепторов гистамина-2 изменяют фекальную микробиоту у недоношенных детей. J Pediatr Gastroenterol Nutr. 2013; 56: 397–400.
CAS Google ученый
Леви Э.И., Хоанг Д.М., Ванденплас Й. Влияние ингибиторов протонной помпы на микробиом у маленьких детей. Acta Paediatr. 2020; 109: 1531–8.
CAS Google ученый
Vich Vila A, Collij V, Sanna S, Sinha T, Imhann F, Bourgonje AR, et al. Влияние часто используемых препаратов на состав и метаболическую функцию микробиоты кишечника. Nat Commun. 2020; 11: 362.
CAS PubMed PubMed Central Google ученый
Джексон М.А., Верди С., Максан М.Э., Шин С.М., Зирер Дж., Бойер Р.Ц.и др. Связь микробиоты кишечника с распространенными заболеваниями и лекарствами, отпускаемыми по рецепту, в популяционной когорте. Nat Commun. 2018; 9: 2655.
Nat Commun. 2018; 9: 2655.
PubMed PubMed Central Google ученый
Iszatt N, Janssen S, Lenters V, Dahl C, Stigum H, Knight R, et al. Экологические токсиканты в грудном молоке норвежских матерей, а также состав и метаболиты кишечных бактерий у их младенцев в возрасте 1 месяца. Микробиом 2019; 7: 34.
PubMed PubMed Central Google ученый
Лауэ Х. Э., Мороиши Ю., Джексон Б. П., Палис Т. Дж., Мадан Дж. К., Карагас МР.Смеси питательных и токсичных элементов и микробиом кишечника в раннем постнатальном периоде в когорте продольных рождений в США. Environ Int. 2020; 138: 105613.
CAS Google ученый
Маклин С., Джун С., Козырский А. Влияние курения матери на микробиоту кишечника младенца и его связь с избыточным весом ребенка: обзорный обзор. Мир J Pediatr. 2019; 15: 341–9.
Google ученый
Tun HM, Konya T, Takaro TK, Brook JR, Chari R, Field CJ и др. Контакт с домашними пушистыми домашними животными влияет на микробиоту кишечника младенца в возрасте 3-4 месяцев после различных сценариев рождения. Микробиом. 2017; 5: 40.
PubMed PubMed Central Google ученый
D’Agata AL, Wu J, Welandawe MKV, Dutra SVO, Kane B, Groer MW. Влияние стресса ОИТН в раннем возрасте на развивающийся микробиом кишечника. Dev Psychobiol. 2019; 61: 650–60.
PubMed PubMed Central Google ученый
Ho TTB, Groer MW, Kane B, Yee AL, Torres BA, Gilbert JA, et al. Дихотомическое развитие микробиома кишечника у недоношенных детей. Микробиом. 2018; 6: 157.
PubMed PubMed Central Google ученый
Parra-Llorca A, Gormaz M, Alcantara C, Cernada M, Nunez-Ramiro A, Vento M и др. Микробиом кишечника недоношенных в зависимости от типа кормления: значение донорского грудного молока.Front Microbiol. 2018; 9: 1376.
PubMed PubMed Central Google ученый
Тафт Д.Х., Салинеро Л.К., Вонгбхавит К., Каланетра К.М., Масарве К., Ю А. и др. Бактериальная колонизация и гены устойчивости к противомикробным препаратам в неонатальных трубках для энтерального питания. FEMS Microbiol Ecol. 2019; 95: физ039.
FEMS Microbiol Ecol. 2019; 95: физ039.
CAS PubMed PubMed Central Google ученый
Ногачка А., Салазар Н., Суарес М., Милани С., Арболея С., Солис Г. и др.Влияние антимикробной профилактики во время родов на микробиоту кишечника и распространенность генов устойчивости к антибиотикам у доношенных новорожденных, родившихся через естественные родовые пути. Микробиом. 2017; 5: 93.
PubMed PubMed Central Google ученый
Гаспаррини А.Дж., Крофтс Т.С., Гибсон М.К., Тарр П.И., Уорнер Б.Б., Дантас Г. Нарушение антибиотиками микробиома кишечника недоношенных детей и резистома. Кишечные микробы. 2016; 7: 443–9.
CAS PubMed PubMed Central Google ученый
Гибсон М.К., Ван Б., Ахмади С., Бернхэм Калифорния, Тарр П.И., Уорнер Б.Б. и др. Динамика развития микробиоты кишечника недоношенных новорожденных и резистома к антибиотикам. Nat Microbiol. 2016; 1: 16024.
CAS PubMed PubMed Central Google ученый
Rutayisire E, Huang K, Liu Y, Tao F. Способ родов влияет на разнообразие и структуру колонизации кишечной микробиоты в течение первого года жизни младенцев: систематический обзор.BMC Gastroenterol. 2016; 16:86.
PubMed PubMed Central Google ученый
Dahl C, Stigum H, Valeur J, Iszatt N, Lenters V, Peddada S, et al. У недоношенных новорожденных есть различные микробиомы, которые не объясняются способом родов, продолжительностью грудного вскармливания или воздействием антибиотиков. Int J Epidemiol. 2018; 47: 1658–69.
Int J Epidemiol. 2018; 47: 1658–69.
PubMed PubMed Central Google ученый
Tun MH, Tun HM, Mahoney JJ, Konya TB, Guttman DS, Becker AB. и другие. Послеродовое воздействие бытовых дезинфицирующих средств, микробиоты кишечника младенцев и последующий риск избыточного веса у детей. Can Med Assoc J. 2018; 190: E1097 – e107.
Google ученый
Шоу К.А., Берта М., Хофмеклер Т., Чопра П., Ватанен Т., Шриватса А. и др. Дисбактериоз, воспаление и реакция на лечение: продольное исследование педиатрических субъектов с недавно диагностированным воспалительным заболеванием кишечника.Genome Med. 2016; 8: 75.
PubMed PubMed Central Google ученый
Xia GH, You C, Gao XX, Zeng XL, Zhu JJ, Xu KY, et al. Индекс дисбактериоза инсульта (SDI) в микробиоме кишечника связан с травмой головного мозга и прогнозом инсульта. Фронт Neurol. 2019; 10: 397.
PubMed PubMed Central Google ученый
Го Й, Чжан И, Герхард М., Гао Дж. Дж., Мехиас-Луке Р., Чжан Л. и др.Влияние Helicobacter pylori на микробиоту желудочно-кишечного тракта: популяционное исследование в Linqu, зоне высокого риска рака желудка. Кишечник. 2019. https://doi.org/10.1136/gutjnl-2019-319696.
Casen C, Vebo HC, Sekelja M, Hegge FT, Karlsson MK, Ciemniejewska E, et al. Отклонения в микробиоте кишечника человека: новый диагностический тест для определения дисбактериоза у пациентов с IBS или IBD. Пищевая Pharmacol Therap. 2015; 42: 71–83.
Пищевая Pharmacol Therap. 2015; 42: 71–83.
CAS Google ученый
Мандл Т., Марсал Дж., Олссон П., Олссон Б., Андреассон К. Тяжелый кишечный дисбактериоз распространен при первичном синдроме Шегрена и связан с системной активностью заболевания. Arthritis Res Ther. 2017; 19: 237.
PubMed PubMed Central Google ученый
Ватанен Т., Костич А.Д., д’Хеннезель Э., Сильяндер Х., Франзоса Э.А., Яссур М. и др. Вариабельность иммуногенности LPS микробиома способствует развитию аутоиммунитета у людей.Клетка. 2016; 165: 842–53.
CAS PubMed PubMed Central Google ученый
Ватанен Т., Франзоза Э.А., Швагер Р., Трипати С., Артур Т.Д., Вехик К. и др. Микробиом кишечника человека при диабете типа 1 с ранним началом из исследования TEDDY. Природа. 2018; 562: 589–94.
CAS PubMed PubMed Central Google ученый
Chua HH, Chou HC, Tung YL, Chiang BL, Liao CC, Liu HH, et al.Дисбактериоз кишечника с обилием ruminococcus gnavus ассоциируется с аллергическими заболеваниями у младенцев. Гастроэнтерология. 2018; 154: 154–67.
PubMed PubMed Central Google ученый
Lee MJ, Kang MJ, Lee SY, Lee E, Kim K, Won S, et al. Нарушения генов микробиома кишечника у младенцев с атопическим дерматитом в зависимости от типа кормления. J Allergy Clin Immunol. 2018; 141: 1310–9.
J Allergy Clin Immunol. 2018; 141: 1310–9.
CAS PubMed PubMed Central Google ученый
Ламонт Р.Ф., Моллер Люф Б., Стенер Йоргенсен Дж. Воспалительное заболевание и нарушение обмена веществ у детей после воздействия антибиотиков во время беременности, антенатального, интранатального и неонатального периода. F1000Res. 2020; 9: 144.
Google ученый
Доухауэр Карпа К., Пол И.М., Леки Дж. А., Шунг С., Каркачи-Салли Н., Врана К. Е. и др. Обзор ретроспективной карты для выявления перинатальных факторов, связанных с пищевой аллергией. Нутр Дж. 2012; 11: 87.
PubMed PubMed Central Google ученый
Metz TD, McKinney J, Allshouse AA, Knierim SD, Carey JC, Heyborne KD. Воздействие стрептококковой антибиотикопрофилактики группы B и индекс массы тела в раннем детстве в когорте вагинальных родов. J Matern Fetal Neonatal Med. 2020; 33: 3318–3323.
PubMed PubMed Central Google ученый
Wohl DL, Curry WJ, Mauger D, Miller J, Tyrie K. Антибиотики во время родов и детский атопический дерматит. J Am Board Fam Med. 2015; 28: 82–9.
PubMed PubMed Central Google ученый
Памми М., Коуп Дж., Тарр П.И., Уорнер Б.Б., Морроу А.Л., Май В. и др. Дисбактериоз кишечника у недоношенных детей, предшествующий некротическому энтероколиту: систематический обзор и метаанализ. Микробиом. 2017; 5:31.
Микробиом. 2017; 5:31.
PubMed PubMed Central Google ученый
Olm MR, Bhattacharya N, Crits-Christoph A, Firek BA, Baker R, Song YS, et al.Некротическому энтероколиту предшествует усиленная репликация кишечных бактерий, клебсиелл и бактерий, кодирующих фимбрии. Sci Adv. 2019; 5: eaax5727.
CAS PubMed PubMed Central Google ученый
Esmaeilizand R, Shah PS, Seshia M, Yee W, Yoon EW, Dow K. Воздействие антибиотиков и развитие некротического энтероколита у очень недоношенных новорожденных. Педиатр детского здоровья. 2018; 23: e56 – e61.
PubMed PubMed Central Google ученый
Esaiassen E, Fjalstad JW, Juvet LK, van den Anker JN, Klingenberg C. Воздействие антибиотиков у новорожденных и ранние неблагоприятные исходы: систематический обзор и метаанализ. J Antimicrob. Chemother. 2017; 72: 1858–70.
CAS PubMed PubMed Central Google ученый
Guillet R, Stoll BJ, Cotten CM, Gantz M, McDonald S, Poole WK, et al. Связь терапии блокаторами h3 и более высокой частоты некротического энтероколита у младенцев с очень низкой массой тела при рождении.Педиатрия. 2006; 117: e137–42.
PubMed Google ученый
Hewitt KM, Mannino FL, Gonzalez A, Chase JH, Caporaso JG, Knight R, et al. Бактериальное разнообразие в двух отделениях интенсивной терапии новорожденных (ОИТН). PloS ONE. 2013; 8: e54703.
PloS ONE. 2013; 8: e54703.
CAS PubMed PubMed Central Google ученый
Бокулич Н.А., Миллс Д.А., Андервуд М.А. Поверхностные микробы в отделении интенсивной терапии новорожденных: изменения в процессе регулярной очистки и со временем.J Clin Microbiol. 2013; 51: 2617–24.
PubMed PubMed Central Google ученый
Брукс Б., Олм М.Р., Файрек Б.А., Бейкер Р., Геллер-МакГрат Д., Реймер С.Р. и др. Развивающийся микробиом кишечника недоношенных детей является основным фактором, формирующим микробиом отделений интенсивной терапии новорожденных. Микробиом. 2018; 6: 112.
PubMed PubMed Central Google ученый
Стюарт С.Дж., Эмблтон Н.Д., Маррс Э.Л., Смит Д.П., Фофанова Т., Нельсон А. и др. Продольное развитие микробиома и метаболома кишечника у недоношенных новорожденных с поздним началом сепсиса и здоровых людей. Микробиом. 2017; 5: 75.
PubMed PubMed Central Google ученый
Сингер JR, Blosser EG, Zindl CL, Silberger DJ, Conlan S, Laufer VA и др. Предотвращение дисбактериоза кишечного микробиома новорожденных мышей защищает от позднего сепсиса.Nat Med. 2019; 25: 1772–82.
CAS PubMed PubMed Central Google ученый
Masi AC, Stewart CJ. Роль кишечного микробиома недоношенных при сепсисе и некротизирующем энтероколите. Early Hum Dev. 2019; 138: 104854.
PubMed PubMed Central Google ученый
Хемми М.Х., Вольке Д., Шнайдер С. Связь между проблемами плача, сна и / или кормления в младенчестве и долгосрочными поведенческими результатами в детстве: метаанализ.Arch Dis Child. 2011; 96: 622–9.
PubMed PubMed Central Google ученый
Loughman A, Quinn T, Nation ML, Reichelt A, Moore RJ, Van TTH, et al. Детская микробиота при коликах: прогнозирующие ассоциации с проблемным плачем и последующим поведением ребенка. J Dev Orig Health Dis. 2020: 1–11. https://doi.org/10.1017/S2040174420000227.
Huttenhower C, Kostic AD, Xavier RJ. Воспалительное заболевание кишечника как модель трансляции микробиома.Иммунитет. 2014; 40: 843–54.
Воспалительное заболевание кишечника как модель трансляции микробиома.Иммунитет. 2014; 40: 843–54.
CAS PubMed PubMed Central Google ученый
Mayer EA, Tillisch K, Gupta A. Ось кишечника / мозга и микробиота. J Clin исследования. 2015; 125: 926–38.
PubMed PubMed Central Google ученый
Honda K, Littman DR. Микробиота в адаптивном иммунном гомеостазе и болезни. Природа. 2016; 535: 75–84.
CAS PubMed PubMed Central Google ученый
Schroeder BO, Bäckhed F. Сигналы от микробиоты кишечника к отдаленным органам в физиологии и болезнях. Nat Med. 2016; 22: 1079–89.
Nat Med. 2016; 22: 1079–89.
CAS PubMed PubMed Central Google ученый
Леви М., Колодзейчик А.А., Тайс К.А., Элинав Э. Дисбактериоз и иммунная система. Nat Rev Immunol. 2017; 17: 219–32.
CAS PubMed PubMed Central Google ученый
Марувада П., Леоне В., Каплан Л. М., Чанг Е.Б. Микробиом человека и ожирение: выход за рамки ассоциаций. Клетка. Хост-микроб. 2017; 22: 589–99.
CAS PubMed PubMed Central Google ученый
Бах Дж.Ф. Гипотеза гигиены при аутоиммунных заболеваниях: роль патогенов и комменсалов. Nat Rev Immunol. 2018; 18: 105–20.
Nat Rev Immunol. 2018; 18: 105–20.
CAS PubMed PubMed Central Google ученый
Браун JM, Хазен SL. Микробная модуляция сердечно-сосудистых заболеваний. Nat Rev.2018; 16: 171–81.
CAS Google ученый
Тилг Х., Змора Н., Адольф Т.Е., Элинав Э. Микробиота кишечника, питающая метаболическое воспаление. Nat Rev Immunol. 2020; 20: 40–54.
CAS PubMed PubMed Central Google ученый
Iacob S, Iacob DG. Инфекционные угрозы, кишечный барьер и его троянский конь: дисбактериоз.Front Microbiol. 2019; 10: 1676.
PubMed PubMed Central Google ученый
Fouhse JM, Yang K, More-Bayona J, Gao Y, Goruk S, Plastow G, et al. Воздействие амоксициллина на новорожденных изменяет долгосрочный иммунный ответ, несмотря на временное воздействие на кишечную микробиоту у поросят. Фронт Иммунол. 2019; 10: 2059.
CAS PubMed PubMed Central Google ученый
Бомонт М., Паес С., Муссар Э., Кнудсен С., Каукиль Л., Эймард П. и др. Метаболиты кишечной микробиоты способствуют созреванию кишечного барьера при переходе от сосания к отъему. Кишечные микробы. 2020; 11: 1268–86.
PubMed PubMed Central Google ученый
Suh SH, Choe K, Hong SP, Jeong SH, Mäkinen T., Kim KS, et al. Микробиота кишечника регулирует целостность молочных желез, индуцируя VEGF-C в макрофагах ворсинок кишечника.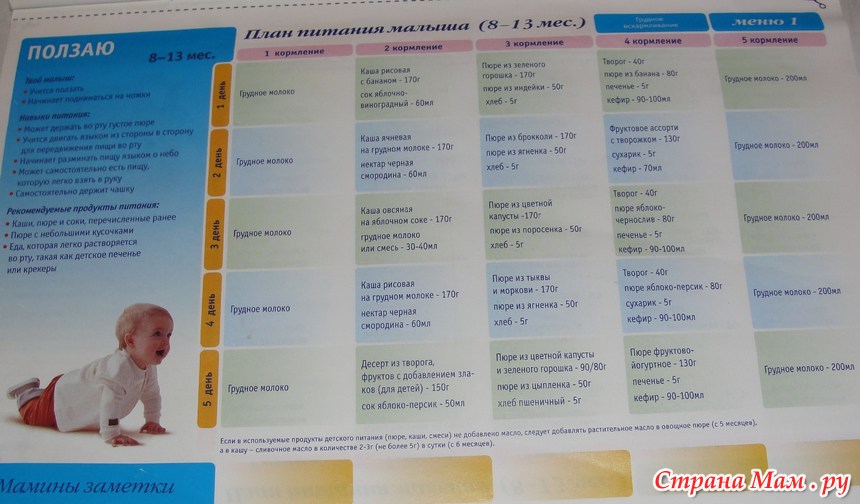 EMBO Rep.2019; 20: e46927.
EMBO Rep.2019; 20: e46927.
PubMed PubMed Central Google ученый
Kulkarni DH, McDonald KG, Knoop KA, Gustafsson JK, Kozlowski KM, Hunstad DA, et al. Прохождение антигена, связанное с бокаловидными клетками, ингибируется во время инфекции Salmonella typhimurium, чтобы предотвратить распространение патогена и ограничить реакцию на пищевые антигены. Mucosal Immunol. 2018; 11: 1103–13.
CAS PubMed PubMed Central Google ученый
Abo H, Chassaing B, Harusato A, Quiros M, Brazil JC, Ngo VL, et al. Регулятор-1 дифференцировки эритроидов, индуцированный микробиотой в раннем возрасте, управляет пролиферацией и регенерацией стволовых клеток кишечника. Nat Commun. 2020; 11: 513.
CAS PubMed PubMed Central Google ученый
Fung TC, Vuong HE, Luna CDG, Проновост Г.Н., Александрова А.А., Райли Н.Г. и др. Воздействие кишечного серотонина и флуоксетина модулирует бактериальную колонизацию кишечника.Nat Microbiol. 2019; 4: 2064–73.
PubMed PubMed Central Google ученый
Canfora EE, Meex RCR, Venema K, Blaak EE. Метаболиты кишечных микробов при ожирении, НАЖБП и СД2. Обзоры природы. Эндокринология. 2019; 15: 261–73.
CAS PubMed PubMed Central Google ученый
Lau WL, Vaziri ND. Микробные короткоцепочечные жирные кислоты кишечника и риск диабета.Нат Рев Нефрол. 2019; 15: 389–90.
Микробные короткоцепочечные жирные кислоты кишечника и риск диабета.Нат Рев Нефрол. 2019; 15: 389–90.
PubMed PubMed Central Google ученый
Санна С., ван Зуйдам Н.Р., Махаджан А., Курильщиков А., Вич Вила А., Воса У и др. Причинно-следственные связи между микробиомом кишечника, короткоцепочечными жирными кислотами и метаболическими заболеваниями. Нат Жене. 2019; 51: 600–5.
CAS PubMed PubMed Central Google ученый
Де Ваддер Ф., Ковачева-Датчари П., Гонсалвес Д., Винера Дж., Зитоун С., Дюшампт А. и др.Метаболиты, вырабатываемые микробиотой, улучшают метаболизм через нейронные цепи кишечника и мозга. Клетка. 2014; 156: 84–96.
PubMed PubMed Central Google ученый
Далиле Б., Ван Ауденхове Л., Вервлиет Б., Вербеке К. Роль короткоцепочечных жирных кислот в коммуникации между микробиотой, кишечником и мозгом. Нат Рев Гастроэнтерол Гепатол. 2019; 16: 461–78.
PubMed PubMed Central Google ученый
Parada Venegas D, De la Fuente MK, Landskron G, Gonzalez MJ, Quera R, Dijkstra G и др. Короткоцепочечные жирные кислоты (SCFAs), опосредуемые эпителиальной и иммунной регуляцией кишечника, и ее значение при воспалительных заболеваниях кишечника. Фронт Иммунол. 2019; 10: 277.
PubMed PubMed Central Google ученый
Frese SA, Hutton AA, Contreras LN, Shaw CA, Palumbo MC, Casaburi G, et al. Стойкость добавок Bifidobacterium longum subsp. Infantis EVC001 у младенцев на грудном вскармливании. мСфера. 2017; 2: e00501–17.
Infantis EVC001 у младенцев на грудном вскармливании. мСфера. 2017; 2: e00501–17.
PubMed PubMed Central Google ученый
Zheng N, Gao Y, Zhu W., Meng D, Walker WA. Короткоцепочечные жирные кислоты, образующиеся при взаимодействии кишечных комменсальных бактерий с сцеженным грудным молоком, обладают противовоспалительным действием в незрелых энтероцитах человека. PloS ONE. 2020; 15: e0229283.
CAS PubMed PubMed Central Google ученый
Waligora-Dupriet AJ, Dugay A, Auzeil N, Nicolis I, Rabot S, Huerre MR, et al. Короткоцепочечные жирные кислоты и полиамины в патогенезе некротического энтероколита: аспекты кинетики у гнотобиотических перепелов. Анаэроб. 2009; 15: 138–44.
CAS PubMed PubMed Central Google ученый
Рой С.К., Менг К., Садовиц Б.Д., Коллиш-Сингул М., Епури Н., Саталин Дж. И др. Энтеральное введение смеси, ферментированной бактериями, новорожденным поросятам: высокоточная модель некротического энтероколита (NEC).PloS ONE. 2018; 13: e0201172.
PubMed PubMed Central Google ученый
Meng D, Sommella E, Salviati E, Campiglia P, Ganguli K, Djebali K, et al. Индол-3-молочная кислота, метаболит триптофана, секретируемый Bifidobacterium longum подвид Infantis, оказывает противовоспалительное действие в незрелом кишечнике. Pediatr Res. 2020. https://doi.org/10.1038/s41390-019-0740-x.
Mukhopadhyay S, Wade KC, Puopolo KM.Препараты для профилактики и лечения сепсиса у новорожденных. Clin Perinatol. 2019; 46: 327–47.
PubMed PubMed Central Google ученый
Кабальеро-Флорес Г., Сакамото К., Цзэн М.Ю., Ван Й., Хаким Дж., Матус-Акунья В. и др. Иммунизация матери обеспечивает защиту потомства от прикрепляющегося и удаляющегося патогена за счет доставки IgG с грудным молоком. Клетка. Хост-микроб. 2019; 25: 313–23.e4.
CAS PubMed PubMed Central Google ученый
Mukhopadhyay S, Sengupta S, Puopolo KM. Проблемы и возможности рационального использования антибиотиков среди недоношенных детей. Arch Dis Child. 2019; 104: F327 – f32.
Google ученый
Шульман Дж., Диманд Р. Дж., Ли ХК, Дуэнас Г. В., Беннетт М. В., Гулд Дж. Б.. Применение антибиотиков в отделении интенсивной терапии новорожденных. Педиатрия. 2015; 135: 826–33.
PubMed PubMed Central Google ученый
Шульман Дж., Профит Дж., Ли ХК, Дуэнас Дж., Беннетт М.В., Паруча Дж. И др. Варианты использования антибиотиков в неонатальном периоде. Педиатрия. 2018; 142: e20180115.
PubMed PubMed Central Google ученый
Chi C, Buys N, Li C, Sun J, Yin C. Влияние пребиотиков на сепсис, некротический энтероколит, смертность, непереносимость кормления, время до полного энтерального питания, продолжительность пребывания в больнице и частоту стула в недоношенные дети: метаанализ. Eur J Clin Nutr. 2019; 73: 657–70.
Eur J Clin Nutr. 2019; 73: 657–70.
CAS PubMed PubMed Central Google ученый
Sun J, Marwah G, Westgarth M, Buys N, Ellwood D, Gray PH. Влияние пробиотиков на некротический энтероколит, сепсис, внутрижелудочковое кровоизлияние, смертность, продолжительность пребывания в больнице и прибавку в весе у очень недоношенных детей: метаанализ. Adv Nutr. 2017; 8: 749–63.
PubMed PubMed Central Google ученый
Deshpande G, Jape G, Rao S, Patole S. Преимущества пробиотиков у недоношенных новорожденных в странах с низким и средним доходом: систематический обзор рандомизированных контролируемых испытаний. BMJ Open. 2017; 7: e017638.
PubMed PubMed Central Google ученый
Dermyshi E, Wang Y, Yan C, Hong W, Qiu G, Gong X и др. «Золотой век» пробиотиков: систематический обзор и метаанализ рандомизированных и обсервационных исследований недоношенных детей.Неонатология. 2017; 112: 9–23.
CAS PubMed PubMed Central Google ученый
Olsen R, Greisen G, Schroder M, Brok J. Профилактические пробиотики для недоношенных детей: систематический обзор и метаанализ наблюдательных исследований. Неонатология. 2016; 109: 105–12.
PubMed PubMed Central Google ученый
Куанг Л., Цзян Ю. Эффект пробиотических добавок у беременных женщин: метаанализ рандомизированных контролируемых исследований.Br J Nutr. 2020; 123: 870–80.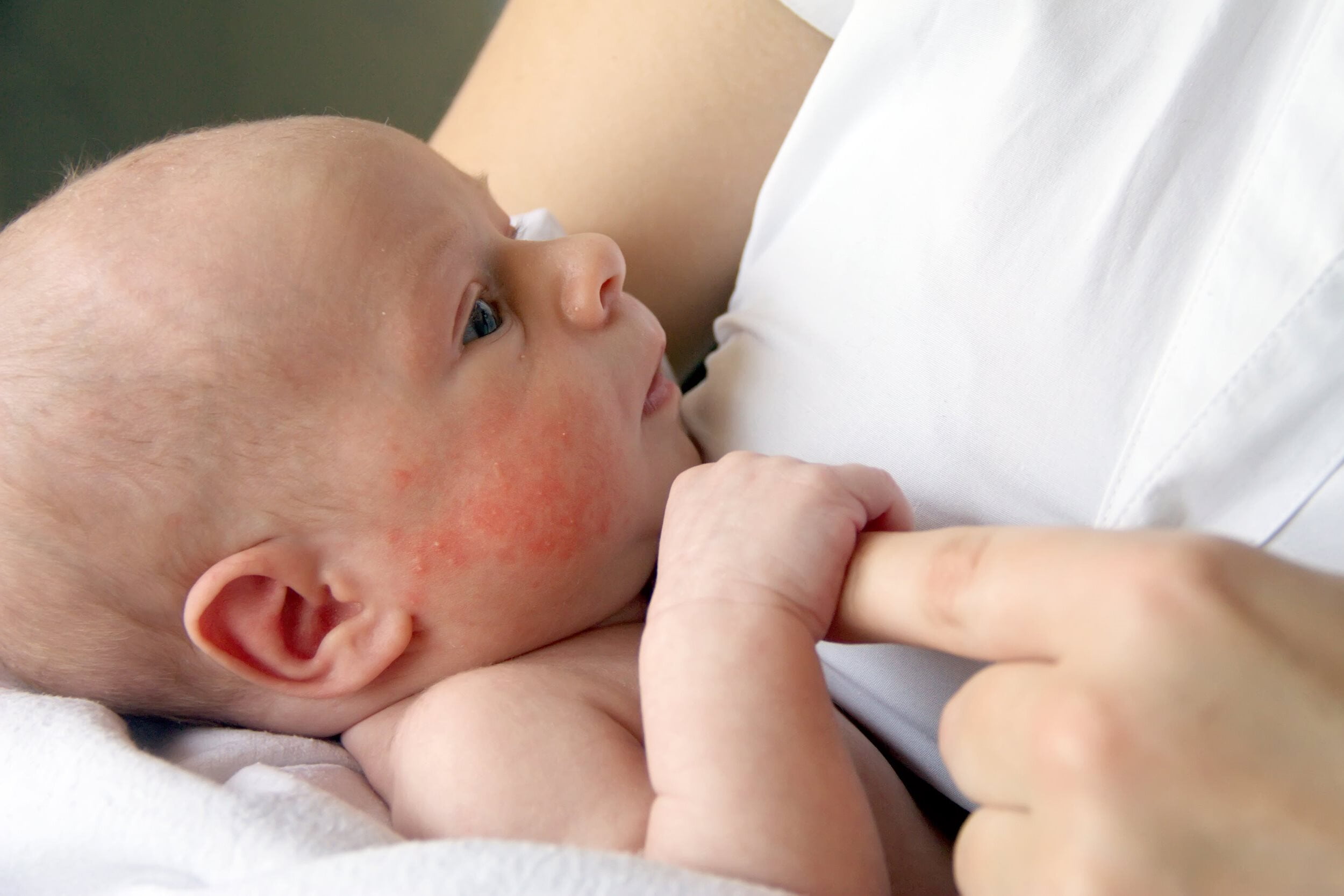
CAS Google ученый
Skonieczna-Zydecka K, Janda K, Kaczmarczyk M, Marlicz W., Loniewski I, Loniewska B. Влияние пробиотиков на симптомы, микробиоту кишечника и маркеры воспаления при детской колике: систематический обзор, метаанализ и мета-регрессия рандомизированных контролируемых исследований. J Clin Med. 2020; 9: 999.
CAS Google ученый
van den Akker CHP, van Goudoever JB, Shamir R, Domellof M, Embleton ND, Hojsak I, et al. Пробиотики и недоношенные дети: позиционный документ Европейского общества педиатрической гастроэнтерологии, гепатологии и комитета по питанию по вопросам питания и рабочей группы Европейского общества педиатрической гастроэнтерологии, гепатологии и питания по пробиотикам и пребиотикам. J Pediatr Gastroenterol Nutr. 2020; 70: 664–80.
J Pediatr Gastroenterol Nutr. 2020; 70: 664–80.
Google ученый
van den Akker CHP, van Goudoever JB, Szajewska H, Embleton ND, Hojsak I., Reid D., et al. Пробиотики для недоношенных детей: систематический обзор штаммов и сетевой метаанализ. J Pediatr Gastroenterol Nutr. 2018; 67: 103–22.
Google ученый
Su GL, Ko CW, Bercik P, Falck-Ytter Y, Sultan S, Weizman AV, et al. Руководство AGA по клинической практике о роли пробиотиков в лечении желудочно-кишечных расстройств.Гастроэнтерология. 2020. https://doi.org/10.1053/j.gastro.2020.05.059.
Льюис З. Т., Шани Г., Масарве К. Ф., Попович М., Фрезе С. А., Села Д. А. и др. Подтверждение идентичности видов и подвидов бифидобактерий в коммерческих пробиотических продуктах. Pediatr Res. 2016; 79: 445–52.
CAS Google ученый
Chiang MC, Chen CL, Feng Y, Chen CC, Lien R, Chiu CH. Lactobacillus rhamnosus сепсис, связанный с терапией пробиотиками у крайне недоношенных новорожденных: патогенез и обзор для клиницистов.J Microbiol Immunol Infect. 2020. https://doi.org/10.1016/j.jmii.2020.03.029
Pell LG, Loutet MG, Roth DE, Sherman PM. Аргументы против рутинного приема пробиотиков для профилактики NEC. Curr Opin Pediatrics. 2019; 31: 195–201.
Google ученый
Влияние собственного материнского молока и различных пропорций смеси на кишечную микробиоту очень недоношенных новорожденных
Абстрактные
Цель
Для определения различий в микробиоте стула недоношенных детей с учетом использования исключительно собственного материнского молока и смеси в различных пропорциях в первые 28 дней жизни.
Методы
В исследование были включены новорожденные с GA ≤ 32 недель, разделенные на 5 групп в соответствии с режимом кормления: 7 исключительно собственным материнским молоком, 8 эксклюзивными смесями для недоношенных детей, 16 смешанных кормлений с> 70% собственного материнского молока, 16 смешанного вскармливания с> 70% молочных смесей для недоношенных детей. , и 15 смешанных 50% собственного материнского молока и смеси для недоношенных детей. Критерии исключения: врожденные инфекции, врожденные пороки развития и новорожденные от наркозависимых матерей. Стул собирали еженедельно в течение первых 28 дней.Были выполнены экстракция микробной ДНК, амплификация 16S рРНК и секвенирование.
Результаты
Все группы были похожи по перинатальным и неонатальным данным. Между лечением наблюдались значительные различия в микробном сообществе. Примерно 37% различий в расстоянии между микробными сообществами объясняется использованием исключительно собственного материнского молока по сравнению с другими диетами. Диета, состоящая из исключительно собственного материнского молока, позволяла повысить микробное богатство (в среднем 85 OTU), в то время как диеты, основанные предпочтительно на детских смесях, эксклюзивных смесях, предпочтительно материнском молоке, и смеси из молочных смесей и материнского молока, содержали в среднем 9, 29, 23 и 25 OTU соответственно.Средняя доля представителей рода Escherichia и Clostridium всегда была больше у тех, кто содержал смесь, чем у тех, кто содержал только материнское молоко.
Выводы
Фекальная микробиота в неонатальном периоде недоношенных детей, которых кормили исключительно собственным материнским молоком, характеризовалась повышенным богатством и отличиями в микробном составе от тех, которых кормили смесью разных пропорций.
Образец цитирования: Zanella A, Silveira RC, Roesch LFW, Corso AL, Dobbler PT, Mai V, et al.(2019) Влияние собственного материнского молока и различных пропорций смеси на кишечную микробиоту очень недоношенных новорожденных. PLoS ONE 14 (5): e0217296. doi: 10.1371 / journal.pone.0217296
Редактор: Пол Дженсен, Иллинойсский университет в Урбана-Шампейн, США
Поступила: 24 октября 2018 г .; Принята к печати: 8 мая 2019 г .; Опубликовано: 20 мая 2019 г.
Авторские права: © 2019 Zanella et al. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные находятся в рукописи. Необработанные последовательности были депонированы в Архив считывания последовательностей (SRA) под идентификатором BioProject ID: PRJNA524815. Номера прогонов от SRR8649276 до SRR8649252.
Финансирование: Финансирование было предоставлено Фондом Билла и Мелинды Гейтс (OPP1107597) и CNPQ и DECIT Ministerio da Saude Brasil. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Микробиота кишечника очень важна для метаболизма, развития и поведения человека [1,2]. Несмотря на несколько исследований по этой теме и ее связи с заболеваниями высокой сложности [1,3,4], исследования были основаны на культуре, генетическом профиле и / или использовании небольших размеров выборки, что дает понять, что переменные, ответственные за формирование кишечная микробиота изучена недостаточно [1,5,6].Известно, что развитие детской микробиоты зависит от медицинских и диетических факторов [1,7], но пока не известно, как эти факторы влияют на общий микробный состав и их связь с человеческим телом [1]. В человеческом теле есть миллионы микроорганизмов, которые работают в сотрудничестве с нашими собственными клетками, чтобы влиять на качество нашего здоровья на протяжении всей жизни [8,9]. На состав кишечного микробиома детского возраста влияют такие факторы, как тип рождения, гестационный и послеродовой возраст, прием антибиотиков, окружающая среда, пищевые воздействия и грудное вскармливание, которые следует выделить как важную переменную для сборки кишечной микробиоты. [5,8,10,11,12].Ла Роса и др. Показали, что микробиома кишечника недоношенных детей, поступивших в отделения интенсивной терапии новорожденных, прогрессирует, а состав бактериальной популяции изменяется с течением времени [6]. Несмотря на влияние грудного молока по сравнению с детской смесью на сборку микробиоты кишечника, истинное влияние грудного молока собственной матери на состав кишечного микробиома недоношенных детей до конца не изучено [8].
На микробиоту незрелого кишечника недоношенных новорожденных влияют такие факторы, как послеродовой возраст, гестационный возраст, масса тела при рождении и воздействие нутриентов [8,13,14,15].В конкретном случае грудного вскармливания это, по-видимому, маскирует влияние массы тела при рождении, что предполагает защитную функцию против незрелости кишечника недоношенного новорожденного в начале жизни [8]. Эти данные свидетельствуют не только о существовании микробного механизма, лежащего в основе совокупности доказательств, объясняющих, что грудное молоко способствует здоровью кишечника недоношенных новорожденных [16], но также о динамическом взаимодействии хозяина и пищевых факторов, которые помогают в колонизации и обогащении. специфических микробов при формировании микробиоты кишечника [8].
Таким образом, целью данного исследования является описание кишечной микробиоты младенцев с очень низкой массой тела при рождении в первые 28 дней в зависимости от использования материнского молока или смеси в различных пропорциях.
Материалы и методы
В этом исследовании использовалась удобная стратегия выборки с пациентами, набранными из отделения неонатологии Клинической больницы Порту-Алегри (HCPA), Бразилия, с мая 2014 г. по январь 2017 г. Беременные женщины с гестационным возрастом ≤ 32 недель, предоставившие письменные информированное согласие было зарегистрировано при госпитализации для их доставки.Протокол исследования был одобрен этическим комитетом Клинической больницы Порту-Алегри (HCPA), и опекуны подписали форму информированного согласия. Критериями исключения были: 1) ВИЧ или врожденные инфекции, 2) матери, злоупотребляющие психоактивными веществами, и 3) врожденные пороки развития новорожденных. Образцы еженедельного стула младенцев собирали из подгузников, начиная с первого стула до 4 -й недели жизни. Все образцы немедленно хранили в жидком азоте до экстракции ДНК.
Новорожденные были разделены на пять групп в зависимости от типа вскармливания: исключительно собственное материнское молоко (LME), эксклюзивное молоко (PFL), смешанное 50% собственного материнского молока и 50% смеси (MFLM), смешанное с молоком и 70% или более собственного молока. материнское молоко (PLM), смешанное с молоком собственной матери и 70% или более смеси (PFL).Новорожденные получали одинаковую диету ежедневно до 28 дней. Разные количества смеси и собственного материнского молока предлагались отдельно в разное время дня, чтобы в конце дня соотношение сохранялось. Соотношение грудного молока и смеси было ограничением доступного количества грудного молока. Используемая формула для преждевременных родов — Pre Nan. Эта формула не содержит ни пробиотиков, ни пребиотиков.
Акушерские данные и неонатальные данные были собраны проспективно.
Экстракция ДНК и подготовка библиотеки 16S рРНК
Лабораторная методика, подробно описанная ранее [16].
Микробную ДНК выделяли из образцов с использованием мини-набора QIAmp Fast DNA Stool Mini (Qiagen, Валенсия, Калифорния, США), следуя инструкциям производителя с изменениями. Все образцы ДНК хранили при -80 ° C до использования. Область V4 гена 16S рРНК была амплифицирована и секвенирована с использованием платформы PGM Ion Torrent (Thermo Fisher Scientific, Уолтем, Массачусетс, США) со штрих-кодами бактериальных / архейных праймеров 515F и 806R [17].ПЦР-амплификацию проводили с использованием штрих-кодированных праймеров, связанных с последовательностью ионного адаптера «A» (5′-CCATCTCATCCCTGCGTGTCTCCGACTCAG-3 ‘) и последовательностью ионного адаптера P1 (5′-CCTCTCTATGGGCAGTCGGTGAT-3’) для получения последовательности праймера, составленного для A- адаптер штрих-код-806R и P1-515F и праймеры. Каждый из 25 мкл смеси для ПЦР состоял из 2 единиц Platinum Taq DNA High Fidelity Polymerase (Invitrogen, Carlsbad, CA, USA), 4 мкл 10X буфера для ПЦР High Fidelity PCR, 2 мМ MgSO4, 0,2 мМ dNTP, 0,1 мкМ праймера 806R со штрих-кодом и праймер 515F, 25 мкг сверхчистого BSA (Invitrogen, Carlsbad, CA, USA) и примерно 50 нг матрицы ДНК.Использовали следующие условия ПЦР: 95 ° C в течение 5 минут, 35 циклов денатурации при 94 ° C в течение 45 секунд; отжиг при 56 ° C в течение 45 с и удлинение при 72 ° C в течение 1 мин; с последующим заключительным этапом удлинения при 72 ° C в течение 10 мин.
Полученные продукты ПЦР очищали с помощью реагента Agencourt AMPure XP (Beckman Coulter, Бреа, Калифорния, США), и конечную концентрацию продукта ПЦР определяли количественно с использованием набора флуорометра Qubit (Invitrogen, Карлсбад, Калифорния, США) в соответствии с рекомендациями производителя. рекомендации. Наконец, реакции были объединены в эквимолярных концентрациях для создания смеси, состоящей из амплифицированных фрагментов гена 16S каждого образца.Этот составной образец использовали для подготовки библиотеки с помощью системы Ion OneTouch 2 с шаблоном набора Ion PGM Template OT2 400 (Thermo Fisher Scientific, Waltham, MA, USA). Секвенирование выполняли с использованием Ion PGM Sequencing 400 в системе Ion PGM с использованием Ion 318 Chip v2 с максимум 40 образцами на микрочип.
Обработка последовательности
Необработанные последовательности 16S рРНК анализировали в соответствии с рекомендациями Brazilian Microbiome Project [18]. Вкратце, таблица OTU (Operational Taxonomic Unit) была построена с использованием конвейера UPARSE [19], в котором чтения были усечены до 200 бит / с и качество отфильтровано с использованием максимальной ожидаемой ошибки 0.5. Отфильтрованные чтения были дереплицированы и синглтоны были удалены. После кластеризации последовательностей в OTU, с отсечкой сходства 97%, химеры были проверены для получения репрезентативных последовательностей для каждого микробного филотипа. Таксономическая классификация проводилась с использованием SINTAX [20] по отношению к базе данных Ribosomal Database Project (RDP) [21] с порогом достоверности 80%. Объем выборки оценивался с использованием охвата Гуда [22].
Статистический анализ.
Все клинические данные были проанализированы с помощью программного обеспечения SPSS 21.0 на уровне значимости 5%. Количественные переменные с нормальным распределением были описаны с помощью среднего / стандартного отклонения и сравнены с помощью ANOVA с тестом Тьюки. Количественные переменные с асимметричным распределением описывались через медианный / межквартильный размах и сравнивались с помощью теста Краскалла-Уоллиса с тестом Данна. Для сравнения пропорций использовали критерий хи-квадрат Пирсона в сочетании с скорректированным анализом остатков.
Для всех последующих анализов 16S рРНК набор данных был отфильтрован, сохранены только OTU, которые присутствовали по крайней мере в 30% образцов в каждой обработке и разрежены до того же количества последовательностей [23].Файл биомов был импортирован в среду R [24], и оценки альфа- и бета-разнообразия были рассчитаны с использованием пакета «phyloseq» [25], а затем построены с использованием пакета «ggpltot2».
Чтобы получить доступ к основным различиям между методами лечения в этом исследовании, был использован пермутационный многомерный дисперсионный анализ (PERMANOVA) [26], выполненный с использованием биномиальной матрицы несходства между образцами и функции adonis , реализованной в веганском пакете [27].
Различия между обработками были доступны с помощью программного обеспечения STAMP [28].P-значения были получены с помощью двустороннего непараметрического t-критерия Уайта с последующей поправкой Бенджамини-Хохберга FDR. Значение p <0,05 вместе с фильтром размера эффекта (разница между пропорциями размера эффекта <1,00) применялось для определения наиболее важных таксонов, которые различались между обработками.
Анализ в течение 28-дневного периода был выполнен с использованием метаанализа величины эффекта, представленного в нескольких точках, с использованием общего линейного смешанного режима [29].
Результаты
Всего было собрано и проанализировано 175 образцов от 62 недоношенных новорожденных, разделенных на пять групп (7 в LME, 8 в FLE, 16 в PLM, 16 в PFL и 15 в MFLM).Эти пять групп были похожи по материнским и акушерским данным (Таблица 1).
РазвернутьТаблица 1. Характеристики испытуемых.doi: 10.1371 / journal.pone.0217296.t001
Более »Неонатальные данные представлены в таблице 2.
РазвернитеТаблицу 2. Неонатальные данные по исследуемой группе.doi: 10.1371 / journal.pone.0217296.t002
Более »Общие различия микробного сообщества между диетами
Различия микробного сообщества на уровне OTU (97% отсечка сходства для определения группировки), обнаруженные среди образцов фекалий недоношенных новорожденных, которых кормили пятью разными рационами в течение 28 дней, представлены на рис. 1.Проведенный анализ выявил значительные различия в структуре микробного сообщества при лечении, предполагая, что кормление с использованием разных диет было ответственно за сборку кишечного сообщества недоношенных. Эти различия были дополнительно подтверждены перестановочным многомерным дисперсионным анализом (таблица 3).
РазвернутьРис. 1. Сравнение бета-разнообразия микробных сообществ.A и B. График A представляет кластеры микробных сообществ. Каждая точка представляет собой отдельный образец, а цвета указывают на способы кормления.График B представляет собой измерение многомерной дисперсии для каждой обработки. FLE = исключительная формула; LME = исключительно собственное материнское молоко; MFLM = 50% смеси и 50% собственного материнского молока; PFL = ≥70% формула; PLM = ≥70% собственного материнского молока.
doi: 10.1371 / journal.pone.0217296.g001
Более » РазвернитеТаблицу 3. Перестановочный многомерный дисперсионный анализ, сравнивающий микробные сообщества, обнаруженные в образцах фекалий недоношенных новорожденных, которых кормили разными диетами в течение 28 дней.doi: 10.1371 / journal.pone.0217296.t003
Более »Общий анализ (все образцы) показывает, что примерно 31% вариации расстояний между обработками объясняется различными диетами, предусмотренными для каждого лечения. Парные сравнения показали, что диеты, основанные на материнском молоке, объединяли микробные сообщества с большим разбросом внутри группы (например, большие различия между микробными сообществами от субъектов, которых кормили материнским молоком), в то время как диеты, основанные на смесях, создавали более похожие микробные сообщества (Рис. 1A и 1B) (Таблица 3 ).Использование материнского молока явилось причиной наибольших различий между диетами. Наибольшая разница между обработками наблюдалась среди образцов исключительно собственного материнского молока и образцов исключительно из смеси. Примерно 37% различий в расстоянии между микробными сообществами можно объяснить лечением только материнским молоком (LME) по сравнению с диетой, основанной преимущественно на смесях (PFL).
Кроме того, наибольшие различия в расстоянии между обработками наблюдались в тех сравнениях, в которых использовалось только материнское молоко.Примерно 37% различий в расстоянии между микробными сообществами можно объяснить лечением только материнским молоком по сравнению с диетой, основанной преимущественно на смесях (Таблица 3).
В соответствии с ординационным анализом, измерения альфа-разнообразия показали значительные различия (p-значение <0,001 в соответствии с тестом Краскела-Уоллиса) среди богатства OTU в рамках лечения (рис. 2). Рацион, состоящий только из материнского молока (LME), позволял увеличить микробное богатство (в среднем 85 OTU).С другой стороны, диета, предпочтительно основанная на формуле (PFL), имела наименьшее богатство (в среднем 9 OTU) (рис. 2). Среднее количество ОТЕ, обнаруженных в других диетах, было аналогичным. Диеты, основанные только на смеси (FLE) и предпочтительно материнском молоке (PLM), содержали в среднем 29 и 23 OTU соответственно, а диета, основанная на смеси смеси и материнского молока, содержала в среднем 25 OTU.
РазвернитеРисунок 2. Количество операционных таксономических единиц, измеренных в образцах фекалий недоношенных детей, которых кормили разными диетами в течение 28 дней.Ячейки охватывают с первого по третий квартили; горизонтальная линия внутри прямоугольников представляет собой медианное значение. Усы, идущие вертикально от прямоугольников, указывают на изменчивость за пределами верхнего и нижнего квартилей. В соответствии с тестом Краскела-Уоллиса (p-value <0,001) методы лечения существенно различались, причем наибольшее разнообразие наблюдалось в группе, исключительной для женского молока. FLE = исключительная формула; LME = исключительно собственное материнское молоко; MFLM = 50% смеси и 50% собственного материнского молока; PFL = ≥70% формула; PLM = ≥70% собственного материнского молока.Все библиотеки были разрежены при одинаковом количестве последовательностей перед анализом OTU.
doi: 10.1371 / journal.pone.0217296.g002
Более »Выявление основных таксономических различий между диетами
После выявления общих различий среди микробных сообществ, обнаруженных в образцах фекалий недоношенных новорожденных, которых кормили разными диетами в течение 28 дней, следующим шагом было определение таксонов микробов, ответственных за это различие. Чтобы обнаружить различия между обработками на уровне рода, была проведена попарная дифференциальная численность на основе двустороннего непараметрического t-критерия Уайта с последующей поправкой Бенджамини-Хохберга FDR.Поскольку лечение LME показало наибольшую разницу в микробном сообществе между диетами, были проведены попарные сравнения между LME и другими диетами (рис. 3).
РазвернутьРисунок 3. Различная численность микробов среди микробных сообществ, обнаруженная в образцах от недоношенных детей, которых кормили разными диетами в течение 28 дней.p-значения были получены с помощью двустороннего непараметрического t-критерия Уайта с последующей поправкой Бенджамини-Хохберга FDR. Значение p <0,05 вместе с фильтром размера эффекта (разница между пропорциями размера эффекта <1.00) был применен для определения наиболее важных таксонов, которые различались между обработками. Показаны только статистически значимые различия.
doi: 10.1371 / journal.pone.0217296.g003
Более »Средняя доля представителей рода Escherichia всегда была больше при лечении смесями (FLE, PLM, MFLM и PFL), чем при лечении только материнским молоком. В частности, рацион, основанный на материнском молоке, представил повышенное количество Acinetobacter , Bradyrhizobium , Caulobacter , Corynebacterium и Paenibacillus , Burkholderia 46, Burkholderia gen. Microbacteriaceae семейства по сравнению с другими препаратами.По сравнению с диетой, основанной на материнском молоке, диета, предпочтительно основанная на материнском молоке (PLM), и диета, состоящая из смеси молочных смесей и материнского молока, увеличивали численность Clostridium и Escherichia . Образцы фекалий новорожденных, получавших диету, предпочтительно основанную на смеси (PFL), показали большее количество Escherichia , Salmonella , Enterococcus и неизвестный род из семейства Enterobacteriaceae по сравнению с обработкой LME (рис. ).
Обсуждение
Переменные, влияющие на состав кишечной микробиоты, являются предметом многочисленных исследований. Предполагается, что, когда они известны и поняты, можно разработать новые стратегии для поддержания состояния здоровья [30,31,32]. В этом исследовании мы обнаружили глобальные различия в микробном сообществе между типами молока, которое давали недоношенным детям, показывая, что наибольшее микробное богатство было обнаружено у тех, кого кормили исключительно собственным материнским молоком.Примерно 37% различий в расстоянии между микробными сообществами объясняется лечением исключительно грудным молоком по сравнению с диетами, основанными предпочтительно на смеси.
Знание общего количества бактерий в зависимости от типа кормления позволяет нам понять определенные ситуации, которые способствуют развитию болезней [8,31,32,33]. В нашем исследовании образцы фекалий недоношенных детей, получавших разные диеты, играли решающую роль в разнообразии микробного сообщества в течение 28-дневного периода.Все младенцы были недоношенными и были разделены в соответствии с типом питания. Кормление их собственным материнским молоком позволило увеличить микробное богатство (в среднем 85 OTU). Группа, основанная на формуле, имела самое низкое богатство (в среднем 9 OTU). Эти диеты, основанные на эксклюзивном предложении смеси и, предпочтительно, грудного молока, показали в среднем 29 и 23 ОТЕ соответственно; а диета, основанная на смеси молочных смесей и грудного молока, содержала в среднем 25 ОТЕ.
Грегори и др. Изучили 30 недоношенных детей (по 10 в каждой группе) в течение первых 60 дней жизни, которых кормили материнским грудным молоком, пастеризованным донорским грудным молоком и смесью для недоношенных детей.Было обнаружено, что те, кого кормили материнским грудным молоком, имели большее разнообразие [8]. Cacho et al. Показали, что инкубация собственного материнского молока с донорским грудным молоком в течение 4 часов может восстановить микробиом материнского молока [31]. Мы не смешивали грудное молоко с молочными смесями. Мы предлагали их индивидуально в разных пропорциях в течение дня. Наши данные показали, что это несмешанное введение грудного молока и смеси не определяет восстановление микробиомы грудного молока.
В нашем исследовании средняя доля представителей рода Escherichia и Clostridium всегда была выше при лечении, содержащем смесь, чем при лечении, которое обеспечивало исключительно грудным молоком. Об этом сообщалось ранее [6]. Возможное объяснение результатов находится в передаче, осуществляемой от матери ребенку и внешней среде после рождения, как уже указывалось в других исследованиях [33,34]. Кроме того, в грудном молоке есть такие факторы, как лактоферрин и гликопротеины, которые защищают от патогенных бактерий [35, 36].
Несмотря на несколько исследований по теме и связи предмета с заболеваниями высокой сложности [1,3,4], такие исследования были ограничены перечислением таких болезней на основе культуры, генетического профиля (16S) и использования малых образцы, что дает понять, что переменные, которые формируют кишечную микробиоту, не были должным образом изучены [1,5,6]. Известно, что развитие микробиоты у младенцев зависит от медицинских и диетических факторов (1,7), но пока не известно, как эти факторы влияют на общий состав микробиоты и как эти факторы взаимодействуют друг с другом. [1].Исследования, основанные на образцах кала младенцев и их матерей, способствуют мониторингу каждой хронологической и функциональной стадии в течение первого года жизни [1,34].
Помимо увеличения количества микробов, грудное молоко также способствует профилактике сепсиса, некротического энтероколита (НЭК) и других заболеваний [29,31,33,37]. НЭК является одной из основных причин заболеваемости и смертности в отделениях интенсивной терапии новорожденных, при этом большинство случаев приходится на недоношенных детей [32,37]. В другом исследовании нашей группы мы приводим доказательства связи между NEC и нарушениями нормального развития микробиоты и низким разнообразием в случаях NEC [32].В рамках этого исследования мы обнаружили, что увеличение разнообразия и грудное вскармливание коррелируют со снижением заболеваемости НЭК [32]. Mai et al. Сообщили о микробиоте, предрасполагающей к позднему началу сепсиса у недоношенных детей, которая была ближе к микробиоте, которую мы обнаружили у недоношенных новорожденных, которых не кормили исключительно грудным молоком собственной матери [38].
Другие исследования подчеркивают влияние диеты в соответствии с этническими и / или географическими характеристиками как переменные, которые влияют на развитие кишечной микробиоты новорожденных [39,40,41].В нашем исследовании эти вопросы не рассматривались, потому что они не были в центре внимания исследования, оставляя открытыми перспективы для инновационных исследований.
Микробиом, обнаруженный в грудном молоке, в краткосрочной и долгосрочной перспективе способствует предотвращению колонизации патогенами, поскольку он стимулирует выработку реактивных антител и создает здоровый микробиом кишечника, способный предотвратить долгосрочные заболевания, такие как ожирение, диабет 2 типа. , хроническое воспаление кишечника, аутоиммунные заболевания, аллергия, синдром раздраженного кишечника и аллергический гастроэнтерит [31,42,43,44].Наше исследование подтверждает, что кишечная микробиота недоношенных детей различается в зависимости от их диеты — будь то грудное молоко или смесь — и подчеркивает важность грудного молока в поддержании микробного богатства микробиоты новорожденного. Escherichia и Clostridium были связаны с NEC, а также высокая доля Proteobacteria с небольшими числами с Firmicutes [45].
Некоторые ситуации, однако, пересекались с этим исследованием, например, потеря образцов кала; трудности, с которыми матери могут кормить недоношенных детей грудным молоком, исключительно из-за социально-экономических трудностей, например; и низкий объем каловых масс недоношенных детей.Еще один важный момент, который следует учитывать при анализе кишечной микробиоты новорожденного, мы анализируем только стул, и мы не знаем микробиоту проксимального отдела толстой кишки и тонкой кишки. Мы не могли скорректировать микробный анализ для веса при рождении и гестационного возраста, потому что количество субъектов в группе исключительно грудного молока было недостаточно большим. Очень трудно кормить крайне недоношенных новорожденных исключительно грудным молоком в течение всего периода в отделении интенсивной терапии, поэтому нам не разрешили изучать различные переменные.Нашей целью было сравнить эксклюзивное молочное вскармливание собственной матери с различными пропорциями кормления смесью. Мы изучали только крайне недоношенных новорожденных, все они относились к одной и той же категории недоношенных, и эти небольшие различия в массе тела при рождении и гестационном возрасте, вероятно, не имели серьезных последствий для микробиомы.
Многие исследования были посвящены проблеме грудного вскармливания, особенно в отношении микробиоты новорожденных, чтобы определить ее преимущества для развития и профилактики заболеваний на протяжении всей их жизни.Учитывая важность темы, это исследование было направлено на описание кишечной микробиоты недоношенных новорожденных в соответствии с их пищевыми привычками, с установлением модификаций кишечной микробиоты в соответствии с типом применяемой энтеральной диеты.
На основании наших данных было замечено, что глобальные различия микробного сообщества обнаруживаются среди типов диет, применяемых для недоношенных детей, показывая, что наибольшее микробное богатство было обнаружено у тех, кто получал исключительно собственное материнское молоко по сравнению с теми, кто получал различная пропорция формулы.
Благодарности
Это исследование было поддержано грантом Фонда Билла и Мелинды Гейтс, CNPQ и DECIT / Ministério da Saúde do Brasil.
Ссылки
- 1. Bäckhed F, Roswall J, Peng Y, Feng Q, Jia H, Kovatcheva-Datchary P, et al. Динамика и стабилизация микробиома кишечника человека в течение первого года жизни. Клеточный микроб-хозяин. 2015; 17: 690–703. DOI: 10.1016 / j.chom.2015.04.004. pmid: 25974306
- 2.
Кабрейро Ф., Самоцветы Д.Черви тоже нуждаются в микробах: микробиота, здоровье и старение у Caenorhabditis elegans. EMBO Mol Med. 2013; 5: 1300–1310. DOI: 10.1002 / emmm.201100972. pmid: 23
8
- 3. Консорциум проекта «Микробиом человека». Структура, функции и разнообразие микробиома здорового человека. Природа. 2012; 486: 207–214. DOI: 10,1038 / природа11234. pmid: 22699609
- 4. Ли Дж, Цзя Х, Цай Х, Чжун Х, Фэн Кью, Сунагава С. и др. Консорциум MetaHIT. Интегрированный каталог эталонных генов микробиома кишечника человека. Нат Биотехнолог . 2014; 32: 834–841. DOI: 10,1038 / НБТ.2942. pmid: 24997786
- 5. Домингес-Белло М.Г., Костелло Е.К., Контрерас М., Магрис М., Идальго Г., Фирер Н. и др. R. Способ доставки определяет приобретение и структуру исходной микробиоты в различных средах обитания новорожденных. Proc Natl Acad Sci USA . 2010; 107: 11971–11975. DOI: 10.1073 / pnas.1002601107. pmid: 20566857
- 6. Субраманиан С., Хук С., Яцуненко Т., Хак Р., Махфуз М., Алам М. и др.Стойкая незрелость кишечной микробиоты у голодающих детей Бангладеш. Природа . 2014; 510: 417–421. DOI: 10,1038 / природа13421. pmid: 24896187
- 7. Ла Роса PS, Warner BB, Zhou Y, Weinstock GM, Sodergren E, Hall-Moore и др. Структурированное развитие бактериальных популяций в кишечнике недоношенных детей. Proc . Нац. . Акад. . Наука . США . 2014; 111: 12522–12527. DOI: 10.1073 / pnas.1409497111. pmid: 25114261
- 8.Грегори К.Е., Самуэль Б.С., Хоутелинг П., Шан Г., Осубель Ф.М., Садреев Р.И. и др. Влияние проглатывания материнского грудного молока на приобретение кишечного микробиома у недоношенных детей. Микробиом . 2016; 4:68. DOI: 10.1186 / s40168-016-0214-х. pmid: 28034306
- 9. Houghteling P, Walker WA. Почему первоначальная бактериальная колонизация кишечника важна для здоровья младенца и ребенка? J Педиатр Гастроэнтерол Нутр . 2015; 60: 294–307.DOI: 10.1097 / MPG.0000000000000597. pmid: 25313849
- 10. Zeissig S, Blumberg RS. Жизнь в начале: нарушение микробиоты антибиотиками в раннем возрасте и его роль в здоровье и болезнях. Нат Иммунол . 2014; 15: 307–10. DOI: 10,1038 / NI.2847. pmid: 24646587
- 11. Брукс Б., Фирк Б.А., Миллер С.С., Шарон И., Томас Б.К., Бейкер Р. и др. Микробы в отделении интенсивной терапии новорожденных напоминают микробы, обнаруженные в кишечнике недоношенных детей. Микробиом . 2014; 2: 1. DOI: 10.1186 / 2049-2618-2-1. pmid: 24468033
- 12. Ардешир А., Нараян Н.Р., Мендес-Лагарес Г., Лу Д., Раух М., Хуанг Й. и др. У новорожденных макак-резусов на грудном и искусственном вскармливании развиваются различные кишечные микробиоты и иммунная система. Научный перевод . 2014; 6: 252ra120. DOI: 10.1126 / scitranslmed.3008791. pmid: 25186175
- 13. Boix-Amorós A, Collado MC, Mira A. Взаимосвязь между микробиотой молока, бактериальной нагрузкой, макроэлементами и человеческими клетками во время лактации. Передний микробиол . 2016; 7: 492 DOI: 10.3389 / fmicb.2016.00492. pmid: 27148183
- 14. Ходяр-Пардо П., Мира-Паскуаль Л., Колладо М.С., Мартинес-Коста К. Влияние на стадию, период беременности и способ родоразрешения на микробиоту грудного молока. Дж . перинатол .2014; 34: 599–605. DOI: 10.1038 / jp.2014.47. pmid: 24674981
- 15. Кабрера-Рубио Р., Мира-Паскуаль Л., Мира А., Колладо МС. Влияние способа родоразрешения на состав молочной микробиоты здоровых женщин. Дж . Дев . Ориг . Здоровье . 2016; 7: 54–60. DOI: 10.1017 / S2040174415001397. pmid: 26286040
- 16. Рош Л.Ф., Сильвейра Р.К., Корсо А.Л., Добблер П.Т., Май В., Рохас Б.С. и др. Разнообразие и состав микробиоты влагалища беременных женщин с риском передачи стрептококков группы B, получавших пенициллин во время родов. PLoS One. 2017; 12 (2): e0169916. DOI: 10.1371 / journal.pone.0169916. pmid: 28178310
- 17. Капорасо Дж. Г., Лаубер С. Л., Уолтерс В. А., Берг-Лайонс Д., Хантли Дж., Фирер Н. и др.Сверхвысокопроизводительный анализ микробного сообщества на платформах Illumina HiSeq и MiSeq. ISME J . 2012; 6: 1621–1624. DOI: 10.1038 / ismej.2012.8. pmid: 22402401
- 18. Пилро В.С., Рош Л.Ф., Мораис Д.К., Кларк И.М., Хирш П.Р., Тотола М.Р. Анализ данных для микробного профилирования 16S с различных настольных платформ секвенирования. Дж . Микробиол . Методы . 2014; 107: 30–37. DOI: 10.1016 / j.mimet.2014.08.018. pmid: 25193439
- 19.Эдгар Р.С. UPARSE: высокоточные последовательности OTU, полученные при считывании микробного ампликона. Нат . Методы . 2013; 10: 996–998., DOI: 10.1038 / nmeth.2604. pmid: 23955772
- 20. Эдгар Р. СИНТАКС: простой небайесовский классификатор таксономии для последовательностей 16S и ITS. 2016. https://doi.org/10.1101/074161
- 21. Коул Дж. Р., Ван К., Фиш Дж. А., Чай Б., МакГаррелл Д. М., Сан Й. и др. Проект базы данных рибосом: данные и инструменты для высокопроизводительного анализа рРНК.Nucleic Acids Res. 42, D633 – D642. 2014. DOI: 10.1093 / nar / gkt1244. pmid: 24288368
- 22. Хорошо IJ. Частота встречаемости видов и оценка популяционных параметров. Биометрика . 1953; 40: 237–264
- 23. Lemos LN, Fulthorpe RR, Triplett EW, Roesch LFW. Переосмысление анализа микробного разнообразия в эпоху высокопроизводительного секвенирования. J. Microbiol . Методы . 2011; 86: 42–51.
- 24. Основная команда разработчиков R.R: Язык и среда для статистических вычислений. 2008. Доступно по адресу: http://www.R-project.org
- 25. McMurdie PJ, Holmes S. phyloseq: пакет R для воспроизводимого интерактивного анализа и графики данных переписи микробиома. PLOS ONE . 2013; 8: e61217. DOI: 10.1371 / journal.pone.0061217. pmid: 23630581
- 26. Андерсон MJ. Новый метод непараметрического многомерного дисперсионного анализа. Austral Ecol . 2001; 26: 32–46
- 27.Оксанен Дж., Бланше Ф.Г., Киндт Р., Лежандр П., Минчин П.Р., О’Хара Р.Б. и др. Веган: Пакет «Экология сообщества». 2015. R пакет веганский, версия. 2.2–1.
- 28. Парки Д.Х., Тайсон Г.В., Гугенольц П., Бейко Р.Г. ШТАМП: статистический анализ таксономических и функциональных профилей. Биоинформатика . 2014; 30: 3123–3124. DOI: 10.1093 / биоинформатика / btu494. pmid: 25061070
- 29. Мусекива А., Манда СО, Мвамби Х.Г., Чен Д.Г. Мета-анализ размеров эффектов, зарегистрированных в несколько моментов времени, с использованием общей линейной смешанной модели.PLoS One. 2016; 11 (10): e0164898 DOI: 10.1371 / journal.pone.0164898. pmid: 27798661
- 30.
Ясмин Ф., Тун Х.М., Конья Т. Б., Гутман Д. С., Чари Р. С., Филд С. Дж. И др. Кесарево сечение, искусственное вскармливание и воздействие антибиотиков на младенцев: отдельные и комбинированные воздействия на микробные изменения кишечника в позднем младенчестве. Передний педиатр . 2017; 5: 200. DOI: 10.3389 / fped.2017.00200. pmid: 2
87
- 31. Cacho NT, Harrison NA, Parker LA, Padgett KA, Lemas DJ, Marcial GE и др.Персонализация микробиоты донорского человеческого молока с материнским молоком. Передний микробиол . 2017; 8: 1470. DOI: 10.3389 / fmicb.2017.01470. pmid: 28824595
- 32. Dobbler PT, Procianoy RS, Mai V, Silveira RC, Corso AL, Rojas BS и др. F. W. Низкое микробное разнообразие и аномальная микробная последовательность связаны с некротическим энтероколитом у недоношенных детей. Передний микробиол . 2017; 8: 2243. DOI: 10.3389 / fmicb.2017.02243. pmid: 29187842
- 33.Гриц ЕС, Бхандари В. Микробиом кишечника новорожденного человека: краткий обзор. Передний . Педиатр . 2015; 3: 17. DOI: 10.3389 / fped.2015.00017. pmid: 25798435
- 34. Мерфи К., Керли Д., О’Каллаган Т.Ф., О’Ши С.А., Демпси Е.М., О’Тул П.В. и др. Состав человеческого молока и фекальной микробиоты младенцев в течение первых трех месяцев жизни: экспериментальное исследование. Научная репутация . 2017; 7: 40597. DOI: 10.1038 / srep40597. pmid: 28094284
- 35.Лю Б., Ньюбург Д.С. Гликопротеины грудного молока защищают младенцев от патогенов человека. Breastfeed Med. 2013; 8: 354–62. DOI: 10.1089 / bfm.2013.0016. pmid: 23697737
- 36. Лис Э.А., Миядзима Ф, Пирмохамед М, Кэррол ЭД. Роль Clostridium difficile в кишечнике детей и новорожденных — обзорный обзор. Eur J Clin Microbiol Infect Dis. 2016; 35: 1047–57. DOI: 10.1007 / s10096-016-2639-3. pmid: 27107991
- 37. Памми М., Коуп Дж., Тарр П.И., Уорнер Б.Б., Морроу А.Л., Май В.и др.Дисбактериоз кишечника у недоношенных детей, предшествующий некротическому энтероколиту: систематический обзор и метаанализ. Микробиом . 2017; 5:31. DOI: 10.1186 / s40168-017-0248-8. pmid: 28274256
- 38. Май В., Торрацца Р.М., Уханова М., Ван Х, Сунь Й., Ли Н. и др. Нарушение развития кишечной микробиоты, связанное с поздним началом сепсиса у недоношенных детей. Plos One 2013; 8 (1): e52876 doi: 10.1371 / journal.pone.0052876. pmid: 23341915
- 39. Stearns JC, Zulyniak MA, de Souza RJ, Campbell NC, Fontes M, Shaikh M и др.Этнические и связанные с питанием различия в микробиоме здорового младенца. Геном Мед . 2017; 9: 32. DOI: 10.1186 / s13073-017-0421-5. pmid: 28356137
- 40. Фаллани М., Амарри С., Уусиярви А., Адам Р., Кханна С., Агилера М. и др. Детерминанты кишечной микробиоты младенца человека после введения первого прикорма в образцах младенцев из пяти европейских центров. Микробиология . 2011; 157: 1385–92.2. DOI: 10.1099 / mic.0.042143-0. pmid: 21330436
- 41.Фаллани М., Янг Д., Скотт Дж., Норин Э., Амарри С., Адам Р. и др. Кишечная микробиота 6-недельных младенцев в Европе: географическое влияние за пределами родовспоможения, грудного вскармливания и антибиотиков. Дж . Педиатр . Гастроэнтерол . Нутрь . 2010; 51: 77–84. DOI: 10.1097 / MPG.0b013e3181d1b11e. pmid: 20479681
- 42. Гуле О. Потенциальная роль кишечной микробиоты в программировании здоровья и болезней. Нутрь . Ред. . 2015; 73: 32–40. DOI: 10.1093 / Nutrit / nuv039. pmid: 26175488
- 43. Уоллес Дж. Г., Гохир В., Слобода Д. М.. Влияние колонизации кишечника в раннем возрасте на метаболические исходы и ожирение: что нам показали модели на животных? Дж . Дев . Ориг . Здоровье . 2016; 7: 15–24. DOI: 10.1017 / S2040174415001518. pmid: 26399435
- 44. Lemas DJ, Yee S, Cacho N, Miller D, Cardel M, Gurka M и др. Изучение вклада материнских антибиотиков и грудного вскармливания в развитие микробиома младенцев и детское ожирение.Семин. Fetal Neonatal Med . 2016; 21: 406–409. DOI: 10.1016 / j.siny.2016.04.013. pmid: 27424917
- 45. Хартс Л.Е., Брэдшоу В., Брэндон Д.Х. Возможное влияние окружающей среды ОИТН на микробиому новорожденного: систематический обзор. Adv Neonatal Care . 2015; 15: 324–335 DOI: 10.1097 / ANC.0000000000000220. pmid: 26340035
Диагностика дисбактериоза
Дисбиоз — это состояние, при котором кишечные бактерии становятся несбалансированными, что приводит к широкому спектру нарушений пищеварения, включая вздутие живота, диарею, запоры и спазмы желудка, среди прочего.Это состояние было связано с различными заболеваниями, включая синдром раздраженного кишечника (СРК), воспалительное заболевание кишечника и гастрит, и это лишь некоторые из них.
Что такое дисбактериоз?
Дисбиоз — это состояние, при котором кишечные бактерии становятся несбалансированными. В результате возникает широкий спектр симптомов нарушения пищеварения, включая диарею, спазмы, запор, вздутие живота и несварение желудка. Когда наблюдается несоответствие нормальной микрофлоры кишечника из-за слишком малого количества полезных бактерий и чрезмерного роста вредных бактерий, это может вызвать дисбактериоз.
В микробиоме кишечника обнаружено не менее 400 видов бактерий. Они необходимы для здоровья в целом, поскольку помогают пищеварению, борются с патогенными микроорганизмами и синтезируют витамины. Нормальную флору тела можно найти в различных областях, и они необходимы для общего здоровья и хорошего самочувствия. Когда эти бактерии становятся несбалансированными, а вредные подавляют полезные бактерии или бесконтрольно разрастаются, это может вызвать болезнь.
Что вызывает дисбактериоз?
Существует множество факторов, которые могут привести к состоянию, включая чрезмерное или неправильное использование антибиотиков, чрезмерное употребление алкоголя, повышенное потребление сахара или белка, частое использование антацидов, воздействие пестицидов и хронический стресс, и это лишь некоторые из них.Также к дисбактериозу могут привести плохая гигиена полости рта и беспокойство.
В некоторых случаях исследования связывают дисбактериоз с рождением через кесарево сечение и вскармливанием смеси среди новорожденных.
Признаки и симптомы дисбактериоза
Основными признаками и симптомами дисбактериоза являются нарушения пищеварения. Люди с этим заболеванием могут испытывать частые газы или вздутие живота. Это означает, что они ощущают вздутие живота почти все дни недели. Кроме того, они страдают от спазмов в животе, диареи и запоров со слизью в стуле.У них может быть сочетание диареи и запора, пищевой чувствительности, пищевой непереносимости и хронического неприятного запаха изо рта.
В некоторых случаях люди могут испытывать затруднение при мочеиспускании, вагинальный или ректальный зуд, боль в груди, сыпь, утомляемость, проблемы с концентрацией внимания, депрессию, беспокойство и туман в мозгу.
Диагностика дисбактериоза
Врач может диагностировать дисбактериоз на основании признаков и симптомов, истории болезни, физического осмотра и диагностических тестов. У человека может быть дисбактериоз, если у него или нее есть диагноз синдрома раздраженного кишечника (СРК), длительное употребление антибиотиков в анамнезе, аутоиммунное заболевание или гастроэнтерит в анамнезе.Однако для подтверждения диагноза врач может порекомендовать следующие диагностические тесты:
Тесты на органическую кислоту
Врач порекомендует тест на органическую кислоту. Это делается путем сбора пробы мочи и ее исследования в лаборатории. Они будут искать и проверять определенные кислоты, которые выделяют бактерии в кишечнике. Аномальные уровни означают, что некоторые бактерии выходят из-под контроля.
Комплексный анализ пищеварительного стула (CDSA)
Всесторонний анализ стула может дать наиболее глубокий анализ бактерий, как полезных, так и патогенных, обитающих в кишечнике.Кроме того, исследование кала может определить наличие других оппортунистических инфекций, например, паразитарных организмов.
Врач разрешит пациенту забрать домой специальное оборудование для взятия пробы стула. Затем образец будет отправлен в лабораторию. Стул будет исследован на наличие бактерий, дрожжей или грибков.
Водородный дыхательный тест
Водородный тест груди определяет наличие газов, производимых бактериями в кишечнике. В водородном дыхательном тесте врач разрешает пациенту выпить раствор глюкозы или сахара.После этого пациент дышит в специальный баллон, где воздух исследуется на наличие газов, выделяемых бактериями. Когда газов слишком много или слишком много, это может указывать на дисбаланс кишечных бактерий.
Биопсия
Врач может взять образец бактериальной ткани из кишечника, где есть активная инфекция, чтобы увидеть, какие бактерии присутствуют.
Лечение дисбактериоза — это больше, чем просто прием пробиотиков для поддержания баланса в кишечнике.Это как-то связано с правильным выбором пищи, отказом от определенных продуктов и занятий, а также с ограничением потребления алкоголя или полным его искоренением. Здоровое питание и сокращение количества потребляемого сахара и пищевых добавок — многообещающий способ обуздать дисбактериоз и сохранить здоровье кишечника.
Дополнительная литература
Младенческая колика представляет воспаление и дисбактериоз кишечника
Микробиота желудочно-кишечного тракта представляет собой сложную и динамичную экосистему, состоящую из нескольких сотен различных микробов, в основном бактерий (1011–12 бактерий / г содержимого толстой кишки, что составляет 60% от общего количества фекалий. масса; Eckburg et al., 2005; О’Хара и Шанахан, 2006 г.). Общее количество бактерий в 10 раз превышает количество клеток человека, а коллекция микробного генома (микробиома) содержит в 100 раз больше генов, чем геном человека (Vael and Desager, 2009). Микробиота кишечника влияет на рост и дифференциацию эпителиальных клеток кишечника и играет основные питательные, метаболические, иммунологические и защитные функции (O’Hara and Shanahan, 2006). Его дерегуляция участвует в патогенезе иммунологических, сердечно-сосудистых и метаболических заболеваний (Hammer, 2011; Maslowski and MacKay, 2011; Harris et al., 2012). Исследование состава микробиоты началось в 1900 году (Tissier, 1900) и проводилось методами культивирования с недавнего появления методов, основанных на последовательностях ДНК, которые, благодаря их способности идентифицировать большое количество видов, которые нельзя культивировать, стали позволили провести более полную и быструю оценку экосистемы желудочно-кишечного тракта (Palmer et al., 2007; Adlerberth and Wold, 2009). На основе гена, кодирующего рибосомную РНК 16S, в дистальном отделе кишечника человека было обнаружено более 7000 различных филотипов (Vael and Desager, 2009) с высокой межиндивидуальной и возрастной изменчивостью, но принадлежащих к ограниченному числу широких таксономических групп. подразделения (в основном анаэробы Bacteroides, Eubacterium, Clostridium; Hayashi et al., 2002; Экбург и др., 2005; Zoetendal et al., 2008). В очень недавнем исследовании Arumugam et al. (2011), объединив фекальные метагеномы людей из разных стран, идентифицировали три разных энтеротипа (с преобладанием видов Bacteroides, Prevotella и Ruminococcus, соответственно), которые не являются специфическими для страны или континента, и показали, что вариации кишечной микробиоты стратифицированы, не непрерывно, что дополнительно указывает на существование ограниченного числа хорошо сбалансированных симбиотических состояний между хозяином и микробом.Эти энтеротипы, по-видимому, не различаются по функциональному разнообразию и, по-видимому, не коррелируют с национальностью, полом, возрастом или индексом массы тела; в то же время они кажутся характерными и довольно стабильными у людей, так что могут восстанавливаться после возмущений. Состав и концентрация кишечной микробиоты физиологически различаются по всему желудочно-кишечному тракту (возрастающий градиент от желудка к толстой кишке и характерное распределение микрофлоры в кишечнике) и на этапах жизни, начиная от бесплодия новорожденного до чрезвычайно изменчивой и плотной колонизации кишечника взрослого человека. влияние различных внутренних и внешних факторов, связанных с хозяином (Mackie et al., 1999; Palmer et al., 2007).
Архив клинической микробиологии | Insight Medical Publishing
Импакт-фактор журнала: 0,72 *; 1,37 * (5-летний импакт-фактор)
Значение индекса Copernicus: 88,97
Индекс H: 3
Глобальный импакт-фактор: 0,564
Влияние журнала Research Gate: 0,16
Архив клинической микробиологии (ISSN: 1989-8436) — это рецензируемый международный журнал, в состав редакционной коллегии которого входят всемирно признанные ученые.С быстрой публикацией статей во всех областях микробиологии и инфекционных болезней. Архив клинической микробиологии действует уже восьмой год, и он был включен в каталог Национальной медицинской библиотеки (NLM) (первый шаг для индексации в PubMed). Кроме того, он проиндексирован в Index Copernicus (ICV: 88.97), DeepDyve, Open J Gate, JournalSeek, EBSCO A-Z.
https://www.imedpub.com/submissions/archives-clinical-microbiology.html или отправьте в виде вложения по электронной почте в редакцию по адресу [электронная почта защищена]
Патогенные бактерии
Патогенные бактерии — это бактерии, которые при попадании в организм способны вызывать заболевание и распространяться через воду, воздух, почву, а также при физическом контакте.В основном бактерии безвредны и полезны, но некоторые из них являются патогенными.
Связанные журналы патогенных бактерий
Журнал гепатита, Журнал иммунологических методов при инфекционных заболеваниях, Журнал инфекционных заболеваний и терапии, Журнал инфекционных заболеваний и лечения, Журнал патологии и трансляционной медицины, Журнал патологии. Клинические исследования, Отчеты о клинических патологиях, Журнал микробиологии и патологии Джейкобса, Текущие отчеты по патобиологии, Международный журнал судебной медицины и патологии, Открытие патологии.
Вирусные болезни
Вирусные болезни — это инфекции, вызываемые вирусом или микроорганизмами. вирус, поражающий клетку, или формирование вирусной капсулы на поверхности клетки, которая может начать размножаться сама по себе и начинает распространяться, что приводит к вирусному заболеванию.
Связанные журналы вирусных заболеваний
Журнал вирусологии и противовирусных исследований, Достижения в области антибиотиков и антител, Журнал СПИДа и клинических исследований,
Журнал аллергии и терапии, Прикладная микробиология: открытый доступ, вирусное заболевание, Журнал болезней, передаваемых членистоногими, Всемирный вирусологический журнал, Текущее мнение в области вирусологии, Темы противовирусной медицины, Исследования и лечение гриппа, Достижения в вирусологии, Пищевая и экологическая вирусология, Исследования вирусов, Достижения в исследованиях вирусов, Адаптация и лечение вирусов.
Микобактериальные болезни
Микобактериальные заболевания — это инфекция одного типа, вызываемая скоплением микробов. Эти микобактериальные заболевания включают туберкулез, проказу, микобактерии язвы и Mycobacterium Para tuberculosis. Обычно они лечатся такими лекарствами, как рифампицин, этамбутол и изониазид. Mycobacterium leprae лечится дапсоном.
Журналы, относящиеся к микобактериальным болезням
Журнал инфекционных заболеваний и лечения, Медицинская микология: открытый доступ, Журнал патологии и эпидемиологии, Исследования первичного и приобретенного иммунодефицита, Журнал вирусологии и антивирусных исследований, Текущие отчеты о грибковых инфекциях, Журнал инвазивных грибковых инфекций, Отчеты о случаях медицинской микологии, Медицинские журнал микологии, Микология, Микозы, Микопатология, Микробиология будущего, Клеточный хозяин и микроб, Журнал Общества педиатрических инфекционных болезней.
Бактериальная инфекция
Бактериальные инфекции — это инфекции, вызываемые бактериями. Инфекционная бактерия быстро размножается и выделяет токсичные химические вещества, которые повреждают ткани. Общие бактериальные инфекции включают пневмонию, инфекции уха, диарею, инфекции мочевыводящих путей и кожные заболевания
Связанные журналы бактериальной инфекции
Журнал гепатита, Журнал иммунологических методов при инфекционных заболеваниях, Журнал инфекционных заболеваний и терапии, Журнал инфекционных болезней и лечения, Патогены и болезни, Текущие отчеты по клинической микробиологии, Международный журнал исследований микробиологии и иммунологии, Журнал прикладной микробиологии и окружающей среды , Журнал глобальной устойчивости к противомикробным препаратам, Спектр микробиологии, микробиология JSM, микробиология OA, микробиология и инфекционные заболевания SOJ, Универсальный журнал исследований микробиологии.
Вирусная инфекция
Вирусные инфекции — это небольшой инфекционный организм, который меньше грибка или бактерии. Вирус прикрепляется к поверхности клетки и высвобождает свою вирусную ДНК или РНК внутри клеток, которые затем реплицируются сами по себе внутри клетки, чтобы сделать клетку более заразной и распространяться от одной клетки к другой, что приводит к вирусной инфекции.
Связанные журналы вирусной инфекции
Журнал ВИЧ и ретро-вирусов, Журнал инфекционных заболеваний и диагностики, Журнал медицинской микробиологии и диагностики, Микобактериальные заболевания, Детские инфекционные заболевания: открытый доступ, вирусология и микология, вирусные заболевания, Журнал болезней, передаваемых членистоногими, Всемирный вирусологический журнал, Текущее мнение в вирусологии, Темы противовирусной медицины, Исследования и лечение гриппа, Достижения в вирусологии, Вирусология пищевых продуктов и окружающей среды, Исследования вирусов, Достижения в исследованиях вирусов, Адаптация и лечение вирусов.
Грибковая инфекция
Грибковые инфекции — это инфекция, которая обычно начинается в легких или на коже, прогрессирует медленно и редко бывает серьезной, если иммунная система не работает на выходных. Когда иммунная система выходит на выходные, она может быть очень агрессивной и быстро распространяться, что приводит к смерти.
Связанные журналы грибковой инфекции
Медицинская микология: открытый доступ, Журнал патологии и эпидемиологии, Исследования первичного и приобретенного иммунодефицита, Журнал вирусологических и противовирусных исследований, Достижения в области антибиотиков и антител, Текущие отчеты о грибковых инфекциях, Журнал инвазивных грибковых инфекций, Отчеты о случаях медицинской микологии, Медицинская микология журнал, Микология, Микозы, Микопатология, Микробиология будущего, Клеточный хозяин и микроб, Журнал Общества педиатрических инфекционных болезней.
Медицинская микробиология
Медицинская микробиология начинается с анализа иммунной системы, с помощью которой микроорганизмы или токсины проникают силой, чтобы победить клетки и встретиться с ними. Это изучение микроорганизмов или микробов, которые влияют на все аспекты нашей жизни, а также включают реакцию хозяина на микроорганизмы.
Связанные журналы медицинской микробиологии
Клиническая микробиология: открытый доступ, журнал новых инфекционных заболеваний, журнал судебной патологии, журнал ВИЧ и ретро-вирусов, журнал инфекционных заболеваний и диагностики, открытый журнал медицинской микробиологии, журнал медицинской микробиологии, международный журнал медицинской микробиологии, медицина Микробиология и иммунология, Индийский журнал медицинской микробиологии, Канадский журнал инфекционных заболеваний и медицинской микробиологии, Обзоры по медицинской микробиологии, Международный журнал медицинской микробиологии, Приложение, Письма по медицинской микробиологии.
Вирус гепатита
Гепатит — это заболевание печени, при котором печень набухает и воспаляется из-за вирусной инфекции, которая приводит к гепатиту. Состояние может быть самоограничивающимся или прогрессировать до фиброза, цирроза или рака печени. Вирусная инфекция гепатита бывает пяти типов: гепатит A, B, C, D и E, а также может возникать в результате употребления алкоголя.
Связанные журналы вируса гепатита
Журнал гепатита, Журнал иммунологических методов лечения инфекционных заболеваний, Журнал инфекционных заболеваний и терапии, Журнал инфекционных заболеваний и лечения, Медицинская микология: открытый доступ, Текущие отчеты гепатологии, Исследования и лечение гепатита, Вирусный гепатит на практике, Ежемесячный гепатит, Текущие отчеты о гепатитах, Hepatitis Weekly, Journal of вирусные гепатиты, Viral Hepatitis Reviews, Hepatitis B Annual, Hot Topics in Viral Hepatitis
Microbial Genomics
Микробная геномика — это исследование микроорганизмов, генетический материал которых содержит микробы.Анализ всего микробного генома дает представление о микробной оценке и разнообразии микробов, помимо филогении одного белка или гена.
Связанные журналы по микробной геномике
Микробная и сравнительная геномика, Наука и технологии генома, Новые микробы и инфекции, Микробная информатика и эксперименты, Микробная биотехнология, Фабрики микробных клеток, Микробные выбросы: вирусы, бактерии, грибы, Микробная экология в здоровье и болезнях.
Золотистый стафилококк
Staphylococcus aureus — это бактерии, вызывающие заболевания человека. Чаще всего абсцессы или целлюлит — это инфекции, вызванные золотистым стафилококком. Это происходит, когда кожа порезается или царапается, что позволяет бактериям проникнуть внутрь, а затем инфицировать. В основном это происходит в ногах и руках.
Журналы, относящиеся к Staphylococcus aureus
Журнал инфекционных заболеваний и лечения, Медицинская микология: открытый доступ, Журнал патологии и эпидемиологии, Исследования первичного и приобретенного иммунодефицита, Журнал вирусологии и противовирусных исследований, Патогены и болезни, Текущие отчеты клинической микробиологии, Международный журнал исследований микробиологии и иммунологии, Журнал прикладной микробиологии и микробиологии окружающей среды, Журнал глобальной устойчивости к противомикробным препаратам, Спектр микробиологии, микробиология JSM, микробиология OA, микробиология и инфекционные заболевания SOJ, Универсальный журнал микробиологических исследований.
Вирус иммунодефицита человека
Вирус иммунодефицита человека — это вирус, который атакует иммунную систему, заражая лейкоциты. Лейкоциты являются важной частью иммунной системы, которая будет уничтожена определенным вирусом, называемым ВИЧ, что приводит к нехватке лейкоцитов, что снижает иммунную силу.
Связанные журналы вируса иммунодефицита человека
Журнал ВИЧ и ретро-вирусов, Журнал инфекционных заболеваний и диагностики, Журнал медицинской микробиологии и диагностики, Микобактериальные заболевания, Детские инфекционные заболевания: открытый доступ, вирусология и микология, The lancet HIV, Журнал клинических исследований в области ВИЧ, СПИДа и профилактики, Исследования и лечение СПИДа, ВИЧ / СПИД (Окленд, Н.Z.), Журнал исследований СПИДа и ВИЧ (онлайн), Журнал эпиднадзора за ВИЧ и эпидемиологией СПИДа, Будущее лечение ВИЧ, Журнал профилактики ВИЧ / СПИДа у детей и молодежи, Исследования СПИДа и ретровирусы человека, Обзор ВИЧ и СПИДа.
Холера
Холера — инфекционное заболевание, вызывающее диарею. Vibrio cholera — это бактерия, вызывающая холеру, которую можно найти в загрязненной воде или пище, и которая приводит к обезвоживанию организма из-за потери жидкости организма во время диареи.
Журналы по теме холеры
Достижения в области антибиотиков и антител, Журнал СПИДа и клинических исследований, Журнал аллергии и терапии, Прикладная микробиология: открытый доступ, Архивы воспаления, Текущие отчеты об инфекционных заболеваниях, Медицина путешествий и инфекционные заболевания, Канадский журнал инфекционных заболеваний и медицинской микробиологии, Текущие клинические темы в инфекционных заболеваниях, Скандинавский журнал инфекционных заболеваний, Инфекционные добавки в клинической практике, Kansenshogaku zasshi.Журнал Японской ассоциации инфекционных заболеваний, Достижения в области детских инфекционных болезней, Междисциплинарные перспективы инфекционных заболеваний, Журнал глобальных инфекционных заболеваний, Американский журнал инфекционных заболеваний.
Болезнь, вызванная вирусом Эбола
Вирус Эбола — это вирус, вызывающий острое и серьезное заболевание, которое при отсутствии лечения часто заканчивается летальным исходом. Его иначе называют геморрагической лихорадкой Эбола, которая является смертельным вирусом, вызывающим внутреннее и внешнее кровотечение в организме.
Связанные журналы болезни, вызванной вирусом Эбола
Архив клинической микробиологии, Журнал вирусологии и антивирусных исследований, Достижения в области антибиотиков и антител, Журнал СПИДа и клинических исследований, Журнал аллергии и терапии, Прикладная микробиология: открытый доступ, Вирусные заболевания, Журнал болезней, передаваемых членистоногими, Всемирный журнал вирусология, Современные мнения в вирусологии, Темы противовирусной медицины, Исследования и лечение гриппа, Достижения в вирусологии, Пищевая и экологическая вирусология, Исследования вирусов, Достижения в исследованиях вирусов, Адаптация и лечение вирусов.
Ротавирусная инфекция
Инфекция, вызванная вирусом Рота, является наиболее частой причиной тяжелой диареи, вызывающей обезвоживание. Она может распространяться через заражение рук, воды, пищи или любых предметов. Вирус попадает в организм через пищевые продукты и распространяется через слизистую оболочку, что в конечном итоге приводит к диарее из-за инфекции.
Связанные журналы ротавирусной инфекции
Журнал вирусологии и противовирусных исследований, Достижения в области антибиотиков и антител, Журнал СПИДа и клинических исследований,
Журнал аллергии и терапии, Прикладная микробиология: открытый доступ, Архив воспаления, вирусных заболеваний, Журнал болезней, передаваемых членистоногими, Всемирный журнал вирусология, Текущие мнения в вирусологии, Темы противовирусной медицины, Исследования и лечение гриппа, Достижения в вирусологии, Пищевая и экологическая вирусология, Исследования вирусов, Достижения в исследованиях вирусов, Адаптация и лечение вирусов.
Новые исследования: эпигенетика и микробиом
Следующие исследования исследуют новые и растущие доказательства того, что генетика, дородовая среда, способы родов и ранняя послеродовая среда, включая метод кормления, могут влиять на микробиом младенца, что имеет значительные последствия для иммунной системы младенца и как краткосрочные, так и долгосрочные последствия для здоровья. Узнайте больше в нашем курсе «Грудное вскармливание и построение отношений».Частое употребление противомикробных препаратов в молодом возрасте меняет бактериальный профиль в слюне
Финское исследование «Здоровье подростков» (Fin-HIT) — это когортное исследование, в котором приняли участие более 11 000 финских подростков.В последнем исследовании Fin-HIT исследователи попытались найти связь между употреблением AM в течение всей жизни и разнообразием и составом микробиоты слюны у подростков. Они использовали данные 808 случайно выбранных детей в когорте Fin-HIT с данными объективного реестра о покупках AM у Учреждения социального страхования Финляндии (KELA). Результаты показали, что в среднем дети совершали покупки в 7,4 утра в течение своей жизни в среднем до 12 лет. Четыре наиболее часто используемых AM — это амоксициллин (43.7%), азитромицин (24,9%), амоксициллин-клавуланат (18,7%) и феноксиметилпенициллин (6,8%). Наиболее сильные ассоциации были представлены с азитромицином, который используется, например, для лечения инфекций среднего уха, ангины и пневмонии.
Университет Хельсинки. «Частое употребление противомикробных препаратов в раннем детстве меняет бактериальный профиль в слюне». ScienceDaily. ScienceDaily, 24 августа 2020 г.
На состав и изменение микробиоты грудного молока влияют факторы материнства и раннего возраста
В этом исследовании 393 диад мать-младенец из когорты ДЕТЕЙ изучались факторы, влияющие на сложное сообщество бактерий в грудном молоке, которые, в свою очередь, могут способствовать развитию микробиоты кишечника младенца.Исследователи обнаружили, что состав и разнообразие молочной микробиоты были связаны с материнскими факторами (ИМТ, равенство и способ родоразрешения), практикой грудного вскармливания и другими компонентами молока в зависимости от пола. Причинно-следственное моделирование выявило, что режим грудного вскармливания является ключевым фактором, определяющим состав микробиоты молока. В частности, предоставление сцеженного грудного молока всегда было связано с множеством параметров микробиоты, включая обогащение потенциальных патогенов и истощение бифидобактерий.Полученные данные также подтверждают гипотезу о том, что ротовая полость младенца, а не микробиом кишечника матери, влияет на микробиоту молока.
Мусави, С., Сепехри, С., Робертсон, Б. и др. (2019). На состав и изменение микробиоты человеческого молока влияют материнские факторы и факторы раннего возраста. Cell Host & Microbe, doi.org/10.1016/j.chom.2019.01.011.
Прочтите краткое содержание этого исследования: https://www.gutmicrobiotaforhealth.com/en/a-new-study-sheds-light-on-maternal-and-infant-factors-that-shape-breast-milk-microbiome/
Кормление грудных детей и причины развития хронических заболеваний в когорте ДЕТЕЙ: роль биологически активных веществ человеческого молока и кишечной микробиоты
Эта статья представляет собой полезный обзор недавних исследований, изучающих потенциальную связь между воздействием в раннем возрасте и развитием хронических заболеваний, таких как аллергия, астма и ожирение.В частности, исследования подчеркивают возможность того, что метод кормления грудных детей может повлиять на микробиоту кишечника ребенка и, следовательно, на его здоровье в будущем. Резюме некоторых исследований, представленных в этой статье, можно найти на этой странице, а также на наших страницах исследований астмы и избыточного веса / ожирения.
Азад, М., (2019). Кормление грудных детей и причины развития хронических заболеваний в когорте ДЕТЕЙ: роль биологически активных веществ человеческого молока и кишечной микробиоты. Медицина грудного вскармливания, doi.org/10.1089/bfm.2019.0029
Влияние ранних событий и образа жизни на микробиоту кишечника и метаболические фенотипы у детей младшего школьного возраста
Это исследование младенцев из когорты рождения KOALA показало, что продолжительность грудного вскармливания в раннем детстве и дошкольный диетический образ жизни коррелируют с составом и функциональными компетенциями микробиоты кишечника у детей школьного возраста.Результаты исследователей также предполагают, что различные метаболические реакции на диетический образ жизни в значительной степени регулируются составом и функциональным потенциалом кишечной микробиоты, подразумевая, что стратификация детей в соответствии с энтеротипами кишечной микробиоты вполне может быть включена в будущие исследования взаимосвязи между диетическим потреблением. и метаболическое здоровье у детей.
Чжун, Х., Пендерс, Дж., Ши, З. и др. (2019). Влияние ранних событий и образа жизни на микробиоту кишечника и метаболические фенотипы у детей младшего школьного возраста.Microbiome, doi.org/10.1186/s40168-018-0608-z
Микробиом кишечника в раннем возрасте как прогностический фактор ожирения и диабета 1 типа
В этой статье освещаются три недавно опубликованных исследования, в которых изучается влияние микробиома кишечника на здоровье. Одно исследование (Станиславский и др.) Обнаружило связь между микробиотой кишечника в раннем возрасте, особенно в двухлетнем возрасте, и ИМТ в возрасте 12 лет в норвежской перспективной когорте. Два других исследования были частью исследования «Экологические детерминанты диабета у молодых» (TEDDY), посвященного изучению развития диабета 1 типа (T1D).Одно исследование (Стюарт и др.) Показало, что получение грудного молока, исключительное или частичное, было наиболее значимым фактором, связанным со структурой микробиома, и что способ родов также был в значительной степени связан с микробиомом во время фазы развития. Исследователи обнаружили тонкую связь между микробной таксономией и развитием островкового аутоиммунитета или СД1. Другое исследование (Vatanen et al) показало, что дети, у которых позже развился СД1, имели микробные особенности, отличные от тех, у которых он не развился; например, микробиом кишечника детей, у которых позже в детстве не развился СД1, содержал больше генов, связанных с ферментацией и образованием короткоцепочечных жирных кислот, защитная роль которых в условиях метаболизма была показана ранее.Полученные данные свидетельствуют о том, что микробиом кишечника в раннем возрасте может помочь выявить детей, подверженных риску ожирения или СД1, и может способствовать усилиям по профилактике.
https://www.gutmicrobiotaforhealth.com/en/early-life-gut-microbiome-as-an-obesity-and-type-1-diabetes-predictor/
Станиславский, М., Дабеля, Д., Вагнер, Б. и др. (2018). Микробиота кишечника в первые 2 года жизни и связь с индексом массы тела в возрасте 12 лет в норвежской когорте рождения. Американское общество микробиологии, DOI: 10.1128 / mBio.01751-18
Стюарт, К., Аджами, Н. и др. (2018). Временное развитие микробиома кишечника в раннем детстве по данным исследования TEDDY. Природа, doi.org/10.1038/s41586-018-0617-x
Ватанен, Т., Франзоза, Э, Швагер, Р. и др. (2018). Микробиом кишечника человека при диабете типа 1 с ранним началом из исследования TEDDY. Природа, doi.org/10.1038/s41586-018-0620-2
Мета-анализ воздействия исключительно грудного вскармливания на микробиоту кишечника младенцев в разных популяциях
В этом исследовании был проведен метаанализ семи исследований микробиома (1825 образцов стула от 684 младенцев) для сравнения микробиоты кишечника детей, вскармливаемых исключительно грудью (EBF) и не получающих EBF, в разных популяциях.Авторы обнаружили, что по сравнению с младенцами EBF, младенцы без EBF имели увеличенное микробное разнообразие и возраст микробиоты, а также измененный микробный состав и функции. Было обнаружено, что EBF оказывает защитное действие на микробиоту кишечника младенца во время эпизодов диареи, и различия в микробиоте кишечника между EBF и младенцами без EBF сохраняются через 6 месяцев. Исследователи пришли к выводу, что полученные данные помогают объяснить некоторые механизмы краткосрочных и долгосрочных преимуществ исключительно грудного вскармливания.
Нан Т.Хо, Фан Ли и др. (2018). Мета-анализ воздействия исключительно грудного вскармливания на микробиоту кишечника младенцев в разных популяциях, Nature Communications, 9, номер статьи: 4169
Связь воздействия смеси в больнице и последующей практики вскармливания младенцев с микробиотой кишечника и риском избыточного веса в первый год жизни
Это исследование показало, что среди 1087 младенцев из когорты здорового младенческого продольного развития (CHILD), более раннее прекращение грудного вскармливания и добавление смеси (в большей степени, чем прикорм) были связаны с дозозависимым увеличением риска избыточного веса к 12 годам. месяцы; эта связь частично объяснялась особенностями микробиоты кишечника в возрасте 3-4 месяцев.Незначительные, но значительные различия в микробиоте наблюдались после кратковременного воздействия смеси, ограниченного пребыванием в роддоме, но эти различия не были связаны с избыточным весом.
Форбс, Дж., Азад, Б. и др. (2018). Связь воздействия смеси в больнице и последующих методов кормления младенцев с кишечной микробиотой и риском избыточного веса в первый год жизни. JAMA Педиатрия, DOI: 10.1001 / jamapediatrics.2018.1161
Причинный механизм острого лимфобластного лейкоза у детей
В этом обзоре исследуется многофакторная причина острого лимфобластного лейкоза (ОЛЛ) у детей.Утверждается, что есть три стадии развития болезни: первоначальная генетическая мутация, происходящая в утробе матери; отсутствие воздействия микробов на первом году жизни; детская инфекция, которая может вызвать сбой в работе иммунной системы. Исследование подчеркивает важную роль, которую микробы играют в определении результатов для здоровья, а также важность грудного вскармливания в поддержке развития этих микробов в кишечнике младенца.
Гривз, Мел, (2018). Причинный механизм острого лимфобластного лейкоза у детей, Nature Reviews Cancer, doi.org / 10.1038 / s41568-018-0015-6
Дополнительный анализ этого обзора доступен здесь: https://www.bbc.co.uk/news/amp/health-44199844
Связь между бактериальными сообществами грудного молока и становлением и развитием микробиома кишечника младенца
Создание микробиома младенцев имеет долгосрочные последствия для здоровья и иммунитета, поскольку микробиота кишечника у лиц, находящихся на грудном вскармливании, по сравнению с лицами, не находящимися на грудном вскармливании, различается как в младенчестве, так и во взрослом возрасте.Грудное молоко содержит разнообразную популяцию бактерий, но мало что известно о вертикальном переносе бактерий от матери к ребенку при грудном вскармливании. В этом 12-месячном продольном исследовании 107 здоровых пар мать-младенец исследователи изучали, переносятся ли материнское грудное молоко и ареолярные бактериальные сообщества кожи в кишечник младенца. Они обнаружили, что младенцы, находящиеся на грудном вскармливании, получили 27,7% кишечных бактерий из грудного молока и 10,4% из ареолярной кожи в течение первого месяца жизни. Они пришли к выводу, что микробы в материнском грудном молоке заселяют кишечник младенца, в том числе те, которые имеют положительное влияние, подчеркивая важность грудного вскармливания в созревании микробиома кишечника младенца.
Паннарадж, П.С. и др. (2017), Ассоциация между бактериальными сообществами грудного молока и созданием и развитием микробиома кишечника младенцев. JAMA Pediatrics, DOI: 10.1001 / jamapediatrics.2017.0378
Микробиом в раннем возрасте: последствия для здоровья
Недавние исследования показали, как генетика хозяина, пренатальная среда и способ доставки могут формировать микробиом новорожденного при рождении. Вслед за этим постнатальные факторы, такие как лечение антибиотиками, диета или воздействие окружающей среды, дополнительно модулируют развитие микробиома и иммунной системы младенца, и долгое время считалось, что воздействие различных микробных организмов в раннем возрасте оказывает защитный эффект на новорожденный.Кроме того, эпидемиологические исследования показали, что факторы, которые изменяют бактериальные сообщества у младенцев в детстве, увеличивают риск некоторых заболеваний, подчеркивая важность понимания состава микробиома в раннем возрасте. В этом обзоре описывается, как пренатальные и постнатальные факторы влияют на развитие микробиома и иммунной системы.
Тамбурини, С. и др. (2016). Микробиом в молодом возрасте: последствия для здоровья, Nature Medicine, DOI: 10,1038 / нм.4142
Роды и последующее атопическое заболевание: новые данные об эпигенетических эффектах, основанные на гипотезах гигиены и EPIIC
В этой статье исследуются появляющиеся доказательства того, что определенные вмешательства во время родов и в раннем неонатальном периоде могут влиять на неонатальный иммунный ответ в долгосрочной перспективе и, возможно, в транс-поколении. В нем обсуждаются две ведущие теории в этой области: гипотеза гигиены и гипотеза EPIIC. Гипотеза гигиены предполагает, что внутриутробно и в первые часы, недели или месяцы жизни ребенку необходимо собрать сообщество уже существующих микробов, исходящих от матери, а также подвергнуться воздействию бактерий из окружающей среды. , с целью защиты от атопических и иммунологических заболеваний.Гипотеза EPIIC, напротив, предполагает, что когда роды происходят в основном без вмешательства (когда процесс протекает физиологически), на плод воздействует здоровая положительная форма стресса (эустресс), которая программирует иммунные реакции, гены, ответственные за регуляцию веса, и специфические гены-супрессоры опухолей. Авторы предлагают использовать обе теории, чтобы объяснить недавний рост заболеваемости атопическими и аутоиммунными заболеваниями.
Dahlen, HG, et al (2016). Роды и последующее атопическое заболевание: новые данные об эпигенетических эффектах, основанные на гипотезах гигиены и EPIIC, BMC по беременности и родам, https: // doi.org / 10.1186 / s12884-015-0768-9
Развитие микробиома младенца: мама имеет значение
В этом обзоре данных авторы утверждают, что микробиом младенца играет важную роль в здоровье человека, и его сборка определяется обменом микробиоты между матерью и потомством. На этот процесс влияют несколько методов, включая кесарево сечение (кесарево сечение), перинатальные антибиотики и кормление смесью, которые связаны с повышенным риском метаболических и иммунных заболеваний.Авторы анализируют последние данные о воздействии на сборку микробиома младенцев, обсуждают профилактические и восстановительные стратегии для смягчения последствий этих воздействий и подчеркивают, где необходимы исследования для развития этой области и улучшения здоровья будущих поколений.
Мюллер, Н.Т. и др. (2014), Развитие микробиома младенца: мама имеет значение, Тенденции в молекулярной медицине, DOI: https://doi.org/10.1016/j.molmed.2014.12.002
Кесарево сечение и хронические иммунные расстройства
В этом исследовании взрослые дети, рожденные путем кесарева сечения, были проанализированы на предмет риска контакта с больницей по поводу хронических иммунных заболеваний, зарегистрированных в датских национальных регистрах за 35-летний период 1977–2012 годов.В первичном анализе приняли участие 2 миллиона доношенных детей. Исследователи обнаружили, что у детей, рожденных путем кесарева сечения, значительно повышен риск астмы, системных заболеваний соединительной ткани, ювенильного артрита, воспалительного заболевания кишечника, иммунной недостаточности и лейкемии. Связи между кесаревым сечением и диабетом 1 типа, псориазом или целиакией не обнаружено.
Севелстед, А. и др. (2014). Кесарево сечение и хронические иммунные расстройства, педиатрия, DOI: 10.1542 / педы.2014-0596
Эпигенетические эффекты грудного молока человека
Эта статья предполагает, что, хотя различные вовлеченные эпигенетические механизмы остаются неясными, преимущества грудного вскармливания против некротизирующего энтероколита (НЭК), инфекционных заболеваний, ожирения и связанных с ним расстройств и рака могут быть частично объяснены эпигенетической моделью. Модулируя экспрессию генов без изменения нуклеотидной последовательности ДНК, грудное молоко может положительно изменить фенотип и результат, даже если существует генетическая предрасположенность к развитию заболеваний.
Verduci, E, et al (2014). Эпигенетические эффекты грудного молока человека, питательные вещества, doi: 10.3390 / nu6041711
Естественные роды и грудное вскармливание как меры профилактики дисбиоза иммунного микробиома и нерегулируемого воспаления
В этом обзоре утверждается, что, хотя технологические достижения в ведении беременности, родов и развития младенцев помогли снизить бремя некоторых детских болезней, они также подорвали богатый микробами опыт естественных родов и грудного вскармливания, что привело к серьезным, непредвиденным последствиям для сегодняшнего дня. дети: повышенная вероятность неполноценности человеческого микробиома, пожизненной иммунной дисфункции и хронических заболеваний, вызванных воспалением.В этом обзоре будут рассмотрены недавние данные, свидетельствующие о том, что более эффективное сочетание древних практик и средств лечения с современными технологиями и медицинскими знаниями могло бы помочь восстановить суперорганизм микробиома человека до его исторического статуса, улучшить педиатрический иммунный гомеостаз и снизить риск хронических заболеваний в более позднем возрасте. болезни.
Дитер, Р.Р. (2013). Естественные роды и грудное вскармливание как меры профилактики дисбактериоза иммунного микробиома и нерегулируемого воспаления. Журнал инфекционных болезней и профилактической медицины, DOI: 10.4172 / 2329-8731.1000103
Обзор эпигенетики в сестринском деле
Эпигенетические изменения в геноме — это биохимические изменения ДНК, которые не изменяют геном человека, но изменяют и влияют на экспрессию генов. В этой статье обсуждаются текущие эпигенетические исследования медсестер, дается обзор того, как эпигенетические исследования связаны с сестринской практикой, даются рекомендации и предоставляются эпигенетические онлайн-ресурсы для медсестринских исследований. Представлен обзор основных эпигенетических исследований в области сестринского дела (специфических для исследований родовспоможения, преэклампсии, метаболического синдрома, иммунотерапии рака и боли) с рекомендациями относительно следующих шагов.
Кларк, А. и др. (2013). Обзор эпигенетики в сестринском деле, Медицинские клиники Северной Америки, DOI: 10.1016 / j.cnur.2013.08.004
Микробиом грудного молока изменяется во время лактации и определяется весом матери и способом родоразрешения
Это исследование показало, что вес матери и способ родов влияют на микробиом грудного молока. Молоко от матерей с ожирением, как правило, содержит иное и менее разнообразное бактериальное сообщество по сравнению с молоком от матерей с нормальным весом.Образцы молока от плановых, но не от невыборных матерей, перенесших кесарево сечение, содержали другое бактериальное сообщество, чем образцы молока от лиц, родивших естественным путем, что позволяет предположить, что это не операция как таковая, а отсутствие физиологического стресса или гормональных сигналов, которые может повлиять на процесс передачи микробов в молоко. Полученные данные подчеркивают необходимость лучшего понимания роли, которую микробиом может играть для здоровья человека.
Кабрера-Рубио, Р. и др. (2012). Микробиом грудного молока изменяется в период лактации и определяется весом матери и способом родов, Американский журнал клинического питания, DOI: 10.3945 / ajcn.112.037382
Эпигенетические изменения в молодом возрасте и будущий риск ожирения
В этом исследовании рассматриваются доказательства влияния окружающей среды плода и раннего постнатального развития на риск развития ожирения в более позднем возрасте, с акцентом на то, как конкретная среда может изменять эпигенетическую регуляцию определенных генов.Исследователи предполагают, что понимание роли эпигенетики в риске ожирения открывает возможность новых вмешательств для изменения долгосрочного риска ожирения и борьбы с быстрым ростом ожирения, который происходит в последние два десятилетия.
Lillycrop, KA, и Burdge, GC (2011). Эпигенетические изменения в раннем возрасте и будущий риск ожирения, Международный журнал ожирения, DOI: 10.1038 / ijo.2010.122
Neocate Syneo Infant | Neocate
Будут ли какие-либо различия в стуле моего ребенка при переходе на Neocate Syneo Infant с грудного молока или других смесей?
Младенцы обычно приспосабливаются к гипоаллергенной смеси и привыкают к обычному режиму питания через несколько дней или недель.То же самое может быть верно при добавлении в рацион пребиотиков и / или пробиотиков — постепенный переход может помочь.
Исследование Neocate Syneo Infant предполагает, что могут быть некоторые начальные изменения в характеристиках стула (например, цвет и консистенция) во время раннего перехода на этот продукт с смеси без пре- и пробиотиков. Стул может быть мягче, как у младенцев, вскармливаемых грудью. В первые дни / недели использования у вашего ребенка также может быть больше газов или метеоризма, что может вызвать временный дискомфорт или беспокойство.Поговорите с врачом вашего ребенка или другим медицинским работником о необходимости постепенного перехода на Neocate Syneo Infant.
Когда ребенок находится на Neocate, первый стул обычно бывает зеленым и может быть темным — многие родители описывают цвет как охотничий зеленый (но обратитесь к врачу вашего ребенка, если стул выглядит черным, что может быть кровью в стуле) . Зеленый — это совершенно нормально (Зеленый — это великолепно!), Благодаря особому составу Neocate и способу его переваривания и усвоения в организме.
У большинства младенцев на Neocate зеленый цвет сохраняется, по крайней мере, в течение первых нескольких дней. Он может исчезнуть через несколько недель, но у некоторых малышей стул будет зеленым, пока они принимают Neocate. Часто стул становится желто-коричневого / хаки, если зеленый цвет исчезает. Это нормально и является результатом адаптации организма к способу переваривания и всасывания Neocate. Цвет также может измениться при добавлении в рацион твердой пищи.
Консистенция стула у младенцев, принимающих Неокейт, имеет тенденцию быть мягким и несколько пастообразным, хотя это может варьироваться.


 д.
д.
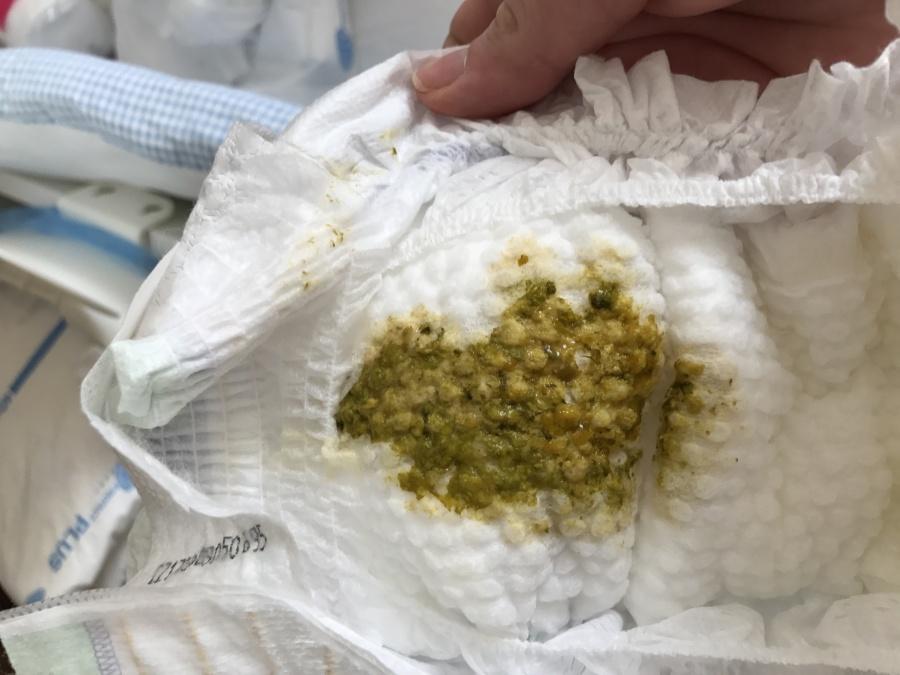
 В этом случае слизистая страдает в результате влияния болезнетворных микроорганизмов и продуктов их жизнедеятельности. Риск развития дисбактериоза значительно возрастает, если маме и /или малышу назначались антибактериальные препараты.
В этом случае слизистая страдает в результате влияния болезнетворных микроорганизмов и продуктов их жизнедеятельности. Риск развития дисбактериоза значительно возрастает, если маме и /или малышу назначались антибактериальные препараты.