Дисметаболическая – признаки, симптомы и лечение, диета :: SYL.ru
Дисметаболическая нефропатия: виды, симптомы, лечение
Дисметаболические нефропатии – группа заболеваний, которые характеризуются поражением почек вследствие нарушения обмена веществ.
В зависимости от причины развития выделяют первичные и вторичные дисметаболические нефропатии.
Первичные являются наследственно обусловленными заболеваниями, характеризуются прогрессирующим течением, ранним развитием мочекаменной болезни и хронической почечной недостаточности.
Вторичные дисметаболические нефропатии могут быть связаны с повышенным поступлением определенных веществ в организм, нарушением их обмена в связи с поражением других органов и систем (например желудочно-кишечного тракта), лекарственной терапией и др.
Подавляющее большинство дисметаболических нефропатий связаны с нарушением обмена кальция (от 70 до 90%), около 85–90% из них – с избытком солей щавелевой кислоты, оксалатов (в виде оксалата кальция), остальные с избытком фосфатов (фосфаты кальция – 3–10%) или являются смешанными – оксалатно/фосфатно-уратными.
Первичные дисметаболические нефропатии встречаются редко.
Проявления дисметаболических нефропатий
Оксалатно-кальциевая нефропатия
Она наиболее часто встречается в детском возрасте. Ее возникновение может быть связано с нарушением как обмена кальция, так и обмена оксалатов (солей щавелевой кислоты).
Оксалаты попадают в организм с пищей или синтезируются самим организмом.
Причины образования оксалатов:
- Повышенное поступление оксалатов с пищей
- Заболевания кишечника – болезнь Крона, язвенный колит, кишечные анастомозы
- Повышенная выработка оксалатов организмом.
Оксалатная нефропатия
Это многофакторное заболевание. По данным различных авторов, доля наследственности в развитии оксалатной нефропатии составляет до 70–75%. Помимо генетических, большую роль играют внешние факторы: питание, стресс, экологическая нагрузка и др.
Первые проявления болезни могут развиться в любом возрасте, даже в период новорожденности.
Чаще всего они выявляются в 5–7 лет в виде обнаружения кристаллов оксалатов, небольшим содержанием белка, лейкоцитов и эритроцитов в общем анализе мочи. Характерно повышение удельной плотности мочи.
Общее развитие детей с оксалатной нефропатией, как правило, не страдает; но для них характерны аллергии, ожирение, вегетативно-сосудистая дистония со склонностью к понижению артериального давления (гипотонии), головными болями.
Заболевание обостряется в период полового созревания в возрасте 10–14 лет, что, по-видимому, связано с гормональной перестройкой.
Прогрессирование оксалатной нефропатии может привести к формированию мочекаменной болезни, развитию воспаления почек при наслоении бактериальной инфекции.
Фосфатная нефропатия
Фосфатная нефропатия встречается при заболеваниях, сопровождающихся нарушением фосфорного и кальциевого обмена. Основная причина фосфатурии – хроническая инфекция мочевой системы.
Часто фосфатно-кальциевая нефропатия сопровождает оксалатно-кальциевую, но при этом выражена в меньшей степени.
Нарушения обмена мочевой кислоты (уратная нефропатия)
За сутки в организме образуется 570–1000 мг мочевой кислоты, одна треть количества которой секретируется в кишечник и разрушается там бактериями.
Остальные две трети фильтруются в почках, большая часть всасывается обратно, и только 6–12% от профильтровавшегося количества выделяется с мочой.
Первичные уратные нефропатии обусловлены наследственными нарушениями обмена мочевой кислоты.
Вторичные возникают как осложнения других заболеваний (эритремии, миеломной болезни, хронической гемолитической анемии и др.), являются следствием применения некоторых препаратов (тиазидовых диуретиков, цитостатиков, салицилатов, циклоспорина А и др.) или нарушения функции канальцев почек и физико-химических свойств мочи (при воспалении почек, например).
Кристаллы уратов откладываются в ткани почек – это приводит к развитию воспаления и снижению почечных функций.
Первые признаки заболевания могут выявляться в раннем возрасте, хотя в большинстве случаев наблюдается длительное скрытое течение процесса.
А в общем анализе мочи обнаруживают ураты, небольшое количество белка и эритроцитов. При наличии большого количества уратов моча приобретает кирпичный цвет.
Нарушения обмена цистина
Цистин является продуктом обмена аминокислоты метионина.Можно выделить две основные причины повышения концентрации цистина в моче:
- избыточное накопление цистина в клетках почки
Накопление цистина в клетках происходит в результате генетического дефекта фермента цистинредуктазы. Это нарушение обмена носит системный характер и называется цистинозом.
Внутриклеточное и внеклеточное накопление кристаллов цистина выявляется не только в канальцах и интерстиции почки, но и в печени, селезенке, лимфоузлах, костном мозге, клетках периферической крови, нервной и мышечной ткани, других органах.
Нарушение обратного всасывания цистина в канальцах почек наблюдается вследствие генетически обусловленного дефекта транспорта через клеточную стенку для аминокислот – цистина, аргинина, лизина и орнитина.
По мере прогрессирования заболевания определяются признаки мочекаменной болезни, а при присоединении инфекции – воспаление почек.
Диагностика
Лабораторно-инструментальная диагностика дисметаболической нефропатии основывается на
- выявлении кристаллов солей в общем анализе мочи,
- повышении концентрации тех или иных солей в биохимическом исследовании мочи,
- исследовании антикристаллообразующей способности мочи (АКОСМ),
- проведении тестов на кальцифилаксию и перекиси в моче,
- УЗИ почек.
Выявление кристаллов солей только в общих анализах мочи не является основанием для постановки диагноза дисметаболической нефропатии. Следует иметь в виду, что выделение кристаллов с мочой у детей часто бывает преходящим и оказывается не связанным с нарушением обмена веществ.
Для подтверждения диагноза дисметаболической нефропатии при выявлении кристаллов солей в общем анализе мочи проводится биохимическое исследование мочи.
Тест на кальцифилаксию позволяет выявить нарушения клеточного обмена кальция. Тест на перекиси в моче отражает активность процессов перекисного окисления клеточных мембран.
Изменения, выявляемые при УЗИ почек, как правило, мало специфичны. Возможно выявление в почке микрокамешков или включений.
Лечение дисметаболических нефропатий
Лечение любой дисметаболической нефропатии можно свести к четырем основным принципам:
- нормализация образа жизни;
- правильный питьевой режим;
- диета;
- специфические методы терапии.
Прием большого количества жидкости является универсальным способом лечения любой дисметаболической нефропатии, так как способствует уменьшению концентрации растворимых веществ в моче.
Одной из целей лечения является увеличение ночного объема мочеиспускания, что достигается приемом жидкости перед сном. Предпочтение следует отдавать простой или минеральной воде.
Диета позволяет в значительной степени снизить солевую нагрузку на почки.
Специфическая терапия должна быть направлена на предупреждение кристаллообразования, выведен
Дисметаболическая нефропатия у детей — причины, симптомы, диагностика и лечение
Дисметаболическая нефропатия у детей – структурные и функциональные изменения почек, развивающиеся на фоне нарушения обмена веществ, сопровождающегося кристаллурией. Дисметаболическая нефропатия у детей клинически может проявляться аллергией и зудом кожи, отеками, болями в пояснице, гипотонией, выделением мутной мочи. У детей дисметаболическая нефропатия обычно впервые диагностируется при исследовании общего анализа мочи; расширенная диагностика включает УЗИ почек, биохимический анализ мочи. Лечение дисметаболической нефропатии у детей проводится с учетом ее вида и включает диету, медикаментозную коррекцию метаболических нарушений и физико-химических свойств мочи, фитотерапию.
Общие сведения
Дисметаболическая нефропатия у детей – группа обменных нарушений, сопровождающихся повышенной экскрецией с мочой различных солей (оксалатов, уратов, фосфатов) и как следствие — повреждением почечных структур. В детской урологии дисметаболические нефропатии составляют около 27-64% всех заболеваний мочевыделительной системы у детей; в практике педиатрии признаки обменных нарушений в моче встречаются практически у каждого третьего ребенка. Дети с дисметаболическими нефропатиями относятся к группе высокого риска по развитию интерстициального нефрита, пиелонефрита, мочекаменной болезни.
Классификация дисметаболической нефропатии у детей
В зависимости от состава солей различают дисметаболические нефропатии у детей, протекающие с:
- оксалатно-кальциевой кристаллурией (85-90%)
- фосфатной кристаллурией (3–10%)
- уратной кристаллурией (5%)
- цистиновой кристаллурией (3%)
- смешанной (оксалатно/фосфатно-уратной) кристаллурией
С учетом причин возникновения выделяют первичные и вторичные дисметаболические нефропатии у детей. Первичные нефропатии – это наследственно обусловленные заболевания, имеющее прогрессирующее течение и рано приводящие к нефролитазу и хронической почечной недостаточности. К группе вторичных нефропатий у детей относятся различные дисметаболические расстройства, протекающие с кристаллурией и развивающиеся на фоне поражения других органов.
Причины дисметаболической нефропатии у детей
Дисметаболическая нефропатия у детей – полиэтиологичный синдром, возникающий при участии множества факторов. Общими причинами могут выступать отравления и интоксикации, тяжелые физические нагрузки, длительный прием лекарственных веществ, монодефицитные диеты. Отмечено частое развитие дисметаболической нефропатии у детей, рожденных от беременности, протекавшей с поздним токсикозом и гипоксией плода, а также детей с нервно-артритическим диатезом. Первичные нефропатии могут быть обусловлены метаболическими нарушениями у родственников ребенка либо накопленными мутациями, вызывающими дисбаланс регуляторных клеточных механизмов у него самого.
Кроме общих причин, в возникновении того или иного вида дисметаболической нефропатии у детей имеет значение воздействие частных факторов.
Оксалатная дисметаболическая нефропатия у детей (оксалурия) патогенетически связана с нарушением обмена кальция и солей щавелевой кислоты (оксалатов). Определенную роль в ее развитии играет дефицит витаминов А, В6, Е, магния, калия; передозировка витамина D в процессе лечения рахита; повышенное поступление оксалатов с пищей. Оксалатная дисметаболическая нефропатия часто встречается у детей с болезнью Крона, энтеритом, колитом, хроническим панкреатитом, дискинезией желчевыводящих путей, сахарным диабетом, пиелонефритом.
Уратная дисметаболическая нефропатия у детей характеризуется выделением с мочой и отложением в почках уратов — натриевой соли мочевой кислоты. Первичная (наследственная) уратурия чаще всего встречается у детей с синдромом Леша-Найхана. Вторичные нефропатии сопровождают течение эритремии, гемолитической анемии у детей, миеломной болезни, пиелонефрита. Возможно развитие уратной дисметаболической нефропатии у детей, получающих лечение цитостатиками, тиазидовыми диуретиками, салицилатами, циклоспорином А и др.
Причинами фосфатурии могут выступать хроническая мочевая инфекция, первичный и вторичный гиперпаратиреоз, заболевания ЦНС. Цистинурия развивается при системном нарушении обмена цистина – цистинозе, характеризующемся внутриклеточным и внеклеточным накоплением кристаллов цистина в интерстиции и канальцах почек, селезенке, печени, лимфоузлах, клетках крови, костном мозге, нервной и мышечной ткани. Вторичная цистиновая дисметаболическая нефропатия у детей обычно связана с пиелонефритом или тубулярным интерстициальным нефритом.
Симптомы дисметаболической нефропатии у детей
Признаки оксалатной дисметаболической нефропатии у ребенка могут манифестировать уже в период новорожденности, однако в большинстве случаев заболевание длительное время протекает латентно. В родословной детей с дисметаболической нефропатией отмечаются артропатии, подагра, спондилез, мочекаменная болезнь, желчнокаменная болезнь, сахарный диабет.
Чаще всего кристаллурия обнаруживается у детей 5-7 лет случайно, при исследовании общего анализа мочи. Внимательные родители могут заметить, что на вид моча ребенка мутная, с осадком, нередко образует на стенках горшка трудно смываемый налет.
При дисметаболической нефропатии у детей отмечается склонность к аллергическим кожным реакциям, вегето-сосудистой дистонии, гипотонии, головным болям, артралгиям, ожирению. Дети могут испытывать повышенную утомляемость, колющие боли в пояснице, частые и болезненные мочеиспускания, энурез, покраснение и зуд в области наружных половых органов, мышечную гипотонию, субфебрилитет, диспепсии, вздутие живота.
Обострение и прогрессирование заболевания отмечается в пубертатном периоде в связи с гормональной перестройкой. Дисметаболическая нефропатия у детей выступает риск-фактором образования камней в почках и мочевом пузыре, развития хронического пиелонефрита и хронической почечной недостаточности.
Диагностика дисметаболической нефропатии у детей
Кроме педиатра, в диагностике дисметаболической нефропатии у детей обязательно должен участвовать детский нефролог или детский уролог.
Общий анализ мочи выявляет кристаллурию, протеинурию, гематурию, абактериальную лейкоцитурию, цилиндрурию. При биохимическом исследовании мочи определяется повышенная концентрация тех или иных солей (оксалатов, фосфатов, уратов и др.). В комплексе лабораторной диагностики проводятся функциональные пробы мочи по Зимницкому, Аддису–Каковскому, Нечипоренко, определение рН мочи. При наслоении вторичной бактериальной инфекции необходимо бактериологическое исследование мочи на микрофлору.
УЗИ почек и мочевого пузыря у детей с дисметаболической нефропатией может обнаруживать кристаллические включения, указывающие на наличие песка или конкрементов. Дисметаболическую нефропатию у детей следует отличать от транзиторной кристаллурии, связанной с ОРВИ, обильным приемом некоторых продуктов.
Лечение дисметаболической нефропатии у детей
К основным принципам лечения дисметаболической нефропатии у детей относятся: соблюдение рациональной диеты, нормализация обменных процессов, устранение условий для кристаллообразования и усиление выведения солей.
При оксалатной дисметаболической нефропатии у детей из рациона исключаются мясные бульоны, шпинат, щавель, клюква, морковь, свекла, какао, шоколад; предпочтение отдается картофельно-капустной диете. Медикаментозная терапия проводится мембранотропными препаратами (витамин В6, А, диметилоксобутилфосфонилдиметил) и антиоксидантами (витамин Е).
Диета при уратной дисметаболической нефропатии у детей не должна содержать продукты, богатые пуриновыми основаниями (почки, печень, мясные бульоны, фасоль, горох, какао и др.). Основу рациона составляют молочные и растительные продукты. Для снижения синтеза мочевой кислоты назначается аллопуринол, никотинамид, фитосборы и др.
При фосфатной дисметаболической нефропатии у детей рекомендуется ограничение продуктов, богатых фосфором (сыров, печени, бобовых, курицы, шоколада). Необходимо подкисление мочи за счет употребления минеральных вод и лекарственных препаратов (аскорбиновой кислоты, настойки корня марены красильной).
Лечение цистиноза включает диету с исключением из питания ребенка продуктов, богатых серосодержащими аминокислотами и метионином (рыбы, творога, яиц и др.). Важно обязательное подщелачивание мочи с помощью цитратной смеси, раствора гидрокарбоната натрия, щелочных минеральных вод. С целью предупреждения кристаллизации цистина назначается прием пеницилламина.
При любом виде дисметаболической нефропатии у детей важна достаточная водная нагрузка, способствующая уменьшению концентрации солей в моче, соблюдение ребенком режима принудительного мочеиспускания (через каждые 1,5-2 ч). В качестве альтернативной коррекции метаболических процессов может проводиться гомеопатическое лечение под контролем детского гомеопата.
Прогноз и профилактика дисметаболической нефропатии у детей
При соблюдении диеты и лекарственной терапии прогноз дисметаболической нефропатии у детей благоприятен: происходит стойкая нормализация биохимических показателей в моче. В случае несоблюдения общего и терапевтического режима естественным исходом нефропатии является пиелонефрит и мочекаменная болезнь. При цистинозе больные, как правило, нуждаются в трансплантации почки, однако выпадение кристаллов цистина со временем развивается и в трансплантате, приводя к гибели детей в возрасте 15–19 лет.
Диспансерное наблюдение детей с дисметаболической нефропатией проводится педиатром и детским нефрологом. Профилактика дисметаболической нефропатии у детей требует соблюдения детьми питьевого режима, исключение действия предрасполагающих факторов, лечение сопутствующей патологии, обследование детей из групп риска.
www.krasotaimedicina.ru
Дисметаболическая нефропатия: что это, причины, симптомы и лечение
Дисметаболическая нефропатия (далее по тексту мы будем иногда использовать аббревиатуру ДН) относится к группе патологий почек, связанных с нарушением обмена веществ.
Существует первичная и вторичная ДН. Классификация данного недуга происходит в зависимости от причин развития заболевания. Первичный тип заболевания является наследственным, протекает особо прогрессивно, при этом мочекаменная болезнь развивается в хронической форме довольно рано, иногда перетекая в почечную недостаточность.
Вторичная ДН связана с непосредственным (приобретенным) нарушением обмена веществ. Главной причиной является чрезмерное поступление специальных веществ в организм.
Классификация
Существует несколько видов ДН, многие из них встречаются, как правило, у детей. Виды:
- Уратурия (обнаруживается благодаря уратам, которые появляются в моче)
- Оксалургия (определяется благодаря оксалатам, которые в избытке обнаруживаются в урине после анализа)
- Фосфатурия (когда обнаруживают фосфаты)
- Цистиновая форма (когда обнаруживаются цистины)
- Смешанный тип (когда могут обнаруживаться сразу несколько видов веществ).
Вторичная нефропатия, как правило, вызвана дисметаболическими нарушениями, которые развиваются вместе с нарушением работы других органов.
Классификация по мкб 10
В международной классификации болезней (МКБ-10) все виды дисметаболических нефропатий обозначаются N16.3. Заболевание отмечается как поражение почек турулоинтерстициального типа, при котором наблюдается нарушение обмена веществ.
Причины
Главными причинами возникновения ДН являются:
- Нарушение в процессе обмена веществ (в усваивании витаминов и полезных ферментов)
- Застой мочи.
- Отрицательное влияние лечебных препаратов (почки не всегда могут справиться с различными таблетками)
- Последствия лучевой терапии и осложнения после онкологических болезней.
- Инфекции мочеполовой системы, осложнения после цистита.
Говоря о влиянии плохого обмена веществ, следует отметить, что уратурия может возникать при чрезмерном употреблении мяса и при лечении различных болезней серьезными химическими препаратами.
При недостатке витамина В6 или явном переизбытке аскорбиновой кислоты может начаться оксалурия. Причинами для развития этой разновидности ДН также могут быть наследственными. Намного реже оксалургия начинается на фоне болезней желудочно-кишечного тракта.
Симптомы
Первые симптомы нефропатии иногда наблюдаются даже у новорожденных детей. Однако следует заметить, что ДН часто протекает первое время бессимптомно.
Первым симптомом расстройства работы почечной системы является, как правило, цвет мочи: урина имеет коричневый цвет, иногда очень темный. Если от урины остается налет, который сложно смывать, это является очень убедительным признаком. При подозрении необходимо сдавать общий анализ мочи и подтверждать (либо исключать) нефропатию.

Если у пациента имеются аллергические реакции, они могут помочь обнаружить проблемы с мочеиспусканием. Зачастую, ДН начинает давать о себе знать в переходной период, на фоне повышения гормонов в молодом организме.
К врачу необходимо обращаться сразу, как только появляется подозрение. В противном случае может начать развиваться пиелонефрит и почечная недостаточность.
Диагностика
Диагностировать данное заболевание удается при помощи лабораторного анализа. Лаборатория подтверждает нефропатию, если:
- В моче обнаруживаются кристаллы соли.
- Биохимия урины указывает на рост концентрации разных видов солей.
- Моча теряет способность предотвращать образование кристаллов.
Также, ультразвуковое исследование помогает обнаружить нарушения в работе почек.
Лечение
Лечение заболевания производят по многим методикам, однако главными (особенно у детей) являются следующие меры:
- Необходимо выпивать дневную норму воды.
- Введение специального режима питания, в который не входят продукты, содержащие кристалообразующие вещества.
- Отказ от вредных привычек.
Воды необходимо выпивать много, это позволяет уменьшить плотность образовываемых веществ (кристаллов). Употребление воды перед сном является крайне важным, так как это предотвращает процесс образования камней и «песков». Вода не должна быть газированной.
Если пациент имеет дело с оксалургией, то из рациона исключается шоколад, морковь, свекла, холодец. Капуста и картошка наоборот снижают уровень оксалатов и позитивно влияют на лечение.
Сухофрукты являются особенно полезными не только при ДН, но и при многих других нарушениях работы почек. Организму необходимо поступление витаминов А, Е, В6, а также магния.
Осложнения и прогноз
Мы уже упоминали, что во избежание развития таких осложнений, как почечная недостаточность и хроническая мочекаменная болезнь, в случае подозрения на ДН, нужно немедленно обращаться к врачу.
Если ребенку поставили диагноз нефропатия, родители не должны паниковать, ведь данный недуг полностью излечим, если изменить образ жизни и ввести необходимую диету, то никаких последствий, влияющих на качество жизни, у ребенка не будет.
Однако бездействие приводит к диаметрально противоположному: у пациента может начаться образование камней, а лечение такой хронической болезни довольно длительное и угнетающее.
ДН у грудных детей обнаруживается совершенно случайно, происходит это, как правило, на плановом осмотре, когда врач исследует анализ мочи. Первичную форму ДН (наследственная форма) удается обнаружить довольно рано, кроме этого родители (которые передали заболевание генетически) сообщают доктору о своих подозрениях.
Намного чаще встречается вторичный тип заболевания. Питание, прием таблеток, сбои в обмене веществ, неприемлемый анализ мочи – все это является признаками заболевания.
Почечная недостаточность является основным видом осложнения, для лечения которого потребуется не только диета, но и ряд процедур, таких как гемодиализ. Необходимо проводить плановые осмотры и внимательно слушать рекомендации врачей, это почти всегда позволяет избежать тяжелых осложнений.
Загрузка…kardiobit.ru
Дисметаболические нефропатии в практике педиатра | #01/19
Диcметаболические нефропатии (ДН) — гетерогенная группа заболеваний с различной этиологией и патогенезом, которые характеризуются поражением тубулоинтерстициального аппарата почек вследствие нарушения обмена веществ [1, 2, 9].
Проблема ДН является достаточно актуальной в педиатрии и детской нефрологии. Это обусловлено высокой частотой ДН в популяции, а также возможностью их прогрессирования вплоть до развития мочекаменной болезни и/или тубулоинтерстициального нефрита. В структуре заболеваемости мочевыделительной системы у детей ДН составляет от 27% до 64%, а в повседневной практике врача-педиатра синдром обменных нарушений в моче встречается практически у каждого третьего больного [8]. Параллельно отмечается увеличение частоты мочекаменной болезни (МКБ) в популяции в целом, которая в возрастной группе 65–69 лет у мужчин достигает 8,8%, у женщин — 5,6%, а в более молодом возрасте — 3,7% у мужчин и 2,8% у женщин [11]. Одной из причин повсеместного роста частоты МКБ является реализация во взрослом возрасте обменных нарушений, возникших в детстве. По данным эпидемиологического исследования, проведенного V. Romero (2010), частота уролитиаза в таких странах, как США, Италия, Германия, Испания, Япония, за последние 20 лет удвоилась, а в последние годы наблюдается наиболее драматический рост этого показателя [14].
В зависимости от причины выделяют первичные и вторичные ДН. Первичные ДН развиваются в рамках системных наследственно-обусловленных нарушений обмена, характеризуются прогрессирующим течением, ранним развитием уролитиаза и хронической почечной недостаточности. К ним относятся первичная наследственная гипероксалурия (оксалоз), синдром Леша–Нихана, цистиноз, цистинурия и некоторые другие заболевания. Первичные дефекты обмена встречаются достаточно редко, поэтому в данной статье в основном речь пойдет о вторичных ДН.
Вторичные ДН представляют собой вторичные тубулярные синдромы, иначе называемые дисметаболическими расстройствами (диатезами) с кристаллуриями, которые могут быть полигенно-наследуемыми или мультифакториальными. Тубулопатии с кристаллуриями, развивающиеся вследствие генетической предрасположенности, М. С. Игнатовой и Ю. Е. Вельтищевым (1992) были объединены термином «дисметаболические диатезы и нефропатии». Однако причиной вторичных ДН может быть также повышенное поступление определенных веществ в организм, нарушение их метаболизма в связи с поражением других органов и систем (например, желудочно-кишечного тракта), лекарственной терапией, нестабильностью цитомембран канальцев, дегидратацией и др. [1, 2, 8, 9, 11, 14].
В зависимости от типа нарушений обмена при дисметаболических диатезах выделяют оксалатный (щавелевокислый), уратный (мочекислый), цистиновый и другие диатезы.
Любые ДН, вне зависимости от причины, характеризуются мочевым синдромом в виде кристаллурии. В большинстве случаев именно первичная нестабильность мембран канальцевого эпителия является одной из причин кристаллурии. Вследствие генетической предрасположенности или токсического и гипоксического воздействия нарушаются процессы перекисного окисления липидов с образованием свободных радикалов, токсических форм кислорода, что приводит к накоплению вторичных токсических продуктов перекисного окисления липидов, в частности, малонового диальдегида. Параллельно активации процессов перекисного окисления липидов отмечается снижение активности ферментов антиоксидантных защитных систем, в том числе супероксиддисмутазы, активность которой может снижаться до четырех раз. Активное течение свободно-радикальных реакций на мембранах клеток в условиях снижения антиоксидантной защиты приводит к канальцевой мембранопатии, клеточной деструкции, вторичной кристаллурии.
Течение мембранопатологических процессов с развитием иммунного воспаления, циркуляторных нарушений может привести к формированию метаболического тубулоинтерстициального нефрита, представляющего собой острое или хроническое неспецифическое, абактериальное, недеструктивное воспаление интерстициальной ткани почек, сопровождающееся вовлечением в патологический процесс канальцев, кровеносных и лимфатических сосудов почечной стромы.
Персистирующая кристаллурия также может приводить к отложению кристаллов в ткани почки, а также к их адгезии, «слипанию» друг с другом, что служит основой формирования камня и развитию МКБ [12].
Наиболее часто в основе кристаллурии и МКБ лежат нарушения обмена кальция, щавелевой кислоты (оксалатов), мочевой кислоты (уратов), фосфатов, цистина и др. Подавляющее большинство кристаллурий и выявляемых камней связано с кальцием (от 70 до 90%), около 85–90% из них — с оксалатами (в виде оксалата кальция), остальные с фосфатами (фосфаты кальция — 3–10%) или являются смешанными — оксалатно-(фосфатно)-уратными. Уратная кристаллурия и литиаз составляют около 5%, цистиновая — до 3%. В 5–15% выявляются трипельфосфаты — фосфатные кристаллы, содержащие ион аммония, магний и кальций.
На кристаллообразование влияют три основных фактора: 1) перенасыщение канальцевой жидкости сверх пределов ее стабильности; 2) снижение активности ингибиторов перенасыщения; 3) активаторы преципитации.
Для образования кристалла необходимо наличие ионной пары — аниона и катиона (например, иона кальция и иона оксалата). Перенасыщение мочи различными видами ионов в конечном итоге приводит к их преципитации в виде кристаллов, к последующему их росту, кульминацией чего является образование камня [5, 6].
Кроме степени насыщения на растворимость ионов влияет ионная сила, способность к комплексообразованию, рН мочи и скорость ее тока. рН мочи также является важным фактором растворимости. Например, при кислых значениях рН мочевая кислота практически не диссоциирует и легко преципитирует; тогда как фосфатные соли (фосфат кальция), наоборот, малорастворимы при щелочных значениях рН мочи. Нарушение тока мочи также будет способствовать выпадению кристаллов, свидетельством чему является повторное образование камней в условиях частичной обструкции на фоне аномалий развития.
Довольно часто при перенасыщении мочи не выявляется кристаллурии. По всей видимости, это связано с действием ингибиторов перенасыщения — веществ, которые повышают способность мочи удерживать кристаллоиды в растворенном состоянии. Важными ингибиторами образования фосфатно-кальциевых кристаллов и камней являются пирофосфаты, цитрат, магний и низкомолекулярные вещества, а оксалатно-кальциевых — пирофосфаты и высокомолекулярные вещества.
Важными активаторами кристаллообразования является инфекция мочевой системы и рН мочи. Так, трипельфосфаты образуются только вследствие действия уреазоактивной флоры и являются свидетельством инфекции мочевой системы. Стойкое изменение рН мочи вследствие тех или иных заболеваний также может провоцировать кристаллообразование и рост камней. Например, при некоторых заболеваниях желудочно-кишечного тракта (ЖКТ) рН мочи постоянно сдвинут в кислую сторону, что приводит к образованию мочекислых камней из-за снижения растворимости мочевой кислоты в кислой среде [5, 6, 12].
Следует отметить, что понятия «дисметаболическая нефропатия» и «кристаллурия» не являются синонимами. Кристаллурия может носить транзиторный характер, выявляясь, например, на фоне интеркуррентных заболеваний, таких как респираторные вирусные инфекции. Дисметаболическая нефропатия, в свою очередь, не всегда сопровождается кристаллурией (например, после курса терапии и/или на фоне соблюдения диеты).
Оксалатно-кальциевая кристаллурия
Одной из наиболее распространенных кристаллурий в детском возрасте к настоящему времени остается оксалатно-кальциевая кристаллурия.
У большинства больных с оксалатно-кальциевой кристаллурией нет выраженного нарушения метаболизма оксалатов или повышения их экскреции с мочой, но выявляется гиперкальциурия. Однако кристаллы оксалата кальция могут образовываться и при нормальном уровне кальция в моче, вследствие повышения содержания оксалатов. Таким образом, патогенез оксалатно-кальциевой кристаллурии может быть связан как с нарушением обмена кальция, так и с нарушением обмена оксалатов. Так как все оксалатные кристаллы содержат кальций, термины «оксалатная нефропатия» и «оксалатно-кальциевая нефропатия» употребляются как синонимы.
Оксалаты являются конечным метаболическим продуктом в организме, поэтому все они должны экскретироваться. Оксалаты попадают в организм экзогенно с пищей и всасываются в кишечнике или образуются эндогенно. Оксалаты полностью фильтруются в клубочках, затем реабсорбируются и секретируются в канальцах. Даже при небольшом повышении количества оксалатов в моче вследствие их высокой ионной силы высока вероятность выпадения кристаллов оксалата кальция, которые практически нерастворимы.
Гипероксалурические состояния возникают при увеличении всасывания оксалатов в кишечнике либо при повышении их эндогенного образования (табл.).
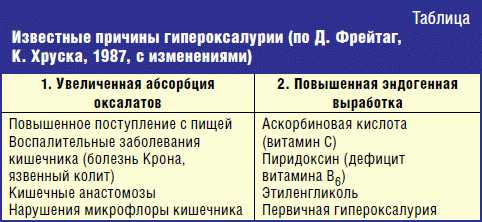
Избыточное всасывание оксалата в кишечнике при питании продуктами, содержащими большие количества щавелевой кислоты (ревень, шпинат, шоколад, крепкий чай, избыток аскорбиновой кислоты и др.) может возникать при увеличенном потреблении с пищей предшественников оксалата, таких как аскорбиновая кислота и этиленгликоль, либо при авитаминозе В6, что означает недостаточность пиридоксина, то есть коэнзима, участвующего в превращении глиоксилата в глицин. Приобретенной гипероксалурии способствуют нарушения функции желудочно-кишечного тракта, сопровождающиеся усиленным всасыванием оксалата. Они возникают при региональном энтерите, синдроме слепой кишки, хроническом панкреатите, хроническом гастрите, неотропическом спру, а также после панкреоэктомии или резекции части кишки. Этот тип гипероксалурии возникает при хирургических вмешательствах, связанных с созданием желудочно-кишечного обхода, когда при интактной толстой кишке создаются условия для движения пищи в обход дистального отдела тонкой кишки и наблюдается избыточное всасывание оксалатов, поступивших с пищей. У таких пациентов развивается стеаторея и затем гипероксалурия. Эти нарушения обусловлены повышением содержания в содержимом толстой кишки жирных кислот. Следует отметить, что жирные и желчные кислоты увеличивают проницаемость толстой кишки для органических веществ, подобных оксалату [7]. Одним из важных факторов нормального обмена оксалатов в кишечнике является Oxalobacter formigenes (O. formigenes), который относится к обычным представителям кишечной микрофлоры и обеспечивает утилизацию около 40–45% оксалатов в полости кишечника. При стойком нарушении кишечного биоценоза число O. formigenes снижается и соответственно увеличивается количество всасываемого оксалата. В целом следует отметить, что роль нарушений ЖКТ в развитии оксалатно-кальциевой кристаллурии настолько велика, что обнаружение оксалатной нефропатии требует обязательной консультации гастроэнтеролога и соответствующего обследования [13, 15].
В генезе гипероксалурий играет важную роль нарушение почечных цитомембран. Причины мембранопатий разнообразны. Лабильность фосфолипидного слоя цитомембран может приводить к кальцифилаксии — нарушению гомеостаза внутриклеточного кальция, приводящего к патологической кальцификации. Нестабильность цитомембран может быть результатом повышенной активности процессов перекисного окисления липидов, как вследствие окислительного стресса, так и снижения факторов антиоксидантной защиты. Все это будет приводить к ускоренному метаболизму мембранных фосфолипидов, вследствие активации фосфолипаз, и высвобождению компонентов липидной оболочки — фосфатидилэтаноламина, фосфатидилсерина, которые через этаноламин и серин будут метаболизироваться в оксалат [3, 5, 6].
Первые симптомы заболевания могут проявиться в любом возрасте, однако чаще отмечаются у детей 5–7 лет в виде лабораторных изменений. Клинически, как правило, данное заболевание себя никак не проявляет. Ввиду отсутствия специфических признаков самочувствие детей, как и общее состояние, чаще всего не страдают. Как правило, это дети, склонные к аллергическим реакциям, к ожирению, дети с синдромом вегетативной дистонии по симпатико-тоническому типу [16]. Иногда отмечаются жалобы на дизурические явления, особенно при присоединении инфекции мочевой системы.
Что касается лабораторных изменений, то мочевой синдром представлен оксалатно-кальциевой или фосфатно-кальциевой кристаллурией, гематурией разной степени выраженности, незначительной протеинурией, абактериальной лейкоцитурией. Также отмечено снижение антикристаллообразующей способности мочи, выявляется фосфолипидурия и повышение фосфолипазной активности мочи. Характерна гиперстенурия.
Морфологически выявляется деструкция апикальных поверхностей эпителия канальцев почек, лимфогистиоцитарная инфильтрация интерстиция. В просветах канальцев и интерстиции обнаруживаются кристаллы оксалата кальция. При прогрессировании заболевания отмечаются явления склероза, вовлечение гломерул.
В случае прогрессирующего течения заболевания, учитывая особенности патогенеза, возможно развитие тубулоинтерстициального нефрита, мочекаменной болезни, рецидивирующего течения пиелонефрита.
Фосфатная кристаллурия
Чаще всего фосфатурия встречается при хроническом течении инфекции мочевой системы, что является основной причиной фосфатурии. Особенное значение для этого имеют микроорганизмы с уреазной активностью. Уреаза разлагает мочевину с ощелачиванием мочи, что приводит к перенасыщению мочи фосфатами магния и аммония (струвит). Соединение струвита с углекислым аппатитом в различных количествах приводит к образованию трипельфосфатных кристаллов. Для кристаллизации трипельфосфатов и дальнейшего формирования камней необходима щелочная реакция мочи. Истинная фосфатурия (или первичная) встречается при заболеваниях центральной нервной системы.
Часто фосфатно-кальциевая кристаллурия сопровождает оксалатно-кальциевую, но выражена при этом в меньшей степени. Фосфатурия также может развиваться вследствие нарушения кальциевого обмена при гиперкальциуриях, при этом кристаллы будут представлены в основном фосфатом кальция.
Нарушения обмена мочевой кислоты
Уратная (подагрическая) нефропатия — патология почек, возникающая вследствие нарушения обмена пуринов или избыточного выведения солей мочевой кислоты почками, приводящая в уратному нефролитиазу или тубулоинтерстициальному нефриту.
Уратные нефропатии в зависимости от происхождения могут быть первичными и вторичными. Первичные уратные нефропатии обусловлены наследственными нарушениями метаболизма мочевой кислоты (подагра, синдром Леша–Нигана). Вторичные возникают как осложнения других заболеваний (эритремии, миеломной болезни, хронической гемолитической анемии, алкоголизма и др.), являются следствием применения некоторых препаратов (тиазидные диуретики, цитостатики, салицилаты, циклоспорин А и др.) или нарушения функции канальцев почек и физико-химических свойств мочи (при пиелонефрите, тубулоинтерстициальном нефрите и др.) [1, 2, 4, 9].
Мочевая кислота (урат) является конечным продуктом обмена пуринов. Следовательно, количество образующейся мочевой кислоты определяется количеством пуринов, поступивших с пищей, эндогенной продукцией и интенсивностью их перехода в мочевую кислоту. Большинство свободных пуриновых оснований утилизируется для ресинтеза пуриновых нуклеотидов.
На кристаллизацию мочевой кислоты влияют рН мочи, суточная экскреция мочевой кислоты и объем мочи. При повышении рН мочи растворимость мочевой кислоты резко возрастает (при изменении рН от 5 до 6 концентрация недиссоциированной формы снижается в 6 раз). В ночное время суток (во время сна) повышается экскреция уратов, снижается количество мочи, а также отсутствует подщелачивание мочи, что усугубляет риск выпадения кристаллов уратов [5, 12].
У больных с уратной нефропатией выявляется дефект почечной экскреции аммония, приводящий к избыточной экскреции титруемых кислот и снижению рН мочи. Причинами экскреции постоянно кислой мочи могут быть заболевания ЖКТ, сопровождающиеся диареей, вследствие дегидратации и/или потери бикарбонатов, а также при илеостоме, лекарственно-индуцированной ацидификации.
Уратурия, как причина, обусловившая поражение почек, выявляется у 14–26% больных. Уратные нефропатии (интерстициальный нефрит на фоне уратурии) представляют собой хронически протекающие заболевания, характеризующиеся умеренной протеинурией, микрогематурией и мочекислой кристаллурией. Результаты обследования детей с уратурией и их родственников выявили обменные нарушения, носящие семейный характер. Очень информативным оказался генеалогический анализ родословных, что позволяет выявлять определенный спектр почечной и внепочечной патологии среди родственников. Так, развитие уратной нефропатии на фоне ожирения, гиперлипидемиии, инсулинрезистентного сахарного диабета рассматривается как клиническое проявление метаболического синдрома, который носит семейный характер. Первые проявления синдрома отмечаются уже в подростковом возрасте. Другая причина развития гиперурикозурии — медикаментозная (диуретики, анальгетики, цитостатики). Экскреция мочевой кислоты с мочой считается превышающей норму при уровне более 1 мг на 1 мл, когда возникает опасность повреждения интерстициальной ткани почек, сосудов и камнеобразования. Что касается клинических проявлений, то при уратной нефропатии могут появиться жалобы на дизурические явления, рецидивирующие боли в животе, боли в поясничной области, в случае уролитиаза (у 5–41%) развивается почечная колика, в тяжелых случаях появляются клинические проявления подагры [4].
Нарушения обмена цистина
Цистин является продуктом метаболизма метионина и представляет собой наименее растворимую из встречаемых в природе аминокислот. Кристаллы цистина выпадают при превышении порога растворимости (более 400 мг/л) и при кислой реакции мочи [1, 2, 5, 9].
Можно выделить две основные причины повышения концентрации цистина в моче: избыточное накопление цистина в клетках почки и нарушение обратного всасывания цистина в почечных канальцах.
Однако наиболее часто кристаллы цистина выявляются при нефропатиях с преимущественным поражением канальцевого аппарата почек (пиелонефрит, тубулоинтерстициальный нефрит), и такая цистинурия носит вторичный характер. Если кристаллы оксалатов, уратов, фосфатов могут появляться эпизодически и при различных колебаниях в диете, то наличие цистина в моче — всегда признак патологии.
Диагноз цистинурии может быть заподозрен у любого пациента при наличии в анамнезе камней в почках, с текущими явлениями уролитиаза, отягощенным семейным анамнезом по мочекаменной болезни и специфическим янтарным окрасом камней.
Диагностические критерии ДН у детей
Постановка диагноза ДН включает в себя комплексную оценку образа жизни ребенка, характер его питания, генеалогический анамнез, результаты лабораторно-инструментальных методов исследования. Скудность клинических проявлений компенсируется характерными лабораторными и инструментальными признаками заболеваний.
Лабораторно-инструментальная диагностика ДН основывается на выявлении кристаллурии в общем анализе мочи, повышении концентрации тех или иных солей в биохимическом исследовании мочи, исследовании антикристаллобразующей способности мочи (АКОСМ) и тестов на кальцифилаксию и перекиси в моче, ультразвуковом исследовании (УЗИ) почек и мочевыводящих путей.
Выявление кристаллов солей только в общих анализах мочи не является основанием для постановки диагноза ДН. Следует иметь в виду, что кристаллурия у детей часто бывает транзиторной и не связанной с патологией обмена и нестабильностью почечных цитомембран. Особенно это касается кристаллурии, выявляемой на высоте лихорадки, после перенесенных инфекций, диареи, а также у детей в периоде новорожденности при развитии «мочекислого инфаркта».
Для подтверждения диагноза ДН при выявлении кристаллурии в общем анализе мочи проводится биохимическое исследование мочи, где следует обратить внимание на концентрацию солей (оксалаты, мочевая кислота, кальций, фосфор и др.) и показатели функции канальцев (глюкоза, титруемая кислотность, аммиак, рН и др.), что позволяет выявить не только повышение экскреции тех или иных веществ, но и оценить условия для кристаллообразования, степень вовлеченности тубулярного аппарата в патологический процесс.
Повышение экскреции солей по данным биохимического исследования мочи при нормальных общих анализах мочи и отсутствии изменений при УЗИ почек также не может в полной мере свидетельствовать о ДН у ребенка, однако позволяет вынести полученные изменения в диагноз, например: гипероксалурия, гиперуратурия и т. д.
При подозрении на ДН отсутствие кристаллурии и повышенной экскреции солей с мочой у ребенка в данный момент не позволяет достоверно исключить этот диагноз. Нормальные показатели в общем и биохимическом анализах мочи могут быть обусловлены, например, правильной диетой и режимом жизни ребенка в данный период, тогда как предпосылки к тем или иным обменным нарушениям сохраняются.
Поэтому важно определить способность мочи растворять различные соли. Для этой цели проводится анализ на АКОСМ к оксалатам кальция, фосфатам кальция и трипельфосфатам, наиболее часто встречаемым при кристаллуриях у детей. В нормальной моче способность растворять эти соли и предотвращать кристаллообразование сохранна за счет наличия ингибиторов кристаллообразования и отсутствия или малой активности активаторов (промоторов) кристаллообразования. При ДН АКОСМ снижена в различной степени за счет повышения концентрации этих солей в растворенном виде и/или нарушения баланса ингибиторов и активаторов.
Тест на кальфилаксию позволят выявить нарушение клеточного гомеостаза кальция, приводящее к патологической кальцификации клеток и тканей. Тест на перекиси в моче отражает активность процессов перекисного окисления липидов цитомембран, повышение уровня перекисей будет являться признаком нестабильности цитомембран.
Ценность методов исследования мочи на АКОСМ, кальцифилаксию и перекиси заключается в возможности доклинического выявления патологии даже при отсутствии каких-либо других лабораторных признаков и в использовании их для контроля эффективности проводимой терапии [3].
Изменения, выявляемые при ультразвуковом исследовании почек, как правило, малоспецифичны и заключаются в очаговом или диффузном повышении эхогенности паренхимы почек за счет отложения кристаллов. Показанием к проведению более углубленного, в частности рентгенологического обследования, является обнаружение в почке при проведении УЗИ микролитов или включений, дающих эффект эхонегативной дорожки.
Общие подходы к лечению ДН
С учетом особенностей этиопатогенеза комплексное лечение ДН предполагает проведение мероприятий неспецифического (нормализация образа жизни, исключение гиподинамии, повышенный питьевой режим) и специфического характера (диета, коррекция метаболических нарушений медикаментозной терапией).
Нормализация образа жизни, физическое и психическое здоровье являются важным условием для достижения положительного эффекта в терапии ДН. Выраженные и длительные нарушения этих составляющих в конечном счете реализуются в микроциркуляторных отклонениях, ведущих к гипоксии, и/или в непосредственном повреждающем воздействии на клетки. Все это активизирует и/или усугубляет нарушения клеточного обмена, интенсивность перекисного окисления липидов мембран, их нестабильность и т. д.
Прием большого количества жидкости является универсальным способом лечения любой ДН, так как способствует уменьшению концентрации растворимых веществ в моче. Также важно время приема жидкости, особенно в периоды максимальной суточной концентрации мочи, т. е. во время сна. Поэтому одной из целей лечения является никтурия, что достигается приемом жидкости перед сном. Предпочтение следует отдавать простой или минеральной воде, поскольку длительный прием жидкостей, например, подкисляющих мочу или содержащих углеводы, может вызвать увеличение экскреции кальция [5].
Диета позволяет в значительной степени снизить метаболическую нагрузку на тубулярный аппарат.
При лечении больных с оксалатной нефропатией назначается картофельно-капустная диета, при которой снижается поступление оксалатов с пищей и нагрузка на тубулярный аппарат. Применение картофельно-капустной диеты в течение 2–3 недель сопровождается статистически достоверным снижением экскреции оксалатов, что сочетается с улучшением мочевого синдрома. Картофельно-капустная диета назначается на 3 недели с трехнедельными перерывами, во время которых ребенок получает диету № 5 по Певзнеру.
Также необходимо исключить экстрактивные мясные блюда, богатые оксалатами щавель, шпинат, клюкву, свеклу, морковь, какао, шоколад и др. «Подщелачивающий» эффект оказывают курага, чернослив, груши.
Из минеральных вод используются такие, как «Славяновская» и «Смирновская», по 3–5 мл/кг/сут в 3 приема курсом 1 мес 2–3 раза в год.
При лечении уратной нефропатии диета предусматривает исключение богатых пуриновыми основаниями продуктов (печень, почки, мясные бульоны, горох, фасоль, орехи, какао и др.). Преимущество должно отдаваться продуктам молочного и растительного происхождения. Важным условием успешной терапии является достаточное употребление жидкости — от 1 до 2 л в сутки. Предпочтение следует отдавать слабощелочным и слабоминерализованным водам, отварам трав (хвощ полевой, укроп, лист березы, брусничный лист, клевер пашенный, спорыш и др.), отвару овса. Для поддержания рН мочи в пределах 6,2–6,6 можно использовать цитратные смеси (Уралит-У, Блемарен, Магурлит, Солимок и др.), которые обладают значительной буферной емкостью [1, 4, 5, 9, 10].
Специфическая терапия должна быть направлена на предупреждение кристаллообразования, выведение солей, нормализацию обменных и энергетических процессов. Поскольку в большинстве случаев мембранопатия у детей является одним из звеньев патогенеза ДН, основной акцент делается на антиоксидантную и мембраностабилизирующую терапию.
Медикаментозная терапия включает мембранотропные препараты и антиоксиданты [5, 6, 9]. Лечение должно быть длительным и курсовым для достижения пролонгированного эффекта.
Пиридоксин (витамин В6) назначается в дозе 1–3 мг/кг/сут (до 400 мг/сут) в течение 1 мес ежеквартально. Витамин В6 оказывает мембраностабилизирующее действие за счет участия в обмене жиров в качестве антиоксиданта и обмене аминокислот. Целесообразно также назначение препарата Магне В6 из расчета 5–10 мг/кг/сут курсом в течение 2 мес 3 раза в год.
Мембраностабилизирующее действие оказывает витамин А, который встраивается в билипидный слой и нормализует взаимодействие белков и липидов мембраны. Суточная доза витамина А 1000 МЕ на год жизни ребенка, курсом 1 мес ежеквартально.
Токоферола ацетат (витамин Е) является мощным антиоксидантом, который поступает в организм извне и вырабатывается эндогенно. Необходимо помнить, что экзогенное введение витамина Е может тормозить его эндогенную продукцию по механизму отрицательной обратной связи. Витамин Е укрепляет белково-липидные связи клеточных мембран, участвует в процессах акцепции электронов при свободно-радикальных реакциях на мембранах. Назначается с витамином А в дозе 1–1,5 мг/кг массы в сутки.
В качестве мембраностабилизаторов также используются Димефосфон и Ксидифон. Димефосфон восстанавливает связь между окислением и фосфорилированием в клеточном дыхании, разобщенность которого наблюдается при нестабильности митохондриальных мембран, прерывая каскадные процессы перекисного окисления липидов. Применяется в дозе 1 мл 15% раствора на каждые 5 кг веса, 3 приема в сутки. Курс — 1 мес, 3 раза в год.
Ксидифон является комплексообразующим препаратом, который облегчает включение кальция в митохондрии и предупреждает отложение его нерастворимых солей. Назначается в дозе 10 мг/кг/сут 2% раствора в 3 приема. Курс — 1 мес, 2 раза в год.
В лечении детей с оксалатно-кальциевой кристаллурией широко применяется фитотерапия. Из комбинированных фитопрепаратов рекомендуется применение Цистона, Фитолизина и Канефрона. Цистон назначается в дозе 1–2 таблетки 2–3 раза в день курсом от 3 до 6 мес. Канефрон у взрослых применяется в форме драже и капель: по 2 драже 3 раза в день (или по 50 капель 3 раза в день). Для детей доза уменьшается в 2–3 раза в зависимости от возраста: по 11–25 капель или по 1 драже 3 раза в день в течение 6–8 недель [3].
Помимо этого, назначается окись магния, особенно при первичной гипероксалурии, в дозе 0,15–0,2 г/сут. При первичной гипероксалурии следует иметь в виду, что любая терапия является паллиативной. Радикальным методом лечения оксалоза является трансплантация печени, что устраняет дефект отсутствия аланин-глиоксилаттрансферазы и восстанавливает нормальный обмен оксалатов.
При гиперурикемии важно уменьшить концентрацию мочевой кислоты до 6 мг/100 мл и менее. Для этого используются средства, снижающие синтез мочевой кислоты, — ингибиторы ксантиноксидазы. Применение в педиатрии аллопуринола ограничено из-за возможных осложнений — гепатит, эпидермальный некроз, алопеция, лейко- и тромбоцитопения, повышение уровня ксантина в крови. Под строгим контролем аллопуринол назначают в дозе 0,2–0,3 г/сут в 2–3 приема в течение 2–3 нед, затем доза снижается. Длительность общего курса — до 6 мес. Никотинамид является более слабым ингибитором активности ксантиноксидазы, чем аллопуринол, но лучше переносится; назначается в дозе 0,005–0,025 г 2–3 раза в сутки по 1–2 мес повторными курсами. Колхицин снижает транспорт пуриновых оснований и скорость их обмена. Назначается в дозе 0,5–2 мг/сут сроком от 18 мес до нескольких лет.
Урикозурическим эффектом также обладают оротовая кислота, Цистон, Этомид, Цистенал, Фитолизин и др. Калия оротата таблетки назначаются в дозе 10 мг/кг в сут в 2–3 приема в течение 1 мес. Урикозурическим и урикозостатическим действием обладает также бензбромарон, который применяют по 50–100 мг/сут 2–3 раза в сочетании с салуретиками и цитратом натрия [5, 6, 9].
Лечение при фосфатной кристаллурии должно быть направлено на подкисление мочи (минеральные воды: «Нарзан», «Арзни», «Дзау-суар» и др.; препараты: Цистенал, аскорбиновая кислота, метионин). Назначается диета с ограничением продуктов, богатых фосфором (сыр, печень, икра, курица, бобовые, шоколад и др.). При выраженной экскреции фосфата кальция необходимо добиться снижения всасывания фосфора и кальция в кишечнике (например, назначением Альмагеля). Обязательным компонентом лечения при наличии трипельфосфатов является антибактериальная терапия и санация хронической инфекции мочевой системы [9].
Лечение цистиноза и цистинурии включает диету, высокожидкостный режим и медикаментозную терапию, направленную на подщелачивание мочи и повышение растворимости цистина [2, 4–6].
Цель диетотерапии — предотвратить избыточное поступление в организм ребенка предшественника цистина — метионина и других серосодержащих кислот. Для этого также исключают (или резко ограничивают) из рациона питания ребенка богатые метионином и серосодержащими аминокислотами продукты — творог, рыбу, яйца, мясо и др. Поступление метионина при таких диетических мероприятиях сокращается до 0,7 г/сут. Поскольку метионин необходим растущему организму ребенка для пластических процессов, длительное применение строгой диеты невозможно, поэтому через 4 нед от начала диетотерапии рацион ребенка расширяется и приближается к обычному, но характеризуется строгим исключением рыбы, творога и яиц.
Количество жидкости, употребляемой ребенком, должно быть не менее 2 л/сут, особенно важно принимать жидкость перед сном. Для подщелачивания мочи используется цитратная смесь, растворы гидрокарбоната натрия, Блемарен, щелочные минеральные воды. Это позволяет добиться повышения рН мочи до 7,5–8,0. Снижению концентрации цистина и повышению рН мочи будут также способствовать ингибиторы карбоангидразы (Диакарб) и Гипотиазид.
Для повышения растворимости цистина и предупреждения кристаллизации назначается пеницилламин, с целью активации тиолзависимых ферментов. Пеницилламин обладает некоторой токсичностью и антиметаболическим действием на пиридоксин, поэтому в начале терапии назначаются невысокие дозы препарата — 10 мг/кг/сут в 4–5 приемов, далее доза увеличивается в течение недели до 30 мг/кг/сут, а при цистинозе — до 50 мг/кг/сут. Лечение пеницилламином должно проводиться под контролем содержания цистина в лейкоцитах и/или цианиднитропруссидного теста (проба на цистин в моче, где концентрация цистина должна составлять до 150–200 мг/л). При достижении этих показателей доза пеницилламина снижается до 10–12 мг/кг/сут. Лечение пеницилламином проводится длительно, годами. Поскольку пеницилламин инактивирует пиридоксин, параллельно назначается витамин В6 (пиридоксин) в дозе 1–3 мг/кг/сут в течение 2–3 мес с повторными курсами. Для стабилизации мембран почечных канальцев назначаются витамин А (6600 МЕ/сут) и витамин Е (токоферол, 1 капля на 1 год жизни 5% раствора в сутки) в течение 4–5 нед с повторными курсами. Имеются данные о положительном эффекте применения вместо пеницилламина менее токсичного его аналога — Купренила в уменьшенной дозе в сочетании с Ксидифоном и другими мембраностабилизаторами [1, 9].
При цистинозе успешно используется трансплантация почки, которая проводится до развития терминальной стадии хронической почечной недостаточности (ХПН). Трансплантация почки позволяет значительно увеличить срок жизни больных — до 15–19 лет, однако отложение кристаллов цистина наблюдается и в трансплантате с преимущественным поражением интерстиция и мезангиума, что в конечном итоге приводит к развитию интерстициального фиброза и склерозированию в пересаженной почке и ХПН.
При развитии на фоне ДН и МКБ хронического пиелонефрита необходимо включение в комплексную терапию наряду с антибиотиками иммунокорригирующих препаратов, повышающих эффективность антибиотикотерапии, особенно учитывая часто наблюдающуюся у таких больных поливалентную антибиотикорезистентность. С этой целью могут использоваться различные препараты (Уро-Ваксом, Иммунал, Имунофан, левамизол, Ликопид и др.) [6].
Прогноз при вторичной ДН в целом благоприятен. В большинстве случаев при соответствующем режиме, диете и медикаментозной терапии удается добиться стойкой нормализации соответствующих показателей в моче. В отсутствие лечения или при его неэффективности наиболее естественными исходами ДН являются МКБ и тубулоинтерстициальный нефрит.
Диспансерное наблюдение и профилактика
Диспансерное наблюдение включает в себя ежегодное обследование по плану. При необходимости биохимическое исследование мочи проводят 1 раз в 3–6 месяцев. Основные профилактические мероприятия направлены на сбалансированное питание ребенка и профилактику осложнений (инфекция мочевой системы, мочекаменная болезнь, тубулоинтерстициальный нефрит).
Литература
- Вельтищев Ю. В., Игнатова М. С. Наследственные и врожденные болезни почек и мочевыводящих путей. В кн.: Наследственная патология человека / Под ред. Ю. В. Вельтищева, Н. П. Бочкова. М., 1992. Т. 2. С. 3–71.
- Возианов А. Ф., Майданник В. Г., Бидный В. Г., Багдасарова И. В. Основы нефрологии детского возраста. Киев: Книга плюс, 2002. С. 214–225.
- Длин В. В., Османов И. М., Юрьева Э. А. Обменные нефропатии. М.: Оверлей, 2009. 128 с.
- Игнатова М. С. Наследственные и врожденные нефропатии. В кн.: Нефрология / Под ред. И. Е. Тареевой. М.: Медицина, 2000. С. 337–371.
- Малкоч А. В. Дисметаболические нефропатии и мочекаменная болезнь. В кн.: Нефрология детского возраста: Практическое руководство по детским болезням. М.: Медпрактика, 2005. Т. 6. С. 472–516.
- Малкоч А. В., Бельмер С. В. Мочекаменная болезнь у детей // Лечащий Врач. 2005, № 7. [Электронный ресурс: URS https://www.lvrach.ru/2005/07/4532751/, дата обращения: 17.08.2018].
- Малкоч А. В., Бельмер С. В. Нефропатии при целиакии // Лечащий Врач. 2012, № 8. [Электронный ресурс]. URL: https://www.lvrach.ru/2012/08/15435496/ (дата обращения: 17.08.2018).
- Рычкова С. В. Дисметаболические нефропатии в педиатрической практике // Лечащий Врач. 2010, № 8. [Электронный ресурс]. URL: https://www.lvrach.ru/2010/08/15392892/ (дата обращения: 17.08.2018).
- Юрьева Э. А., Длин В. В. Диагностический справочник нефролога. Клиническая и лабораторная диагностика. М.: Изд. «Медпрактика-М», 2007. 352 с.
- Cameron J. S., Moro F., Simmonds H. A. Gout, uric acid andpurine metabolism in paediatric nephrology // Pediatr. Nephrol. 1993; 7: 105–118.
- Indridason O. S., Birgisson S., Edvardsson V. O., Sigvaldason H., Sigfusson N., Palsson R. Epidemiology of kidney stones in Iceland: a population-based study // Scand. J. Urol. Nephrol. 2009. Vol. 40, № 3. P. 215–220.
- Jobs K., Rakowska M., Paturej A. Urolithiasis in the pediatric population — current opinion on epidemiology, patophysiology, diagnostic evaluation and treatment // Dev Period Med. 2018; 22 (2): 201–208.
- John C. Lieske Probiotics for prevention of urinary stones [Электронный ресурс]. URL: http://dx.doi.org/10.21037/atm.2016.11.86 (дата обращения: 17.08.2018).
- Romero V., Akpinar H., Assimos D. G. Kidney Stones: A Global Picture of Prevalence, Incidence, and Associated Risk Factors // Rev Urol. 2010. Vol. 12, № 2–3. P. 86–96.
- Sadaf H., Raza S. I., Hassan S. W. Role of gut microbiota against calcium oxalate. // Microb Pathog. 2017 Aug; 109: 287–291.
- Sakhaee K., Capolongo G., Maalouf N. M., Pasch A., Moe O. W., Poindexter J. et al. Metabolic syndrome and the risk of calcium stones // Nephrol Dial Transplant. 2012. № 8. Р. 3201–3209.
А. В. Малкоч*, 1, кандидат медицинских наук, профессор
Е. Г. Куликова**
Ю. Б. Юрасова***, доктор медицинских наук, профессор
* ФГБОУ ДПО РМАНПО, Москва
** ГБУЗ МО МОКДЦД, Мытищи
*** ФГБОУ ВО МГУПП, Москва
1 Контактная информация: [email protected]
Дисметаболические нефропатии в практике педиатра/ А. В. Малкоч, Е. Г. Куликова, Ю. Б. Юрасова
Для цитирования: Лечащий врач № 1/2019; Номера страниц в выпуске: 34-39
Теги: диета, водно-питьевой режим, энерготропные препараты
Купить номер с этой статьей в pdf
www.lvrach.ru
клинические рекомендации, лечение и диета
Среди нефрологических патологий в педиатрии распространена дисметаболическая нефропатия у детей. Ее частотность составляет до 60% от всех заболеваний мочеполовой системы у детей. Болезнь имеет сложный патогенез и может стать причиной других болезней мочевыделительной системы.
Что такое дисметаболическая нефропатия?
Это заболевание вызвано нарушением обменных процессов, в результате чего изменяется состав мочи. В ней обнаруживается повышенное содержание белка, эритроцитов, лейкоцитов и солей. Последние приводят к возникновению камней и развитию мочекаменной болезни, повреждению почечных структур, нарушению функционирования почек.
Дисметаболическая нефропатия у детей сопровождается структурными изменениями почек
К сожалению, за последние годы дисметаболическая нефропатия (ДН) помолодела. Она диагностируется даже у детей младшей возрастной группы, в возрасте 4–5 лет, что значительно ухудшает прогнозы.
Причины
Дисметаболическая нефропатия чаще развивается у детей при воздействии нескольких предрасполагающих факторов, которые могут быть внутренними или внешними. К первым принадлежат обменные нарушения, в частности нарушенный обмен оксалатов, кальция, фосфатов, уратов, цистина, триптофана.
Не последнюю роль в появлении ДН играют такие факторы:
- наследственность;
- врожденные аномалии почек и мочевых путей;
- избыток или дефицит витаминов и полезных веществ – А, В6, С, Д, Е, магния и калия;
- гемолитическая анемия;
- энтерит, колит, болезнь Крона;
- панкреатит;
- мезаденит;
- болезни желудочно-кишечного тракта;
- глистные инвазии;
- сахарный диабет;
- эндокринные нарушения, например гиперфункция паращитовидных желез;
- пиелонефрит;
- дискинезия желчевыводящих путей;
- миеломная болезнь;
- инфекция мочевыводящих путей;
- онкологические заболевания, когда есть необходимость проведения курса химиотерапии или облучения.
Вероятность появления признаков данной болезни повышается при воздействии внешних факторов. К ним принадлежат:
- интоксикация или отравление;
- прием медикаментов, в частности длительная терапия цитостатиками, диуретиками, циклоспоринами или салицилатами;
- неправильное или скудное питание, повышение доли животных белков, щавелевой кислоты в рационе ребенка;
- сухой и жаркий климат, воздействие интенсивного ультрафиолетового излучения;
- неблагоприятная экологическая обстановка;
- несоблюдение питьевого режима, употребление воды повышенной жесткости;
- тяжелые физические нагрузки.
В группе риска также находятся дети, рожденные при беременности, протекавшей с гипоксией и токсикозом.
Классификация
Согласно этиологии происхождения существует две формы:
- первичная – вызвана наследственной предрасположенностью и возникшими вследствие этого обменными нарушениями;
- вторичная – развивается на фоне болезней, воздействия неблагоприятных факторов окружающей среды.
Первичная форма чаще сопровождается возникновением осложнений.
Существует классификация в зависимости от состава солей. Есть такие разновидности ДН:
- оксалатная;
- фосфатная;
- уратная;
- цистиновая;
- смешанная.
Первая разновидность встречается в 80–90% случаев, вызвана нарушенным обменом кальция.
Симптомы
Для заболевания характерно латентное течение, то есть болезнь может не давать о себе знать длительное время. Чаще выявляется случайно в ходе обследования. Именно изменение мочи – первый признак ДН. Меняется не только ее состав, но также и цвет. Она становится мутной; если долго находится в горшке, то выпадает осадок, на стенках может оставаться налет, который без бытовой химии тяжело удалить.
При образовании камней симптомы становятся более выраженными
Основные признаки болезни:
- головная боль;
- усталость;
- мышечная слабость;
- боль в пояснице, в области почек;
- субфебрильная температура тела;
- покраснение в области половых органов, зуд, дискомфортные ощущения;
- вздутие живота;
- аллергические высыпания на коже;
- понижение артериального давления;
- вегето-сосудистая дистония;
- лишний вес.
Накопление солей сопровождается воспалением, запускается процесс формирования камней, мочеиспускание становится болезненным, возможен энурез.
Диагностика
При появлении симптомов ДН ребенка нужно показать педиатру, а затем нефрологу и урологу. Именно эти специалисты назначат комплексное обследование:
- общий анализ мочи;
- пробы мочи по Земницкому;
- моча по Нечипоренко;
- определение кислотности.
Если в анализах заметны отклонения, назначается инструментальная диагностика, которая предполагает УЗИ органов мочевыделительной системы.
Лечение
Терапия не базируется на одних только медицинских препаратах. Основу составляет изменение рациона питания и питьевого режима. Клинические рекомендации следующие:
- увеличение объема потребляемой жидкости до 1,5–2 литров в день;
- принудительное мочеиспускание каждые 2 ч. для очищения почек;
- диета.
Без диетического питания выздоровление невозможно. Подбор диеты осуществляется врачом исходя из вида заболевания. При оксалатной ДН стоит отдать предпочтение капусте и картофелю. Именно эти овощи снижают уровень оксалатов. Полезно есть сухофрукты, пить минеральную воду. Нужно отказаться от наваристых мясных бульонов, свеклы, моркови, щавелевой кислоты, которая содержится в щавеле, а также от продуктов, содержащих какао.
Клинические рекомендации играют важную роль в лечении
При повышении содержания уратов стоит исключить мясные блюда, животные субпродукты и бобовые. Полезна молочная продукция и растительная пища. При фосфатной ДН стоит ограничить потребление фосфатных продуктов, например бобовых, шоколада. Подкисление мочи производится с помощью минеральной воды. Также оправдан прием витамина С.
При цистинозе нельзя употреблять в пищу продукты, богатые серой и метионином. Поэтому из рациона ребенка исключается рыбная и мясная пища, под запретом творог и яйца. Диетического питания стоит придерживаться не менее месяца. Возвращаться к обычному меню можно только после одобрения врача.
В лечении заболеваний мочевыводящей системы важен именно питьевой режим. Чем чаще происходит мочеиспускание, тем меньше вероятность отложения солей и формирования камней.
Одновременно с диетическим питанием проводится медикаментозное лечение, которое предполагает использование антиоксидантов, фитопрепаратов и витаминных средств. Медикаменты назначаются врачом.
При отсутствии правильного и эффективного лечения могут возникнуть последствия в виде моче- или желчнокаменной болезни, пиелонефрита, цистита, артропатии, подагры. Самым тяжелым осложнением является почечная недостаточность.
Профилактика
Профилактические мероприятия предполагают терапию существующих заболеваний и поддержание нормальных обменных процессов. Важно обеспечить ребенка всеми необходимыми питательными веществами, для этого питание должно быть сбалансированным, пищевая ценность продуктов подобрана по возрасту.
При обменных нарушениях нужно придерживаться диеты. Также необходимо укреплять иммунитет ребенка, не допускать переохлаждения и оградить малыша от сильных стрессов.
Прогноз при данном заболевании благоприятный. Главное – нормализовать состав мочи до появления осложнений. После стоит беречь ребенка, поскольку он находится в группе риска, важно следить за тем, что он ест и сколько он пьет жидкости.
Читайте также: цистит у детей
www.baby.ru
Нарушения минерального обмена в почках (дисметаболические нефропатии)
Дисметаболические нефропатии (наршения минерального обмена почек — НМО) представляют собой группу заболеваний, характеризующихся поражением почек вследствие нарушения обмена веществ и приводящим к развитию мочекаменной болезни (МКБ), воспалению почек (пиелонефрит), которые могут осложниться хронической почечной недостаточностью (ХПН).
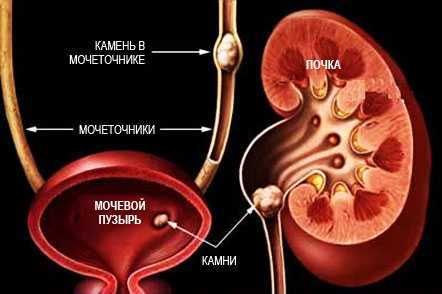
В зависимости от причины развития выделяют первичные и вторичные НМО.
Первичные нарушения представляют собой наследственно обусловленные формы заболеваний, характеризующихся прогрессирующим течением, ранним развитием мочекаменной болезни (МКБ) и хронической почечной недостаточности (ХПН). Первичные дисметаболические нефропатии встречаются редко и начало клинических проявлений развивается уже в детском возрасте.
Вторичные дисметаболические нефропатии могут быть связаны с повышенным поступлением определенных веществ в организм, нарушением их метаболизма в связи с поражением других органов и систем (например, желудочно-кишечного тракта), применением ряда лекарственных средств и др.
Подавляющее большинство (от 70 до 90%) дисметаболических нефропатий связаны с нарушением обмена кальция, при этом около 85–90% из них обусловлены избытком солей щавелевой кислоты в виде оксалата кальция — оксалатов, 3–10% — перегрузкой фосфатами (фосфаты кальция), существуют смешанный вариант нарушений – оксалатно/фосфатно-уратные.
Оскалатно-кальциевая нефропатия
Оксалатно-кальциевая нефропатия наиболее часто встречается в детском возрасте. Ее возникновение может быть связано с нарушением обмена кальция или оксалатов (солей щавелевой кислоты).
Причины образования оксалатов:
- повышенное поступление оксалатов с пищей
- заболевания кишечника – воспалительные заболевания кишечника (болезнь Крона, язвенный колит), кишечные анастомозы при проведении оперативных вмешательств на кишечнике
- повышенная выработка оксалатов самим организмом
Оксалатная нефропатия представляет собой многофакторный патологический процесс. Наследственная предрасположенность к развитию оксалатной нефропатии встречается в 70–75%. Помимо генетических, большую роль играют такие внешние факторы, как: питание, стресс, экологические проблемы и др.
Первые проявления болезни могут развиться в любом возрасте, даже в период новорожденности. Чаще всего они выявляются в 5–7 лет в виде обнаружения кристаллов оксалатов, небольшим содержанием белка, лейкоцитов и эритроцитов в общем анализе мочи. Характерно повышение удельной плотности мочи. Заболевание обостряется в период полового созревания в возрасте 10–14 лет, что, по-видимому, связано с гормональной перестройкой.
Прогрессирование оксалатной нефропатии может привести к формированию мочекаменной болезни, развитию воспаления почек — пиелонефриту при наслоении бактериальной инфекции.
Фосфатная нефропатия
Фосфатная нефропатия встречается при заболеваниях, сопровождающихся нарушением фосфорного и кальциевого обмена. Основная причина фосфатурии – хроническая инфекция мочевой системы. Часто фосфатно-кальциевая нефропатия сопровождает оксалатно-кальциевую, но при этом выражена в меньшей степени.
Уратная нефропатия (нарушения обмена мочевой кислоты)
Эта группа обменных нарушений наиболее часто встречается у взрослых. Первичные уратные нефропатииобусловлены наследственными нарушениями обмена мочевой кислоты. Вторичные возникают как осложнениядругих заболеваний (болезней крови и др.), являются следствием применения некоторых препаратов (тиазидовых диуретиков, цитостатиков, салицилатов, циклоспорина А и др.) или нарушения функции канальцев почек и физико-химических свойств мочи (при воспалении почек, например). Кристаллы уратов откладываются в ткани почек – это приводит к развитию воспаления и снижению почечных функций.
Первые признаки заболевания могут выявляться в раннем возрасте, хотя в большинстве случаев наблюдается длительное скрытое течение процесса.
Цистиновая нефропатия
Цистин является продуктом обмена аминокислоты метионина. Можно выделить две основные причины повышения концентрации цистина в моче:
- избыточное накопление цистина в клетках почки
- нарушение обратного всасывания цистина в почечных канальцах.
Накопление цистина в клетках происходит в результате генетического дефекта фермента цистинредуктазы. Это нарушение обмена носит системный характер и называется цистинозом. Внутриклеточное и внеклеточное накопление кристаллов цистина выявляется не только в канальцах и интерстиции почки, но и в печени, селезенке, лимфоузлах, костном мозге, клетках периферической крови, нервной и мышечной ткани, других органах. Нарушение обратного всасывания цистина в канальцах почек наблюдается вследствие генетически обусловленного дефекта транспорта через клеточную стенку для аминокислот – цистина, аргинина, лизина и орнитина.
По мере прогрессирования заболевания определяются признаки мочекаменной болезни, а при присоединении инфекции – воспаление почек.
Симптомы НМО
НМО почек, как правило, клинически течет бессимптомно до формирования мочекаменной болезни или пиелонефрита, но в ряде случаев могут проявляться следующими симптомами:
- дискомфорт при мочеиспускании
- учащенное мочеиспускание
- ноющая боль или дискомфорт, локализующиеся преимущественно в поясничной области или животе
- приступообразная («почечная колика») или постоянная боль, отдающая в. подвздошную или паховую область, на внутреннюю поверхность бедра, в половые органы
- боль над лоном может развиваться при отложении солей или наличии камней в мочевом пузыре
Диагностика НМО
Необходимое комплексное обследование включает лабораторные и инструментальные методы.
Лабораторная диагностика
- Общий анализ мочи, в котором выявляются кристаллы солей той или иной кислоты. Однако данное исследование не позволяет с полной уверенностью утверждать о присутствии дисметаболической нефропатии. Выявление кристаллов солей только в общих анализах мочи не является основанием для постановки диагноза дисметаболической нефропатии. Следует иметь в виду, что выделение кристаллов с мочой часто бывает преходящим и оказывается не связанным с нарушением обмена веществ. Поэтому для уточнения диагноза прибегают ко второму этапу исследования – проведению биохимического исследования мочи.
- Биохимический анализ мочи позволяет оценить концентрации тех или иных солей в порции мочи. Метод является более точным и чувствительным для определения количественного уровня оксалатов, фосфатов, уратов и других кристаллов солей.
- АКОСМ — определение антикристаллобразующей способности мочи. Метод достаточно сложный, проводится не в каждом лечебном заведении.
- Ряд тестов на перекиси в моче и кальцифилаксию. Данная методика позволяет выявить нарушения кальциевого обмена и оценить степень активности перекисного окисления мембран клеток почечной ткани, что является важным звеном в процессах развития дисметаболических нефропатий.
Инструментальная диагностика
УЗИ органов брюшной полости. Изменения, выявляемые при УЗИ почек, как правило, мало специфичны. Возможно выявление в почке микролитов или «песка» (включений). УЗИ почек, как правило, является неспецифичным методом диагностики, однако в ряде случаев позволяет отследить формирование мелких камней и, таким образом, зафиксировать время возникновения мочекаменной болезни.
Лечение
Рекомендации по питанию являются основой терапии как в детском, так и во взрослом состоянии.
| Вид нефропатии | Запрещенные продукты |
| Оксалатная нефропатия | Мясные блюда, щавель, шпинат, клюква, свекла, морковь, какао, шоколад |
| Уратная нефропатия | Печень, почки, мясные бульоны, горох, фасоль, орехи, какао, алкогольные напитки |
| Фосфатная нефропатия | Сыр, печень, икра, курица, бобовые, шоколад |
| Цистиновая нефропатия | Творог, рыба, яйца, мясо |
Лечение оксалатной нефропатии
Диета
- при лечении больных с оксалатной нефропатией назначается картофельно-капустная диета, при которой снижается поступление оксалатов с пищей и нагрузка на почки
- необходимо исключить холодец, крепкие мясные бульоны, щавель, шпинат, клюкву, свеклу, морковь, какао, шоколад
- рекомендуется ввести в рацион курагу, чернослив, груши
- из минеральных вод используются такие, как славяновская и смирновская, по 3–5 мл/кг/сут. в 3 приема курсом 1 месяц 2–3 раза в год
Лекарственная терапия включает мембранотропные препараты и антиоксиданты. Лечение должно быть длительным. Применяются витамины группы В, А, Е. Назначаются специальные препараты при кристаллурии. Помимо этого, назначается окись магния, особенно при повышенном содержании оксалатов.
Лечение уратной нефропатии
Диета
- при лечении уратной нефропатии диета предусматривает исключение богатых пуриновыми основаниями продуктов (печени, почек, мясных бульонов, гороха, фасоли, орехов, какао и др.)
- преимущество должно отдаваться продуктам молочного и растительного происхождения
- важным условием успешной терапии является достаточное употребление жидкости – от 1 до 2 л в сутки. Предпочтение следует отдавать слабощелочным и слабоминерализованным водам, отварам трав (хвощ полевой, укроп, лист березы, брусничный лист, клевер, спорыш и др.), отвару овса
Для поддержания оптимальной кислотности мочи можно использовать цитратные смеси. При уратной нефропатии важно уменьшить концентрацию мочевой кислоты. Для этого используются средства, снижающие синтез мочевой кислоты.
Лечение фосфатной нефропатии
Назначается диета с ограничением продуктов, богатых фосфором (сыр, печень, икра, курица, бобовые, шоколад и др.).
Лечение при фосфатной нефропатии должно быть направлено на подкисление мочи (минеральные воды – нарзан, арзни, дзау-суар и др.; препараты – цистенал, аскорбиновая кислота, метионин).
При любой степени тяжести заболевания необходимо незамедлительно обратиться к врачу нефрологу или урологу за помощью, так как длительно текущие, в целом обратимые, нарушения обмена при отсутствии лечения могут привести к развитию мочекаменной болезни с последующим оперативным вмешательством и хронической почечной недостаточности. Самолечение не допустимо!
Все виды лекарственной терапии должен назначать и обязательно контролировать врач нефролог или уролог, так как:
- эти лекарства имеют серьезные побочные эффекты на другие органы и системы
- у части пациентов отмечается изначальная невосприимчивость или постепенно развивается устойчивость к препаратам
На первом этапе лечения составляется план лечения. Лечение любой дисметаболической нефропатии можно свести к четырем основным принципам:
- нормализация образа жизни
- правильный питьевой режим
- диета
- специфические методы терапии
Прием большого количества жидкости является универсальным способом лечения любой дисметаболической нефропатии, так как способствует уменьшению концентрации растворимых веществ в моче.
Одной из целей лечения является увеличение ночного объема мочеиспускания, что достигается приемом жидкости перед сном. Предпочтение следует отдавать простой или минеральной воде.
Диета позволяет в значительной степени снизить солевую нагрузку на почки.
Специфическая терапия должна быть направлена на предупреждение конкретного кристаллообразования, выведение солей, нормализацию обменных процессов.
На втором этапе терапии производится оценка эффективности диеты, проводятся контрольные УЗ-исследования и анализы.
Третий этап лечения осуществляется после достижения стойкой ремиссии. Он представляет собой схему постепенного снижения доз назначенных препаратов до поддерживающих или полной их отмены с сохранением диетических рекомендаций.
Даже после достижения долгожданной ремиссии пациенту рекомендуется быть внимательным к себе и регулярно наблюдаться у врача нефролога или уролога, так как высок риск рецидива заболеваний.
Практически всем пациентам необходимо принимать рекомендованные врачом средства противорецидивной терапии или придерживаться ранее разработанной диеты для предотвращения формирования или прогрессирования МКБ, воспаления почек.
Прогноз
Прогноз при дисметаболической нефропатии в целом благоприятен. В большинстве случаев при соответствующем режиме, диете и лекарственной терапии удается добиться стойкой нормализации соответствующих показателей в моче. В отсутствие лечения или при его неэффективности наиболее естественным исходом дисметаболической нефропатии является мочекаменная болезнь и воспаление почек.
Самым частым осложнением дисметаболической нефропатии является развитие инфекции мочевой системы, в первую очередь пиелонефрита.
Если вы обнаружили у себя какие-либо из перечисленных выше симптомов (нарушение мочеотделения, изменения свойств мочи, боли), необходимо в ближайшее время обратиться к врачу за помощью.
Помните, что очень важно начать лечение на ранних стадиях болезни, так как НМО в почках является преимущественно обратимым состоянием, а в случае отсутвтия лечения итогом является развитие мочекаменной болезни, пиелонефрита.
Рекомендации
Для профилактики развития заболевания, а так же рецидива, необходимо придерживаться правильного, сбалансированного и регулярного питания – избегать острой пищи, маринадов и пр. В период обострения пациентам рекомендуется щадящая диета, соответствующая требованиям биохимического вида нефропатии (оксалатная, уратная и пр.).
С целью профилактики рецидивов всем пациентам рекомендуется один раз в квартал консультация врача нефролога или уролога для необходимой коррекции медикаментозной терапии и пищевых рекомендаций.
Пациенты, длительно страдающие НМО в почках, относятся к группе повышенного риска по МКБ. Поэтому в период ремиссии им необходимо ежегодно проходить по назначению врача контрольные обследования (общий анализ мочи, биохимия мочи, УЗИ почек, мочеточников, мочевого пузыря) мочевыводящей системы.
Часто задаваемые вопросы
Излечимы ли НМО?
НМО часто обусловлено наследственными нарушениями обмена, что требует постоянного соблюдения как минимум диетических рекомендаций.
Из-за чего возникает заболевание?
НМО может быть связано с наследственной предрасположенностью, а также с заболеваниями внутренних органов (желудочно-кишечные проблемы, заболевания крови и пр.), применением определенных групп лекарственных препаратов (мочегонные средства, цитостатики и пр.).
Является ли заболевание противопоказанием к беременности?
Само НМО в почках требует наблюдения весь период беременности с соблюдением диетических рекомендаций.
При развитии МКБ, пиелонефрита и их осложнений в виде ХПН, возможность беременности и ее сохранения зависит от обострения процесса и стадии осложнений и решается в каждом конкретном случае.
Может ли заболевание почек проявляться снижением потенции?
Непосредственно НМО конечно не влияет на потенцию, но в случае развития осложнений МКБ, воспаления почек или развития ХПН снижение потенции может появиться как реакция на хроническое заболевание.
Увеличивается ли риск заболеть, если близкий родственник страдает данным заболеванием?
Да, существует группа первичных обменных нефропатий (НМО в почках), имеющая наследственную предрасположенность.
expert-clinica.ru
Дисметаболическая нефропатия у детей и взрослых: что это такое, лечение
Дисметаболическая нефропатия – заболевание почек, которое развивается в результате нарушения метаболизма. Особенность данной патологии заключается в том, что она не всегда связана с болезнями почек, чаще развивается на фоне других заболеваний.

Описание и классификация
Что такое дисметаболическая нефропатия? Этим вопросом задается каждый пациент, услышав подобный диагноз. Дисметаболическая нефропатия – это собирательное название, включающее множество метаболических нарушений, которые в конечном итоге приводят к серьезным нарушениям в работе почек.
Дисметаболическая нефропатия у детей чаще бывает наследственным заболеванием. Опасно, так как приводит к серьезным осложнениям за короткий промежуток времени. У взрослых нефропатия, связанная с нарушением обменных процессов в организме, возникает в результате негативного воздействия внутренних и внешних факторов.
В зависимости от содержания веществ в урине, нефропатия у ребенка и взрослого может быть:
- Оксалатной – характеризуется повышенной концентрацией оксалатов в моче, является наиболее часто диагностируемым видом.
- Уратной – при повышенном уровне мочевой кислоты.
- Фосфатной – в ходе клинических исследований обнаруживается рост фосфатов.
- Цистиновой – развивается в результате нарушения обмена метионина, что приводит к повышению цистина.
- Смешанная – в моче повышается одновременно уровень оксалатов, уратов, фосфатов и цистина.
Причины нарушения обмена веществ
Основной причиной нефропатии является нарушение обменных процессов в организме из-за врожденных и приобретенных патологий мочевыделительных органов. К нарушению метаболизма приводит уролитиаз, воспалительные процессы в мочеполовых органах, аномальное строение и расположение органов мочевыделительной системы, из-за которого происходит обратный заброс мочи и ее застой.
К нарушению обмена веществ приводят сбои в процессах синтеза, транспортировки и усвоения фосфатов, кальция, мочевой кислоты, щавелевой кислоты и цистина. Также дисметаболическая нефропатия у детей может быть результатом гормональных сбоев, нарушения работы эндокринной системы или заболеваний органов пищеварительного тракта.
Негативное воздействие на обмен веществ во взрослом и детском организме оказывает длительное лечение гормональными препаратами и некоторыми другими видами лекарств, радиационное и лучевое облучение, отравление токсическими соединениями.
Симптомы
Дисметаболические нефропатии, вне зависимости от вида, сопровождаются нарушением очистительной функции, уролитиазом и пиелонефритом. Для заболеваний почек свойственно расстройство мочеиспускания, которое сопровождается болями, резями и жжением в мочевыделительном канале, снижением объема мочи.

При дисфункции почек нарушается работа сердечно-сосудистой системы, что проявляется повышением/снижением артериального давления, тахикардией. Со стороны пищеварительного тракта отмечается ухудшение аппетита, метеоризм, запоры.
Из-за ухудшения отхождения мочи нарастает отечность, жажда. Пациент жалуется на регулярные головные боли и чрезмерную потливость. В результате нарушенного обмена у ребенка может развиться склонность к аллергии, избыточному весу. Обострение симптомов приходится на переходный возраст, что связано с гормональными изменениями в детском организме.
Оксалатная нефропатия
Оксалурия является наиболее распространенным видом нефропатий, развивающихся в результате нарушения обмена веществ. Делится на 2 подвида: оксалатно-калициевую нефропатию и оксалатурию. Первая развивается при нарушении процесса транспортировки и усвоения кальция, фосфора и щавелевой кислоты. Оксалатурия – вид нефропатии, который возникает при нарушении обмена щавелевой кислоты в организме. Данный вид нефропатии может развиться в любом возрасте, даже у новорожденных.
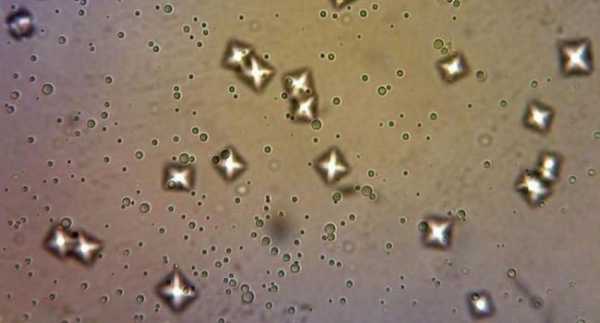
Причины и симптомы
Более чем в половине случаев оксалатная нефропатия является врожденной патологией и развивается при наследственном дефиците некоторых ферментов, что негативно сказывается на обмене веществ. Повышению количества оксалатов способствуют воспалительные патологии органов пищеварительного тракта, язвы, болезнь Крона.
Еще одной причиной является неправильное питание с повышенным содержанием щавелевой и аскорбиновой кислоты и недостаточным поступлением витамина В6. Также к повышению уровня щавелевой кислоты приводит недостаток жидкости в организме.
Заподозрить развитие заболевание крайне тяжело, так как оксалатурия редко оказывает отрицательное влияние на состояние здоровья. Обнаруживается случайно по результатам планового исследования мочи. При оксалатурии в урине повышается содержание оксалатов, уровень белка, лейкоцитов и эритроцитов. Также происходит рост плотности урины.
Диагностика и лечение
При подозрении на оксалатную нефропатию ребенку необходимо сдать суточную урину на определение концентрации солей. Важное место в постановке диагноза играет УЗИ органов мочевыделительной системы, которое помогает определить расположение, размеры и свойства оксалатов.

На основе полученных диагностических данных оксалатная дисметаболическая нефропатия у детей лечится с помощью изменения рациона и назначения лекарственных препаратов. Диета поможет снизить нагрузку на почки и сократить поступление щавелевой и аскорбиновой кислот в организм вместе с пищей. Под запрет попадают все мясные и рыбные продукты и блюда из них. Также следует исключить зелень, кислые ягоды и фрукты, свеклу, морковь и продукты, содержащие какао. В рацион необходимо включить сухофрукты, груши, яблоки, арбузы, дыни, картофель и капусту. Важно соблюдать питьевой режим, рекомендованный врачом, – вода способствует вымыванию лишних солей из организма.
В ходе лечения важно обеспечить достаточное поступление витаминов группы В, А, Е и магния, которые можно получать с пищей или препаратами.
Достаточное поступление витаминов группы В способствует улучшению обмена жиров и антиоксидантов. Витамин А нормализует процесс расщепления и усвоения белка и сахара. Витамин Е улучшает связь белка и сахаров в клетках. Для снижения концентрации оксалатов рекомендуется принимать окись магния.
Уратная нефропатия
Уратная нефропатия почек у детей менее распространена, чем оксалатная. Для данного вида заболевания характерно повышение концентрации мочевой кислоты. Последняя, оседая на стенках органов, приводит к закупорке и снижению их работоспособности, в результате развиваются воспалительные процессы.
Причины и симптомы
Заболевание может быть врожденным или приобретенным. В первом случае болезнь развивается на фоне генетической предрасположенности, встречается чаще у новорожденных. Во втором причинами развития патологии могут быть болезнь Рустицкого-Калера, гемолитическая анемия, воспаление почек, неправильное питание и длительный прием гормональных и мочегонных препаратов.

Уратная нефропатия у новорожденных на протяжении длительного времени протекает латентно. Первые симптомы возникают при значительном скоплении солей в детском организме. Ребенок становится капризным и плаксивым, появляется кожная сыпь и зуд, возможны приступы удушья. При переизбытке уратов в организме моча приобретает темно-красный цвет.
Диагностика и лечение
Чтобы поставить точный диагноз, необходимо сдать анализ крови на уровень мочевой кислоты и кислотность. После подтверждения нефропатии уратного происхождения врач рекомендует диету и лекарственные препараты.
Диета с полным отказом от продуктов, богатых пурином (телятина, свинина, субпродукты, продукты, содержащие какао, рыба жирных сортов, бобовые и орехи). Под ограничение попадают также сладости, хлебобулочные изделия, жареные и копченые блюда. Добавить в рацион необходимо молочные продукты, нежирные сорта мяса и рыбы (есть в утренние часы), крупы, фрукты и овощи.
Важно употреблять достаточно воды, которая способствует выведению солевых отложений. Из минеральных вод отдавать предпочтение слабощелочным. Рекомендуется пить мочегонные отвары и чаи, в состав которых входит укроп, листья брусники и смородины, спорыш, хвощ и другие.
Для лечения уратной дисметаболической нефропатии у детей назначается курс медикаментов, действие которых направлено на нормализацию содержания мочевой кислоты и улучшение мочеиспускания. С этой целью назначаются Милурит, Цилорик, Фитолизин, Уролесан и другие.
С помощью лекарственных препаратов и питания необходимо обеспечить достаточное поступление в детский организм витаминов групп В и С, которые способствуют улучшению метаболизма.
Фосфатная нефропатия
На это заболевание приходится около 3% случаев нефропатии. Характеризуется повышением концентрации фосфатов в урине, которое вызвано сбоями в процессе образования, транспортировки и усвоения фосфора и кальция.
Причины и симптомы
Фосфатная нефропатия развивается в результате неправильного питания с высокой долей растительных продуктов и рыбы. Нарушение фосфатно-кальциевого обмена приводит к развитию рахита. К скоплению большого количества фосфора и кальция в организме приводят инфекционные заболевания почек и хронические болезни органов пищеварения. Некоторые эндокринные расстройства, такие, как сахарный диабет, также являются причиной фосфатной нефропатии.
Определить заболевание сложно: больной описывает симптомы заболеваний, которые привели к нарушению фосфатно-кальциевого обмена. Моча больного становится мутной, с белым осадком. Уровень концентрации фосфатов определяется с помощью специального анализа — суточной экскреции фосфатов.
Лечение
Важное место в лечении занимает диета с ограниченным потребление продуктов, содержащих фосфор в большом количестве (сыры, печень, диетическое мясо, бобовые и какаосодержащие продукты). В рационе должны присутствовать белковые продукты (мясо, рыба), но не более 1 г белка на 1 кг веса в сутки. Не попадают под ограничение каши, кислые овощи, фрукты и ягоды. Исключить необходимо соленое, копченое, жареное и сладкое.

Важно обеспечить достаточное поступление витамина А и аскорбиновой кислоты с помощью продуктов питания и лекарственных препаратов. Из медикаментов используются Канефрон, Цистенал и Метионин.
Цистиновая нефропатия
Цистинурия развивается при нарушении процесса всасывания аминокислоты метионина и его чрезмерном скоплении в почках. Чаще является результатом наследственного заболевания – цистиноза. Также может быть следствием воспалительных процессов в почках. Цистин имеет свойство накапливаться и в других органах (печени, костном мозге, мышцах, крови и других). Клинические признаки схожи с уролитиазом и пиелонефритом.
Диагностика и лечение
Определить концентрацию цистина в моче можно с помощью биохимических лабораторных анализов урины и ультразвукового исследования органов мочевыделительной системы.
В ходе лечения необходимо исключить на рекомендуемый врачом срок продукты с высоким содержанием метионина: яйца, творог, рыбу и мясо. Позднее допускается постепенное введение мясных продуктов. Важно пить много чистой воды и щелочных минеральных вод, в том числе и в вечернее время, что поможет снизить концентрацию цистина в моче.
С этой же целью назначается и пенициллинамин, дозировка которого постепенно увеличивается, а вместе с ним вводятся и витамины В6, Е и А для улучшения состояния мембран. Для контроля выполнения рекомендаций и их эффективности необходимо регулярно делать тесты на содержание цистина в лейкоцитах и цианиднитропруссидный.
При присоединении инфекции назначается курс антибактериальной терапии. При развитии осложнений из-за критической концентрации цистина в почках врачи прибегают к операции по пересадке органа. Но в большинстве случаев скопление цистина отмечается и в трансплантируемом органе.
tvoyapochka.ru
