Этиология атопического дерматита у детей – Информационно-методическое письмо «Атопический дерматит»
Атопический дерматит | Дерматит
Одним из самых тяжелых и распространенных аллергических заболеваний, которые встречаются у 12% населения, является атопический дерматит. Несмотря на то, что медицина и фармакология сделали за последние десятилетия огромный шаг вперед, лечение этого заболевания у детей все еще имеет множество сложностей, преодолеть которые поможет совместная работа всех членов семьи с врачом.
Этиология атопического дерматита
Факторами, вызывающими атопический дерматит, могут быть различные вещества:
- эпидермальные;
- бытовые;
- пищевые;
- пыльцевые;
- грибковые и другие.
У детей различного возраста наблюдается тесная взаимосвязь заболевания с реакцией на пищевые продукты и патологиями системы пищеварения. У взрослых атопический дерматит также связан с заболеваниями пищеварительного тракта (язва, гастрит, дисбактериоз), хроническими болезнями ЛОР-органов, нарушениями психического состояния и глистными инвазиями.
Вероятность заболеть атопическим дерматитом напрямую связана с генетической предрасположенностью.
При этом наследуется не само заболевание, а совокупность генетических факторов, связанных с возможной аллергической реакцией. Симптомы проявятся только при совпадении нескольких внешних или внутренних условий. Факторы риска очень разнообразны, вот основные из них:
- раннее отлучение от груди и неправильный режим питания;
- инфекционные заболевания матери еще во время беременности;
- неблагоприятные социальные и экологические факторы;
- прием антибиотиков во время беременности или в младенческом возрасте у детей;
- нарушения функции пищеварения;
- хронические инфекционные заболевания и глистные инвазии;
- расстройство деятельности нервной системы.
Патогенез атопического дерматита
Механизм возникновения заболевания достаточно изучен. Его симптомы возникают как ответная реакция на попадание аллергена в организм человека, склонного к атопическому дерматиту, при этом резко повышается выработка антител IgE. Они скапливаются на тучных клетках, которые являются важной составляющей гуморального иммунитета благодаря их активной работе по выработке гистамина.
Действие гистамина направлено на расслабление стенок капилляров, что препятствует образованию застойных явлений и отеков.
В свою очередь, отек – это защитная реакция, которая затрудняет распространение чужеродных веществ и ограничивает воспаления. У людей, склонных к атопическому дерматиту, повторное попадание в организм аллергенных веществ вызывает активизацию большого числа IgE-антител, что приводит к гибели тучных клеток и повышению гистамина в крови, образованию покраснений и отеку тканей.
Классификация атопического дерматита
Классификация заболевания опирается на такие признаки, как возраст, распространенность болезни и ее тяжесть.
По распространенности процесса различают такие виды заболевания:
- диффузный;
- распространенный;
- ограниченно-локализованный.
В зависимости от возраста пациента заболевание разделяют на возрастные категории:
- младенческий;
- детский;
- подростковый.
По тяжести течения заболевание классифицируют так:
- легкое;
- среднее;
- тяжелое.
Атопический дерматит по МКБ 10
МКБ 10 (Международная классификация болезней) призвана систематизировать и упростить регистрацию, анализ, расшифровку, передачу и сравнение данных о заболеваниях или смертельных случаях, полученных в различных странах и в разное время. Каждому заболеванию присваивается трехзначный код.
Согласно МКБ 10, атопический дерматит классифицируют таким образом:
- Болезни кожи и подкожной клетчатки (L00-L99).
- Дерматит и экзема (L20-L30).
- Атопический дерматит (L20).
- Почесуха Бенье (L20.0).
- Неуточненный атопический дерматит (L20.9).
- Другие атопические дерматиты (L20.8): экзема (сгибательная, детская, эндогенная), нейродерматит (атопический, диффузный).
Психосоматика атопического дерматита
Контакт через кожу матери и новорожденного ребенка является определяющим фактором для формирования нормальной психики ребенка в будущем. Прикосновения дарят малышу ощущение защиты, покоя и близости с родным человеком, дают почувствовать себя отдельной от матери личностью. Новорожденные способны понимать отношение матери и ее настроения через прикосновения. Дисбаланс в этих тонких отношениях может послужить причиной психосоматических заболеваний таких как атопический дерматит.
В более взрослом возрасте обострения болезни могут происходить как результат внутреннего конфликта человека с самим собой, чувствительности к критике окружающих и подавления эмоций. Чтобы избавиться от дерматита, вызванного психологическими проблемами, больному необходимо пересмотреть отношение к самому себе или обратиться за помощью к психологу.
Атопический дерматит новорожденных
Это заболевание принято еще называть диатезом или младенческой экземой. Главной его причиной является генетическая предрасположенность, неправильный уход и кормление ребенка.
На ранней стадии появляется зуд, сухость кожи и ее покраснение. Барьерные функции покровов нарушаются, кожа обезвоживается и становиться грубой на ощупь, на ней могут образовываться волдыри. На пораженных болезнью участках может развиться вторичная инфекция. Чаще всего симптомы появляются на лице, под волосяным покровом, в области колен и локтей.
Заболевание требует своевременного лечения, иногда достаточно использования коррекции питания ребенка или ограничение рациона кормящей матери. Опасность атопического дерматита состоит в том, что он может быть предвестником серьезных аллергических реакций в будущем.
Терапия атопического дерматита
Хроническое течение заболевания предполагает длительный контроль за его течением. Терапия атопического дерматита должна иметь системный подход. Лечение состоит из таких этапов:
- правильный уход за кожей;
- противовоспалительная терапия по мере необходимости;
- ограничение контакта с аллергенами.
Для проведения результативного лечения дерматита у детей младшего возраста и новорожденных, важен постоянный контакт родителей с врачом. Это должен быть дерматолог, аллерголог и по необходимости гастроэнтеролог и невропатолог.
Наружное лечение подбирается в зависимости от площади и тяжести поражений с целью подавления воспалительных реакций на коже, уменьшения зуда, увлажнения кожи и профилактики развития вторичной инфекции.
Можно ли вылечить атопический дерматит?
На лечение атопического дерматита требуется много сил и времени. У детей заболевание проявляется обычно в первый год жизни и может пройти сам по себе до периода полового созревания.
От пациента требуется соблюдение жестких ограничений в питании, постоянного контроля за контактами с повседневными, обычными для здорового человека, вещами. Эти меры могут не принести результата, но нужно постараться снизить количество рецидивов заболевания до минимального количества. Если все принятые меры оказались неэффективными, то нужно провести тщательное обследование на предмет хронических патологий. Скрытой причиной атопического дерматита могут быть заболевания органов пищеварения, эндокринной или нервной системы.
На поиск причины болезни могут уйти месяцы или даже годы, но тем не менее важно не опустить руки и пробовать новые методы лечения, купировать обострения, ведь безвыходных ситуаций не бывает.
derma-wiki.ru
Атопический дерматит: этиология
Атопический дерматит является распространенным заболеванием, на долю которого приходится половина случаев в общей структуре аллергической патологии с тенденцией к дальнейшему увеличению. Понять суть болезни можно лишь при рассмотрении причин и механизмов, участвующих в ее развитии. Поэтому при атопическом дерматите этиология и патогенез заслуживают пристального внимания.
Предрасполагающие факторы
Причины и условия, способствующие развитию болезни, рассматриваются в рамках раздела медицины, известного как этиология. Атопический дерматит возникает на фоне повышенной чувствительности организма к различным аллергенам, окружающим человека в повседневной жизни. Ими становятся следующие:
- Пищевые (яйца, морепродукты, орехи, цитрусовые, клубника).
- Растительные (пыльца, пух).
- Животные (шерсть, перья, клещи, укусы насекомых).
- Бытовые (пыль).
- Химические (моющие средства, синтетические ткани).
- Лекарственные (практически любые медикаменты).
Это вещества, которые становятся сенсибилизаторами и запускают развитие в организме патологических процессов. Все это происходит на фоне предрасположенности к такому типу реакций, которая формируется на генетическом уровне. При семейном анамнезе заболевания у обоих родителей риск дерматита у ребенка находится на уровне 60–80%, если же кожное поражение было у одного из них, то вероятность наследственно обусловленного заболевания снижается до 40%. Однако и без явных семейных случаев
Кроме того, в развитии атопического дерматита отмечается роль и других этиологических факторов эндогенной природы:
- Гельминтозов.
- Гормональных и обменных сбоев.
- Нейроэндокринной патологии.
- Расстройств пищеварения.
- Интоксикаций.
- Стрессовых состояний.
Заболевание возникает чаще всего уже в раннем детском возрасте, в условиях экссудативно-катарального диатеза, нарушений питания, экзематозных процессов. Они, наряду с генетической предрасположенностью, формируют предпосылки для атопического дерматита. Поэтому такие состояния нуждаются в своевременном выявлении у ребенка и полноценной коррекции, что позволит снизить риск развития болезни.
Выявление причин и факторов, способствующих развитию аллергического дерматоза – это основной аспект в его устранении. А значит, вопросам этиологии атопического дерматита следует уделять должное внимание.
Механизмы развития
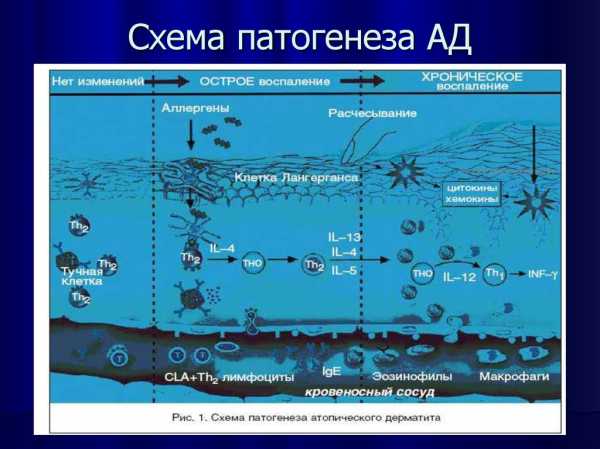
Патогенезом называют раздел медицинской науки, изучающий механизмы, по которым идет развитие болезни. Основополагающее значение при атопическом дерматите имеют иммунопатологические процессы. Аллерген провоцирует в организме выработку антител (иммуноглобулинов класса E), которые расположены на клетках Лангерганса в коже. Последних у пациентов с рассматриваемым дерматозом значительно больше, чем обычно.
Клетки Лангерганса представляют собой тканевые макрофаги, которые после поглощения и расщепления антигена презентируют его лимфоцитарному звену. Далее происходит активация T-хелперов, которые вырабатывают цитокины (особенно ИЛ-4). Следующим этапом иммунного механизма идет сенсибилизация B-лимфоцитов, преобразующихся в плазматические клетки. Именно они и синтезируют специфические иммуноглобулины (антитела к аллергену), которые откладываются на клеточной мембране. При повторном контакте с аллергеном происходит дегрануляция тучных клеток и выделение из них биологических веществ (гистамин, простагландины, лейкотриены, кинины), инициирующих повышение сосудистой проницаемости и воспалительные реакции. В эту фазу наблюдаются покраснение кожи, отечность и зуд.
Выделение факторов хемотаксиса и интерлейкинов (ИЛ-5, 6, 8) стимулирует проникновение в патологический очаг макрофагов, нейтрофилов и эозинофилов (включая длительно живущие виды). Это становится определяющим фактором в хронизации дерматоза. А в ответ на длительный воспалительный процесс в организме уже вырабатываются иммуноглобулины G.
Патогенез атопического дерматита также характеризуется снижением супрессорной и киллерной активности иммунной системы. Резкое повышение уровней Ig E и Ig G, наряду со снижением уровня антител класса M и A, приводит к развитию кожных инфекций, нередко принимающих тяжелое течение.
В процессе исследований механизмов развития атопического дерматита было выявлено снижение экспрессии DR-антигенов на поверхности моноцитов и B-лимфоцитов, в то время, как T-лимфоциты, наоборот, имеют более плотное расположение подобных молекул. Также определена ассоциация заболевания с определенными антигенами главного комплекса гистосовместимости (A1, A9, A24, B12, B13, D24), по которым можно предполагать о высоком риске развития дерматита у пациента.
Немаловажное значение в появлении патологии отводится эндогенной интоксикации, возникающей из-за ферментопатии пищеварительного тракта. Это ведет к нейроэндокринным нарушениям, дисбалансу в калликреин-кининовой системе и обмене катехоламинов, синтезе защитных антител.
На фоне аллергического воспаления в коже происходит повреждение эпидермиса и водно-жирового слоя. Через кожу увеличивается потеря жидкости, из-за чего она становится пересушенной, усиливаются процессы ороговения (гиперкератоз), появляются шелушение и зуд. А из-за снижения барьерных функций повышается риск вторичного инфицирования.
Изучение патогенеза аллергического дерматоза дает массу важных сведений о развитии и течении болезни, необходимых для понимания сути проблемы.
Этиопатогенез атопического дерматита включает информацию о причинах, факторах возникновения и механизмах, по которым развивается патология. Именно эти аспекты играют определяющую роль в формировании терапевтической стратегии, ведь для избавления от болезни нужно устранить контакт с аллергеном и разорвать иммунопатологические процессы.
moyakoja.ru
Атопический дерматит: вопросы этиологии, патогенеза, методы диагностики, профилактики и лечения | Бутов Ю.С., Подолич О.А.
Общие сведения
Атопический дерматит (АД) – распространенный, упорно протекающий дерматоз, занимающий в структуре аллергических заболеваний 50–60%, причем эта цифра неуклонно растет (Балаболкин И.И., Гребенюк В.Н., Williams H.C. et al. 1994) Впервые термин «атопический дерматит» предложил Sulzbeger в 1923 г. для кожных поражений, сопровождающихся повышенной чувствительностью к различным аллергенам, проявляясь нестабильностью клеточных мембран сосудов кожи, сочетанием с другими атопическими заболеваниями (бронхиальная астма, сенная лихорадка, ринит и др.).
Атопический дерматит (АД) – распространенный, упорно протекающий дерматоз, занимающий в структуре аллергических заболеваний 50–60%, причем эта цифра неуклонно растет (Балаболкин И.И., Гребенюк В.Н., Williams H.C. et al. 1994) Впервые термин «атопический дерматит» предложил Sulzbeger в 1923 г. для кожных поражений, сопровождающихся повышенной чувствительностью к различным аллергенам, проявляясь нестабильностью клеточных мембран сосудов кожи, сочетанием с другими атопическими заболеваниями (бронхиальная астма, сенная лихорадка, ринит и др.).В настоящее время АД рассматривается как самостоятельная нозологическая форма, явно отличающаяся от контактного аллергического дерматита, микробной и себорейной экзем, ограниченного нейродермита. Возникает АД чаще всего в раннем детском возрасте на фоне экссудативного диатеза, экзематозного процесса, нередко с отягощенной наследственностью в связи с нерациональным питанием, интоксикациями, обменными нарушениями, расстройствами нервной и эндокринной систем (гипофункция коры надпочечников, половых желез, гиперфункция щитовидной железы), но может сформироваться и в зрелом возрасте.
Ведущими признаками атопии являются сильный зуд хроническое рецидивирующее течение, белый дермографизм, повышенное содержание в сыворотке крови IgE, снижение IgM и IgA, резкое увеличение IgG, косвенно указывающих на гиперреактивность замедленного типа (Самсонов В.А. 1985, Суворова К.Н. 1998, Sanford A.J. 1995). Воздействие неблагоприятных, экзогенных (физических, химических, биологических) и эндогенных (генетической предрасположенности, иммунных нарушений) факторов, отягощают клиническую картину болезни. Тем не менее, этиология остается не выясненной, патогенез полностью не исследован, четкая классификация не разработана.
Патогенез
Определенное значение в развитии АД играют психосоматические расстройства. Сильный зуд, раздражительность, тревожный поверхностный сон, неадекватность реакций, белый дермографизм – классические проявления психосоматической патологии. При оценке психосоматического статуса у пациентов выявлялась высокая степень тревожности, развитие реактивных депрессий, астеновегетативный синдром. (Ревякина В.А., Иванов О.Л., Белоусова Т.А. 2000).
Было показано, что основным субстратом в психонейроиммунном взаимодействии являются нейропептиды, (субстанция P, кальцитонин–геноподобный пептид), обеспечивающие взаимосвязь между нервными волокнами, тучными клетками и сосудами. Под действием «аксон–рефлекса», развивается вазодилатация, проявляющаяся эритемой. Субстанция P обеспечивает высвобождение гистамина из тучных клеток кожи и оказывает прямое воздействие на сосуды, увеличивая их проницаемость, чем можно объяснить слабую эффективность, в ряде случаев, антигистаминных препаратов. Таким образом просматривается прямая взаимосвязь между центральными и вегетативными отделами нервной системы. Улучшение в психоэмоциональном статусе под влиянием терапии, коррелировалось с положительной динамикой кожного процесса. (Иванов О.Л., Белоусова Т.А. 2000).
Наследственная предрасположенность в патогенезе атопического дерматита подтверждается высокой частотой встречаемости ассоциации антигенов HLA: A3, A9, B7,8, B12, B40. Клинические данные также указывают на роль наследственности в закреплении патологических признаков от родителей детям. Так, от отца – аллергика признаки атопии у ребенка развиваются в 40 – 50% случаев, от матери – в 60 – 70%. Если оба родителя являются носителями атопии, то частота развития заболевания у ребенка достигает 80%. (Мазитов Л.П. 2001).
Исследованиями Тороповой Н.П. показана возможность транспланцентарной передачи готовых антител от матери к плоду и его гиперсенсибилизация, этим, по видимому объясняется развитие аллергических реакций на молоко матери в первые месяцы жизни. Таким матерям рекомендуется соблюдение строгой диеты, с ограничением употребления азотистых экстрактивных веществ, хлоридов, белков.
У определенного числа детей формируется латентная сенсибилизация, которая реализуется в виде аллергических реакций в возрасте 19–20 лет. Наследуется не болезнь, а совокупность генетических факторов способствующих к формированию в организме аллергического фактора (Феденко Е.С. 2001).
В формировании АД большое значение имеет функциональное состояние желудочно–кишечного тракта. Выявлена дисфункция гастринового звена регуляции, состоящая в несовершенстве пристеночного пищеварения, недостаточной активности ферментов в обработке химуса, накоплению в просвете тонкой кишки огромного количества белковых аллергенных комплексов, свободному их всасыванию и созданию предпосылок для сенсебилизазии и агрессивного течения кожного процесса. (Торопова Н.П., Синявская О.А. 1993).
Риск развития пищевой аллергии возрастает в связи с несоблюдением питания беременной женщины, детей первых месяцев жизни, находящихся на искусственном вскармливании, а также использованием пищевых добавок, содержащих ксенобиотики. Так, у детей первого года жизни частой причиной развития АД являются куриные яйца, белки коровьего молока, злаков. Усугубляется течение АД развитием дисбактериоза, в связи с бесконтрольным, нередко, приемом антибиотиков, кортикостероидов, наличием очагов хронической инфекции, аллергических заболеваний (астма, ринит), дисметаболических нефропатий, гельминтозов. Продукты жизнедеятельности последних активизируют иммунокомпетентные клетки, осуществяющие синтез IgE, иммунных комплексов.
В развитии обострения АД, немаловажное значение играют ингаляционные аллергены. Показана возможность образования сложных ассоциаций с бактериальными, грибковыми, вирусными и медикаментозными аллергенами, обусловливющая формирование поливалентной сенсибилизации (Максимова А.Е. 1997).
По данным Феденко Е.С. (2001) причинно–значимым аллергеном в развитии обострения АД являются нестероидные противовоспалительные препараты, сульфаниламиды, витамины группы В . Мы также наблюдали развитие аллергических реакций типа токсикодермии, крапивницы, на витамины группы В, у больных диффузным нейродермитом, истинной экземой (Желтаков М.М., Скрипкин Ю.К., Сомов Б.А., Бутов Ю.С. 1969).
Значительное внимание, в последнее время, уделяется полигенному типу наследования, характерными чертами которого являются иммунные нарушения на уровне дифференцировки субпопуляции Т–лимфоцитов. Установлено, что нулевые Т–хелперы (Тh0) под воздействием антигенов дифференцируются в Т–хелперы первого (Th1), либо Т–хелперы второго типов (Th2), отличающихся друг от друга секрецией цитокинов, ПГЕ. Первый тип контролирует апоптоз мутированых клеток, через a–TNF, а g–IFN тормозит развитие вирусов. Второй тип, обеспечивает защиту от бактериальных аллегенов, активирует антителогенез, за счет IL–4, IL–5 и IL–13.
При АД дифференцировка лимфоцитов идет через Th2, активируя b–клетки и синтез аллергических IgE–антител. Процесс сенсибилизации происходит при участии тучных клеток с выбросом гистамина, серотонина, кининов и др. биологически активных веществ, что соответствует ранней фазе гиперергической реакции. Затем следует IgE–зависимая поздняя фаза, характеризующаяся инфильтрацией Т–лимфоцитами кожи, определяя хронизацию аллергического процесса.
Показано, что развитие воспалительного процесса у больных АД осуществляется в присутствии дендритических клеток, клеток Лангерганса при постоянно высоком уровне эозинофилов, IgE, цитокинов и медиаторов. Способность эозинофилов к долгожительству и продукции в ткани нейротоксинов и ферментов обеспечивают хронизацию процесса сопровождающегося сильным зудом, повреждением кератиноцитов и еще большим высвобождением цитокинов и медиаторов воспаления, создавая условия для «порочного круга».
Таким образом, проведенный анализ показывает, что в развитии АД принимает участие экзогенные (физические, химические и биологические) и эндогенные (роль нервной системы, ЖКТ, генетической предрасположенности и иммунных нарушений) факторы.
Клинические аспекты АД
Типичная клиническая картина АД характеризуется: зудом кожных покровов, стойкой гиперемией или переходящей эритемой, папуловезикулезными высыпаниями, экссудацией, сухостью кожи, шелушением, экскориацией, лихенификацией, носящими распространенный или ограниченный характер. Заболевание начинается обычно в первые месяцы жизни, принимая затем рицидивирующее течение с возможностью полной или неполной ремиссии различной частоты и длительности.
Атопические реакции в детском возрасте возникают:
Возможные клинические формы проявления:
– эритематозно–сквамозная;
– везикуло–крустозная;
– эритематозно–сквамозная со слабой или умеренной лихенификацией в локтевых и подколенных сгибах;
– лихеноидная с большим количеством лихеноидных папул;
– пруригоподобная (Суворова К.Н. 1998).
На основании проведенных исследований у детей с АД, Короткий Н.Г. выделил ряд клинико–патогенетических вариантов развития и течения заболевания:
1. Истинный, аллергический вариант АД с преобладанием специфического IgE–опосредованного иммунного механизма
2. Смешанный вариант АД, где выражены и специфические и неспецифические механизмы.
3. Псевдоаллергический вариант с преобладанием неспецифических механизмов.
При истинном, аллергическом и смешанном варианте АД тяжесть течения процесса зависит не только от поражения кожи, которая может быть не всегда значительная, но и от других органных проявлений атопии, в частности, бронхиальной астмы и патологии ЖКТ. При псевдоаллергическом варианте АД ведущее место в развитии патологического процесса отводится нейровегетативным и микроциркуляторным расстройством.
Диетотерапия
В связи с выраженной дисфункцией, со стороны ЖКТ, своевременно и адекватно назначенная диетотерапия, в большинстве случаев, способствует ремиссии заболевания или даже полному выздоровлению. Элиминационная диета строится на основе достоверно доказанной сенсибилизирующей роли тех или иных продуктов в развитии обострений АД и их исключения.
Из пищевого рациона больных, страдающих АД исключают продукты, содержащие пищевые добавки (красители, консерванты, эмульгаторы), а также – крепкие, мясные бульоны, жареные блюда, пряности, острые, соленые, копченые, консервированные продукты, печень, рыбу, икру, яйца, сыры, кофе, мед , шоколад и цитрусовые фрукты.
В рацион следует включать кисломолочные продукты, каши (овсяные, гречневые, перловые крупы), отварные овощи и мясо. Разработанные диеты, должны быть оптимальны по содержанию белков и витаминов и составляются при тесном сотрудничестве аллерголога и диетолога.
Медикаментозная терапия
При выборе медикаментозного средства системного действия учитывается возраст больного, период болезни, наличие сопутствующих заболеваний.
В лечении АД, для уменьшения невротических реакций назначают седативные и психотропные препараты. Из препаратов растительного происхождения предпочтительно применять настойку пиона, пустырника и корня валерианы, ново–пассит. В терапии используют также антидепрессанты. Амитриптилин назначают внутрь 0,025–0,05 г; ниаламид внутрь 0,025–0,01 г. Из транквилизаторов используют диазепам 0,005–0,015 г в сутки, лоразепам 0,001–0,0025 г в сутки.
Показание к назначению антигистаминных препаратов обосновано важнейшей ролью гистамина в механизме кожного зуда и развития воспаления при АД. В связи с наличием седативного эффекта антигистаминные препараты 1–го поколения не целесообразно назначать детям школьного возраста. При планируемом длительном применении здесь рациональнее выбрать какой–либо антигистаминный препарат 2–го поколения (лоратадин, терфенадин, цетиризин, эбастин). Эбастин (Кестин) не вызывает выраженного антихолинергического и седативного эффектов, назначается в суточной дозе 10 мг, а при выраженной симптоматике возможно повышение дозы до 20 мг. Цетиризин назначается в таблетках по 0,01 г в течении 7 дней, из расчета – 0,25 мг/кг 1–2 раза в сутки. Препараты 2–го поколения в настоящее время не применяются у детей до 2–х лет.
Диазолин, хлоропирамин, клемастин предпочтительнее применять в период выраженного кожного зуда, в течение 7–15 дней, если необходим не только противозудный, но и седативный эффект. Ципрогептадин обладает антисеротониновой активностью, что расширяет область его применения. Клемастин от 6 до 12 лет по 0,5 – 1,0 мг, старше 12 лет по 1 мг 2 раза в сутки. Хлоропирамин назначают детям до 1 года по 6,25 мг (1/4 таб.), от 1 до 6 лет по 8,3 мг. (1/3 таб.), от 6 до 14 лет по 12,5 мг. 2–3 раза в сутки. В терапии нередко приходится комбинировать применение препаратов 1–го и 2–го поколений.
Мембраностабилизирующие средства. Из этой группы в терапии АД используют кетотифен и кромогликат натрия. Они стабилизируют мембраны тучных клеток, обладают антагонизмом по отношению к Н1–гистаминовым рецепторам, тормозят развитие аллергического процесса и могут выступать в качестве блокатора кальциевых каналов. Терапевтический эффект появляется через 2–4 недели. Кромогликат натрия дополнительно воздействует на слизистую оболочку ЖКТ, предупреждая развитие аллергических реакций на этом уровне. Препарат назначают в острый и подострый период АД в комбинации с антигистаминными средствами. Детям от 1 года до 3 лет в дозе 100 мг (1 капсула) 3–4 раза в сутки; от 4 до 6 лет – по 100 мг 4 раза в сутки; от 7 до 14 лет – по 200 мг 4 раза в сутки. Продолжительность курса терапии составляет в среднем, от 1,5 до 6 месяцев.
Целесообразно назначение препаратов улучшающих пищеварение, для коррекции расщепления аллергенных субстанций пищи (Фестал, Мезим–форте, Хилак–форте).
Показана эффективность ферментных препаратов, учитывая нарушения ферментных систем органов ЖКТ у больных. (Короткий Н.Г. 2000). Дисбактериоз является показанием для полноправного использования пробиотиков, нормализующих микробный пейзаж кишечника.
Повышению эффективности лечения, способствует назначение витаминных препаратов. Из витаминов группы В отдается предпочтение кальцию пантотенату (В15), его назначают по 0,05–0,1 г 2 раза в день в течении месяца, и пиридоксаль фосфату (В6), который принимают по 0,1–0,2 г в день. Целесообразно назначение b–каротина, он повышает устойчивость мембран лизосом и митохондрий к действию метаболических токсинов, стимулирует иммунную систему и регулирует перикисное окисление липидов.
Иммунномодулирующая терапия проводится в тех случаях, когда АД протекает в сочетании с клиническими признаками иммуннологической недостаточности и наличием дефектов в иммунограмме. В виде снижения В–клеточного звена, фагоцитирующих клеток, увеличения IgE, дисбаланса Th1–Th2 клеток. К клиническим признакам следует отнести: наличие очагов пиогенной инфекции; частые обострения кожного процесса; частые ОРВИ с субфебрилитетом и лимфоаденопатией; отсутствие клинического эффекта от проведения адекватной стандартной терапии АД.
Применение системных антибиотиков целесообразно при субфебрильной температуре и лимфодените. С предварительным определением чувствительности микрофлоры к антибиотикам. При эмпирической терапии предпочтение отдается использованию макролидов, цефалоспоринов 2–3–го поколений.
Системные глюкокортикостероиды (ГКС) чаще всего назначают в особо тяжелых, упорных случаях течения АД, применяются в условиях стационара и короткими курсами под прикрытием антацидных препаратов (Алмагель) и препаратов кальция (кальций глюконат, кальция глицерофосфат). Используют преднизолон, дексаметазон 20–25 мг в сутки, взрослым назначают инъекции бетаметазона. Механизм противовоспалительной активности ГКС состоит в блокировании активности фосфолипазы А, угнетении синтеза лейкотриенов и простагландинов, снижении активности гиалуронидазы и лизосомальных ферментов, активизации синтеза гистаминазы (Гребенюк В.Н., Балаболкин И.И. 1998).
Наружная терапия является неотъемлемой частью комплексного лечения АД, занимая в ней ведущее место. С помощью местного лечения достигается ряд эффектов: подавление признаков воспаления кожи; устранение сухости; восстановление поврежденного эпителия; улучшение барьерных функций кожи.
Выбор препарата определяется стадией болезни, фазой воспаления и степенью выраженности кожных проявлений. Для того чтобы добиться успеха необходимо соблюдать определенную последовательность в назначении местного лечения. При острых мокнущих процессах используются примочки, дерматологические пасты. По мере стихания воспаления назначают нефторированные кортикостероиды в виде крема или мази. Мази оказывают более выраженное противовоспалительное действие и назначаются для лечении подострых и хронических кожных поражений. Кремы являются формой выбора для острых процессов.
В случаях присоединения пиодермии, назначают эритромициновую, линкомициновую, геоксизоновую мази, анилиновые красители. Среди других противовоспалительных препаратов, издавна используемых в терапии АД, следует указать средства содержащие деготь, нафталан, серу.
Коррекция сопутствующих заболеваний включает обследование, выявление и санацию очагов хронической инфекции, паразитарных инвазий, дисбактериоза, восстановление корковой нейродинамики и вегетативных нарушений.
Прогноз течения АД и качество жизни больного и его семьи во многом зависят от полученных им достоверных знаний о причинах развития высыпаний на коже, зуда, от тщательного выполнения всех рекомендаций врача и профилактики.
Основные направления профилактики – это соблюдение режима питания, особенно беременным и кормящим матерям, грудное вскармливание детей. Особое внимание следует обратить на ограничение воздействия ингаляционных аллергенов, уменьшение контакта с химическими средствами в быту, предупреждение простудных и инфекционных заболеваний и обусловленное назначение антибиотиков
Литература:
1. Балаболкин И.И., Гребенюк В.Н., Williams H.C. etal.
2. Воронцов И.М. Атопический дерматит у детей. М.–с.263.
3. Гребенюк В.Н. Балаболкин И.И. Прогресс наружной кортикостероидной терапии АД//Педиатрия –1998г. №5 с.88–91.
4. Желтаков М.М. Скрипкин Ю.К. Сомов Б.А. Бутов Ю.С. Аллергические реакции, вызванные витаминами группы В. ВДВ 1969,№1,с.62–65
5. Короткий Н.Г. Патогенетическая роль нарушений гормональной регуляции полостного пищеварения и всасывания при АД и коррекция энзимными препаратами. Российский журнал кожных и венерических болезней. 2000 – №1 – С. 12–17.
6. Яздовский В.В. HLA и аллергические заболевания. Пульмонология 1994, 4, 6–9.
7. Максимова А.Е. Особености микрофлоры кожи у больных АД. Автор. дисс. к.м.н.1997.
8. Мазитов Л.П. Современные аспекты патогенеза и лечение аллергодерматозов у детей. Российский медицинский журнал 2001г. т.9. №11 с. 457–459.
9. Наумов Ю.Н., Котенков В.И., Алексеев Л.П. Структура генов и антигенов HLA человека 1–2 классов./ Иммунология 1994,2,4–8.
10. Ревякина В.А. Роль этиологически значимых аллергенов в развитии АД у детей //Аллергология–1998 №4 с.13–14.
12. Самсонов В.А. Нейродермит и бактериальная аллергия .Автореф. д.м.н. М. 1984.
13. Скрипкин Ю.К. Сомов Б.А. Бутов Ю.С. Аллергические дерматозы. М.1975. 234 с.
14. Смирнова Г.И. Аллергодерматозы у детей//М.БУК, лтд. 1998, с.299.
15. Суворова К.Н. Атопический дерматит: иммунопатогенез и стратегия иммунотерапии. Русский мед. журнал. 1998,т.6, 368–367.
16. Торопова Н.П. Синявская О.А. Экзема и нейродермит у детей .Екатеренбург.1993,147 с.
17. Феденко Е.С. – Атопический дерматит: Обоснованием поэтапного подхода к терапии. Consilium medicum 2001г. т.3 №4 с.176–183.
18. Хаитов Р.М., Лусс Л.В., Арипова Т.У. Распространенность симптомов БА, АР и АД у детей. /Аллергия, астма и клиническая иммунология. – 1998. – №9. – С. 58–69.
19. Leung D.Y.M. Role of IgE in atopic dermatitis//Curr. Opinion Immunol–1993–Vol.5–P.956.
20. Sanford A.J. «Genetic map of cromosome llg, including the atopy locus. Eur Hum Genet 1995, №3 с.188.
21. Casale T.B., Bowman S. Induction of human cutaneous mast cell degranulation by opiates peptides//Immunol–1984–Vol.73.
www.rmj.ru
Атопический дерматит у детей
Этиология.
Ведущее значение в развитии болезни имеет пищевая аллергия. У детей первого года жизни причинно-значимой чаще всего является сенсибилизация к белкам коровьего молока и злаковых. В дальнейшем возрастает значение сенсибилизации к облигатным пищевым аллергенам (яйца, рыба, шоколад, орехи и др.), овощам и фруктам. С возрастом спектр причинно-значимых аллергенов расширяется и, наряду с пищевой, выявляется аллергия к домашней пыли, клещам рода Dermatophagoides и плесневым грибам. Также возможно развитие обострений атопического дерматита при контакте с лекарственными и грибковыми, а также клещевыми и пыльцевыми аллергенами [2,14,17,18,19,23].
Патогенез. Формирование аллергически измененной реактивности является ведущим звеном в патогенезе атопического дерматита у детей. Ее развитию способствуют внутриутробная сенсибилизация плода пищевыми антигенами и медикаментозными препаратами, назначаемыми матери во время беременности по поводу осложнений, присоединения острых и обострения хронических болезней, перенесенная натенатальная и интранатальная гипоксия плода, профессиональные вредности. На первом году жизни ребенка фактором риска возникновения атопического дерматита является искусственное вскармливание молочными смесями. Не исключается возможность развития сенсибилизации к белковым антигенам коровьего молока и яиц, поступающих в организм ребенка с молоком матери. Патогенетическую основу атопического дерматита составляют IgE-опосредуемые реакции. Возможно участие иммунокомплексных и клеточно-опосредованных реакций в его развитии [1,10,15]. Также существенное значение придается наследственному предрасположению к аллергическим реакциям и заболеваниям.
Вне зависимости от пусковых факторов, при сформировавшейся клинической картине у больных отмечается 2 принципиальных дефекта:
доминирование холинергических процессов с угнетением адренергических и преобладанием цГМФ над цАМФ в клетке (возможно, в результате b-адренергической блокады – низкой активности аденилатциклазы или высокой активности фосфодиэстеразы), что предрасполагает к освобождению гистамина из тучных клеток, усилению проницаемости сосудов и др.
дефицит зрелых Т-клеток (CD3) и Т-супрессоров (CD8) с повышением соотношения CD4/CD8 (хелперы/супрессоры), вероятно, и обуславливающий высокий уровень IgE. У части больных отмечается сниженный ответ лимфоцитов и гранулоцитов на адренергические стимулы, что также подтверждает дисфункцию Т-системы иммунитета [20,21].
Клиническая картина. Характер клинических проявлений атопического дерматита у детей определяется возрастом больного. Заболевание развивается тем раньше, чем выше уровень общего IgE в пуповинной крови ребенка и чем выраженнее отягощение его наследственности аллергическими реакциями и заболеваниями.
У детей выделяют 3 формы атопического дерматита: экссудативную, пролиферативную и смешанную [6,14,17,18,19,21].
Экссудативная форма характеризуется развитием аллергического воспаления кожи, протекающего по типу истинной экземы. Возникновение атопического дерматита с выраженным экссудативным компонентом чаще всего происходит первые два года жизни. Начальные признаки болезни обычно возникают в первые месяцы жизни в виде покраснения кожи щек и лба. Последующее вскрытие пузырьков вызывает мокнутие кожи и образование корочек. Воспалительный процесс может распространяться на кожу головы, туловища, конечностей и сопровождаться увеличением периферических лимфатических узлов [6, 17,18,20,21].
Пролиферативная форма проявляется обычно картиной нейродермита, развивающегося чаще у детей старше 2 лет, но у некоторых больных первые его признаки возникают уже к концу первого года жизни. У ряда детей этому клиническому варианту атопического дерматита предшествует истинная экзема. Клинически нейродермит характеризуется гиперемией, инфильтрацией, лихенизацией и зудом кожи вокруг рта, в области шеи, локтевых и коленных сгибов, запястий, бедренно-ягодичных складок. Воспалительный процесс может распространяться и на другие участки туловища и конечностей. В период ремиссии атопического дерматита происходит восстановление нормальной структуры кожи. Заболевание имеет рецидивирующее течение [1,2,10,16, 17,18,19,21,23].
Лечение.Осуществляется элиминация причинно-значимых аллергенов из окружающей больного домашней среды [6,14,18,19,21]. Проводят коррекцию питания с исключением пищевых продуктов, служивших причиной обострения воспалительного процесса кожи. Элиминационные диеты назначают на срок до 9-12 месяцев. При аллергии к коровьему молоку у детей первого года жизни его заменяют соевым молоком. При отсутствии соевых смесей в случаях небольшой и умеренно выраженной сенсибилизации к белкам коровьего молока могут быть использованы кисломолочные смеси, сухое, пастеризованное молоко, молоко других видов животных [18,19]. При непереносимости белков коровьего молока целесообразно исключить или резко ограничить употребление говядины. Ее можно заменить мясом других животных, птиц, кониной. При непереносимости белков злаковых исключают продукты, содержащие глютен и глиадин (манная каша, хлеб, печенье и др.). Режим гипоаллергенной диеты предусматривает исключение облигатных пищевых аллергенов, острых и экстрактивных веществ. Диету корригируют с учетом сопутствующей патологии ЖКТ.
При выявлении гастроинтестинальной аллергии осуществляют превентивную терапию в течение 2-3 месяцев – назначают налкром или интал внутрь [6,14,21].
Проводится лечение антигистаминными препаратами (димедрол, пипольфен, супрастин, тавегил, диазолин, бикарфен, фенкарол) или препаратами комбинированного антигистаминного и антисеротонинового действия (перитол), которые назначают внутрь. При этом нужно проводить смену препарата каждые 5 дней. При распространенных формах атопического дерматита с мучительным зудом показано парентеральное (утром и вечером) введение препаратов антигистаминного действия, а также прием внутрь антигистаминных препаратов в дневное время (2 приема). Эффективны при атопическом дерматите антигистаминные препараты второго поколения (терфен, астемизол, тинсет), оказывающие маловыраженное седативное действие. Удобен препарат лоратадин (кларитин), принимаемый 1 раз в день. Уменьшить зуд можно назначением беллатаминала или седативных средств (радедорм, триоксазин) на ночь [6,18,19,21].
С противорецидивной целью уже в остром периоде болезни назначают кетотифен (задитен) в дозе 0,025 мг/кг 2 раза в день в течение 3-6 месяцев и более.
Важное место в лечении занимают витаминные препараты. Их следует назначать в период стихания острых кожных проявлений, в начале ремиссии, но при отсутствии аллергических реакций на сами эти препараты. Целесообразно применение пантотената кальция (витамин В5), который обладает гипосенсибилизирующим действием; пиридоксина или его активной формы – пиридоксальфосфата (витамин В6) поскольку при аллергодерматозах синтез В6 часто понижен. Показаны также рибофлавин (витамин В2), пангамат кальция (витамин В15), витамин А (ацетат или более активная форма – пальмитат). Витамин Е оказывает положительный мембрано-стабилизирующий эффект [18,19,21].
В связи с упоминавшимися выше нарушениями кишечного всасывания и пищеварения часто необходимо назначение пищеварительных ферментов (панкреатин, фестал, панзинорм, абомин) [14,18,19,21].
Рекомендуется лечение эубиотиками (бифидумбактерин, лактобактерин, бификол, колибактерин) при наличии признаков дисбактериоза кишечника [18,19].
Местно применяются для ликвидации мокнутия примочки свинцовой воды, анилиновые красители, 0,25% раствор нитрата серебра, 1-2% раствор танина и другие средства. После снятия острых явлений используют индифферентные мази, содержащие нафталан, деготь, анестезин. Иногда применяют гормональные мази, но это следует делать с осторожностью [1,2,14,16,17,18,19,21,23].
Применение энтеросорбентов при аллергических заболеваниях представляется весьма полезным, поскольку сорбенты, связывая пищевые и непищевые аллергены, а также обычные пищевые антигены, могут существенным образом уменьшать антигенную нагрузку на пищеварительную систему и иммунный барьер кишечника. Кроме того, применение энтерсорбентов способствует нормализации микробиоценоза кишечника и восстановлению структуры и функции слизистой оболочки желудка, тонкой и толстой кишки [9,12,21].
В свете изложенных фактов целесообразным представляется применение энтеросорбентов для дезинтоксикации организма и очищения ЖКТ, как составной части в
комплексном лечении нейродермитов и кожных проявлений диатеза [12].
Нейродермит (neurodermitis) — представляет собой хронически рецедивирующее заболевание кожи при котором изменения кожи развиваются преимущественно в результате расчесывания кожи, обусловленного первично возникающим зудом. Существуют две клинические формы:ограниченный нейродермит и диффузный нейродермит (атопический дерматит).
Этиология и патогенез. Определенную роль играют генетические факторы, создающие предрасположенность к атопической аллергии, одним из механизмов является блокада бета-адренергических рецепторов, приводящая прежде всего к нейровегетативным нарушениям. У боль-шинства больных атопическим дерматитом определяется повышенная способность продуцировать IgE на фоне уменьшения в периферической крови количества Т-клеток, IgA и IgM и увеличения IgG. Аллергены, реализующие клинические проявления атопичес-
кого дерматита могут быть в каждом конкретном случае разные.
Клиника. При ограниченном нейродермите, встречается у взрослых мужчин, возникает 1-2 зудящих очага в области шеи, внитренней поверхности бедер, мошенки, заднего прохода. Основным клиническим признаком является лихенизация кожи.
Диффузный нейродермит (атопический дерматит) представляет собой заболевание, которое, как правило начинается в грудном возрасте с эксудативного диатеза, переходящего затем в детскую экзему, а в возрасте 7-8 лет в собственно диффузный ней-
родермит.
Проявляется сильным зудом, который особенно беспокоит в ночные часы. Процесс локализуется в области боковых поверхностей шеи, груди, лба, щек, красной каймы губ, локтевых и подколенных складок. Пораженная кожа слегка гиперемирована, сухая лихинизирована, на ней много экскориаций, корочек. Граници поражения не резкие, на местах расчесов эксудация. У ряда больных вовлекается красная кайма губ и прилегающая кожа — атопический хейлит. Течение длительное, обострения при-емущественно в осенне-зимний период. К окончанию периода полового созревания (25-26 лет) у большенства больных наблюдается самоизлечение.
Лечение. Применяется неспецифическая десенсебилизирующая терапия, включая антигистаминные препараты витамины (пиридрксин, рибофловин). Применяют гистоглобулин (8-10 иньекций в/к 2 р в нед. в возрастных дозах 0.2-1.0 мл), натрия тиосульфат, седативные препараты.При упорном течении назначают кортикостероиды (преднизолон 15-20 мг. через день в течении мес.) Местно кортикостероидные мази, мази с 3-10% нафталана, серы. (седуксен, триоксазин)
Прогноз: благоприятный, к окончанию периода полового созревания (25-26 лет) у большенства больных наблюдается самоизлечение.
Схема лечения аллергодерматозов:
1. Кларитин по 1 таблетке 1 раз в день (утром) в течение 5 дней.
2. Кетасма в возрастной дозировке в течение 3-6 месяцев.
3. Лактобактерин или диалакт (лучше) по 5 доз 2 раза в день за 30-40 минут до еды в течение 10 дней.
4. Бифидумбактерин по 5 доз 2 раза в день за 30-40 минут до еды в течение 10 дней.
5. Панкреатин (панкреал, фестал, дигестал, панзинорм) по 1 таблетке 3-4 раза в день во время или сразу после еды в течение 10 дней.
6. Активированный уголь в порошке (белосорб, энтеросорб, энтеродез) по 1 столовой ложке с верхом в виде взвеси в воде принимать 1 раз в день утром натощак в течение 10-15 дней.
7. Местно:
— 1 часть яичного желтка
— 1 часть сливок
— 1 часть березового дегтя.
Смешать в однородную массу, нанести на небольшой (до 5 см) участок тела. На следующий день должно быть обострение местного процесса. Если на 3-й день произошло местное улучшение — продолжить обрабатывать всю поврежденную поверхность.
8. Антиоксидантный комплекс по схеме:
вит.А — 3 капсулы
вит. Е — 6 капсул
вит.С — 4 таблетки
принимать 1 раз в день во время еды через день 3 раза (доза насыщения). После этого:
вит.А — 1 капсула
вит.Е — 3 капсулы
вит.С — 2 таблетки
принимать 1 раз в день во время еды 2 раза в неделю длительно (поддерживающая доза).
Данная схема расщитана на антиоксидантный комплекс ПО Белмедпрепараты.
9. Напиток из пивных дрожжей:
— 25 г пивных дрожжей
— 4 чайные ложки сахара
— 1/2 стакана воды
все смешать и довести да кипения, но не кипятить. К полученной смеси добавить 1/2 стаканалюбого сока и выпить сразу же. Принимать в течение 10 дней.
P.S. Пункты 1-7 выполняются одновременно. Пункты 8-9 начинают выполнять после
окончания 3-6 пунктов.
Что такое атопия? Термин введен в 1923 г. д-ром Кока и означает «не на месте» или «иной». Атопию относят к симптомам-предшественникам развития астмы, аллергического ринита и кожного заболевания, называемого атопическим дерматитом. У больных с атопией отмечаются эозинофилия крови и тканей, иммунные дисфункции, связанные с угнетением клеточного иммунитета, повышение уровня IgE, увеличение трансэпидермальной потери воды, резкое повышение чувствительности к факторам, вызывающим зуд. Причина заболевания неизвестна, но у 70 % больных в семейном анамнезе отмечается по крайней мере одно из трех атопических заболеваний. Распространенность атопического дерматита возросла с 2 % у рожденных до 1960 г. до 9-20 % рожденных после 1970 г. Причина данного явления неизвестна.
Как диагностировать атопический дерматит? Характерных лабораторных показателей нет. Атопический дерматит можно диагностировать по наличию следующих 3-4 «больших» критериев: • Зуд — основной симптом заболевания, называемый «первичным повреждением» • Типичная клиническая картина и локализация для различных возрастных групп • Хроническое или хронически-рецидивирующее течение • Персональный или семейный анамнез атопии
Как меняется атопический дерматит с возрастом? Атопический дерматит может начаться в любом возрасте, однако у 60 % больных признаки заболевания появляются на первом году жизни, а у 20 % — к пятому. Выделяют 4 фазы дерматоза: • Младенческая (2 месяца — 2 года). В этот период атопический дерматит характеризуется интенсивным зудом, эритемой, папулами, везикулами и корками на щеках, лбу, волосистой части головы, в меньшей степени — на туловище и конечностях. Дерматит разрешается у половины больных к третьему году жизни (снимок А) • Детская (3 года — 11 лет). Очаги поражения более лихенифицированы и представлены ограниченными шелушащимися пятнами в области запястьев, лодыжек, бедер, ягодиц, локтевых и коленных сгибов, реже — поверхности разгибателей. У 2/3 больных атопический дерматит разрешается к 6-му году жизни (снимок В) • Подростковая (молодежная) (12-20 лет). Для этой фазы характерны утолщенные, сухие, лихенифицированные бляшки на лице, шее, верхних конечностях, спине и в области сгибателей (снимок С) • Взрослая (старше 20 лет). Атонический дерматит обычно разрешается в детстве, но у взрослых может сохраняться повышенная сухость кистей, лица, шеи, редко — обширных участков. Только у 10 % детей со стойким атоническим дерматитом он сохранится, когда они повзрослеют
Каковы сопутствующие изменения кожи у больных атопическим дерматитом? Сухость, выраженность кожных борозд ладоней, фолликулярный кератоз, вульгарный ихтиоз. Встречаются также двойные инфраорбитальные складки (линии Денни-Моргана), белый лишай, темная отечная кожа под глазами, чрезмерно выраженная носовая складка (из-за частого «теребления» носа). Повышены восприимчивость к кожной инфекции, особенно к герпесу простому и Staphylococcus aureus, и чувствительность кистей к холоду; часто наблюдается бледность в области носа, рта и ушей. Может развиться ранняя передняя субкапсулярная катаракта.
Что такое оспоподобные высыпания Капоши? Осложнение атопического дерматита вследствие распространения инфекции на фоне воспаленной кожи с образованием везикул с пупкообразным вдавливанием, вызванных простым герпесом (герпетическая экзема).
Какие факторы провоцируют или обостряют атопический дерматит? Наиболее частый провоцирующий фактор — чрезмерное мытье без применения смягчающих средств, а также другие местные раздражители: шерсть, синтетические материалы, минеральные масла, растворители, песок. Табачный дым, шерсть животных, домашние пылевые клещи, плесень, повышенное потоотделение нередко вызывают обострение у некоторых больных. Вторичная инфекция, вызванная St. aureus или Pityrosporum orbiculare, также способны ухудшать течение заболевания.
Играет ли роль в развитии атопического дерматита пищевая аллергия? Наиболее распространенные пищевые аллергены — это молоко, яйца, соя, морские продукты. Однако их роль в развитии обострения атопического дерматита остается неясной; нет также единого мнения об эффективности диет с исключением различных аллергенов.
Излечим ли атопический дерматит? Нет, но его развитие замедляется, если придерживаться следующих положений: • Избегать действия провоцирующих факторов • Уменьшать сухость кожи и зуд посредством нанесения смягчающих препаратов на влажную кожу, т. е. регидратации; применять мягкие мыла или их заменители; наносить эти средства в течение трех минут после мытья в ванне или под душем (эффективны мочевина и альфа-гидроксикислоты) • При остром воспалении и мокнутии применять открытые влажные компрессы, обладающие противозудным, очищающим, гидратирующим и охлаждающим свойствами • При подостром и хроническом течении основой терапии являются местные кортикостероиды • При торпидном течении показаны окклюзионные повязки с кортикостероидами, посредством которых проникновение препарата в кожу увеличивается в 100 раз. Они накладываются ежедневно на 8-12 ч в течение 3-7 дней • Препараты дегтя обладают сосудосуживающим, вяжущим, дезинфицирующим и противозудным свойствами • Эффективны общие или местные противозудные средства; препараты общего действия оказывают седативный и антигистаминный эффект • При присоединении вторичной инфекции показана антибиотикотерапия как минимум в течение двух недель
В подостром периоде атонического дерматита эффективным может быть применение гистаглобулина, противоаллергического иммуноглобулина, алерглобулина, витаминов В$, Bg, физиотерапевтических методов (переменное магнитное поле, ультразвук, индуктотермия области надпочечников, рефлексотерапия).
При наслоении вторичной инфекции для снятия ее назначают местно 1—2 % раствор бриллиантового зеленого, 0,5—1 % раствор метиленового синего, раствор перманганата калия 1 : 5000, гелиомициновую мазь. В подостром периоде и периоде ремиссии атопического дерматита рекомендуется санаторное лечение (Анапа, Евпатория, Пятигорск, санатории гастроэнтерологиче-ского профиля).
С учетом характера воспалительного процесса кожи осуществляют местное лечение. При выраженном экс-судативном компоненте воспаления применяют примочки (фурацилин 1 : 5000, Aqua plumbi, 0,25 % раствор нитрата серебра), в подостром периоде атонического дерматита назначают нафталановую, салициловую мази, крем, содержащий витамин F-99. В случае малой эффективности указанных средств при выраженном обострении атонического дерматита с интенсивным зудом используют глюкокортикостероидные препараты в виде мазей и кремов (преднизолон, фторокорт, лоринден, флуцинар, синафлан, целестодерм, гидрокортизон и др.) и аэрозолей (полькортолон, оксикорт).
studfile.net
Атопический дерматит. У детей до года (Андрей Соколов)
Глава 1. Этиология и патогенез атопического дерматита у детей до года
Роль иммуноглобулинов и действие КИПа в ЖКТ.
В настоящее время не представляется возможным отделить пищеварительную функцию кишечника от иммунологической. ЖКТ – важный орган иммунитета. Он участвует в развитии защитных реакций организма против патогенных, условно-патогенных микроорганизмов и многих неорганических веществ. Иммунокомпетентная (лимфоидная) ткань ЖКТ представлена организованными структурами (пейеровы бляшки, аппендикс, миндалины, лимфатические узлы) и отдельными клеточными элементами. Популяция клеток лимфоидной ткани разнородна и состоит из множества групп, подгрупп и клонов клеток с различными функциональными свойствами и специфичностью рецепторов к антигенам [1].
Также нельзя на данном этапе исследований выделить роль иммуноглобулинов КИПа среди всех иммуноглобулинов ЖКТ. Предполагается, что иммуноглобулины КИПа действуют в ЖКТ аналогично собственным иммуноглобулинам человека. И пока фармакокинетика КИПа изучена недостаточно, имеет смысл ориентироваться на приведенные ниже исследования действия собственных иммуноглобулинов человека в ЖКТ.
Эпителий ЖКТ отграничивает ткани макроорганизма от огромного количества живых и неживых антигенов – субстанций, несущих признаки чужеродной генетической информации. Пероральное воздействие антигена (в том числе микробов и их токсинов) обычно создает, с одной стороны, местную «слизистую» IgA – защиту (секреторный иммунитет) и клеточно-опосредованную реакцию, но с другой стороны – и системную толерантность или гипореактивность – подавление последующей выработки антигеноспецифических антител классов G и М и развития клеточно-опосредованного иммунитета (Richman L.K. et al., 1981). По отношению к патогенным и условно-патогенным микроорганизмам система местного иммунитета кишечника должна проявить адекватные защитные свойства, а по отношению к нормофлоре – как минимум, толерантность, а в лучшем случае, активно участвовать в процессах адгезии, выживания и размножения представителей нормофлоры.
Специфические иммунные механизмы вырабатываются в течение всей жизни кишечником для защиты от потенциально опасных микроорганизмов. Недифференцированные лимфоциты, продуцирующие в большинстве своем секреторные IgA или IgM – антитела, присутствуют в собственном слизистом слое или пейеровых бляшках. Стимуляция В- и Т-лимфоцитов в присутствии чужеродного антигена происходит вслед за их выходом из брыжеечных узлов в грудной проток, кровеносное русло и возвращением в кишечник, где они скапливаются также в собственном слое слизистой оболочки. Активированные клетки продуцируют специфические антитела классов IgА и IgМ, которые секретируются на поверхности слизистой оболочки через 4 – 8 дней после стимуляции. Иммуноглобулины образуют комплексы с антигенами, нейтрализуют токсины, препятствуют контакту микроорганизмов с клетками – «мишенями» макроорганизма, способствуют быстрому выведению микроорганизмов из ЖКТ благодаря агглютинации.
Аналогично собственным иммуноглобулинам, работают и иммуноглобулины КИПа.
Главная функция кишечных антител – иммунное отторжение у поверхности слизистой оболочки. Известно, что IgA преобладает среди иммуноглобулинов во всех секретах и в собственной пластинке кишечника. Секреторный IgA, выполняющий роль главного «чистильщика» и иммуномодулятора слизистой оболочки ЖКТ [2], удерживается около эпителиальных клеток в результате взаимодействия с гликокаликсом, во многом благодаря присутствию нормофлоры. IgA занимает благоприятную позицию, препятствующую поглощению антигенов. Двумерная молекула IgA может функционировать как агглютинин, уменьшая прилипание бактерий к энтероцитам. Полагают, что IgA не способен активировать систему комплемента, его бактерицидная деятельность рассматривается вместе с индукцией клеточно-опосредованной цитотоксичности (Lowell G.H. et al., 1980).
В слизистой оболочке есть также клетки, вырабатывающие иммуноглобулины других классов, но их значительно меньше. Так соотношение плазматических клеток, продуцирующих IgA, IgM, IgG равно, соответственно, 20: 3: 1 [1].
В просвете кишечника работают не только нативные молекулы иммуноглобулинов, но и активные Fc- и F (ab) «2 – фрагменты, образующиеся в результате расщепления молекул иммуноглобулинов протеолитическими ферментами ЖКТ [3]. Показано, что возможность фрагментации белковых молекул под воздействием ферментов не влияет на способность иммуноглобулинов длительно сохранять серологическую [4] и антигенсвязывающую активность [5, 6].
Важнейшее свойство системы местного иммунитета кишечника – феномен рециркуляции лимфоцитов (Hopkins J. et al., 1984). Сенсибилизированные антигенами лимфоциты пейеровых бляшек мигрируют в брыжеечные лимфатические узлы, а оттуда по лимфатическим сосудам через грудной проток и систему кровообращения направляются к собственному слою слизистой кишечника, главным образом в качестве клеток, секретирующих IgA. Этот механизм обеспечивает формирование клонов лимфоцитов и образование специфических антител в участках слизистой оболочки, отдаленных от очага первичной сенсибилизации. В процессе сенсибилизации плазматических клеток с последующим клонированием лимфоцитов, вырабатывающих антитела с определенными свойствами (аналогичными тем, которые выступили матрицей), участвуют не только нативные молекулы иммуноглобулинов, но и активные Fc- и F (ab) «2 – фрагменты.
Клеточный иммунитет кишечника в отличие от системы секретируемых им антител изучен недостаточно. Известно, что после перорального воздействия антигенов системные клеточные иммунные реакции выявляются редко. Очевидно, когда здоровые люди получают безвредные антигены (например антигены нормофлоры) в слизистой оболочке кишечника не развиваются реакции клеточного иммунитета [1].
Система местного иммунитета кишечника работает следующим образом. Попавшие в просвет кишечника или на слизистые оболочки микроорганизмы распознаются иммуноглобулинами памяти (IgG), после чего информация передается в иммунокомпетентные клетки слизистой оболочки, где из сенсибилизированных лимфоцитов клонируются плазматические клетки, ответственные за синтез иммуноглобулинов классов А и М. В результате защитной деятельности этих иммуноглобулинов включаются механизмы иммунореактивности или иммунотолерантности. Иммунная система «запоминает» антигены нормофлоры, чему способствуют генетические факторы, а также антитела класса G, передающиеся от матери плоду во время беременности, и иммуноглобулины, поступающие в ЖКТ ребенка с грудным молоком. В результате рециркуляции лимфоцитов и клонирования иммунный ответ охватывает все слизистые ЖКТ.
Регуляция иммунных реакций слизистой оболочки кишечника представляет собой сложный процесс, который может изменяться в различных ситуациях, таких как: наличие или отсутствие повреждения слизистой оболочки, сохранение целостности и функциональности биопленки, наличие острых или хронических инфекций, зрелость иммунной системы, состояние питания и генетический потенциал индивидуума. В результате повреждения слизистой оболочки могут возникнуть изменения иммунологической реактивности, хотя в этой ситуации трудно различить первичные и вторичные эффекты (Jackson P.G. et al., 1981).
Предпосылки применения КИП при дисбактериозе.
Известно, что одна из функций нормофлоры – иммунотропная [7], заключающаяся в стимуляции синтеза иммуноглобулинов, потенцировании механизмов неспецифической резистентности, системного и локального иммунитета, пропердина, комплемента, лизоцима [8, 9]; в стимуляции созревания лимфоидного аппарата кишечника [7]; в стимуляции созревания системы фагоцитирующих мононуклеаров. Нормофлора стимулирует не только систему местного иммунитета кишечника, но и системный иммунитет, что подтверждается в опытах на безмикробных животных [10, 11].
В результате антигенной стимуляции нормофлорой иммунной системы в организме человека создается и поддерживается общий пул иммуноглобулинов (Куваева И. Б., Ладодо К. С., 1991).
Слой слизь – IgA – нормофлора занимает все выпуклости, образуемые энтероцитами, и защищает слизистую оболочку от дегидратации, физической и химической агрессии, а также от атак микроорганизмов, бактериальных токсинов, паразитов [12].
На фоне снижения бифидо- и лактобактерий повышается проницаемость эпителиального барьера кишечника для макромолекул пищи и дефицит секреторного IgA [13, 14]. Дефицит секреторного IgA, в свою очередь может приводить к развитию заболеваний кишечника, а также к частым синубронхиальным инфекциям, а в конечном итоге – к предрасположенности к атопии и аутоиммунным заболеваниям [15]. Задача КИПа при дисбактериозе не только воздействовать на условно-патогенную флору, но и временно восполнить недостаток собственного секреторного IgA. КИП – единственный пероральный препарат, в состав которого входит IgA, действие которого, предположительно аналогично собственному секреторному IgA.
Проведенные на животных исследования показали, что при нарушениях биоценоза в ЖКТ развивается аутоиммунизация к комплексному антигену кишечной стенки, а применение иммунобиологических препаратов предотвращает этот процесс [16].
Иммунная система регулирует баланс биоценоза кишечника, т.е. механизмы саморегуляции нормофлоры контролируются местным иммунитетом кишечника. Поскольку любой микроорганизм является антигеном, должны существовать механизмы отторжения чужеродных микроорганизмов, а также толерантности и создания благоприятных условий для нормофлоры. Однако данные процессы изучены недостаточно [17].
Известно, что через плаценту от матери плоду передаются иммуноглобулины класса G, то есть иммуноглобулины, обеспечивающие иммунологическую память. Антитела классов М и А через плаценту не проходят, что объясняет недостаточную защищенность новорожденного против грамотрицательных микроорганизмов (энтеробактерии, сальмонеллы) [18]. Кроме того, доказано, что первые микроорганизмы, попадающие в кишечник, появляются там в процессе и после рождения ребенка и прикрепляются к определенным рецепторам [19, 20]. Будучи антигенами, лактобактерии и бифидобактерии, тем не менее, не вызывают иммунного ответа, направленного на элиминацию. Скорее всего, это связано с регулирующей функцией материнских IgG, которые «запомнили» необходимую информацию о балансе нормофлоры.
Процесс специфической адгезии микроорганизмов к слизистой оболочке ЖКТ может блокироваться среди прочих факторов (дефицит ионов железа, аналоги рецепторов эпителиальных клеток) присутствием секреторных иммуноглобулинов (IgA) и лизоцимом [57].
Подтверждением роли IgA в предотвращении колонизации слизистых посторонними микроорганизмами является тот факт, что 99% бактерий – представителей нормофлоры не покрыты секреторными иммуноглобулинами. Напротив, энтеробактерии, энтерококки, другие условно-патогенные и сапрофитные микроорганизмы полностью покрыты IgA [17, 21]. В основе этого явления лежит феномен иммунологической толерантности к нормофлоре.
Согласно одной из гипотез [17], если в организме матери в результате воздействия дисбиотических агентов пул микроорганизмов сдвигается в сторону увеличения аллохтонной микрофлоры, то в организме ребенка этот сдвиг может закрепиться, что связано с нарушениями антигенной стимуляции тимуса, формирования иммунологической памяти и иммунологической толерантности.
У новорожденных и детей раннего возраста транзиторная иммунная недостаточность – это биологическая закономерность, в основном относящаяся к гуморальному иммунитету [18]. У детей этой возрастной группы также значительно чаще, чем у детей старше года возникают стойкие нарушения биоценоза кишечника, что, на наш взгляд, отчасти связано с недостаточностью иммунной системы.
Физиологическая недостаточность системы местного иммунитета кишечника в первые 3 мес жизни ребенка компенсируется поступлением IgA и других защитных факторов с женским молоком. При грудном вскармливании ребенок получает ежесуточно до 1,5 г IgА (Bullen C., 1980). У детей, лишенных защитных факторов женского молока, находящихся на искусственном или раннем смешанном вскармливании, значительно чаще отмечаются пищевые аллергии и дисбактериозы кишечника, что отмечается большинством исследователей в этой области. Таким образом КИП при искусственном вскармливании восполняет дефицит IgА, который ребенок должен был получить от матери.
Проникновение инфекционных агентов на слизистые оболочки ЖКТ и других органов вызывает ответную реакцию системы местного иммунитета в виде нарастания концентрации IgA [18], который, как было указано ранее, вырабатывается при участии нормофлоры. Соответственно, может возникнуть ситуация, когда микробиологический дисбаланс одного типа будет способствовать усугублению микроэкологических нарушений: снижение количества нормофлоры – дефицит IgA – колонизация слизистых оболочек УПФ. Следует отметить, что врожденный дефицит IgA отмечается нередко: у 1 из 700 человек (Cassidi Y.T., 1979; [18]), такие люди подвержены рецидивирующим заболеваниям верхних дыхательных путей, кишечным инфекциям и дисбактериозу кишечника. Этот аспект также объясняет клинический эффект от применения КИП, в частности его большую эффективность по сравнению с бактериофагами при лечении дисбактериоза.
Врожденные и транзиторные аномалии системы местного иммунитета кишечника снижают резистентность организма не столько к агрессивным вирулентным микроорганизмам, сколько к УПФ. С ними связана устойчивость кишечного дисбактериоза [18, 22].
Практически у 100% животных и людей с приобретенными иммунодефицитами (в результате радиационного воздействия) имеются нарушения состава кишечной микрофлоры, при этом у них отмечается не только повышенный рост УПФ, но и резкое снижение нормофлоры [23, 24], то есть нарушаются и защитная функция местного иммунитета, и иммунологическая толерантность, что может косвенно свидетельствовать о том, что система местного иммунитета способствует не только элиминации аллохтонных микроорганизмов, но и создает оптимальные условия (а не только иммунологическую толерантность) для нормофлоры.
Ферментная недостаточность желудка и кишечника, дискинезия желчевыводящих путей, сопровождающие дисбактериоз, проявляются недостаточным, патологическим усвоением важнейших ингредиентов пищи и синтезом токсических и аутоаллергических комплексов. На этом фоне возникают нейроэндокринные расстройства, нарушения деятельности калликреин-кининовой системы, синтеза катехоламинов и защитных антител, гиперпродукция IgE [25].
Перегрузка иммунной системы кишечника вследствие дисбактериоза ведет к локальному недостатку секреторного IgA, что в свою очередь может приводить к развитию заболеваний кишечника, дыхательных путей, атопии и аутоиммунным состояниям [26]. Это надо учитывать при коррекции дисбактериоза, сопровождающегося атопическим дерматитом у детей до года. В этом случае применению КИПа альтернатив нет.
При физиологических родах источником первичной контаминации плода становятся родственные в антигенном отношении организму ребенка (поэтому обладающие максимальной способностью к приживлению) микроорганизмы из нормофлоры влагалища, а также кишечника и кожи матери, т.е. микробное заселение ребенка в процессе родов – первый этап формирования его биоценоза. Учитывая этот факт, отработаны практические рекомендации по коррекции вагинальной флоры женщины в последнем триместре беременности с помощью КИП (КИПферон) в свечах – вагинально [7].
Постнатальная профилактика дисбактериоза у новорожденных детей.
Излишняя забота о «стерильности» условий для новорожденных при родах может приводить к увеличению частоты дисбактериоза. Эра антибиотиков в условиях их неконтролируемого использования также внесла в это свой вклад [27, 28, 29].
Другими словами, в жизни ребенка можно выделить два наиболее критических момента, оказывающих исключительное влияние на бактериальную колонизацию кишечника, первый при рождении ребенка и второй – при отлучении от груди. В связи с существенным изменением характера питания в сжатые сроки происходят выраженные качественные и количественные изменения в составе микрофлоры кишечника [29].
В связи с этим основные профилактические мероприятия в роддоме заключаются в следующем: ребенок после рождения должен быть сразу приложен к груди и в дальнейшем как можно дольше находиться с матерью (в одной палате постоянно), в палату к ребенку могут допускаться близкие родственники; по возможности, сроки пребывания ребенка и матери в роддоме должны быть сведены к минимуму; важно провести мероприятия по стимуляции лактации (научить маму правильно сцеживаться, расцедить грудь), по возможности избегать введения искусственных смесей.
Новорожденным из групп риска показаны корригирующие мероприятия для профилактики развития дисбактериоза. Оптимально введение КИП и пробиотиков коротким курсом (7 – 14 дней) [7, 30, 31].
Клиническая фармакология иммунотерапии дисбактериоза.
Иммунологическая дисфункция – это важнейшее патогенетическое звено в развитии дисбактериоза кишечника. Задача системы местного иммунитета кишечника – не только нейтрализация УПФ, но и поддержание нормального баланса нормофлоры. Развитие у человека дисбактериоза кишечника свидетельствует о недостаточности работы системы местного иммунитета кишечника. Главной причиной развития любого дисбактериоза является иммунологическая дисфункция и прежде всего – недостаточность гуморального иммунитета.
У детей первых месяцев жизни транзиторная иммунная недостаточность – это биологическая закономерность, в основном относящаяся к гуморальному иммунитету [45]. Именно поэтому у детей этой возрастной группы значительно чаще, чем у детей старше года, возникают стойкие и транзиторные нарушения биоценоза кишечника без каких-либо других видимых причин. В более старшем возрасте причинами иммунной дисфункции могут быть хронические вялотекущие паразитарные или микробные инфекции; острые кишечные инфекции; острые респираторные заболевания; детские инфекции; вакцинации; неблагоприятные экологические факторы; стрессы; применение антибиотиков и др. Очень часто проявления дисбактериоза отмечаются через некоторое время после перечисленных воздействий.
Иммунокоррекция – важнейшее направление лечения дисбактериоза – показана не только при дисбактериозе с повышенным количеством УПФ (дисбактериоз II типа), но и при дисбактериозе со сниженным количеством нормофлоры (дисбактериоз I типа).
Основной препарат для иммунокоррекции – КИП, разработанный сотрудниками МНИИЭМ им. Г.Н.Габричевского [2, 21]. Материалом для получения КИП служит донорская плазма от нескольких тысяч доноров, поэтому можно говорить о коллективном иммунитете. КИП, в отличие от нормального иммуноглобулина человека, содержит иммуноглобулины трех классов: 50% IgG, 25% IgM, 25% IgA. КИП характеризуется повышенным содержанием антител к энтеробактериям (шигеллы, сальмонеллы, эшерихии, протей, клебсиелла и др.), Ps.aeruginosa, стафилококкам, а также к ротавирусам [1, 3]. Таким образом, в состав КИП входят иммуноглобулины 3 классов к основным видам патогенной и УПФ. Специфические антитела, содержащиеся в КИП, нейтрализуют действие энтеропатогенных микроорганизмов, что достигается наличием в препарате антител одинаковой специфичности, но разных классов, способствующих агглютинации, нейтрализации и преципитации инфекционных агентов.
Препарат представляет собой лиофилизированную смесь во флаконах. 1 стандартная доза содержит 300 мг белка и следовые количества консервантов. Введенный перорально, КИП частично расщепляется в желудке и двенадцатиперстной кишке на активные составляющие: Fc- и F (ab) «2 – фрагменты, которые сохраняют активность иммуноглобулинов. Эти фрагменты имеют слишком большую молекулярную массу, чтобы проникнуть в системный кровоток через слизистую оболочку кишечника, поэтому КИП оказывает в основном местное действие в просвете, на слизистых оболочках и в собственном слое слизистой оболочки, проникая в кровоток в микроколичествах путем пиноцитоза и т. п. [51]. Действие КИП происходит на протяжении всего ЖКТ, но особенно в толстом кишечнике, где сосредоточено большое количество лимфоидной ткани (пейеровы бляшки).
Чтобы понять механизм действия КИП, нужно вспомнить основные положения классической иммунологии [42, 45]. Известно, что наиболее представленные в сыворотке любого человека (75%) иммуноглобулины класса G имеют самую простую среди антител структуру и являются основными носителями иммунологической памяти. Специфические моноклональные иммуноглобулины образуются в лимфоидной ткани, их синтезируют лимфоциты, прошедшие дифференцировку за счет сенсибилизированных антигеном антител. Несмотря на короткий срок жизни иммуноглобулинов класса G (21 – 28 дней), за счет дифференцировки лимфоцитов иммунологическая память сохраняется достаточно долго (часто пожизненно), Молекулы иммуноглобулинов у всех людей имеют сходную структуру (т.е. например IgG к клебсиелле одинаков у всех), поэтому не воспринимаются иммунной системой как чужеродные белки. Таким образом, введенные в организм «чужие» антитела, достигнув лимфоидной ткани кишечника, включаются в формирование иммунологической памяти наряду с собственными (которые вырабатываются в результате контакта с антигеном). Феномен рециркуляции лимфоцитов (Hopkins J. et al., 1984), описанный в главе 2, способствует образованию специфических антител в участках слизистой оболочки, отдаленных от очага первичной сенсибилизации. Таким образом, иммуноглобулины, введенные энтерально, не только выполняют функцию иммунного ответа в кишечнике, но и выступают в роли матрицы, с которой клонируются плазматические клетки с заданными свойствами. Система местного иммунитета кишечника приобретает способность противостоять тем микроорганизмам, антитела к которым содержатся в КИП.
Таким же образом осуществляется пассивная иммунизация ребенка, получающего материнское молоко, через иммуноглобулины, содержащиеся в нем. Таким образом, иммунокоррекция комплексным иммуноглобулиновым препаратом физиологична. КИП стимулирует механизмы развития собственного местного гуморального иммунитета, что особенно важно для детей, лишенных материнского молока.
Кроме действия на иммунитет кишечника, КИП обладает прямым антимикробным действием за счет содержания в нем антител классов М и А. Эти иммуноглобулины, связываясь с комплементом, вызывают лизис бактерий. Поэтому КИП может использоваться без добавления других антибактериальных препаратов [37].
Теоретическое обоснование общего иммуномодулирующего действия КИП еще недостаточно. При дисбактериозе может нарушаться барьерная функция слизистой оболочки кишечника, и крупные молекулы иммуноглобулинов, всасываясь в системный кровоток, могут оказать и эффект общей иммуностимуляции. Существует научная концепция орального использования КИП, основанная на синергическом защитном действии антител одной специфичности, но различных классов [1 – 3, 21].
Инфицированное грудное молоко и дисбактериоз
Естественное вскармливание материнским молоком – наилучший способ питания детей первого года жизни. Грудное молоко – это не только полезный для ребенка пищевой продукт. Оно обладает уникальными биологическими свойствами, которые отсутствуют даже в самых совершенных молочных смесях, предназначенных для искусственного вскармливания. Гормоны, биологически активные вещества, иммунные комплексы, живые клетки материнского молока оказывают мощное благотворное влияние на организм ребенка, обеспечивая нормальное течение процессов обмена веществ, устойчивость к действию инфекций и других неблагоприятных внешних факторов [33]. Грудное молоко способствует заселению ЖКТ ребенка полезными микроорганизмами и препятствует размножению болезнетворных бактерий. У детей, отлученных от груди, развивается дисбактериоз с повышенным количеством УПФ [56]. Дети, вскармливаемые грудью, реже болеют не только кишечными, но и острыми респираторными инфекциями за счет того, что в грудном молоке содержатся лимфоциты, макрофаги, а также антитела к тем инфекционным заболеваниям, которые перенесла мать. Кроме того, кормление грудью не только оказывает уникальное биологическое воздействие на здоровье ребенка, но и благоприятно сказывается на психологическом состоянии и здоровье матери, в частности способствует предотвращению мастита и уменьшению риска развития онкологических заболеваний молочных желёз и яичников [38, 47, 48, 58].
Тем не менее в 1995 году было распространено фактически повсеместно, да и сейчас совершенно не редки случаи, когда маме запрещают кормить грудью, если в молоке высевается не о что бы золотистый стафилококк, а даже сапрофитный или эпидермальный, который может попасть в пробирку при заборе, но к молоку отношения не иметь (с рук, с кожи груди и т.д.). Есть ли основания для однозначной и безоговорочной отмены грудного вскармливания при «плохом» анализе на «стерильность» грудного молока?
Основным возбудителем гнойного мастита является золотистый стафилококк, который был выделен из гноя в монокультуре у 90,8% пациенток и в ассоциации с другой микрофлорой – у 2,5%. Данные посева молока на микрофлору при этом, как правило, идентичны. При мастите следует воздержаться от прикладывания ребенка к больной и здоровой молочным железам. Естественное вскармливание можно продолжить только после купирования воспаления и при отрицательном посеве молока на микрофлору. [52].
Отлучение ребенка от груди практикуется в связи с тем, что раньше при не гнойном лактационном мастите не всегда проводилось эффективное лечение или была опасность, что должного лечения проведено не будет. Также, довольно часто, кормящих мам с подозрением на гнойный мастит сразу госпитализировали, что сильно затрудняло возможность грудного вскармливания.
Между тем следует отметить, что гнойному маститу предшествует негнойный. А не гнойный (серозный или инфильтративный) также развиваются на фоне или лактостаза или проникновения в молочную железу УПФ (в количестве не достаточном для развития гнойного мастита). И при адекватных и своевременных мерах по ликвидации лактостаза гнойный мастит не развивается. Между тем при обнаружении в посеве молока каких либо микробов рекомендуется отлучение от груди как от больной, так и от здоровой. Учитывая ценность материнского молока для ребенка это чрезмерно перестраховочная мера. [35]
Во многих лабораториях кормящим матерям делают анализ на микробиологическую чистоту грудного молока и очень часто высевают различные условно-патогенные микроорганизмы, золотистый стафилококк, что почти всегда является поводом для терапевта к назначению отмены грудного вскармливания и перехода на адаптированные молочные смеси. При этом, как правило, у матерей нет никаких симптомов мастита.
Однако, ребенок после родов не существует в условиях гнотобиологического изолятора и постоянно сталкивается с УПФ при кормлении грудью или сосании рук – с кожи, при сосании соски или игрушки – с их поверхности. Таким образом (и массой других) в организм ребенка попадает УПФ, например стафилококки – эпидермальный, сапрофитный, золотистый). Т.о. это не всегда должно являться причиной отлучать ребенка от груди, так как инфицированное грудное молоко не всегда влияет на отрицательно на здоровье ребенка. В настоящей работы будет предпринята попытка доказать верность этого утверждения.
По данным Чадаева А. П., Зверева А. А., В 85,8% наблюдений маститу предшествовал лактостаз, который является основным «пусковым» механизмом развития воспалительного процесса в молочной железе, а при гнойном мастите он присутствовал всегда. При лактостазе молочная железа увеличивается в объеме, повышается температура тела, пальпируются плотные увеличенные дольки с сохраненной мелкозернистой структурой. В то же время отсутствуют гиперемия кожи и отечность ткани железы, которые появляются при воспалении. Если лактостаз не купирован в течение 3—4 сут, то возникает мастит, так как при лактостазе количество микробных клеток в молочных протоках увеличивается в несколько раз и вследствие этого реальна угроза быстрого развития воспаления.
Основанием для оперативного лечения являются сочетание высокой температуры тела и наличие плотного болезненного инфильтрата в тканях молочной железы. В то же время следует отметить, что при лактостазе температура тела может повышаться до 39—40°С. Это объясняется повреждением молочных протоков, всасыванием молока и его пирогенным действием. Диагностика гнойного мастита на фоне выраженного лактостаза иногда затруднительна. Поэтому при наличии выраженного лактостаза вопрос об оперативном лечении следует решать в течение 3—4 ч после тщательного сцеживания молока.
При длительности заболевания менее 3 сут, температуре тела до 37,5°, удовлетворительном состоянии больных, наличии инфильтрата в пределах одного квадранта железы и отсутствии других местных признаков гнойного воспаления возможна консервативная терапия. При отсутствии положительной динамики в течение 2 сут. консервативной терапии показано оперативное лечение.
При длительности заболевания более 3 сут. консервативная терапия возможна только при удовлетворительном состоянии больных, нормальной температуре тела, наличии инфильтрата, занимающего не более одного квадранта железы, без местных признаков гнойного воспаления, неизмененных показателях общего анализа крови и отрицательных данных пункции инфильтрата [52].
Некоторые врачи придерживаются более мягких взглядов на патогенез лактационного мастита и его пускового механизма – лактостаза.
Вскармливание грудного ребенка материнским молоком – необходимое условие для его нормального роста и развития. В материнском молоке содержатся все питательные вещества – белки, жиры, углеводы, соли, вода, витамины. С ним в организм ребенка поступают и защитные вещества, предохраняющие его от инфекционных заболеваний. Материнское молоко, в отличие от других видов пищи, полностью переваривается и не вызывает пищевых расстройств. Преждевременное отнятие ребенка от груди неизбежно влечет за собою расстройство функции нервно-эндокринной системы, в том числе яичников и гипофиза, разлад в нормальной выработке половых гормонов. Убедительные данные об очень важной роли достаточно продолжительного вскармливания грудного ребенка материнским молоком были представлены научной экспедицией Института онкологии им. Н. Н. Петрова (1975). Работая в районе Небит-Дага, экспедиция установила, что за 10 лет здесь не было зарегистрировано ни одного случая затвердений в молочных железах. Выяснилось, что в этом районе грудное вскармливание детей длится в течение 2—3 лет, а иногда и 6 лет. Нормальная продолжительность грудного вскармливания ребенка должна быть не менее года. [53]
Все вышесказанное не оставляет в настоящее время сомнений в преимуществе естественного вскармливания, когда речь идет о нормальном молоке здоровой женщины и хорошей его переносимости ребенком. Тем не менее, в повседневной педиатрической практике часто встречаются ситуации, когда перед врачом встает вопрос о сохранении или отмене кормления грудью. В частности, возможно ли безопасное естественное вскармливание, когда грудное молоко инфицировано УПФ? Вызывают ли условно-патогенные микроорганизмы из грудного молока нарушения биоценоза кишечника ребенка?
Атопический дерматит.
Что же касается атопического дерматита у детей первого года жизни, то для того что-бы понять, насколько важно осторожное ведение прикормов достаточно вспомнить о том, что неадекватное кормление ребенка пищей не по возрасту может привести к инвагинации, что первое, что делают аллергологи – отменяют маме ряд продуктов при жалобах на атопический дерматит, а так же весьма распространенный диагноз «лактазная недостаточность», который приводит зачастую к переводу ребенка с грудного вскармливания на гидролизат, безлактозную или соевую смесь. Однако, как показали исследования НИИ «Иммунологии» [54] более 75% атопического дерматита «псевдоаллергической» природы и связаны с дисбактериозом, неправильным кормлением матери, транзиторной ферментативной недостаточностью, неадекватным введением смеси и прикормов.
Атопический дерматит – мультифакториальное заболевание с аномальной направленностью иммунного ответа, которое характеризуется:
1. Генетически детерминированным механизмом развития;
2. Аномальным Th3—IgЕ опосредованным воспалением;
3. Стадийностью клинического течения.
Общепризнанно, что генетическая предрасположенность к атопии характеризуется полигенным наследованием.
Конец ознакомительного фрагмента.
kartaslov.ru
Фармакологическая группа | МНН препарата | Форма выпуска | Дозировка | Кратность применения | Примечание |
| Системная терапия | |||||
| Антигистаминные препараты (уровень доказательности от А-В-С) | Лоратадин (второго поколения) | таблетки, 10 мг; сироп во флаконе | Взрослым и детям старше 12 лет назначают 1 таблетку (10 мг) или 2 чайные ложки сиропа в сутки. Длительность курса лечения — 10–15 дней. Детям в возрасте от 3 до 12 лет — назначают по 1/2 таблетки или 1 чайную ложку сиропа в сутки. | 1 раз в сутки в течение, в среднем, 10-15 дней | Применять при обострении. Детям школьного возраста целесообразно назначение антигистаминных препаратов второго поколения, не обладающих седативным свойством и не снижающих концентрацию внимания. У детей до 2-х лет антигистаминные препараты второго поколения не применяют
|
Дезлоратадин (третьего поколения) | таблетки, 5 мг; сироп во флаконе | детям от 1 до 5 лет 2,5 мл сиропа, от 6 до 11 лет 2,5 мг или 5 мл сиропа, старше 12 лет 5 мг или 10 мл сиропа в день | 1 раз в сутки в течение, в среднем, 10-15 дней | ||
Цетиризин (второго поколения) | таблетки, 10 мг | детям старше 2-х лет 0,25 мг/кг массы тела 1 раз в день | 1 раз в сутки в течение, в среднем, 10-15 дней | ||
Хлорапирамин (первого поколения) | таблетки, 25 мг раствор для инъекций – ампулы по 1,0 мл (20 мг) | Детям начинают лечение с дозы 5 мг (0,25 мл). В дальнейшем повышение дозы лимитируется преимущественно появлением побочных эффектов. Детям в возрасте 1-12 месяцев — 5 мг (0,25 мл) Детям в возрасте 2-6 лет — 10 мг (0,5 мл) Детям в возрасте 7-14 лет — 10-20 мг (0,5-1 мл) Суточная доза не должна превышать 2 мг/кг массы тела. Детям: В возрасте 1-12 месяцев по 1/4 таблетки (6,25 мг) 2-3 раза в день (в растертом до порошка виде вместе с детским питанием). В возрасте 1-6 лет по 1/4 таблетки (8,3 мг) 3 раза в день или по 1/2 таблетки 2 раза в день. В возрасте 6-14 лет по 1/2 таблетки (12,5 мг) 2-3 раза в день. | 1-3 раза в день в течение, в среднем, 7-10 дней | ||
Дифинилгидра- (первого поколения) | Порошок и таблетки по 20 мг; 30 мг и 50 мг; р-р для инъекций 1% (ампулы и шприц-тюбик). Свечи по 5 мг, 1 мг, 15 мг и 20 мг. | Детям дифинилгидрамин назначают в меньших дозах: до 1 года — по 0,002-0,005 г, от 2 до 5 лет — по 0,005-0,015 г, от 6 до 12 лет — по 0,015-0,03 г на прием. Свечи с дифинилгидра- вводят в прямую кишку 1-2 раза в день после очистительной клизмы или самопроизволь- | 1-3 раза в день в течение, в среднем, 7-10 дней | ||
Клемастин (первого поколения) | таблетки 1 мг, сироп, ампулы по 2,0 мл | детям от 1 года до 3 лет по 2,0-2,5 мл сиропа 2 раза в день; от 3-6 лет – по 5,0 мл (0,5 мг) 2 раза в день; старше 7 лет по 5,0-10,0 мл (0,5-1,0 мг) 2 раза в день | 1 -2 раза в сутки, в среднем, в течение 7-10 дней | ||
Мебгидролин (первого поколения) | таблетки, драже по 50 и 100 мг | детям до двух лет по 50-100 мг в день, от 2 до 5 лет по 50-150 мг в день, | 1-3 раза в сутки, в среднем, в течение 7-10 дней | ||
| Хифенадин | таблетки, 10 и 25 мг | детям до 3 лет по 5 мг, 3-7 лет по 10-15 мг -2-3 раза в день | 1-3 раза в сутки, в среднем, в течение 7-10 дней | ||
| Диметинден | капсулы по 4 мг, капли (1 мл – 20 капель — 1 мг) | Детям целесообразнее назначать препарат в виде капель. Детям старше 3 лет назначают по 15-20 капель в сутки. Детям в возрасте от 1 года до 3 лет — по 10-15 капель 3 раза в сутки. | 1-3 раза в сутки, в среднем, в течение 7-10 дней | ||
| Наружная терапия | |||||
Глюкокортико- | Клобетазол пропионат | 0,05% мазь, крем | зависит от количества очагов поражения | 1-2 раза в день наружно | Препараты выбора. Длительное и непрерывное применение ТГКС у грудных детей может вызвать подавление функции коры надпочечников. У грудных детей пеленки могут действовать как окклюзионные повязки и увеличивать абсорбцию кортикостероидов. При поддерживающей терапии в лечении пациентов с умеренной и тяжелой степенью АД, испытывающих частые рецидивы, следует рассмотреть целесообразность |
| Сильные (III) | Бетаметазона валерианат | 0,1%мазь, крем | зависит от количества очагов и площади поражения | 1-2 раза в день наружно | |
| Метилпредни- золона ацепонат | 0,05%мазь, крем, эмульсия | зависит от количества очагов и площади поражения | 1-2 раза в день наружно | ||
| Мометазона фуроат | 0,1% крем, мазь | зависит от количества очагов и площади поражения | 1-2 раза в день наружно | ||
| Гидрокортизона-17 бутират | 1,0% мазь, крем | зависит от количества очагов и площади поражения | 1-2 раза в день наружно | ||
| Флютиказона пропионат | 0,05% крем, мазь | зависит от количества очагов и площади поражения | 1-2 раза в день наружно | ||
| Бетаметазона дипропионат | 0,05% крем, мазь | зависит от количества очагов и площади поражения | 1-2 раза в день наружно | ||
| Десонид | 0,1% крем | зависит от количества очагов и площади поражения | 1-2 раза в день наружно | ||
| Предникарбат | 0,25% крем, мазь | зависит от количества очагов и площади поражения | 1-2 раза в день наружно | ||
| Умеренно сильные (II) | Флуоцинола ацетонид | 0,025% крем, мазь | зависит от количества очагов и площади поражения | 1-2 раза в день наружно | |
| Триамцинолона ацетонид | 0,1% крем, мазь | зависит от количества очагов и площади поражения | 1-2 раза в день наружно | ||
| Аклометазона дипропионат | 0,05% крем, мазь | зависит от количества очагов и площади поражения | 1-2 раза в день наружно | ||
| Флуметазона пивалат | 0,02% крем, мазь | зависит от количества очагов и площади поражения | 1-2 раза в день наружно | ||
| Слабые (I) | Дексаметазон | 0,025% крем, мазь | зависит от количества очагов и площади поражения | 1-2 раза в день наружно | |
| Преднизолон | 0,25%, 0,5% крем, мазь | зависит от количества очагов и площади поражения | 1-2 раза в день наружно | ||
| Гидрокортизона ацетат | 0,1%, 0,25%, 1,0% и 5,0% крем, мазь | зависит от количества очагов и площади поражения | 1-2 раза в день наружно | ||
| Комбинирован- ные | Бетаметазона дипропионат + гентамицина сульфат + клотримазол | трехкомпонентная мазь, содержащая в 1000 мг: бетаметазона дипропионат + гентамицина сульфат (1 мг) + клотримазол (10мг) | зависит от количества очагов и площади поражения | 1-2 раза в день наружно | Применяются при присоединении вторичной пиогенной, грибковой инфекции |
| Гидрокортизон + натамицин + неомицин | трехкомпонентная мазь, крем, содержащие в 1000 мг: гидрокортизон + натамицин (10 мг) + неомицин (3500 ЕД) | зависит от количества очагов и площади поражения | 1-2 раза в день наружно | ||
| Бетаметазон + гентамицин | двухкомпонентная мазь, крем, содержащие в 1000 мг: бетаметазон (1мг) + гентамицина сульфата (1 мг) | зависит от количества очагов и площади поражения | 1-2 раза в день наружно | ||
| Ингибиторы кальциневрина | Такролимус | 0,1% мазь | зависит от количества очагов и площади поражения | 1-2 раза в день наружно | необходимо рассматривать применение топического такролимуса , для пациентов в возрасте двух лет и старше, на короткий курс, в сулчаях когда интермиттирую- щая терапия средней или тяжелой формы АД не контролируется использованием топических кортикостероидов или в случаях серьезного риска отрицательного эффекта от дальнейшего использования топических кортикостероидов, в частности, атрофии кожи [4,5] |
| Пимекролимус | 1% крем | зависит от количества очагов и площади поражения | 1-2 раза в день наружно | ||
| Препараты цинка | Пиритион цинк активированный | 0,2% крем, мазь, спрей | зависит от количества очагов и площади поражения | 1-2 раза в день наружно | |
diseases.medelement.com
Атопический дерматит — клиника (симптомы), этиология и патогенез, диагностика и лечение
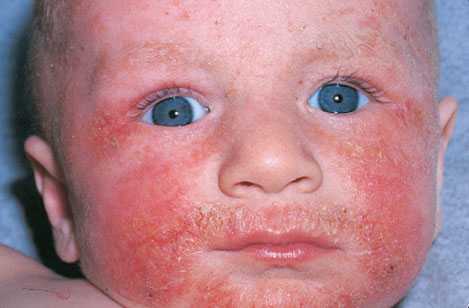 Атопический дерматит — генетически обусловленное хроническое рецидивирующее заболевание кожи, клинически проявляющееся первично возникающим, часто мучительным зудом, возрастной эволюцией клинической картины, гиперчувствительностью ко многим иммунным и неиммунным стимулам.
Атопический дерматит — генетически обусловленное хроническое рецидивирующее заболевание кожи, клинически проявляющееся первично возникающим, часто мучительным зудом, возрастной эволюцией клинической картины, гиперчувствительностью ко многим иммунным и неиммунным стимулам.
Этиопатогенез. В этиологии атопического дерматита вклад генетических факторов является установленным фактом. Предполагается аутосомно-доми- нантный тип наследования. Если оба родителя имеют дерматоз, то риек развития атопического дерматита у ребенка составляет 70-80%, при болезни только матери или отца риск формирования болезни снижается до 30-60%.
В патогенезе атопического дерматита ведущее значение придается иммунным механизмам.
Среди экзогенных факторов, оказывающих провоцирующее воздействие при атопическом дерматите, выделяют пищевые вещества-ингалянты, наружные раздражители физического характера, животного и растительного происхождения и отрицательные эмоции.
К наружным раздражителям относят шерсть, мех, латекс, синтетические волокна, детергенты, никель, кобальт, ланолин, антибиотики и даже наружные кортикостероидные средства. При лекарственной непереносимости у больных причинно-значимыми аллергенами являются антибиотики — пенициллин и его полусинтетические производные, сульфаниламиды, местные анестетики, нестероидные противовоспалительные препараты, витамины группы В. Известно значение психоэмоциональных стрессов в ухудшении состояния больных.
Эпидемиология. В Украине заболеваемость колеблется в пределах 3-10 на 10ОО детей. Чаще болеют лица женского пола — 65%, реже мужского — 35%.
Риск развития у больных атопическим дерматитом в дальнейшем респираторных симптомов аллергии составляет 40-60% (поллинозов — 40%, сезонных ринитов — 25%, атопической астмы — 25%). Для хронического течения АД характерны сезонные (летние месяцы) и внесезонные ремиссии. Обострение заболевания обычно происходит в возрасте 7-8 и 12-14 лет.
Клинические проявления. Первые признаки атопического дерматита обычно возникают в возрасте от 2-3 мес. до 1,5-2 лет. Начальные изменения появляются на щеках в виде «физиологической гиперемии» или эритемы, шелушения на коже волосистой части головы, в дальнейшем распространяющихся на лоб, заушные складки, подбородок, шею, туловище.
Для младенческого периода типичны эритематозно-сквамозные отечные очаги с островоспалительными мелкими округлыми папулами красного цвета, микровезикулами с серозным содержимым, быстро вскрывающиеся, с образованием «серозных колодцев». Экссудат из высохших везикул образует желтовато-коричневые корки. После 6-месячного возраста и на 2-м году жизни экссудативные явления уменьшаются, начинают появляться лихеноидный и пруригинозный компоненты поражения. Очаги становятся сухими, инфильтративными, шелушащимися, появляются мелкие, поверхностные, едва заметные полигональные папулы на лбу, верхней части груди. На туловище и конечностях развиваются воспалительные фолликулярные папулы, иногда — пруригинозные и эпизодически уртикарные высыпания. Поражения к концу 2-го года жизни обычно становятся ограниченными, на конечностях занимают разгибательную и сгибательную поверхности, но начинает появляться тенденция к ограничению очагов в голеностопных, локтевых, шейных складках, поражение лица менее выражено.
Для второго периода развития атопического дерматита характерны локализация сыпи в складках, хронический воспалительный характер поражений с более выраженным лихеноидным синдромом, развитие вторичных изменений кожи (дисхромии), волнообразность течения, реакции на многие провоцирующие влияния с уменьшением алиментарной гиперчувствительности. Основная локализация поражений кожи — локтевые и подколенные складки, сгибательные поверхности верхних и нижних конечностей, шея, заушные складки и пе- риоральная область, тыльная поверхность кистей и пальцев, при более распространенном процессе — верхняя часть спины, боковые поверхности туловища. Лицо у большей части больных свободно от высыпаний.
Из эффлоресценций наиболее часты воспалительные фолликулярные и ли- хеноидные папулы, эритематозно-инфильтративно-сквамозные и лихенифи- цированные очаги. Поражения кожи, в начале периода распространенные, в дальнейшем приобретают локализованный характер.
Поражения в складках сменяются диффузными изменениями кожи лица, шеи, верхней части туловища, верхних конечностей. На щеках они менее выражены, вовлекаются в процесс носогубной треугольник, кожа лба. Лишь у небольшой части больных сохраняются выраженные изменения локтевых и подколенных складок, локальные периоральные высыпания, очаги на кистях. Наиболее характерные высыпания — полигональные лихеноидные папулы, лихенифицированные очаги, экскориации.
Основным признаком атопического дерматита является зуд, который длительно сохраняется даже при исчезновении кожных поражений. Интенсивность зуда высокая, особенно при лихеноидной и пруригинозной формах, может приобретать характер биопсирующего зуда. В период островоспалительных высыпаний нередко появляются жжение, болезненность, сухость и стягивание кожи
У больных атопическим дерматитом закономерно обнаруживают функциональные нарушения нервной системы и вегетососудистую дистонию. Проявления респираторной атопии в виде астматического бронхита, атопического ринита, бронхиальной астмы отмечают почти у 25% больных. Поражения глаз (конъюнктивиты, двусторонняя «атопическая катаракта») относятся к проявлениям, имеющим связь с атопическим дерматитом. Характерными являются поражения ЖКТ в виде гипо- или гиперацидных состояний желудочной секреции, гастритов, дуоденитов, воспалительных заболеваний желчевыводящих путей, панкреатитов, дисбактериоза кишечника.
Диагностика. Диагноз, в подавляющем большинстве случаев, ставится на основании клинической картины заболевания. Для идентификации специфического триггера при атопическом дерматите используются кожные приктесты с различного рода аллергенами. У больных с обширным поражением кожи и выраженным белым дермографизмом вместо кожных тестов проводят тесты in vitro (RAST или ELISA — определение специфических ІдЕ-антител). Для оценки тяжести атопического дерматита и экспертизы инвалидности разработана система оценки клинических симптомов в баллах SCORAD (scoring of atopic dermatitis). В гемограмме больных наиболее часто встречается эозинофилия (6-10%). При биохимическом исследовании крови обнаруживается гипоальбуминемия, изменение глобулиновых фракций, повышение сиаловой кислоты, серомукоида, иногда — появление С-реактивного протеина. В иммунограмме больных содержание Т-лимфоцитов снижено за счет Т-супрессоров и Т-килле- ров, дисиммуноглобулинемия (увеличение содержания IgE и IgG, угнетение синтеза IgA), а также повышение уровня ЦИК.
Лечение атопического дерматита. Лечение больных атопическим дерматитом преследует основную цель — снижение готовности к аллергическим реакциям и устранение клинических симптомов поражения кожи. Весь комплекс лечебно-оздоровительных мероприятий, включающий организацию правильного режима и рационального питания ребенка, использование различных фармакологических препаратов, физиотерапевтических процедур; фито- и рефлексотерапии, санаторно- курортного лечения, можно обозначить в широком смысле как неспецифическую гипосенсибилизацию.
Больным следует принимать ванны с крахмалом, отрубями, специальными средствами (Триксера — смягчающие ванны, Экзомега — масло для душа). Мыло, гель должны иметь нейтральную pH. Необходимо контролировать температуру и влажность воздуха в квартире, регулярно проводить уборку жилья. Необходима санация очагов хронической бактериальной, вирусной и глистно- протозойной инфекции специфическими препаратами. Нормализация микрофлоры кишечника достигается назначением препаратов, содержащих микробы-антагонисты условно-патогенной флоры (бактисубтил, биоспорин, ацилакт, биобактон, бифидумбактерин, лактобактерин, бификол, линекс, прима- долюкс, лактофильтрум, хилак-форте, нормазе), средств с антибактериальной активностью (метронидазол, хпорхинольдол), нитрофурановых препаратов, фитотерапии (зверобой, тысячелистник, гранат, календула).
Коррекция процессов пищеварения и всасывания осуществляется использованием диетотерапии, желудочно-кишечных ферментов (ацидин-пепсин, абомин, пепсидил, панкреатин, холензим, панкурмен, мезим-форте), фитотерапия (полынь, бессмертник, зеленый чай), восстановление функций печени и коллоидного состояния желчи — правильным режимом питания, назначением гепатопротекторов (легалон, гепабене, эссенциале), пищевых волокон (пшеничные отруби, овсяные отвары), сорбентов (энтеросгель), минеральной воды. Коррекция патофизиологических и патохимических эффектов аллергических (иммунопатологических) реакций достигается антимедиаторной терапией (стабилизаторы мембран тучных клеток, блокаторы Нггистаминовых рецепторов), применением антиоксидантов и антигипоксантов (витамин Е, этимизол, димефосфон, ксидифон).
Свойствами предупреждать деструкцию тучных клеток и высвобождение медиаторов аллергии при длительном применении обладают интап (по 1 капсуле 4 раза в день на протяжении 3-4 нед. или в микроклизмах), Н1-гистаминолитик — кетотифен (задитен). Его назначают в возрасте от 6 мес. до 3 лет по 0,5 мг 2 раза в сутки; в возрасте более 3 лет — по 1 мг 2 раза в день с едой, максимальной продолжительностью не менее 2 мес.
Антигистаминные препараты используются для контроля зуда и аллергического воспаления кожи, их эффективность обусловлена важнейшей ролью гистамина в механизмах развития большинства клинических симптомов атопии.
Терапевтические мероприятия при тяжело протекающих и торпидных формах могут включать системные кортикостероиды. Предпочтительны метипред или триамцинолон из расчета суточной дозы 1-5 мг/кг (30-40 мг в сутки) с постепенной отменой. Существует и альтернирующий метод лечения — двойная суточная доза назначается через день.
При особой торпидности используется избирательный иммуносупрессор циклоспорин в виде капсул или раствора в дозе 5 мг/кг. Полезным при тяжелом АД может оказаться курс экстракорпоральной детоксикации, в частности, в виде плазмафереза.
В случаях неоднократного выявления изменений лабораторных показателей (иммунограммы), больным показана иммуномодулирующая терапия. Предпочтение следует отдавать препаратам с полипотентным механизмом действия: нуклеинат натрия, рибомунил, бронховакс, некоторым препаратам интерферонов (лейкинферон), таким средствам заместительной иммунотерапии, как титрованный донорский иммуноглобулин (противогриппозный, проти- востафилококковый), нативная плазма. Во всех остальных ситуациях для восстановления функциональной активности иммунокомпетентных клеток достаточно режима антигенного щажения, ликвидации синдрома эндогенной интоксикации, стимуляции неспецифической резистентности с использованием адаптогенов (дибазол, метилурацил, элеутерококк, китайский лимонник), некоторых методов физиотерапии (общее УФО, УВЧ на грудину или солнечное сплетение).
Топическая терапия при атопическом дерматите предусматривает: подавление или устранение зуда, элиминацию биологически активных веществ и деструктивных субстанций, устранение бактериальной и микотической инфекции, улучшение микроциркуляции и метаболизма в очагах поражения, устранение лихенификации, уменьшение или ликвидацию сухости.
При лечении острой стадии заболевания применяются примочки и влажно- высыхающие повязки, кремы и гели с витаминами А, Е, кортикостероидные топические средства со слабой или умеренной активностью, при этом следует помнить, что максимально возможная поверхность для лечения стероидами — не более 20% поверхности тела и длительность применения у детей — 14 дней с возвратом к индифферентной терапии; разводить кортикостероидные средства и не использовать их под окклюзионные повязки; не использовать в области губ, мошонки, опрелостей.
Для детей с аллергодерматозами наиболее безопасны на короткий период стероиды, содержащие мометазона фуроат, метилпреднизолона ацепонат, гидрокортизона бутират (элоком, адвантан, локоид) и нестероидный крем элидел. При осложнении бактериальной или грибковой инфекцией — растворы анилиновых красителей, кремы или мази пимафукорт, тридерм, триакутан, бактробан, банеоцин, фузидин и проч. На стадии хронического процесса используют препараты нафталана, дегтя, фенистил-гель, псило-бальзам, актовегин, солкосерил, аппликации озокерита, парафина, локальные ванны для рук, ног, сапропели, крем ДАРДИЯ (Липо Бальзам), мягкие шампуни серии Freederm, средства для ванн триксера, экзомега. После ванны, душа, сауны рекомендуются смягчающие кремы, содержащие полиненасыщенные жирные кислоты, витамин Е (крем и молочко экзомега), кремы триксера, бепантен.
Санаторно-курортное лечение: SPA-курорты.
Профилактика атопического дерматита. Первичная профилактика, направленная на предупреждение развития первых проявлений атопического дерматита у детей раннего возраста, должна проводиться у беременных из группы риска (имеющих семейную предрасположенность к атопии или больных атопическим дерматитом). Вторичная профилактика предусматривает своевременную диагностику нарушений иммунной и нервной систем, заболеваний органов пищеварения, их адекватную терапию.
medpuls.net
