Сумамед от бронхита для детей: Антибиотик Сумамед | Отзывы покупателей
Антибиотик Сумамед — «Отзыв провизора. Когда принимать антибиотик? Сумамед. Сильный и щадящий, действующий быстро и при любой проблеме. Почему надо сказать «нет» аналогам?И почему я рекомендую его детям »
Добрый день!
Если говорить откровенно, то я совсем не сторонник экономии на препаратах. Лучше один раз пролечиться с минимум побочных, чем потом постоянно лечиться дешевым, до конца не выходя из состояния болезни.
Особенно я не сторонник экономии на антибиотиках. Вы можете купить дешевые отхаркивающие, не покупать препараты для профилактики антибиотика, но САМ АНТИБИОТИК должен быть качественным. В идеале — оригинальным. Но начну я с другого.
Когда нужно принимать антибиотик?
Я знаю, что в России все антибиотики продаются по рецепту. У нас в Беларуси есть некоторые, которые можно приобрести без рецепта (те, в составе которых, например, амоксициллин или доксициклин). Когда ко мне приходят с просьбой продать антибиотик, то первое, что я спрашиваю — назначил ли Вам его врач? Если ответ утвердительный, то отпадают все вопросы, если нет, то я начинаю расспрос.
1. Сколько держится температура? Обычно температура держится дня 3, после чего должна спадать. Конечно, это при условии постельного режима (или отдыха), обильного питья, приема отхаркивающих и противовирусных (можно ставить кое-где вместо «и» или). Т.е. суть проста. Человек лечится, температура не спадает. Это значит одно. Где-то в организме идет воспалительный процесс, с которым без антибиотика трудно справиться. Однако не стоит забывать об индивидуальных особенностях организма. У некоторых людей температура обычно держится 4 или даже 5 дней вне зависимости от тяжести заболевания. Такое вполне может быть.И для этих людей нужно смотреть колебания температуры уже после этих 4-5 дней.
2. Гаймориты, синуситы и прочая пакость. У многих людей они возникают практически постоянно. Человек уже и без врача в состоянии определить, есть ли он у него. Постоянный чих, характерные серозные выделения из слизистой, заложенность в пазухах. головная боль, отдающая к вискам. Тут однозначно нужен антибиотик. Конечно, если у человека это впервые и он подозревает, то пускай топает к врачу.
Конечно, если у человека это впервые и он подозревает, то пускай топает к врачу.
3. Затяжной кашель. Тут очень спорная ситуация. Всем людям, у которых кашель больше 5-7 дней я настойчиво советую сходить к врачу или сделать флюорографию. Даже подсказываю где. Рядом с моей аптекой можно зайти в специализированное заведение, где можно сделать флюро за 1,5 доллара. Если уж они не хотят и вот просто «дайте антибиотик», то тут я ничего не могу сделать — отказать в продаже безрецептурного препарата на основе собственных соображений нельзя.
Но по некоторым признакам все же можно определить, что антибиотик нужен. Это мокрота выраженного желтого цвета или с зеленоватым оттенком. Возможно, густая. Кашель ночью. Хрипы, которые можно услышать при резком вздохе. Незначительная  Но еще более серьезным основанием для похода к врачу. Сейчас очень много случаев пневмоний, есть ли нужда так основательно рисковать своим здоровьем? А вот если видите в мокроте прожилки крови или боль в спине или груди выраженная — однозначное направление на флюорографию и на прием к врачу. С таким не шутят!
Но еще более серьезным основанием для похода к врачу. Сейчас очень много случаев пневмоний, есть ли нужда так основательно рисковать своим здоровьем? А вот если видите в мокроте прожилки крови или боль в спине или груди выраженная — однозначное направление на флюорографию и на прием к врачу. С таким не шутят!
4. Ангина. Сейчас, конечно, хватает вирусов, которые «маскируются» под ангину, но по особым симптомам узнать ангину все же можно. Те, кто не впервые болеет ангиной, могут ее узнать. К тому, безрецептурный амоксициллин является антибиотиком 1-ого ряда( 1 ряд препарата — тот, который назначают при том или ином заболевании в первую очередь) при лечении ангины.
Вывод. Все антибиотики желательно принимать с назначения врача. Конечно, есть случаи, когда можно принимать антибиотик с консультации провизора или фармацевта, но… Но здесь одно большое «но». Нет ваших анализов, нет вашей медицинской карточки, этот антибиотик Вы принимаете буквально на авось.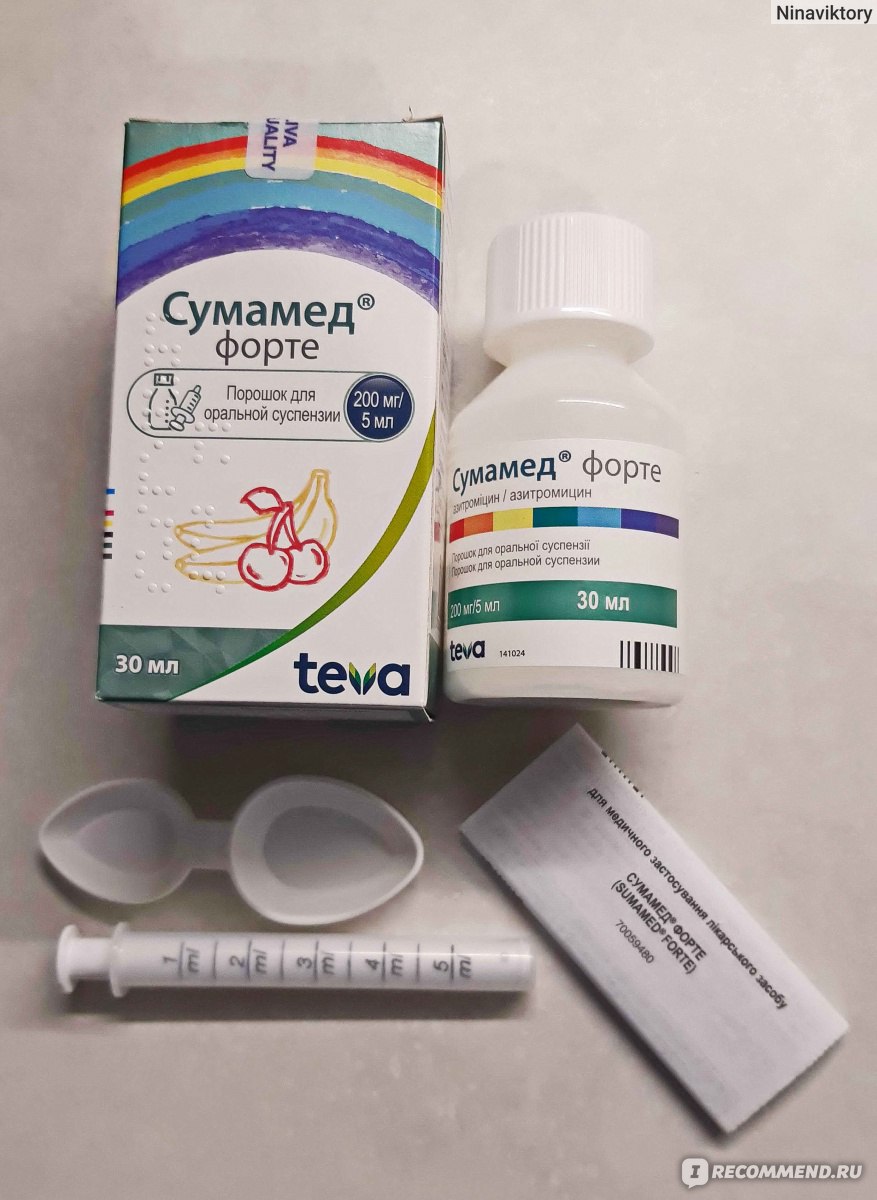
Даже я, будучи провизором, человеком, которые имеет непосредственное отношение к медицине, не всегда решаюсь принимать антибиотик без врача. Мне нужно сходить к врачу, послушаться, есть ли в легких хрипы, жесткое ли дыхание. И только после этого принять решение о том, нужен ли мне антибиотик. И если врач говорит, что можно попробовать ОБОЙТИСЬ, то я лучше обойдусь без антибиотика.
Почему не стоит покупать синонимы сумамеда?
Действующее вещество сумамеда — азитромицин. Наверняка, Вы встречали много аналогов — азикар, азитромицин, азинорт, азипол и т.п. Однако сумамед — оригинальный препарат, и это о многом говорит.
И самое главное, что нужно понимать! В отличие от перечисленных аналогов, именно с сумамедом проводили клинические испытания на людях. Для аналогов просто проводили опыты в лабораториях на соответствие определенным показателям.
Если говорить прямо. Представьте, что антибиотик — это нанятый солдат по уничтожению бактерий в новенькой форме. Так вот, оригинальный препарат — это профессионал, а первый синоним этого препарата — это новобранец, второй — физрук из гимназии, а третий вообще в руках держал только скалку и черпак, ибо повар. А на всех одна форма, одно оружие. Как думаете, кто окажется эффективнее? Конечно, новобранец справится, правда, дополнительно может частично порушить здание. Физрук тоже что-нибудь да сделает. А вот с поваром беда — навряд ли он справится.
Поэтому и бывает, что антибиотики помогают слабо или с большим количеством побочек. Поэтому я все же предпочту заплатить больше, но получить профессионала.
Особенности приема
Обычно лечение рекомендовано начинать с амоксициллина — антибиотика первого ряда. Азитромицин относят ко второму ряду. Я начинаю принимать именно азитромицин, потому что аллергик и на пенициллиновые антибиотики у меня сильнейшая аллергия.
У сумамеда есть формы для детей и для взрослых. Я беру обычно 3 таблетки по 500 мг. Этого достаточно, чтобы справиться с бронхитом или гайморитом.
Упаковка фирменная, с гарантией от вскрытия.
Внутри 3 таблетки не самого большого размера.
Плюс таблеток — на них прописана дозировка и фирма. С одной стороны — гарантия, что не перепутаете, с другой, частичная гарантия, что препарат оригинальный. Так и должно быть в идеале:
В инструкции Вам четко написано — вне зависимости от приема пищи. Но в других есть рекомендации либо за час после еды, либо через два часа после. От себя добавлю — после еды всегда лучше. Каким бы крепким не был ваш желудок, если выпьете антибиотик после еды, он скажет Вам спасибо отсутствием гастрита или побочек.
Запивайте простой водой. Нет чаю, кофе, соку и даже минералке. Это АНТИБИОТИК.
Нет чаю, кофе, соку и даже минералке. Это АНТИБИОТИК.
Забудьте про алкоголь.
Полный анализ приема при разных заболеваниях
Бронхит
Сейчас у меня был незапущенный бронхит, жесткое дыхание, прослушивались хрипы. Флюорография была хорошая. Принимала вечером в 19 часов.
1 день приема. Часа через 4 после приема стало легче дышать, не хотелось заходиться в кашле каждый раз, когда вдыхала чуть поглубже. К утру появилась стандартная белая мокрота вместо сгустков желтой (однако и они встречались).Температура с 38 упала до стабильной 37,2. Меньше болела голова. Аппетита пока не было. Побочных не проявилось.
2 день приема. Сгустки мокроты стали светлее. Продуктивный кашель (с выделением мокроты) стал чаще. К утру кашель превратился в достаточно редкий — кашляла раз в час с откашливанием.Температура пришла практически в норму — 36,8 и 36, 7 попеременно. Появился аппетит, смогла поесть, потому что хотела, а не потому что надо.
3 день приема. Практически исчезли плотные сгустки мокроты. Кашель прошел, температура в норме. Общее самочувствие отличное в сравнении с предыдущими днями — не болит голова, кашель остаточный, температуры нет. Живот немножко поболел, но скорее из-за того, что я много съела в сравнении с предыдущими днями голодовки.
Действует. Если у Вас бронхит запущенный ( Вы не начали лечить его вовремя). Если есть какие-то пятна на флюро, то принимаете не 3 дня по 500 мг, а 6 дней по 500 мг. Но это уже врач поможет. Препарат-то рецептурный.
Синусит
У меня эта беда проявилась лишь однажды. Поэтому, скажу одну вещь. В первый раз его главное вылечить до самого конца. И тогда проблем в будущем не будет. Антибиотик при синусите — основное, но не единственное средство. Но об этом позже.
1 день приема. Практически ничего не ощущала — голова из-за носа так же раскалывалась, температура чуть сбилась — но не более. Заложенность ужасная, не помогают никакие капли — нос не дышит.
Заложенность ужасная, не помогают никакие капли — нос не дышит.
2 день приема. Прошла голова. Температура стала адекватной. Нос не дышит, но капли хоть немного помогают.
3 день приема. Пошла к врачу, сделала снимок. Синусит больше не показывал, только остаточное воспаление. С некоторыми проблемами, но нос дышит.
Долечивала уже каплями с антибиотиками и прочим.
Вывод
Высокоэффективный антибиотик. Минимум побочных реакций, пить надо всего три дня. Один минус — основательная стоимость. Но я готова платить за свое здоровье.
инструкция, аналоги, показания, цена — Ютека
Сумамед — это антибиотик, который выпускается двумя европейскими производителями: хорватской компанией Pliva Hrvatska и израильской фирмой Teva.
Сумамед относится к сильнодействующим препаратам, поэтому назначается только по рецепту и может выписываться в форме таблеток, капсул или суспензии.
Сумамед подходит для лечения пневмонии, бронхита, болезни Лайма, тонзиллита, фарингита, отита и прочих заболеваний, связанных с дыхательными путями и ЛОР-органами. Также его эффективно использовать при заболеваниях кожи, мочеполовой системы и комбинированных затяжных инфекциях, сопровождающихся гнойными выделениями. Лечение может назначаться детям и взрослым.
Также его эффективно использовать при заболеваниях кожи, мочеполовой системы и комбинированных затяжных инфекциях, сопровождающихся гнойными выделениями. Лечение может назначаться детям и взрослым.
Далее мы поговорим о том, как пользоваться сумамедом: сначала разберем инструкцию, после ответим на часто задаваемые вопросы и расскажем об аналогах. Вы получите общее представление о том, что это за препарат и как им пользоваться.
Если останутся вопросы — уточняйте их у своего лечащего врача.
Рисунок 1 — Инфорграфика об антибиотиках
Инструкция
Посетите лечащего доктора
Чувствуете недомогание — обращайтесь к врачу. Самостоятельно приобретать сумамед запрещается: если у организма будет несовместимость с препаратом, то его произвольное применение может навредить здоровью. Поэтому без рецепта врача пользоваться данной инструкцией можно только в ознакомительных целях.
Приобретите препарат
Здесь обратите внимание на форму и количество препарата, которое вам понадобится для лечения. Когда получите товар, обратите внимание на срок годности, целостность упаковки и наличие защитных наклеек на торцах упаковки. Если упаковка будет выглядеть непрезентабельно — запросите сертификат качества и убедитесь, что перед вами не подделка.
Когда получите товар, обратите внимание на срок годности, целостность упаковки и наличие защитных наклеек на торцах упаковки. Если упаковка будет выглядеть непрезентабельно — запросите сертификат качества и убедитесь, что перед вами не подделка.
Рисунок 2 — Памятка: как проверить подлинность любого лекарственного препарата.
Изучите противопоказания
Купили препарат — выполните распаковку, откройте инструкцию и найдите раздел «Противопоказания». Посмотрите, кому применять сумамед не рекомендовано, а кому противопоказано. Важно всегда смотреть ту инструкцию, которая идет в паре в продаваемым препаратом — лекарственные формулы периодически обновляются, поэтому информация из интернета и с других упаковок может быть неактуальной.
Если вы входите в группу риска — обратитесь к лечащему врачу за дополнительной консультацией. Пока не получите ответ — не принимайте препарат. Если доктор не учел противопоказания на осмотре, то ваша информация поможет скорректировать курс лечения. Если все в порядке — переходите к приему лекарства.
Если все в порядке — переходите к приему лекарства.
Примите препарат
Прочтите назначенный рецепт и инструкцию от производителя. Если будут вопросы по схеме приема и дозировке — обращайтесь к лечащему врачу за дополнительной консультацией. Если все понятно — переходите к приему препарата.
Видео 1 — Официальная инструкция к препарату сумамед (таблетки)
Видео 2 — Официальная инструкция к препарату сумамед (суспензия)
Оцените результат
Если назначенное лечение помогло — препарат выполнил свою функцию и больше ничего делать не нужно. Если сумамед использован не полностью — пересмотрите инструкцию и найдите пункт, описывающий условия хранения лекарства. В будущем сохраненный препарат можно использовать только при следующих условиях: вы получите новый рецепт от врача, будут соблюдены условия хранения и не пройдет срок годности. В остальных случаях неиспользованный сумамед утилизируется.
В остальных случаях неиспользованный сумамед утилизируется.
Если сумамед не помог или ваше состояние ухудшилось — нужно повторно записываться к лечащему врачу на осмотр. Самостоятельно продлевать лечение и принимать сумамед категорически запрещается — причина недомогания может быть связана со множеством факторов и без квалифицированной помощи не разобраться.
FAQ
Если вас беспокоит какой-то вопрос, то задавайте его врачу и не ищите ответы в интернете — ваше лечение назначается исходя из индивидуальных особенностей организма, поэтому советы посторонних людей могут навредить. В этом разделе мы собрали ответы на популярные вопросы, касающиеся сумамеда. Эта информация публикуется в ознакомительных целях и должна уточняться у лечащего доктора.
Если лечащий врач отказывается вас консультировать или проявляет халатность в работе, то вы можете пожаловаться на него главврачу, в местный департамент здравоохранения, в полицию, в прокуратуру или в суд. Если вас попросят составить жалобу, то готовится она в произвольной форме с указанием всех контактных данных, обстоятельств дела и подтверждающих документов.
Если вас попросят составить жалобу, то готовится она в произвольной форме с указанием всех контактных данных, обстоятельств дела и подтверждающих документов.
К какой группе антибиотиков относится сумамед?
Сумамед относится к макролидам, входит в подгруппу азалидов и создан на основе азитромицина — это современный антибиотик, который устойчив к желудочному соку и легко проникает внутрь клеток организма. Высокая пропускная способность дополняется специальной молекулярной формулой, позволяющей препарату проникать через клеточные мембраны, быстро находить очаги воспаления и оставлять в крови небольшую концентрацию вещества. На месте воспаления азитромицин замедляет развитие вирусных бактерий и при должной концентрации оказывает бактерицидный эффект — подавляет появление новых микроорганизмов.
Рисунок 3 — Сумамед — это препарат, который умеет обезвреживать и останавливать вирусные бактерии
Как принимать сумамед: до еды или после?
Сумамед можно принимать в любой последовательности: до или после еды. Если это делать до еды, то схема будет такой: прием препарата → перерыв в 1 час или больше → прием пищи. Если это делать после еды, то схема будет другой: прием пищи → перерыв в 2 часа или больше → прием препарата.
Если это делать до еды, то схема будет такой: прием препарата → перерыв в 1 час или больше → прием пищи. Если это делать после еды, то схема будет другой: прием пищи → перерыв в 2 часа или больше → прием препарата.
Сколько раз в день принимать сумамед?
Рекомендованная доза для взрослого человека без специальных указаний врача — 1 раз в день. В случае пропуска схема действия будет такой: нужно как можно раньше принять новую дозу и для всех последующих приемов выдерживать паузу в 24 часа.
|
1 день |
2 день |
3 день |
Последующие дни |
|
Прием |
Пропуск |
Прием в 13.00 |
Прием в 13.00. Раньше нельзя |
В случае передозировки возможна рвота, тошнота, нарушение стула или временные проблемы со слухом. Специального лечения здесь не требуется и достаточно симптоматической терапии: если тошнит — пейте больше жидкости и т.д.
Специального лечения здесь не требуется и достаточно симптоматической терапии: если тошнит — пейте больше жидкости и т.д.
Сколько дней принимать сумамед?
Сумамед относится к той группе лекарственных препаратов, которые продаются по рецепту врача. Поэтому только врач может определить длительность лечения и указать количество дней, на протяжении которых необходимо принимать препарат.
Сколько дней пить сумамед взрослому?
Для каждого взрослого курс лечения определяется в индивидуальном порядке после осмотра врача — все зависит от степени заболевания и общего состояния пациента. Например, при бронхите стандартный курс лечения составляет 3 дня и за это время больной должен принять 1,5 грамм азитромицина. Если инфекционное заболевание связано с мочевыводящими путями, то 1 грамм азитромицина вводится за один раз. Когда у пациента наблюдаются признаки клещевого боррелиоза, то курс лечения может растянутся на 5 дней — в первые сутки принимается 1 грамм азитромицина, а во все последующие дни доза снижается до 500 миллиграмм.
Можно ли пить сумамед больше 3 дней?
Можно, однако для этого необходимо согласие лечащего врача. Некоторым пациентам стандартного трехдневного курса недостаточно — организм не успевает нормализоваться и улучшить показатели крови. В этом случае врачи продлевают курс лечения еще на три дня и в итоге получается так, что пациент принимает сумамед на протяжении шести дней. При этом важно знать, что некоторые медики с таким подходом категорически не согласны. Они считают, что если в назначенные сроки положительная динамика не наблюдается, то стоит заменить препарат. Поэтому здесь пациент должен самостоятельно решить, что делать дальше: продлить курс лечения и довериться лечащему врачу или искать нового доктора.
Через сколько действует сумамед?
Обычно препарат начинает действовать в течение 30-60 минут после приема. На первый ощутимый эффект в плане улучшения самочувствия можно рассчитывать спустя сутки. Однако это общее правило, которые может меняться в зависимости от состояния болезни и индивидуальных особенностей организма. При этом важно понимать, что если самочувствие улучшилось, а курс лечения не завершен, то прием препарата без предварительной консультации врача прекращать нельзя.
При этом важно понимать, что если самочувствие улучшилось, а курс лечения не завершен, то прием препарата без предварительной консультации врача прекращать нельзя.
Сколько действует сумамед?
Концентрация препарата в организме может сохранятся до семи дней после завершения лечения и приема последней дозы. Если вам нужны точные данные — обратитесь к лечащему врачу. Он назначит анализы, которые дадут точный ответ.
Можно ли давать сумамед ребенку?
Детям до шести месяцев прием сумамеда противопоказан. Во всех остальных случаях необходимо согласие и рецепт лечащего врача. Если малышу не исполнилось три года, то назначают порошковую смесь сумамеда, которая размешивается с водой до состояния однородной суспензии. С трехлетнего возраста допускается использование таблеток: можно глотать целиком или растворить препарат в 50 милилитрах воды (кипяченой или дистилированной). При этом нужно помнить о дозировке, которая рассчитывается исходя из массы тела, характера заболевания и указаний врача. Точные данные по соотношению между массой тела и необходимым количеством препарата нужно перепроверять в инструкции от производителя, которая идет в упаковке с порошком или таблетками.
Точные данные по соотношению между массой тела и необходимым количеством препарата нужно перепроверять в инструкции от производителя, которая идет в упаковке с порошком или таблетками.
Сколько дней принимать сумамед ребенку?
Курс лечения и дозировки может прописать только доктор, однако в большинстве случаев на прием отводится 3 дня.
Можно ли пить просроченный сумамед?
Нет. У препарата есть установленный срок годности, который нарушать нельзя: для порошков — это два года, а для таблеток — три года. Всегда учитывайте этот момент перед планированием лечения и не забывайте, что срок годности лекарственных препаратов нужно проверять в аптеке на кассе. В противном случае вы не вернете просрочку и не сможете воспользоваться купленным препаратом.
Рисунок 4 — Никогда не используйте просроченные лекарства
Можно ли пить сумамед при ангине?
Если причина возникновения ангины связана со стрептококковыми инфекциями, то сумамед не назначается. Во всех остальных случаях пользоваться препаратом можно, если организм показал нормальную реакцию на тестовые мазки, которые врач берет перед составлением рецепта лечения.
Во всех остальных случаях пользоваться препаратом можно, если организм показал нормальную реакцию на тестовые мазки, которые врач берет перед составлением рецепта лечения.
Если принимаю сумамед, то можно ли пить алкоголь?
Сумамед — это сложный антибиотик, который каждый организм переносит по своему и для крепкой иммунной системы его применение может пройти незамеченным. Однако даже для крепкого организма совместный прием сумамеда с любым спиртным напитком чреват двумя негативными последствиями:
- Алкоголь может полностью нейтрализовать действие препарата и все лечения окажется неэффективным.
- Алкоголь будет провоцировать появление побочных эффектов и в первую очередь от этого пострадает печень. Если печень не справится с нагрузкой, то может развиться острая интоксикация или токсический гепатит.
Поэтому если принимаете сумамед, то алкоголь в любом количестве противопоказан.
Рисунок 5 — Не совмещайте алкоголь и антибиотики
Если принимал сумамед, то через сколько можно пить алкоголь?
Нужно запомнить дату приема последней дозы и отсчитать семь дней — этот тот период, на протяжении которого часть препарата может храниться в крови и принимать алкоголь нежелательно. Закончили принимать препарат → выдержали семидневную паузу → убедились в отсутствие других медицинских противопоказаний → начиная с восьмого дня можете употреблять алкоголь.
Закончили принимать препарат → выдержали семидневную паузу → убедились в отсутствие других медицинских противопоказаний → начиная с восьмого дня можете употреблять алкоголь.
Можно ли принимать сумамед после амоксиклава?
Если после прохождения назначенного курса лечения один антибиотик не помог, то его можно заменить на другой. Чтобы провести замену, лечащему доктору нужно выполнить несколько действий: посмотреть на результат приема первого антибиотика → подобрать новый антибиотик → исследовать реакцию организма на новый антибиотик → выписать рецепт и назначить лечение. Отсюда делаем вывод, что принимать сумамед после амоксиклава можно только с разрешения врача.
Аналоги
Сумамед относится к антибиотикам широкого спектра действия, где существует множество других препаратов с похожими фармакологическими характеристиками. Пользоваться этими аналогами можно только в том случае, если их одобрил лечащий врач. Ниже мы сравним сумамед с другими антибиотиками, которые больше остальных подходят под его свойства. Вы сможете посмотреть основные различия между препаратами и по этим различиям выбрать оптимальный антибиотик.
Вы сможете посмотреть основные различия между препаратами и по этим различиям выбрать оптимальный антибиотик.
Рисунок 6 — Самолечение опасно для жизни
Что лучше Вильпрафен или Сумамед?
|
Вильпрафен |
Сумамед |
|
Активное вещество: джозамицин |
Активное вещество: азитромицин |
|
Курс лечения может доходить до десяти дней, в течение которых препарат нужно принимать два-три раза в сутки |
Стандартный курс лечения: нужно принимать по одной таблетке три раза в день |
|
В отличие от сумамеда обладает меньшим количеством побочных эффектов, поэтому больше подходит для лечения детей |
По сравнению с вильпрафеном обладает большим количеством противопоказаний и побочных эффектов |
Что лучше для ребенка: Флемоксин Солютаб или Сумамед?
|
Флемоксин Солютаб |
Сумамед |
|
Активное вещество: амоксициллин |
Активное вещество: азитромицин |
|
Курс лечения занимает пять-десять дней. |
Стандартный курс лечения: нужно принимать по одной таблетке три раза в день |
|
По сравнению с сумамедом обладает меньшим числом побочных эффектов, легче переносится и применяется для лечения более тяжелых заболеваний |
Хуже переносится и может проявлять больше побочных реакций |
Что лучше: Аугментин или Сумамед?
|
Аугментин |
Сумамед |
|
Активные вещества: амоксициллин и клавулановая кислота |
Активное вещество: азитромицин |
|
Антибиотик нужно принимать на протяжении пяти суток с интервалом в 12 часов между дозами. |
Стандартный курс лечения: нужно принимать по одной таблетке три раза в день |
|
Быстрее выводится и меньше задерживается в организме. Если использовать вариант с суспензией, то подходит для лечения детей начиная с трехмесячного возраста |
Дольше выводится, хуже переносится, показывает больше побочных реакций и может приниматься детьми только с шестимесячного возраста |
Что лучше: Клацид или Сумамед?
|
Клацид |
Сумамед |
|
Активное вещество: кларитромицин |
Активное вещество: азитромицин |
|
Препарат нужно принимать два раза в день на протяжении пяти-пятнадцати суток |
Стандартный курс лечения: нужно принимать по одной таблетке три раза в день |
|
Быстрее выводится и легче переносится |
Больше побочных реакции и более длительный цикл выведения из организма |
Что лучше: Супракс или Сумамед?
|
Супракс |
Сумамед |
|
Активное вещество: цефиксим |
Активное вещество: азитромицин |
|
Препарат нужно принимать дважды в день на протяжении семи-десяти суток |
Стандартный курс лечения: нужно принимать по одной таблетке три раза в день |
|
Быстрее выводится из организма, меньше задерживается в крови и обладает большим количеством вероятных побочных эффектов. |
Дольше выводится, обладает меньшим числом побочных реакций и практически всегда используется как самостоятельный препарат |
Что лучше: Сумамед или Амоксиклав?
|
Амоксиклав |
Сумамед |
|
Активное вещество: амоксициллин и клавулановая кислота |
Активное вещество: азитромицин |
|
Препарат нужно принимать один-три раза в день на протяжении пяти-четырнадцати суток |
Стандартный курс лечения: нужно принимать по одной таблетке три раза в день |
|
Быстрее выводится, дает меньше побочных эффектов и в таблетированной форме противопоказан детям до двенадцати лет. |
Дольше задерживается в организме, хуже переносится и разрешен детям достигших шестимесячного возраста |
Что лучше: Сумамед или Азитромицин?
|
Азитромицин |
Сумамед |
|
Активное вещество: азитромицин |
Активное вещество: азитромицин |
|
Стандартный курс лечения: нужно принимать по одной таблетке три раза в день |
Стандартный курс лечения: нужно принимать по одной таблетке три раза в день |
|
Азитромицин — это лекарственная копия (дженерик) сумамеда. Препарат практически полностью копирует сумамед по степени эффективности, количеству побочных реакций, курсу лечения и составу. |
Используются качественные сопутствующие вещества, помогающие лучше всасываться в организм и проводить более эффективное лечение. Отсюда меньше побочных реакций и лучшая переносимость у детей. Всегда будет стоить дороже азитромицина |
Запомнить
- Сумамед — это популярный антибиотик, который помогает в короткий срок вылечится от многих инфекционных заболеваний.
- Сумамед — это рецептурный препарат, который может назначить только лечащий врач. Прием без рецепта опасен для здоровья детей и взрослых.
- У сумамеда есть множество аналогов, большинство из которых легче переносятся, но требуют более длительного приема.
Что еще важно знать
Часто врачи назначают антибиотики в профилактических целях для противодействия вирусным инфекциям — на процесс выздоровления это не влияет, но детскому организму может навредить. Это делается из-за того, что родители заболевших детей пользуются народными методами лечения и провоцируют развитие серьезных заболеваний. Чтобы всего этого избежать — посмотрите следующие видео. В них Доктор Комаровский рассказывает, какие методы самолечения недопустимы в домашних условиях и при каких признаках записываться к врачу на консультацию.
Это делается из-за того, что родители заболевших детей пользуются народными методами лечения и провоцируют развитие серьезных заболеваний. Чтобы всего этого избежать — посмотрите следующие видео. В них Доктор Комаровский рассказывает, какие методы самолечения недопустимы в домашних условиях и при каких признаках записываться к врачу на консультацию.
Видео 3 — Доктор Комаровский о целесообразности назначения антибиотиков
Видео 4 — Доктор Комаровский о правилах приемах антибиотиков
Применение азитромицина (Сумамеда) в лечении внебольничных бронхитов и пневмоний у детей
Авторы: А.Н. Грацианская, кафедра клинической фармакологии Российского государственного медицинского университета, г. Москва
Москва
Инфекции дыхательных путей являются наиболее частой патологией в
человеческой популяции, у детей же острые респираторные заболевания составляют
до 90% всех случаев инфекционной заболеваемости [1].
В основном респираторные инфекции относятся к внебольничным и являются частой
причиной госпитализации, а также возникновения хронических воспалительных
заболеваний при неадекватном лечении в амбулаторных условиях. Бактериальные
инфекции респираторного тракта занимают ведущее место среди всех диагностируемых
инфекционных процессов, поэтому основным компонентом лечения при заболеваниях
органов дыхания является антибиотикотерапия.
В этиологии внебольничных, то есть развившихся в обычных условиях жизни
ребенка, бронхитов и пневмоний принимает участие довольно большой спектр
возбудителей. В настоящее время в зависимости от характера клинических
проявлений внебольничные бронхиты и пневмонии принято делить на типичные и
атипичные.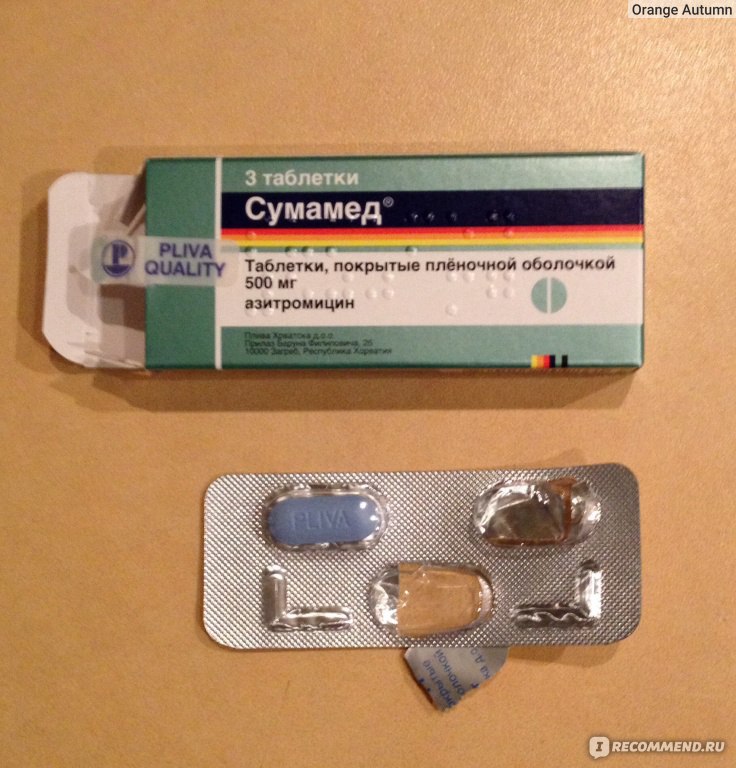
Для типично протекающего заболевания характерно острое начало с выраженной
лихорадочной реакцией, интоксикацией, кашлем и выраженными физикальными
проявлениями, что обычно обусловлено присутствием пневмококка (Streptococcus
pneumoniae), моракселлы (Moraxella catarrhalis) и гемофильной палочки (Haemophilus
influenzae).
Для атипичного течения болезни характерно малосимптомное подострое начало, с
нормальной или субфебрильной температурой, отсутствием интоксикации. Наиболее
типичным симптомом является сухой непродуктивный навязчивый кашель. Причинами
атипичных внебольничных респираторных инфекций являются хламидия (Chlamydia
pneumoniae) и микоплазма (Mycoplasma pneumoniae) [2-4]. Очевидно, этиологическая
значимость хламидий (Chlamydia pneumonia) и микоплазм (Mycoplasma pneumoniae),
являющихся внутриклеточными возбудителями инфекций, значительно выше, чем
предполагалось ранее. Микоплазменная и хламидийная этиология бронхита и
пневмонии у детей в настоящее время может составлять от 25 до 40%, причем она
наиболее высока в первый год жизни и после 10 лет [3, 4]. Особенностью
внутриклеточных возбудителей является их нечувствительность к традиционной
антибактериальной терапии, поэтому микоплазменные и хламидийные инфекции нередко
приобретают затяжное или рецидивирующее течение.
Особенностью
внутриклеточных возбудителей является их нечувствительность к традиционной
антибактериальной терапии, поэтому микоплазменные и хламидийные инфекции нередко
приобретают затяжное или рецидивирующее течение.
Показанием к назначению антибиотиков при респираторном заболевании следует
считать клинические признаки, указывающие на бактериальную природу
воспалительного процесса (слизисто-гнойный и гнойный характер мокроты) в
совокупности с выраженной интоксикацией и длительной гипертермией (более 3
дней). Затяжное течение заболевания, особенно при подозрении на внутриклеточную
природу возбудителя, также является показанием к проведению антибактериальной
терапии.
Наиболее широко при лечении инфекций дыхательных путей в педиатрической практике
в настоящее время используются антибиотики, принадлежащие к группам
пенициллинов, цефалоспоринов и макролидов.
Полусинтетические пенициллины широкого спектра действия (амоксициллин,
ко-амоксиклав) и цефалоспорины II поколения (цефаклор, цефуроксим аксетил)
эффективны против наиболее вероятных возбудителей внебольничных бронхитов и
пневмоний (S. pneumoniae, H. influenzae, M. catarrhalis), относятся к наиболее
без-опасным группам антибиотиков и все имеют пероральные формы. При типичной
картине заболевания (высокая температура, интоксикация, кашель, выраженные
физикальные изменения в легких) они рассматриваются в качестве препаратов
выбора.
pneumoniae, H. influenzae, M. catarrhalis), относятся к наиболее
без-опасным группам антибиотиков и все имеют пероральные формы. При типичной
картине заболевания (высокая температура, интоксикация, кашель, выраженные
физикальные изменения в легких) они рассматриваются в качестве препаратов
выбора.
Вместе с тем, как и все β-лактамные антибиотики, пенициллины и цефалоспорины не
оказывают воздействия на внутриклеточных возбудителей (хламидии, микоплазмы) и
чаще, чем антибиотики других групп, вызывают аллергические реакции [5], поэтому
со-временные макролиды при лечении внебольничных инфекций дыхательных путей
составляют им серьезную конкуренцию.
При атипичных проявлениях болезни (нормальная или субфебрильная температура,
отсутствие отчетливой интоксикации и одышки, невыразительность физикальных
данных при наличии упорного, сухого или непродуктивного коклюшеподобного
навязчивого кашля) препаратами выбора являются макролиды.
Первый антибиотик группы макролидов – эритромицин – был синтезирован в 1952 г. и
по настоящий день широко применяется в клинической практике для лечения инфекций
дыхательных путей, кожи и мягких тканей. Макролидные антибиотики в течение
нескольких десятилетий были представлены в клинике только эритромицином и
синтезированными несколько позднее олеандомицином (утратившим к настоящему
времени свое клиническое значение) и спирамицином. Широкое применение
эритромицина быстро привело к появлению эритромицинустойчивых штаммов
стафилококка, что в сочетании с сообщениями о плохой биодоступности препарата
из-за инактивации в кислой среде желудка обусловило снижение к нему интереса
врачей. В 70-80-х годах ХХ века резко возросло внимание к макролидам, что было
обусловлено интенсивным изучением роли внутриклеточных возбудителей заболеваний,
а также открытием хеликобактерной (Helicobacter pylori) инфекции. Одновременно
увеличение числа штаммов микроорганизмов, продуцирующих β-лактамазы, привело к
снижению активности «традиционных» пенициллинов. Все это стимулировало
разработку и внедрение в клиническую практику новых макролидных антибиотиков с
улучшенными (по сравнению с эритромицином) микробиологическими и
фармакокинетическими параметрами, а также лучшей переносимостью. Для макролидов
наступил период «возрождения» – особенно в педиатрической практике, где они
завоевали признание из-за высокой эффективности, безопасности и удобства
применения [6].
Все это стимулировало
разработку и внедрение в клиническую практику новых макролидных антибиотиков с
улучшенными (по сравнению с эритромицином) микробиологическими и
фармакокинетическими параметрами, а также лучшей переносимостью. Для макролидов
наступил период «возрождения» – особенно в педиатрической практике, где они
завоевали признание из-за высокой эффективности, безопасности и удобства
применения [6].
Одним из привлекательнейших представителей группы макролидов, с точки зрения
выбора антибиотика для лечения респираторных инфекций в педиатрической практике,
является азитромицин (Сумамед).
Азитромицин – полусинтетический антибиотик, представитель группы «новых»
макролидов, который был синтезирован в 1983 г. путем включения атома азота
в 14-членное лактонное кольцо эритромицина. 15-членный азитромицин по структуре
молекулы существенно отличается от других макролидов – его даже выделяют в
отдельную подгруппу азалидов (в которой пока он является единственным).
Азитромицин имеет широкий спектр антимикробного действия, который включает
грамположительные и грамотрицательные (Haemophilus influenzae, Moraxella
catarrhalis, Bordetella pertussis, Bordetella parapertussis, Campylobacter
jejuni, Legionella pneumophila, Neisseria gonorrhoeae, Gardnerella vaginalis)
микроорганизмы, анаэробы (Bacteroides bivius, Peptostreptococcus spp.,
Peptococcus, Clostridium perfringens), хламидии (Chlamydia trachomatis,
Chlamydia pneumoniae), микобактерии (Mycobacteria avium complex), микоплазмы (Mycoplasma
pneumoniae), уреаплазмы (Ureaplasma urealyticum), спирохеты (Treponema pallidum,
Borrelia burgdorferi).
Азитромицин стоит на первом месте среди макролидов по активности в отношении H.
influenzae, M. catarrhalis, N. gonorrhoeae, B. melitensis, R. rickettsii,
включая их β-лактомазопродуцирующие штаммы. По дейст-вию на H. influenzae он
уступает аминопенициллинам и цефалоспоринам, но превосходит эритромицин в 2-8
раз. Азитромицин in vitro незначительно активнее эритромицина в отношении
хламидий, микоплазм и уреаплазм, несколько более активен он в отношении
легионелл. Однако in vivo эффективность азитромицина в отношении этих
внутриклеточных патогенов во много раз выше из-за его чрезвычайно высокой
способности проникать в клетки.
Азитромицин in vitro незначительно активнее эритромицина в отношении
хламидий, микоплазм и уреаплазм, несколько более активен он в отношении
легионелл. Однако in vivo эффективность азитромицина в отношении этих
внутриклеточных патогенов во много раз выше из-за его чрезвычайно высокой
способности проникать в клетки.
Для азитромицина, как и для других макролидов, характерен постантибиотический
эффект, то есть сохранение антимикробного действия препарата после его удаления
из среды [5, 7, 8].
Азитромицин, как и другие макролиды, обладает также суб-МПК-постантибиотическим
эффектом, то есть под действием азитромицина в концентрации даже ниже МПК,
микроорганизмы, в том числе обычно резистентные к антибиотику (например,
синегнойная палочка), становятся более чувствительными к факторам иммунной
защиты. Азитромицин проявляет постантибиотический и суб-МПК-постантибиотический
эффект в отношении S. pyogenes, S. pneumoniae, H.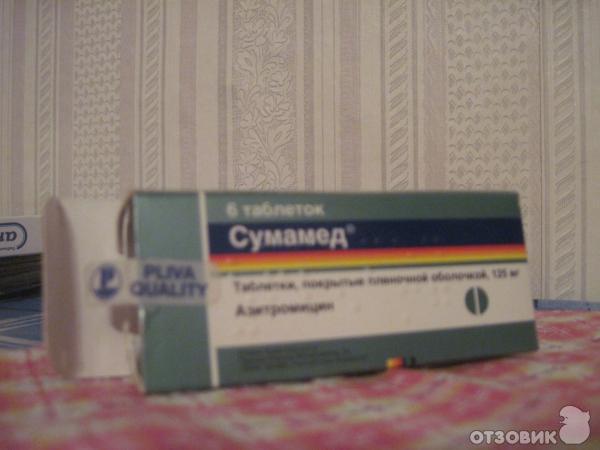 influenzae, L. pneumophila.
influenzae, L. pneumophila.
Азитромицин, как и другие макролиды, обладает противовоспалительным и
иммуномодулирующим действием [8]. В наибольшей степени противовоспалительное
действие позволяет реализовать длительный прием. Макролиды повышают активность
Т-киллеров и усиливают фагоцитарную активность и миграцию макрофагов в очаг
воспаления. Наличие противовоспалительного эффекта у азитромицина успешно
используется у пациентов с муковисцидозом, не отвечающих на стандартную терапию
[9].
Макролиды применяются в основном перорально и хорошо абсорбируются из кишечника.
Всасывание азитромицина происходит быстро, максимальная концентрация в плазме
достигается через 2-4 ч. Благодаря хорошей растворимости в липидах азитромицин
легко проникает в ткани и биологические жидкости, причем значительная его часть
поглощается полиморфноядерными лейкоцитами и макрофагами. Фагоциты,
«нагруженные» азитромицином, при миграции транспортируют его в очаг воспаления,
где создается концентрация антибиотика на 24-36% выше, чем в здоровых тканях.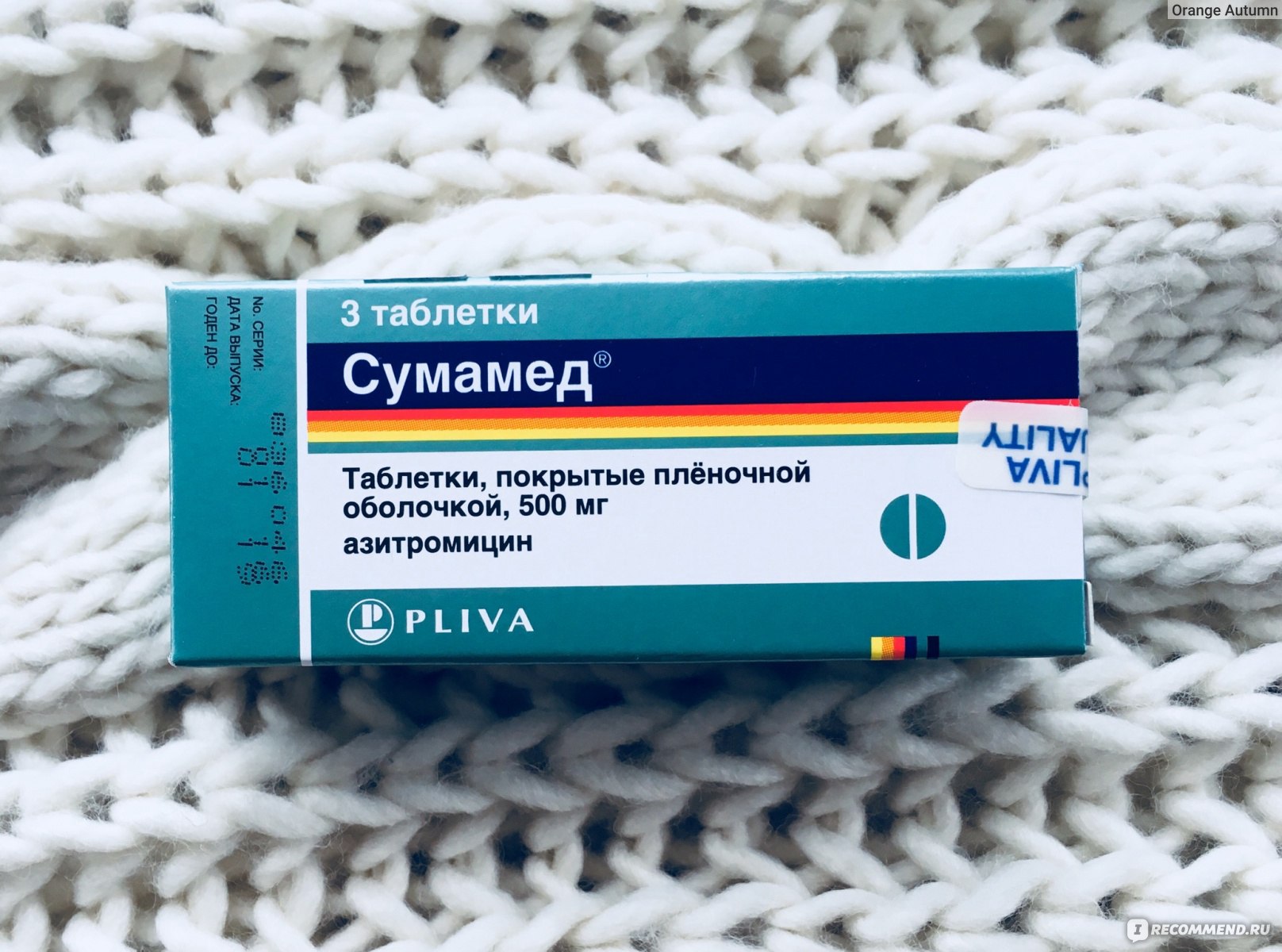 По
способности проникать через гистогематические барьеры (кроме
гематоэнцефалического) азитромицин превосходит β-лактамы и аминогликозиды. Среди
макролидов азитромицин создает самую высокую тканевую концентрацию (в 10-100 раз
превышающую сывороточную), поэтому уровень его в плазме крови низкий. В наиболее
высоких концентрациях азитромицин обнаруживается в миндалинах, среднем ухе,
придаточных пазухах носа, легких, бронхиальном секрете, альвеолярной жидкости,
лимфатических узлах, печени, почках, в меньших (однако более чем в 10 раз
превышающих сывороточные) – в мышечной и жировой тканях. Через 24-96 ч после
приема азитромицина его концентрация в слизистой оболочке бронхов в 200 раз, а в
бронхиальном секрете – в 80 раз превышает сывороточную.
По
способности проникать через гистогематические барьеры (кроме
гематоэнцефалического) азитромицин превосходит β-лактамы и аминогликозиды. Среди
макролидов азитромицин создает самую высокую тканевую концентрацию (в 10-100 раз
превышающую сывороточную), поэтому уровень его в плазме крови низкий. В наиболее
высоких концентрациях азитромицин обнаруживается в миндалинах, среднем ухе,
придаточных пазухах носа, легких, бронхиальном секрете, альвеолярной жидкости,
лимфатических узлах, печени, почках, в меньших (однако более чем в 10 раз
превышающих сывороточные) – в мышечной и жировой тканях. Через 24-96 ч после
приема азитромицина его концентрация в слизистой оболочке бронхов в 200 раз, а в
бронхиальном секрете – в 80 раз превышает сывороточную.
У азитромицина среди макролидов самый длинный период полувыведения (Т1/2) –
35-50 ч, при многократном приеме – до 48-96 ч, что позволяет назначать
антибиотик 1 раз в сутки. Период полувыведения из тканей значительно больше. Терапевтическая концентрация азитромицина в тканях сохраняется до 5-7 дней после
отмены (эритромицина – в течение 1-3 дней). Макролиды подвергаются
биотрансформации в печени при участии цитохрома Р450 и выводятся с желчью в виде
активных или неактивных метаболитов и в неизмененном виде. Азитромицин
метаболизируется в небольшой степени (в связи с чем не влияет на метаболизм
других лекарственных средств). 50% препарата в неизмененном виде выделяется с
желчью и около 6% – с мочой.
Терапевтическая концентрация азитромицина в тканях сохраняется до 5-7 дней после
отмены (эритромицина – в течение 1-3 дней). Макролиды подвергаются
биотрансформации в печени при участии цитохрома Р450 и выводятся с желчью в виде
активных или неактивных метаболитов и в неизмененном виде. Азитромицин
метаболизируется в небольшой степени (в связи с чем не влияет на метаболизм
других лекарственных средств). 50% препарата в неизмененном виде выделяется с
желчью и около 6% – с мочой.
Несмотря на присущую макролидам экстраординарную тканевую и внутриклеточную
аккумуляцию, вся эта группа является нетоксичными и безопасными антибиотиками,
что объясняется их однонаправленным действием с защитными механизмами
макроорганизма. Общая частота развития побочных эффектов азитромицина у детей
составляет около 9% (при использовании эритромицина – 30-40%). Частота побочных
эффектов, требующих отмены препарата, составляет 0,8%. В двойном слепом
исследовании переносимости азитромицина, проведенном у 2598 детей, побочные
эффекты наблюдались у 8,4% больных.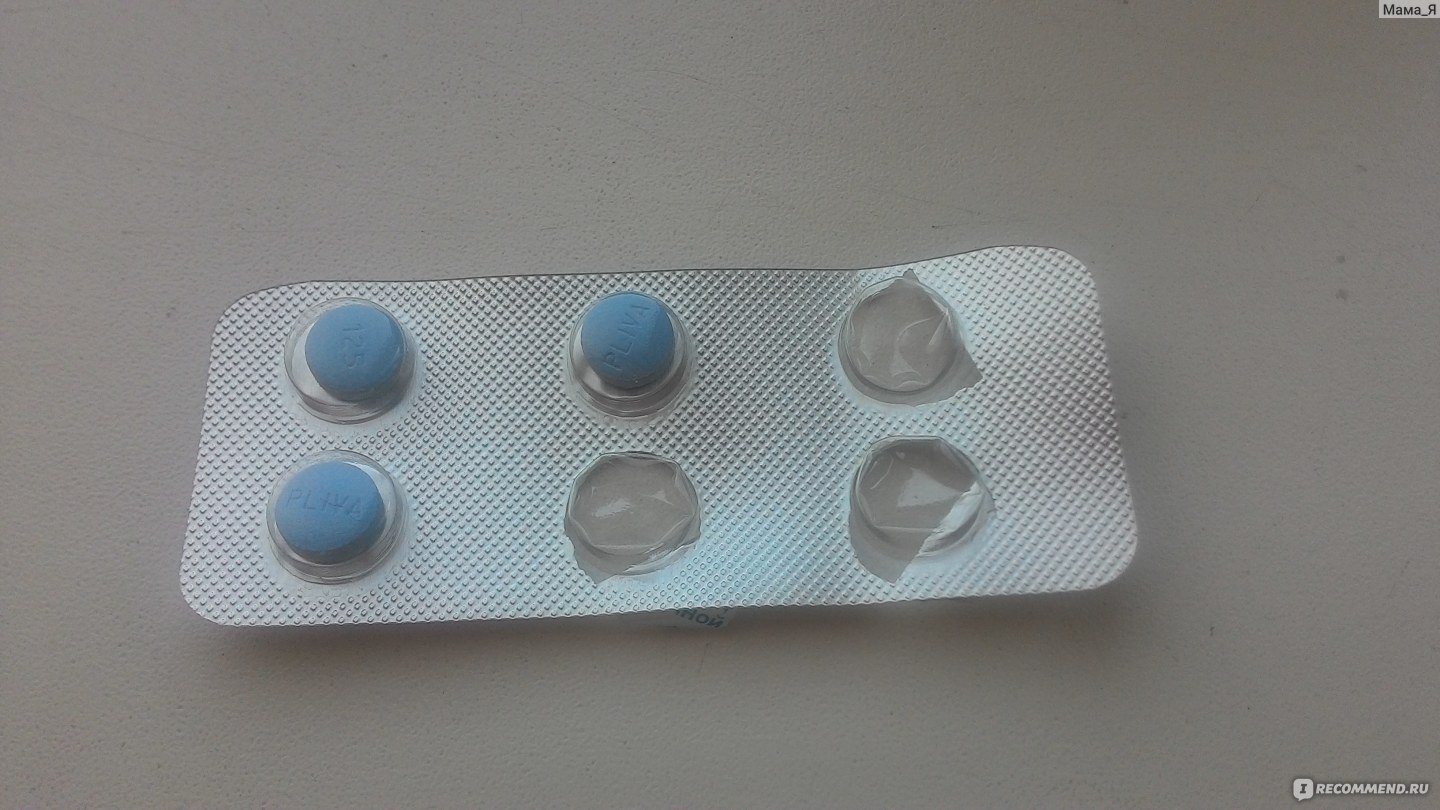 Они встречались достоверно чаще у детей,
получавших препараты сравнения (12,9%) – ко-амоксиклав, ампициллин,
феноксиметилпенициллин, цефалексин, цефаклор, доксициклин, диклоксациллин,
флуклоксациллин, джозамицин и эритромицин [10].
Они встречались достоверно чаще у детей,
получавших препараты сравнения (12,9%) – ко-амоксиклав, ампициллин,
феноксиметилпенициллин, цефалексин, цефаклор, доксициклин, диклоксациллин,
флуклоксациллин, джозамицин и эритромицин [10].
У 5% детей при лечении азитромицином отмечались легкие или умеренные
абдоминальные боли, тошнота, рвота или диарея (при приеме эритромицина и других
14-членных препаратов, являющихся стимуляторами мотилиновых рецепторов, она
встречается значительно чаще).
Нежелательные эффекты со стороны центральной нервной и сердечно-сосудистой
систем нетяжелые и встречаются менее чем в 1% случаев.
В отличие от терапии β-лактамными антибиотиками дисбактериоз и связанные с ним
осложнения при лечении азитромицином не характерны, поскольку он, как и
остальные макролиды, не оказывает влияния на нормальную микрофлору кишечника.
Аллергические реакции на азитромицин встречаются менее чем в 1% случаев, в то
время как на пенициллины они развиваются в 10%, а на цефалоспорины – в 4%
случаев. Описаны аллергические реакции, развившиеся в течение 3-4 нед после
отмены азитромицина. Отмечается перекрестная аллергия с другими макролидами.
Описаны аллергические реакции, развившиеся в течение 3-4 нед после
отмены азитромицина. Отмечается перекрестная аллергия с другими макролидами.
Азитромицин противопоказан при повышенной чувствительности к макролидам,
печеночной недостаточности, в I триместре беременности (за исключением случаев,
когда ожидаемая польза для матери превышает потенциальный риск для плода) и в
период кормления грудью.
Подавляющее большинство клинических исследований азитромицина было посвящено
изучению его эффективности при инфекциях верхних и нижних отделов дыхательных
путей.
С 1991 по 2001 год эффективность азитромицина при инфекциях верхних дыхательных
путей изучалась в 29 исследованиях в целом у 7240 больных, в том числе 4263
детей [11]. В 5 исследованиях (n=1687) изучалась эффективность 3-дневного курса
терапии азитромицином, а в качестве препаратов сравнения применяли рокситромицин,
кларитромицин, ко-амоксиклав или цефаклор в течение 7-14 дней. В трех
исследованиях азитромицин по клинической и бактериологической эффективности был
сопоставим с препаратами сравнения, а в 1 – превосходил их. В 1 исследовании
были оценены результаты 3- и 5-дневного курса лечения азитромицином, которые
оказались сравнимыми.
В трех
исследованиях азитромицин по клинической и бактериологической эффективности был
сопоставим с препаратами сравнения, а в 1 – превосходил их. В 1 исследовании
были оценены результаты 3- и 5-дневного курса лечения азитромицином, которые
оказались сравнимыми.
В течение 10 лет эффективность азитромицина при инфекциях нижних дыхательных
путей изучалась в 29 крупных рандомизированных контролируемых исследованиях у
5901 больного, в том числе 762 детей [11]. В 12 исследований были включены
больные с различными инфекциями, в 9 – больные с обострением хронического
бронхита,
в 9 – больные с пневмонией. В 22 ис-следованиях изучалась эффективность
3-дневного курса терапии азитромицином, в 5 – 5-дневного, в 2 – ступенчатой
терапии (внутривенно, а затем внутрь) и в 1 – одно-кратного приема. В качестве
препаратов сравнения в 8 исследованиях использовали макролиды (эритромицин,
кларитромицин, рокситромицин, диритромицин), в 13 – пенициллины (ко-амоксиклав,
амоксициллин, бензилпенициллин), в 4 – пероральные цефалоспорины (цефаклор,
цефуроксим аксетил, цефтибутен), в 1 – фторхинолоны (моксифлоксацин). Чаще всего
(9 исследований) азитромицин сравнивали с ко-амоксиклавом. Длительность
применения препаратов сравнения обычно составляла 10 дней. Эффективность как
3-дневного, так и
Чаще всего
(9 исследований) азитромицин сравнивали с ко-амоксиклавом. Длительность
применения препаратов сравнения обычно составляла 10 дней. Эффективность как
3-дневного, так и
5-дневного курсов терапии азитромицином была высокой и в большинстве
исследований оказалась сопоставимой с эффективностью 10-дневных курсов лечения
препаратами сравнения. В 5 исследованиях азитромицин превосходил по
эффективности препараты сравнения (ко-амоксиклав, эритромицин, бензилпенициллин
и цефтибутен). Переносимость терапии в основных и контрольных группах была в
целом сопоставимой, хотя в 4 исследованиях азитромицин вызывал нежелательные
эффекты реже, чем ко-амоксиклав или цефуроксим аксетил. Разница была в основном
обусловлена более низкой частотой желудочно-кишечных расстройств. Ни в одном
исследовании азитромицин по переносимости не уступал препаратам сравнения.
Эффективность азитромицина при инфекциях нижних отделов дыхательных путей у
детей, таких как острый гнойный бронхит и внебольничная пневмония, так же
высока, как и у взрослых [12]. Результаты сравнительных контролируемых
исследований свидетельствуют о том, что по клинической эффективности, которая
превышает 90%, азитромицин при таких инфекциях не уступает эритромицину,
джозамицину, ко-амоксиклаву и цефаклору. В многоцентровом двойном слепом
исследовании выявлена высокая эффективность азитромицина при микоплазменных
пневмониях у детей.
Результаты сравнительных контролируемых
исследований свидетельствуют о том, что по клинической эффективности, которая
превышает 90%, азитромицин при таких инфекциях не уступает эритромицину,
джозамицину, ко-амоксиклаву и цефаклору. В многоцентровом двойном слепом
исследовании выявлена высокая эффективность азитромицина при микоплазменных
пневмониях у детей.
При внебольничных пневмониях у детей (39 человек получали азитромицин 10 мг/кг 1
раз в день и 34 – ко-амоксиклав 40 мг/кг в 3 приема) клиническая эффективность
составила 100 и 94% соответственно [13].
В сравнительном исследовании азитромицина (10 мг/кг 1 раз в день) и
ко-амоксиклава (40 мг/кг в 3 приема) у 97 и 96 детей с инфекциями нижних отделов
дыхательных путей клиническая эффективность составила 97 и 96% соответственно
[14]. При этом у детей, получавших азитромицин, выздоровление наступало
достоверно быстрее, а частота побочных эффектов терапии была меньше.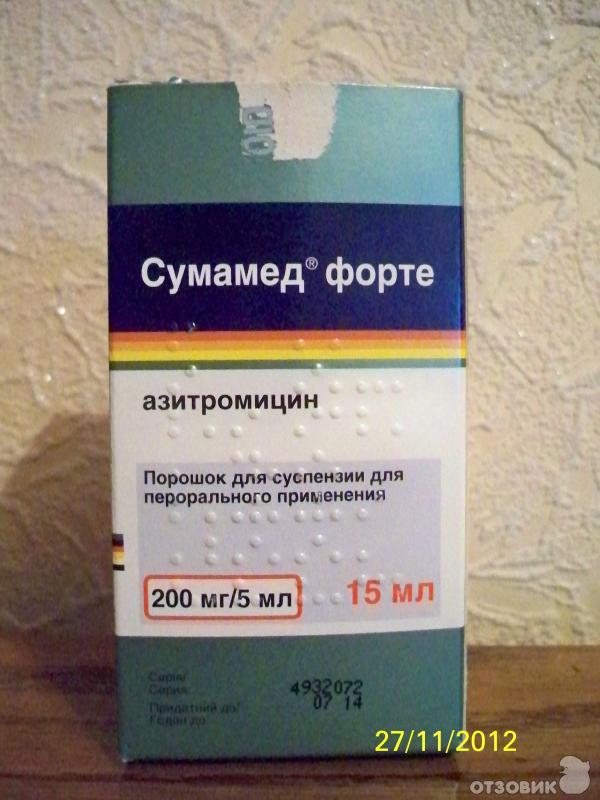
В целом показана сравнимая эффективность короткого курса азитромицина и
традиционных курсов лечения внебольничных пневмоний у детей [15].
Свидетельством высокой эффективности коротких курсов азитромицина (3-дневный
курс при назначении внутрь 1 раз в сутки 500 мг взрослым и 10 мг/кг детям) при
лечении острых инфекций верхних и нижних дыхательных путей различной локализации
являются результаты проспективного несравнительного изучения препарата в 235
медицинских центрах у 1574 взрослых и 781 ребенка. Излечение или быстрое
улучшение наблюдалось более чем в 96% случаев, эрадикация возбудителей – в 85,4%
[16].
Азитромицин, назначаемый в первый день в дозе 10 мг/кг, а в последующие 4 дня –
по 5 мг/кг, приводил к клиническому излечению и эрадикации B. pertussis при
коклюше у детей. В сравнительном контролируемом исследовании установлено, что по
бактериологической эффективности азитромицин (10 мг/кг в сутки в течение 5 дней)
превосходит эритромицин (40-50 мг/кг в сутки в течение 2 нед) – 100 и 89%
соответственно [12].
Наконец, азитромицин показывает наилучшую приверженность лечению (комплайенс) не
только среди макролидов, но и по сравнению с препаратами других групп, так как
применяется всего 1 раз в сутки, в среднем в течение 3 дней. Это имеет большое
значение, поскольку чем меньше кратность приема и короче курс лечения, тем
большее число больных оказывается способно соблюдать предписанный режим
антибиотикотерапии. В педиатрической практике на комплайенс лечения существенное
влияние оказывают также органолептические свойства препарата (вкус суспензий, их
консистенция, гомогенность). В двух двойных слепых исследованиях было
продемонстрировано, что суспензия азитромицина является одной из наиболее
предпочитаемых детьми суспензий антибиотиков [17].
Таким образом, азитромицин, первый представитель 15-членных макролидных
антибиотиков (азалидов), может рассматриваться как один из препаратов выбора
терапии внебольничных инфекций дыхательных путей у детей и как препарат первого
ряда в том случае, если есть основания считать заболевание вызванным
внутриклеточными возбудителями.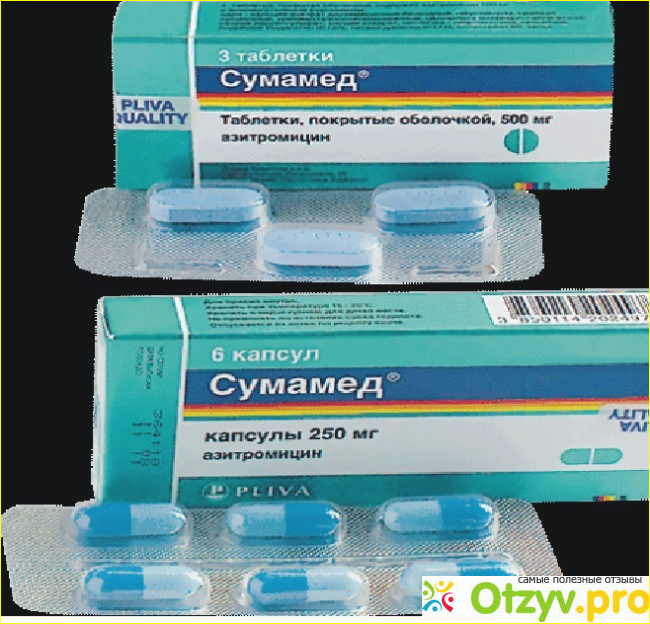 По сравнению с эритромицином азитромицин более
активен против грамотрицательной флоры (особенно H. influenzae), не разрушается
в кислой среде желудка, создает более высокие и стабильные концентрации в
тканях, имеет длительный период полувыведения (что делает возможным однократный
прием препарата в день), используется коротким курсом (3 или 5 дней), редко
вызывает нежелательные реакции и лекарственные взаимодействия. Применение
азитромицина позволяет значительно упростить лечение, улучшить приверженность
лечению и, следовательно, повысить эффективность антибактериальной терапии.
По сравнению с эритромицином азитромицин более
активен против грамотрицательной флоры (особенно H. influenzae), не разрушается
в кислой среде желудка, создает более высокие и стабильные концентрации в
тканях, имеет длительный период полувыведения (что делает возможным однократный
прием препарата в день), используется коротким курсом (3 или 5 дней), редко
вызывает нежелательные реакции и лекарственные взаимодействия. Применение
азитромицина позволяет значительно упростить лечение, улучшить приверженность
лечению и, следовательно, повысить эффективность антибактериальной терапии.
Литература
1. Острые респираторные заболевания у детей: лечение и профилактика /
Научно-практическая программа Союза педиатров России под ред. акад. РАМН А.А.
Баранова. М.: 2002.
2. Руководство по медицине. Диагностика и терапия / Под ред. Р. Беркоу. М.:
1997; 1: 449-450.
3. Самсыгина Г.А., Зайцева О.В., Брашнина Н.П., Казюкова Т. В. // Педиатрия.
1998; 3: 50-53.
В. // Педиатрия.
1998; 3: 50-53.
4. Самсыгина Г.А., Охлопкова К.А., Суслова О.В. Болезни органов дыхания у детей.
Матер. конф. М.: 21-22.09.99: 112.
5. Белоусов Ю.Б., Шатунов С.М. Антибактериальная химиотерапия. 2001; М.:
Ремедиум, 2001.
6. Мизерницкий Ю.Л., Сорокина Е.В. Макролиды при инфекциях дыхательных путей у
детей: современные представления о механизмах действия // Сonsilium medicum
2006; 8.
7. Лукьянов С.В. Клиническая фармакология макролидов // Consilium medicum 2004;
6: 10: 769-773.
8. Лукьянов С.В. Фармакология и клиническое применение азитромицина у детей //
Consilium medicum 2005; 07: 1.
9. Equi A., Balfour-Lynn I.M., Bush A., Rosenthal M. Long term azithromycin in
children with cystic fibrosis: a randomized, placebo-controlled crossover trial
// Lancet 2002; 360: 978-984.
10. Hopkins S.J. Clinical Toleration and Safety of Azithromycin in Adults and
Children // Rev Contemp Pharmacother 1994; 5: 383-389.
11. Моисеев С.В., Левшин И.Б. Азитромицин: старые и новые показания. Клин.
Фармакол. и тер. 2001; 10: 5.
12. Страчунский Л.С., Козлов С.Н. Макролиды в современной клинической практике.
http://www.antibiotic.ru, 27.09.2007.
13. Tredway G., Goyo R., Suares J. et al. Comparative study of azithromycin and
amoxicillin/clavulanic acid (co-amoxiclav) in the treatment of
community-asquired in peadiatric patients. Zithromax ICMAS Poster Book. 1996; p.
82-83.
14. Страчунский Л.С., Жаркова Л.П., Квирквелия М.А. и др. Лечение внебольничной
пневмонии у детей коротким курсом азитромицина // Педиатрия 1997; 5: 91-96.
15. Foulds G., Johnson R.B. Selection of dose regimens of azithromycin. J
Antimicrob Chemother 1993; 31: Suppl E: 39-50.
16. Буданов С.В. Азитромицин (сумамед): основные свойства и особенности
применения в терапии внебольничной пневмонии // Антибиотики и химиотер. 2000;
10: 28-37.
17. Карпов О.И. Комплайенс антибиотикотерапии инфекций дыхательных путей //
Антибиотики и химиотер 1999; 8: 37-45.
Карпов О.И. Комплайенс антибиотикотерапии инфекций дыхательных путей //
Антибиотики и химиотер 1999; 8: 37-45.
«Трудный пациент», № 2-3, 2008 г.
СТАТТІ ЗА ТЕМОЮ
21.02.2021 Кардіологія Лікування дорослих пацієнтів із вродженими вадами серцяНа сьогодні поширеність вроджених вад серця (ВВС) у всьому світі становить 9 випадків на 1 тис. новонароджених із варіацією показників відповідно до географічного розташування. Поширеність тяжких ВВС у багатьох розвинених країнах зменшилася через проведення скринінгу плода та переривання вагітності, однак загальна частота захворюваності у міжнародному масштабі підвищилася. Завдяки розвитку медицини, хірургії та технологій за останні десятиліття >90% осіб, що народилися із ВВС, доживають до зрілого віку. Як наслідок, поширеність ВВС у популяції зросла. Робоча група з лікування вроджених вад серця у дорослих хворих Європейського товариства кардіологів (ESC) 2020 р. розробила оновлену настанову на основі ретельного вивчення наукових та клінічних знань та наявних доказів із цього питання. …
Поширеність тяжких ВВС у багатьох розвинених країнах зменшилася через проведення скринінгу плода та переривання вагітності, однак загальна частота захворюваності у міжнародному масштабі підвищилася. Завдяки розвитку медицини, хірургії та технологій за останні десятиліття >90% осіб, що народилися із ВВС, доживають до зрілого віку. Як наслідок, поширеність ВВС у популяції зросла. Робоча група з лікування вроджених вад серця у дорослих хворих Європейського товариства кардіологів (ESC) 2020 р. розробила оновлену настанову на основі ретельного вивчення наукових та клінічних знань та наявних доказів із цього питання. …
Серцево-судинні захворювання (ССЗ) і порушення сексуального здоров’я мають деякі спільні фактори ризику, як-от артеріальна гіпертензія (АГ), цукровий діабет (ЦД), дисліпідемія, ожиріння, куріння, а також механізми, що опосередковують розвиток хвороби (ендотеліальна дисфункція, субклінічне запалення, атеросклероз тощо). Останнім часом доведено судинне походження еректильної дисфункції (ЕД) у більшості випадків, що свідчить про її більшу поширеність у пацієнтів із наявним ССЗ або пов’язаними із ним чинниками ризику. З іншого боку, виникнення ЕД у певних категорій хворих може асоціюватися з небажаними ефектами антигіпертензивних препаратів….
Останнім часом доведено судинне походження еректильної дисфункції (ЕД) у більшості випадків, що свідчить про її більшу поширеність у пацієнтів із наявним ССЗ або пов’язаними із ним чинниками ризику. З іншого боку, виникнення ЕД у певних категорій хворих може асоціюватися з небажаними ефектами антигіпертензивних препаратів….
Частка пацієнтів з інфарктом міокарда без елевації сегмента ST (NSTEMI) серед усіх осіб з інфарктом міокарда (ІМ) останніми роками значно зросла. Переважно це пояснюється появою більш точної діагностики NSTEMI. Суттєвих змін у вихідних характеристиках щодо віку та куріння в популяції NSTEMI не спостерігається, тоді як частота розвитку цукрового діабету, артеріальної гіпертензії (АГ) та ожиріння підвищилася порівняно із хворими на ІМ з підйомом сегмента ST. За період 1995‑2015 рр. застосування ранньої ангіографії та черезшкірного коронарного втручання (ЧКВ) протягом перших годин після госпіталізації збільшилося з 9 до 60% та з 12,5 до 67% відповідно. Основними клінічними наслідками цих змін є зменшення 6-місячної смертності з 17,2 до 6,3%. …
Переважно це пояснюється появою більш точної діагностики NSTEMI. Суттєвих змін у вихідних характеристиках щодо віку та куріння в популяції NSTEMI не спостерігається, тоді як частота розвитку цукрового діабету, артеріальної гіпертензії (АГ) та ожиріння підвищилася порівняно із хворими на ІМ з підйомом сегмента ST. За період 1995‑2015 рр. застосування ранньої ангіографії та черезшкірного коронарного втручання (ЧКВ) протягом перших годин після госпіталізації збільшилося з 9 до 60% та з 12,5 до 67% відповідно. Основними клінічними наслідками цих змін є зменшення 6-місячної смертності з 17,2 до 6,3%. …
На сьогодні остеоартроз (ОА) вважається найпоширенішим ревматичним захворюванням. Останніми роками цій патології приділяють все більше уваги завдяки відкриттю нових механізмів розвитку хвороби та патогенетичних факторів, підвищенню частоти виявлення, появі інформативних інструментів діагностики й ефективної медикаментозної терапії ОА. У науковців продовжує зростати інтерес до тих методів лікування ОА, які мають потенціал зменшити потребу в застосуванні препаратів із високим ризиком виникнення побічних реакцій. У цьому аспекті великого значення набувають хондропротектори із протизапальною ефективністю для корекції внутрішньосуглобового метаболізму та мінімальними несприятливими явищами. …
Останніми роками цій патології приділяють все більше уваги завдяки відкриттю нових механізмів розвитку хвороби та патогенетичних факторів, підвищенню частоти виявлення, появі інформативних інструментів діагностики й ефективної медикаментозної терапії ОА. У науковців продовжує зростати інтерес до тих методів лікування ОА, які мають потенціал зменшити потребу в застосуванні препаратів із високим ризиком виникнення побічних реакцій. У цьому аспекті великого значення набувають хондропротектори із протизапальною ефективністю для корекції внутрішньосуглобового метаболізму та мінімальними несприятливими явищами. …
Применение азитромицина (Сумамеда) в лечении внебольничных бронхитов и пневмоний у детей :: ТРУДНЫЙ ПАЦИЕНТ
А.Н. Грацианская,
Кафедра клинической фармакологии ГОУ ВПО РГМУ, Москва
Инфекции дыхательных путей являются наиболее частой патологией в человеческой популяции, у детей же острые респираторные заболевания составляют до 90 % всех случаев инфекционной заболеваемости [1].
В основном респираторные инфекции относятся к внебольничным и являются частой причиной госпитализации, а также возникновения хронических воспалительных заболеваний при неадекватном лечении в амбулаторных условиях. Бактериальные инфекции респираторного тракта занимают ведущее место среди всех диагностируемых инфекционных процессов, поэтому основным компонентом лечения при заболеваниях органов дыхания является антибиотикотерапия.
В этиологии внебольничных, т. е. развившихся в обычных условиях жизни ребёнка, бронхитов и пневмоний, принимает участие довольно большой спектр возбудителей. В настоящее время в зависимости от характера клинических проявлений внебольничные бронхиты и пневмонии принято делить на типичные и атипичные.
Для типично протекающего заболевания характерно острое начало с выраженной лихорадочной реакцией, интоксикацией, кашлем и выраженными физикальными проявлениями, что обычно обусловлено присутствием пневмококка (Streptococcus pneumoniae), моракселлы (Moraxella catarrhalis) и гемофильной палочки (Haemophilus influenzae).
Для атипичного течения болезни характерно малосимптомное подострое начало, с нормальной или субфебрильной температурой, отсутствием интоксикации. Наиболее типичным симптомом является сухой непродуктивный навязчивый кашель. Причинами атипичных внебольничных респираторных инфекций являются хламидия (Chlamydia pneumoniae) и микоплазма (Mycoplasma pneumoniae) [2,3,4]. Очевидно, этиологическая значимость хламидий (Chlamydia pneumonia) и микоплазм (Mycoplasma pneumoniae), являющихся внутриклеточными возбудителями инфекций, значительно выше, чем предполагалось ранее. Микоплазменная и хламидийная этиология бронхита и пневмонии у детей в настоящее время может составлять от 25 до 40 %, причём она наиболее высока в первый год жизни и после 10 лет [3, 4]. Особенностью внутриклеточных возбудителей является их нечувствительность к традиционной антибактериальной терапии, поэтому микоплазменные и хламидийные инфекции нередко приобретают затяжное или рецидивирующее течение.
Показанием к назначению антибиотиков при респираторном заболевании следует считать клинические признаки, указывающие на бактериальную природу воспалительного процесса (слизисто-гнойный и гнойный характер мокроты) в совокупности с выраженной интоксикацией и длительной гипертермией (более 3 дней). Затяжное течение заболевания, особенно при подозрении на внутриклеточную природу возбудителя, также является показанием к проведению антибактериальной терапии.
Затяжное течение заболевания, особенно при подозрении на внутриклеточную природу возбудителя, также является показанием к проведению антибактериальной терапии.
Наиболее широко при лечении инфекций дыхательных путей в педиатрической практике в настоящее время используются антибиотики, принадлежащие к группам пенициллинов, цефалоспоринов и макролидов.
Полусинтетические пенициллины широкого спектра действия (амоксициллин, ко-амоксиклав) и цефалоспорины II поколения (цефаклор, цефуроксим аксетил) эффективны против наиболее вероятных возбудителей внебольничных бронхитов и пневмоний (S. pneumoniae, H. influenzae, M. catarrhalis), относятся к наиболее безопасным группам антибиотиков и все имеют пероральные формы. При типичной картине заболевания (высокая температура, интоксикация, кашель, выраженные физикальные изменения в лёгких) они рассматриваются в качестве препаратов выбора.
Вместе с тем, как и все бета-лактамные антибиотики, пенициллины и цефалоспорины не оказывают воздействия на внутриклеточных возбудителей (хламидии, микоплазмы) и чаще, чем антибиотики других групп, вызывают аллергические реакции [5], поэтому современные макролиды при лечении внебольничных инфекций дыхательных путей составляют им серьёзную конкуренцию.
При атипичных проявлениях болезни (нормальная или субфебрильная температура, отсутствие отчётливой интоксикации и одышки, невыразительность физикальных данных при наличии упорного, сухого или непродуктивного коклюшеподобного навязчивого кашля) препаратами выбора являются макролиды.
Первый антибиотик группы макролидов – эритромицин был синтезирован в 1952 г. и по настоящий день широко применяется в клинической практике для лечения инфекций дыхательных путей, кожи и мягких тканей. Макролидные антибиотики в течение нескольких десятилетий были представлены в клинике только эритромицином и синтезированными несколько позднее олеандомицином (утратившим к настоящему времени свое клиническое значение) и спирамицином. Широкое применение эритромицина быстро привело к появлению эритромициноустойчивых штаммов стафилококка, что в сочетании с сообщениями о плохой биодоступности препарата из-за инактивации в кислой среде желудка обусловило снижение к нему интереса врачей. В 70-80-х годах ХХ века резко возросло внимание к макролидам, что было обусловлено интенсивным изучением роли внутриклеточных возбудителей заболеваний, а также открытием хеликобактерной (Helicobacter pylori) инфекции. Одновременно увеличение числа штаммов микроорганизмов, продуцирующих β-лактамазы, привело к снижению активности «традиционных» пенициллинов. Всё это стимулировало разработку и внедрение в клиническую практику новых макролидных антибиотиков с улучшенными (по сравнению с эритромицином) микробиологическими и фармакокинетическими параметрами, а также лучшей переносимостью. Для макролидов наступил период «возрождения» – особенно в педиатрической практике, где они завоевали признание из-за высокой эффективности, безопасности и удобства применения [6].
Одновременно увеличение числа штаммов микроорганизмов, продуцирующих β-лактамазы, привело к снижению активности «традиционных» пенициллинов. Всё это стимулировало разработку и внедрение в клиническую практику новых макролидных антибиотиков с улучшенными (по сравнению с эритромицином) микробиологическими и фармакокинетическими параметрами, а также лучшей переносимостью. Для макролидов наступил период «возрождения» – особенно в педиатрической практике, где они завоевали признание из-за высокой эффективности, безопасности и удобства применения [6].
Одним из привлекательнейших представителей группы макролидов, с точки зрения выбора антибиотика для лечения респираторных инфекций в педиатрической практике, является азитромицин (Сумамед).
Азитромицин – полусинтетический антибиотик, представитель группы «новых» макролидов, который был синтезирован в 1983 г. путём включения атома азота в 14-членное лактонное кольцо эритромицина. 15-членный азитромицин по структуре молекулы существенно отличается от других макролидов – его даже выделяют в отдельную подгруппу азалидов (в которой пока он является единственным).
Азитромицин имеет широкий спектр антимикробного действия, который включает грамположительные и грамотрицательные (Haemophilus influenzae, Moraxella catarrhalis, Bordetella pertussis, Bordetella parapertussis, Campylobacter jejuni, Legionella pneumophila, Neisseria gonorrhoeae, Gardnerella vaginalis) микроорганизмы, анаэробы (Bacteroides bivius, Peptostreptococcus spp., Peptococcus, Clostridium perfringens), хламидии (Chlamydia trachomatis, Chlamydia pneumoniae), микобактерии (Mycobacteria avium complex), микоплазмы (Mycoplasma pneumoniae), уреаплазмы (Ureaplasma urealyticum), спирохеты (Treponema pallidum, Borrelia burgdorferi).
Однако азитромицин стоит на первом месте среди макролидов по активности в отношении H. influenzae, M. catarrhalis, N. gonorrhoeae, B. melitensis, R. rickettsii, включая их бета-лактомазопродуцирующие штаммы. По действию на H. influenzae он уступает аминопенициллинам и цефалоспоринам, но превосходит эритромицин в 2-8 раз. Азитромицин in vitro незначительно активнее эритромицина в отношении хламидий, микоплазм и уреаплазм, несколько более активен он в отношении легионелл. Однако in vivo эффективность азитромицина в отношении этих внутриклеточных патогенов во много раз выше из-за его чрезвычайно высокой способности проникать в клетки.
Однако in vivo эффективность азитромицина в отношении этих внутриклеточных патогенов во много раз выше из-за его чрезвычайно высокой способности проникать в клетки.
Для азитромицина, как и для других макролидов, характерен постантибиотический эффект, т. е. сохранение антимикробного действия препарата после его удаления из среды [5, 7, 8].
Азитромицин, как и другие макролиды, обладает также суб-МПК-постантибиотическим эффектом, т. е. под действием азитромицина в концентрации даже ниже МПК, микроорганизмы, в т. ч. обычно резистентные к антибиотику (например, синегнойная палочка), становятся более чувствительными к факторам иммунной защиты. Азитромицин проявляет постантибиотический и суб-МПК-постантибиотический эффект в отношении S. pyogenes, S. pneumoniae, H. influenzae, L. pneumophila.
Азитромицин, как и другие макролиды, обладает противовоспалительным и иммуномодулирующим действием [8]. В наибольшей степени противовоспалительное действие позволяет реализовать длительный приём. Макролиды повышают активность Т-киллеров и усиливают фагоцитарную активность и миграцию макрофагов в очаг воспаления. Наличие противовоспалительного эффекта у азитромицина успешно используется у пациентов с муковисцидозом, не отвечающих на стандартную терапию [9].
Макролиды повышают активность Т-киллеров и усиливают фагоцитарную активность и миграцию макрофагов в очаг воспаления. Наличие противовоспалительного эффекта у азитромицина успешно используется у пациентов с муковисцидозом, не отвечающих на стандартную терапию [9].
Макролиды применяются в основном перорально и хорошо абсорбируются из кишечника. Всасывание азитромицина происходит быстро, максимальная концентрация в плазме достигается через 2-4 часа. Благодаря хорошей растворимости в липидах азитромицин легко проникает в ткани и биологические жидкости, причём значительная его часть поглощается полиморфноядерными лейкоцитами и макрофагами. Фагоциты, «нагруженные» азитромицином, при миграции транспортируют его в очаг воспаления, где создаётся концентрация антибиотика на 24-36 % выше, чем в здоровых тканях. По способности проникать через гистогематические барьеры (кроме гематоэнцефалического) азитромицин превосходит бета-лактамы и аминогликозиды. Среди макролидов азитромицин создаёт самую высокую тканевую концентрацию (в 10-100 раз превышающую сывороточную), поэтому уровень его в плазме крови низкий. В наиболее высоких концентрациях азитромицин обнаруживается в миндалинах, среднем ухе, придаточных пазухах носа, лёгких, бронхиальном секрете, альвеолярной жидкости, лимфатических узлах, печени, почках, в меньших (однако более чем в 10 раз превышающих сывороточные) – в мышечной и жировой тканях. Через 24-96 ч после приёма азитромицина его концентрация в слизистой оболочке бронхов в 200 раз, а в бронхиальном секрете – в 80 раз превышает сывороточную.
В наиболее высоких концентрациях азитромицин обнаруживается в миндалинах, среднем ухе, придаточных пазухах носа, лёгких, бронхиальном секрете, альвеолярной жидкости, лимфатических узлах, печени, почках, в меньших (однако более чем в 10 раз превышающих сывороточные) – в мышечной и жировой тканях. Через 24-96 ч после приёма азитромицина его концентрация в слизистой оболочке бронхов в 200 раз, а в бронхиальном секрете – в 80 раз превышает сывороточную.
У азитромицина среди макролидов самый длинный период полувыведения (Т1/2) – 35-50 ч, при многократном приёме – до 48-96 ч, что позволяет назначать антибиотик 1 раз в сутки. Период полувыведения из тканей значительно больше. Терапевтическая концентрация азитромицина в тканях сохраняется до 5-7 дней после отмены (эритромицина – в течение 1-3 дней). Макролиды подвергаются биотрансформации в печени при участии цитохрома Р-450 и выводятся с желчью в виде активных или неактивных метаболитов и в неизменённом виде. Азитромицин метаболизируется в небольшой степени (в связи, с чем не влияет на метаболизм других лекарственных средств).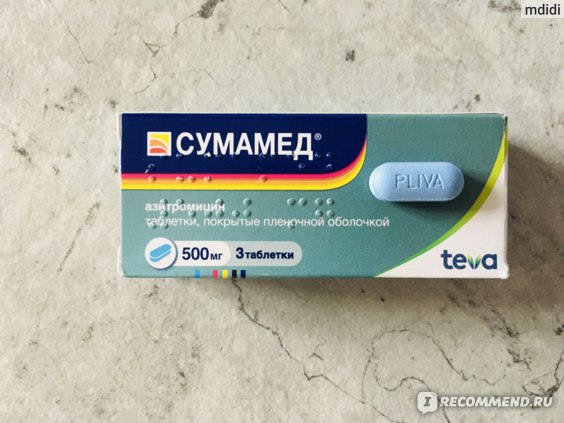 50 % препарата выделяется с желчью в неизменённом виде и около 6 % выделяется с мочой.
50 % препарата выделяется с желчью в неизменённом виде и около 6 % выделяется с мочой.
Несмотря на присущую макролидам экстраординарную тканевую и внутриклеточную аккумуляцию, вся эта группа является нетоксичными и безопасными антибиотиками, что объясняется их однонаправленным действием с защитными механизмами макроорганизма. Общая частота развития побочных эффектов азитромицина у детей составляет около 9 % (при использовании эритромицина – 30-40 %). Частота побочных эффектов, требующих отмены препарата, составляет 0,8 %. В двойном-слепом исследовании переносимости азитромицина, проведённом у 2598 детей, побочные эффекты наблюдались у 8,4 % больных. Они встречались достоверно чаще у детей, получавших препараты сравнения (12,9 %) – ко-амоксиклав, ампициллин, феноксиметилпенициллин, цефалексин, цефаклор, доксициклин, диклоксациллин, флуклоксациллин, джозамицин и эритромицин [10].
У 5 % детей при лечении азитромицином отмечались лёгкие или умеренные абдоминальные боли, тошнота, рвота или диарея (при приёме эритромицина и других 14-членных препаратов, являющихся стимуляторами мотилиновых рецепторов, она встречается значительно чаще).
Нежелательные эффекты со стороны центральной нервной и сердечно-сосудистой систем нетяжёлые и встречаются менее чем в 1 % случаев.
В отличие от терапии бета-лактамными антибиотиками дисбактериоз и связанные с ним осложнения при лечении азитромицином нехарактерны, поскольку он, как и остальные макролиды, не оказывает влияния на нормальную микрофлору кишечника.
Аллергические реакции на азитромицин встречаются менее чем в 1 % случаев, в то время как на пенициллины они развиваются в 10 %, а на цефалоспорины – в 4 % случаев. Описаны аллергические реакции, развившиеся в течение 3-4 нед. после отмены азитромицина. Отмечается перекрестная аллергия с другими макролидами.
Азитромицин противопоказан при повышенной чувствительности к макролидам, печёночной недостаточности, в I триместре беременности (за исключением случаев, когда ожидаемая польза для матери превышает потенциальный риск для плода) и в период кормления грудью.
Подавляющее большинство клинических исследований азитромицина было посвящено изучению его эффективности при инфекциях верхних и нижних отделов дыхательных путей.
С 1991 по 2001 г. эффективность азитромицина при инфекциях верхних дыхательных путей изучалась в 29 исследованиях в целом у 7 240 больных, в том числе 4 263 детей [11]. В 5 исследованиях (n = 1687) изучалась эффективность 3-дневного курса терапии азитромицином, а в качестве препаратов сравнения применяли рокситромицин, кларитромицин, ко-амоксиклав или цефаклор в течение 7-14 дней. В трёх исследованиях азитромицин по клинической и бактериологической эффективности был сопоставим с препаратами сравнения, а в 1 – превосходил их. В 1 исследовании были оценены результаты 3- и 5-дневного курса лечения азитромицином, которые оказались сравнимыми.
В течение 10 лет эффективность азитромицина при инфекциях нижних дыхательных путей изучалась в 29 крупных рандомизированных контролируемых исследованиях у 5 901 больного, в том числе 762 детей [11]. В 12 исследований были включены больные с различными инфекциями, в 9 – больные с обострением хронического бронхита, в 9 – больные с пневмонией. В 22 исследованиях изучалась эффективность 3-дневного курса терапии азитромицином, в 5 – 5-дневного, в 2 – ступенчатой терапии (внутривенно, а затем внутрь) и в 1 – однократного приёма. В качестве препаратов сравнения в 8 исследованиях использовали макролиды (эритромицин, кларитромицин, рокситромицин, диритромицин), в 13 – пенициллины (ко-амоксиклав, амоксициллин, бензилпенициллин), в 4 – пероральные цефалоспорины (цефаклор, цефуроксим аксетил, цефтибутен), в 1 – фторхинолоны (моксифлоксацин). Чаще всего (9 исследований) азитромицин сравнивали с ко-амоксиклавом. Длительность применения препаратов сравнения обычно составляла 10 дней. Эффективность как 3-дневного, так и 5-дневного курсов терапии азитромицином была высокой и в большинстве исследований оказалась сопоставимой с эффективностью 10-дневных курсов лечения препаратами сравнения. В 5 исследованиях азитромицин превосходил по эффективности препараты сравнения (ко-амоксиклав, эритромицин, бензилпенициллин и цефтибутен). Переносимость терапии в основных и контрольных группах была в целом сопоставимой, хотя в 4 исследованиях азитромицин вызывал нежелательные эффекты реже, чем ко-амоксиклав или цефуроксим аксетил. Разница была в основном обусловлена более низкой частотой желудочно-кишечных расстройств.
В качестве препаратов сравнения в 8 исследованиях использовали макролиды (эритромицин, кларитромицин, рокситромицин, диритромицин), в 13 – пенициллины (ко-амоксиклав, амоксициллин, бензилпенициллин), в 4 – пероральные цефалоспорины (цефаклор, цефуроксим аксетил, цефтибутен), в 1 – фторхинолоны (моксифлоксацин). Чаще всего (9 исследований) азитромицин сравнивали с ко-амоксиклавом. Длительность применения препаратов сравнения обычно составляла 10 дней. Эффективность как 3-дневного, так и 5-дневного курсов терапии азитромицином была высокой и в большинстве исследований оказалась сопоставимой с эффективностью 10-дневных курсов лечения препаратами сравнения. В 5 исследованиях азитромицин превосходил по эффективности препараты сравнения (ко-амоксиклав, эритромицин, бензилпенициллин и цефтибутен). Переносимость терапии в основных и контрольных группах была в целом сопоставимой, хотя в 4 исследованиях азитромицин вызывал нежелательные эффекты реже, чем ко-амоксиклав или цефуроксим аксетил. Разница была в основном обусловлена более низкой частотой желудочно-кишечных расстройств. Ни в одном исследовании азитромицин по переносимости не уступал препаратам сравнения.
Ни в одном исследовании азитромицин по переносимости не уступал препаратам сравнения.
Эффективность азитромицина при инфекциях нижних отделов дыхательных путей у детей, таких как острый гнойный бронхит и внебольничная пневмония, так же высока, как и у взрослых [12]. Результаты сравнительных контролируемых исследований свидетельствуют о том, что по клинической эффективности, которая превышает 90 %, азитромицин при таких инфекциях не уступает эритромицину, джозамицину, ко-амоксиклаву и цефаклору. В многоцентровом двойном слепом исследовании выявлена высокая эффективность азитромицина при микоплазменных пневмониях у детей.
При внебольничных пневмониях у детей (39 человек получали азитромицин 10 мг/кг 1 раз в день и 34 – ко-амоксиклав 40 мг/кг в 3 приёма) клиническая эффективность составила 100 и 94 % соответственно [13].
В сравнительном исследовании азитромицина (10 мг/кг 1 раз в день) и ко-амоксиклава (40 мг/кг в 3 приёма) у 97 и 96 детей с инфекциями нижних отделов дыхательных путей клиническая эффективность составила 97 и 96 % соответственно [14]. При этом у детей, получавших азитромицин, выздоровление наступало достоверно быстрее, а частота побочных эффектов терапии была меньше.
При этом у детей, получавших азитромицин, выздоровление наступало достоверно быстрее, а частота побочных эффектов терапии была меньше.
В целом показана сравнимая эффективность короткого курса азитромицина и традиционных курсов лечения внебольничных пневмоний у детей [15].
Свидетельством высокой эффективности коротких курсов азитромицина (3-дневный курс при назначении внутрь 1 раз в сутки 500 мг взрослым и 10 мг/кг детям) при лечении острых инфекций верхних и нижних дыхательных путей различной локализации являются результаты проспективного несравнительного изучения препарата в 235 медицинских центрах у 1574 взрослых и 781 ребенка. Излечение или быстрое улучшение наблюдалось более чем в 96 % случаев, эрадикация возбудителей – в 85,4 % [16].
Азитромицин, назначаемый в первый день в дозе 10 мг/кг, а в последующие 4 дня – по 5 мг/кг, приводил к клиническому излечению и эрадикации B. pertussis при коклюше у детей. В сравнительном контролируемом исследовании установлено, что по бактериологической эффективности азитромицин (10 мг/кг в сутки в течение 5 дней) превосходит эритромицин (40-50 мг/кг в сутки в течение 2 нед. ) – 100 и 89 % соответственно [12].
) – 100 и 89 % соответственно [12].
Наконец, азитромицин показывает наилучшую «приверженность лечению» (комплаенс) не только среди макролидов, но и по сравнению с препаратами других групп, так как применяется всего 1 раз в сутки, в среднем в течение 3 дней. Это имеет большое значение, поскольку чем меньше кратность приёма и короче курс лечения, тем большее число больных оказывается способно соблюдать предписанный режим антибиотикотерапии. В педиатрической практике на комплаенс лечения существенное влияние оказывают также органолептические свойства препарата (вкус суспензий, их консистенция, гомогенность). В двух двойных-слепых исследованиях было продемонстрировано, что суспензия азитромицина является одной из наиболее предпочитаемых детьми суспензий антибиотиков [17].
Таким образом, азитромицин, первый представитель 15-членных макролидных антибиотиков (азалидов), может рассматриваться как один из препаратов выбора терапии внебольничных инфекций дыхательных путей у детей и как препарат первого ряда в том случае, если есть основания считать заболевание вызванным внутриклеточными возбудителями. По сравнению с эритромицином азитромицин более активен против грамотрицательной флоры (особенно H. influenzae), не разрушается в кислой среде желудка, создаёт более высокие и стабильные концентрации в тканях, имеет длительный период полувыведения (что делает возможным однократный приём препарата в день), используется коротким курсом (3 или 5 дней), редко вызывает нежелательные реакции и лекарственные взаимодействия. Применение азитромицина позволяет значительно упростить лечение, улучшить «приверженность лечению» и, следовательно, повысить эффективность антибактериальной терапии.
По сравнению с эритромицином азитромицин более активен против грамотрицательной флоры (особенно H. influenzae), не разрушается в кислой среде желудка, создаёт более высокие и стабильные концентрации в тканях, имеет длительный период полувыведения (что делает возможным однократный приём препарата в день), используется коротким курсом (3 или 5 дней), редко вызывает нежелательные реакции и лекарственные взаимодействия. Применение азитромицина позволяет значительно упростить лечение, улучшить «приверженность лечению» и, следовательно, повысить эффективность антибактериальной терапии.
Литература
1. Острые респираторные заболевания у детей: лечение и профилактика / Научно-практическая программа Союза педиатров России под ред. акад. РАМН А.А. Баранова. М.: 2002.
2. Руководство по медицине. Диагностика и терапия / Под ред. Р. Беркоу. М.: 1997; 1: 449-450.
3. Самсыгина Г. А., Зайцева О. В., Брашнина Н. П., Казюкова Т. В. // Педиатрия. 1998; 3: 50-53.
4. Самсыгина Г. А., Охлопкова К. А., Суслова О. В. Болезни органов дыхания у детей. Матер. конф. М.: 21-22.09.99: 112.
А., Суслова О. В. Болезни органов дыхания у детей. Матер. конф. М.: 21-22.09.99: 112.
5. Белоусов Ю.Б., Шатунов С.М. Антибактериальная химиотерапия. 2001; М.: Ремедиум, 2001.
6. Мизерницкий Ю.Л. .Сорокина Е.В. Макролиды при инфекциях дыхательных путей у детей: современные представления о механизмах действия // Сonsilium-medicum 2006; 8.
7. Лукьянов С.В. Клиническая фармакология макролидов // Consilium medicum 2004; 6: 10: 769-773,
8. Лукьянов С.В. Фармакология и клиническое применение азитромицина у детей // Consilium medicum 2005; 07: 1.
9. Equi A., Balfour-Lynn I.M., Bush A., Rosenthal M. Long term azithromycin in children with cystic fibrosis: a randomized, placebo-controlled crossover trial // Lancet 2002; 360: 978-984.
10. Hopkins S.J. Clinical Toleration and Safety of Azithromycin in Adults and Children // Rev Contemp Pharmacother 1994; 5: 383-389.
11. Моисеев С.В., Левшин И.Б. Азитромицин: старые и новые показания. Клин. фармакол и тер 2001; 10: 5.
12. Страчунский Л.С., Козлов С.Н. Макролиды в современной клинической практике. http://www.antibiotic.ru, 27.09.2007.
Страчунский Л.С., Козлов С.Н. Макролиды в современной клинической практике. http://www.antibiotic.ru, 27.09.2007.
13. Tredway G., Goyo R., Suares J. et al. Comparative study of azithromycin and amoxicillin/clavulanic acid (co-amoxiclav) in the treatment of community-asquired in peadiatric patients. Zithromax ICMAS Poster Book. 1996; p. 82-83.
14. Страчунский Л.С., Жаркова Л.П., Квирквелия М.А. и др. Лечение внебольничной пневмонии у детей коротким курсом азитромицина // Педиатрия 1997; 5: 91-96.
15. Foulds G, Johnson RB. Selection of dose regimens of azithromycin. J Antimicrob Chemother 1993; 31: Suppl E: 39-50.
16. Буданов С.В. Азитромицин (сумамед): основные свойства и особенности применения в терапии внебольничной пневмонии // Антибиотики и химиотер 2000; 10: 28-37.
17. Карпов О.И. Комплаенс антибиотикотерапии инфекций дыхательных путей // Антибиотики и химиотер 1999; 8: 37-45.
Сумамед при бронхите у взрослых и детей: инструкция по применению
Отзывы
- Прошлой зимой ребенок в 5 лет заболел обструктивным бронхитом, очень долго не могли найти подходящий препарат.
 Врач скорой помощи назначил Сумамед, на третий день приема дочке стало намного легче, пошли на поправку. Хороший антибиотик, параллельно желательно принимать что-то для кишечника, мы пили Лактиале, обошлось без побочных эффектов.
Врач скорой помощи назначил Сумамед, на третий день приема дочке стало намного легче, пошли на поправку. Хороший антибиотик, параллельно желательно принимать что-то для кишечника, мы пили Лактиале, обошлось без побочных эффектов. - Давали Сумами нашему сыну в три годика. Перед тем как купить таблетки посоветовались с несколькими педиатрами, сразу сделали все необходимые анализы, в том числе и на чувствительность. Препарат давали по инструкции, по одной таблетке раз в день. Начиталась отзывов, что Сумамед может вызвать аллергическую реакцию, поэтому комбинировала антибиотик с антигистаминными и бифидобактериями. Все обошлось без осложнений, на поправку пошли уже на второй день, препаратом очень довольна.
- Ребенку 11 месяцев, попали в стационар, дежурный врач сразу назначил Сумамед. Пока результат сомнительный, температура непостоянная, не снижается, хрипы слышно отчетливо. Очень надеюсь на положительный результат.
Что делать, если Сумамед не помог при бронхите?
В тех случаях, когда применение препарат длительное времени не приносит положительный результат необходимо обратиться за консультацией к лечащему врачу. Причиной отсутствия эффекта может стать резистентность бактерий к действующему веществу.
Причиной отсутствия эффекта может стать резистентность бактерий к действующему веществу.
Аналоги
Еще несколько десятков лет назад аналогов такому препарату как Сумамед найти было просто невозможно, на сегодняшний же день дела обстоят намного лучше. Фармацевтический рынок заполонили подобные препараты, поэтому стоит выделить только те аналоги антибиотики при бронхите, которые получили максимум положительных отзывов от врачей и пациентов.
Супракс это сильно действующее бактерицидное средство, чаще всего которое назначают при тяжелом течении инфекционно-воспалительного процесса. От Сумамеда препарат отличается по составу разное действующее вещество.
Амоксиклав препарат группы пенициллинов, обладающий антибактериальным действием. По своему действию данный перепарит является слабее Сумамеда, поэтому назначается Амоксиклав на ранних стадиях заболевания, без развития тяжелых осложнений.
Флемоксин относится к группе пенициллинов, обладает антибактериальным действием и является менее токсичным, чем Сумамед. Существенным минусом данного препарата является то, что выпускается он только в таблетированной форме.
Существенным минусом данного препарата является то, что выпускается он только в таблетированной форме.
Аугментин по химическому составу полностью совпадает с Амоксиклавом, единственного его отличия от этой группы препаратов страна производитель.
Вильпрафен также как и Сумамед относится к группе макролидов, но по составу препараты отличаются. Перечень показаний к применению Вильпрафена намного шире, но при этом длительность курса и кратность приемов доставляется некоторые неудобства пациента.
Азитромицин препарат преднадлежащий к структурным аналогам сумамеда. По составу есть некоторые различия в вспомогательных веществах, по всем остальным критериям препарат полностью идентичен Сумамеду
[32], [33]
Антибиотики при гайморите
Гайморит — серьезное заболевание, в основе развития которого лежит воспаление придаточных (гайморовых) пазух. В большинстве случаев причиной развития патологии являются патогенные микроорганизмы. К предрасполагающим факторам относится низкая защита иммунитета, анатомические особенности носовых ходов, околоносовых полостей, а также посттравматические изменения в данной зоне, которые нарушают вентиляцию в пазухах, сужают носовые проходы.
Несвоевременное начало терапии может привести к развитию тяжелых осложнений, а именно инфицированию полости уха, оболочек головного мозга. Заподозрить гайморит можно на основании следующих симптомов:
- слизистые выделения из носа, которые постепенно приобретают гнойный характер и беспокоят более недели;
- заложенность носа из-за отека тканей, гиперсекреции, что заставляет человека дышать через рот;
- отсутствие обоняния;
- изменение вкуса;
- лихорадка выше 39 градусов;
- боль в околоносовой области, которая распространяется на лоб, глазницы, зубы и усиливается при наклонах, поворотах головы;
- недомогание;
- сонливость;
- снижение двигательной активности.
Чтобы вовремя диагностировать заболевание, необходимо пройти обследование у врача на этапе появления первых клинических признаков патологии. Проконсультироваться с квалифицированным отоларингологом можно в медицинском центре Здоровье столицы. Здесь работают опытные специалисты разного профиля, что позволяет оказать медицинскую помощь взрослым и детям.
Здесь работают опытные специалисты разного профиля, что позволяет оказать медицинскую помощь взрослым и детям.
Лечение гайморита основано на приеме антибактериальных средств. Они могут использоваться местно или системно. В зависимости от тяжести заболевания, состояния здоровья пациента, препараты могут назначаться для приема внутрь или инъекционно (внутримышечно, внутривенно).
Заметим, что дозу препаратов, вид антибиотика и длительность терапии устанавливает исключительно врач на основании результатов инструментального, лабораторного обследования. Самостоятельный прием лекарств может не только не принести облегчения общего состояния, но и ухудшить течение болезни, спровоцировать появление побочных реакций.
Далее рассмотрим группы антибактериальных средств, которые чаще всего используются в лечении гайморита.
- Пенициллиновый ряд. Препараты выпускаются в комбинации с клавулановой кислотой. К представителям данной группы антибиотиков относится Флемоксин, Амоксиклав, Аугментин, Флемоксин.
 Лекарства широко применяются в лечении гайморита у малышей. Для них продаются препараты в форме суспензии с добавлением фруктовых наполнителей для придания приятного вкуса.
Лекарства широко применяются в лечении гайморита у малышей. Для них продаются препараты в форме суспензии с добавлением фруктовых наполнителей для придания приятного вкуса. - Цефалоспорины, такие как Цефтриаксон, Цефуроксим, Зефтера. Препараты делятся по поколениям, в зависимости от спектра действия в отношении патогенных микроорганизмов. Выбор лекарства осуществляется на основании результатов бакпосева биологического материала.
- Макролиды (Кларитромицин, Сумамед, Фромилид, Макропен) — действуют на внутриклеточные бактерии (хламидии, микоплазмы). Они назначаются в случае, когда вышеперечисленные антибиотики не могут быть использованы из-за аллергических реакций или их неэффективности.
Для местной терапии назначаются антибиотики из группы аминогликозидов. Они имеют большее количество побочных эффектов в сравнении с другими препаратами, поэтому крайне редко назначаются для системного введения.
С целью интраназального введения применяются капли Полидекса. В своем составе они имеют не только антибиотик, но и сосудосуживающий, гормональный компонент. Спрей Изофра также назначается для местного использования. Помимо антибактериальных препаратов назначаются солевые растворы для промывания носовых ходов.
В своем составе они имеют не только антибиотик, но и сосудосуживающий, гормональный компонент. Спрей Изофра также назначается для местного использования. Помимо антибактериальных препаратов назначаются солевые растворы для промывания носовых ходов.
Комплексный подход терапии позволяет побороть инфекцию, уменьшить воспаление, устранить заложенность носа, восстановить носовое дыхание, облегчить общее состояние человека, а также предупредить развитие осложнений.
Последние Новости
Новые направления клинического использования азитромицина в педиатрической практике | #08/12
Азитромицин (Сумамед®) — первый представитель группы полусинтетических 15-членных макролидных антибиотиков (азалидов) — применяется в клинической практике с 1991 г. и является одним из наиболее часто назначаемых препаратов во многих странах мира. Так, по данным информационно-аналитической компании IMS Health (2009) в США было выписано 53,8 млн рецептов на азитромицин (5-е место среди всех лекарственных средств) [1]. В настоящее время азитромицин одобрен Администрацией США по контролю за качеством продуктов питания и лекарственных средств (Food and Drug Administration — FDA) для использования у взрослых и детей старше 6 месяцев для лечения инфекций, вызванных чувствительными к нему возбудителями, в том числе инфекций дыхательных путей (ИДП) [2]. Азитромицин обладает высокой активностью в отношении как типичных, так и атипичных бактериальных возбудителей ИДП, а его фармакокинетические особенности позволяют создавать максимальные концентрации в инфицированных тканях. Основными показаниями к использованию препарата являются острый средний отит, острый бактериальный риносинусит, внебольничная пневмония и острый стрептококковый тонзиллит/фарингит, скарлатина, инфекции кожи и мягких тканей (рожа, импетиго, вторично инфицированные дерматозы). К настоящему времени проведен ряд клинических исследований, подтверждающих эффективность азитромицина при других нозологических формах, о которых и пойдет речь в данном обзоре.
В настоящее время азитромицин одобрен Администрацией США по контролю за качеством продуктов питания и лекарственных средств (Food and Drug Administration — FDA) для использования у взрослых и детей старше 6 месяцев для лечения инфекций, вызванных чувствительными к нему возбудителями, в том числе инфекций дыхательных путей (ИДП) [2]. Азитромицин обладает высокой активностью в отношении как типичных, так и атипичных бактериальных возбудителей ИДП, а его фармакокинетические особенности позволяют создавать максимальные концентрации в инфицированных тканях. Основными показаниями к использованию препарата являются острый средний отит, острый бактериальный риносинусит, внебольничная пневмония и острый стрептококковый тонзиллит/фарингит, скарлатина, инфекции кожи и мягких тканей (рожа, импетиго, вторично инфицированные дерматозы). К настоящему времени проведен ряд клинических исследований, подтверждающих эффективность азитромицина при других нозологических формах, о которых и пойдет речь в данном обзоре.
Рецидивирующие инфекции дыхательных путей
Традиционно считалось, что большинство случаев так называемых острых респираторных заболеваний (ОРЗ), острого бронхита и ларинготрахеита вызваны вирусами и не требуют назначения антибиотиков. Однако в последнее время появляется все больше информации о роли бактериальных возбудителей (таких как Mycoplasma pneumoniae, Chlamydia pneumoniae) в этиологии подобных инфекций, особенно у лиц молодого возраста без сопутствующей патологии [3, 4] и у детей [5]. Так, частота инфекции, вызванной C. pneumoniae и M. pneumoniae, при острых респираторных инфекциях составляет, в среднем, до 10% во внеэпидемический период и может достигать 25–50% во время эпидемических вспышек [3]. Несомненно, препаратами выбора при лечении инфекций, предположительно вызванных «атипичными» возбудителями (хламидиями и микоплазмами), являются макролиды.
В исследовании, выполненном S. Esposito с соавт. [6], была изучена роль M.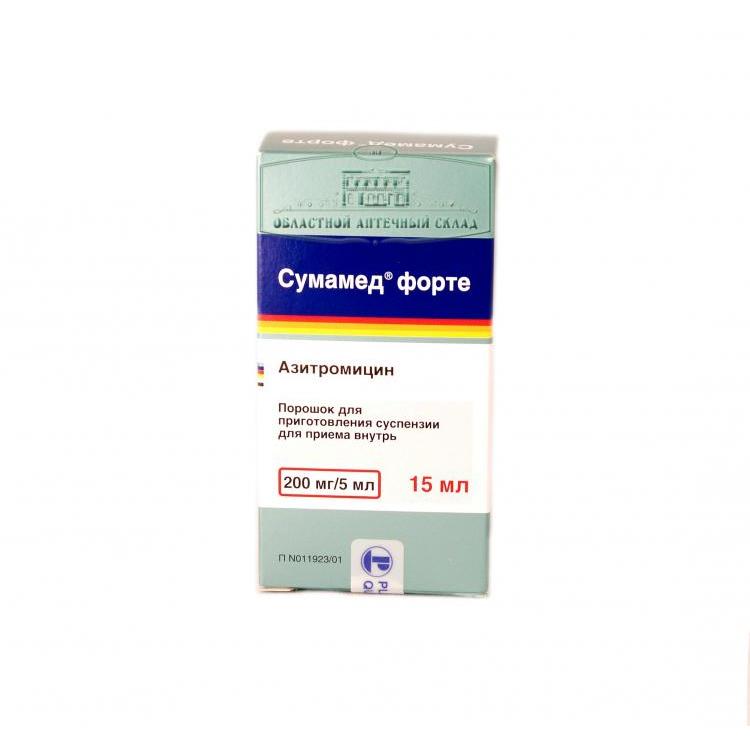 pneumoniae и C. pneumoniae в развитии ОРЗ у детей с рецидивирующими ИДП, а также способность специфической антибактериальной терапии уменьшать частоту возникновения рецидивов. В исследовании приняло участие 353 часто болеющих детей (ЧБД) в возрасте от 1 до 14 лет; контрольную группу составили 208 здоровых детей. ЧБД были рандомизированы в группы лечения с использованием только симптоматической терапии и симптоматической терапии с азитромицином (10 мг/кг/сутки 3 дня в неделю на протяжении 3 недель). Инфекции, вызванные «атипичными» возбудителями, были диагностированы у 54% ЧБД и только у 3,8% детей контрольной группы (р < 0,0001). Краткосрочный (на протяжении 1 месяца) клинический эффект более часто отмечался у ЧБД, получавших азитромицин, однако различия были статистически значимыми только в группе пациентов с инфекцией, вызванной «атипичными» возбудителями. Долговременный клинический эффект (на протяжении 6 месяцев) отмечался достоверно чаще у ЧБД при терапии азитромицином, независимо от этиологии рецидивирующих ИДП.
pneumoniae и C. pneumoniae в развитии ОРЗ у детей с рецидивирующими ИДП, а также способность специфической антибактериальной терапии уменьшать частоту возникновения рецидивов. В исследовании приняло участие 353 часто болеющих детей (ЧБД) в возрасте от 1 до 14 лет; контрольную группу составили 208 здоровых детей. ЧБД были рандомизированы в группы лечения с использованием только симптоматической терапии и симптоматической терапии с азитромицином (10 мг/кг/сутки 3 дня в неделю на протяжении 3 недель). Инфекции, вызванные «атипичными» возбудителями, были диагностированы у 54% ЧБД и только у 3,8% детей контрольной группы (р < 0,0001). Краткосрочный (на протяжении 1 месяца) клинический эффект более часто отмечался у ЧБД, получавших азитромицин, однако различия были статистически значимыми только в группе пациентов с инфекцией, вызванной «атипичными» возбудителями. Долговременный клинический эффект (на протяжении 6 месяцев) отмечался достоверно чаще у ЧБД при терапии азитромицином, независимо от этиологии рецидивирующих ИДП. Авторы полагают, что «атипичные» бактерии, возможно, играют определенную роль в возникновении рецидивирующих инфекций дыхательных путей у детей и длительная терапия азитромицином может значительно улучшить течение острого эпизода и уменьшить риск возникновения рецидивов [6].
Авторы полагают, что «атипичные» бактерии, возможно, играют определенную роль в возникновении рецидивирующих инфекций дыхательных путей у детей и длительная терапия азитромицином может значительно улучшить течение острого эпизода и уменьшить риск возникновения рецидивов [6].
В другом исследовании, в котором участвовало 1706 детей в возрасте от 6 месяцев до 14 лет с рецидивирующими инфекциями дыхательных путей (≥ 8 эпизодов ОРЗ в год, если возраст ребенка < 3 лет и ≥ 6 эпизодов в год, если возраст ребенка ≥ 3 лет), было показано, что, независимо от возраста и клинического диагноза, назначение макролидов пациентам с рецидивирующими инфекциями дыхательных путей приводило к статистически более выраженной и краткосрочной, и долговременной клинической эффективности терапии по сравнению с бета-лактамами (p < 0,0001) или назначением только симптоматической терапии (p < 0,0001) [5].
Длительный кашель и коклюш
Длительный кашель — одна из частых причин обращений к врачам-педиатрам, наиболее вероятной причиной которого может быть коклюш. Заболеваемость коклюшем остается на высоком уровне, несмотря на наличие эффективной и безопасной вакцины. Серологически подтвержденная инфекция Bordetella pertussis выявляется в 37% случаев кашля, продолжающегося более 2 недель после перенесенного ОРЗ [12]. Еще у 12,9% детей с длительным кашлем была выявлена инфекция M. pneumoniae [12]. Таким образом, примерно в половине случаев длительного кашля, обусловленного инфекционными причинами, имеются показания для назначения антибактериальных препаратов (АБП) из группы макролидов.
Заболеваемость коклюшем остается на высоком уровне, несмотря на наличие эффективной и безопасной вакцины. Серологически подтвержденная инфекция Bordetella pertussis выявляется в 37% случаев кашля, продолжающегося более 2 недель после перенесенного ОРЗ [12]. Еще у 12,9% детей с длительным кашлем была выявлена инфекция M. pneumoniae [12]. Таким образом, примерно в половине случаев длительного кашля, обусловленного инфекционными причинами, имеются показания для назначения антибактериальных препаратов (АБП) из группы макролидов.
Препаратом выбора при лечении и постэкспозиционной профилактике коклюша считается эритромицин, который назначается на протяжении 14 дней [13]. Тем не менее, несмотря на эффективность терапии эритромицином, необходимость применения 4 раза в сутки и достаточно высокая частота возникновения нежелательных лекарственных реакций со стороны желудочно-кишечного тракта являлись причиной низкой комплаентности рекомендованного 14-дневного курса [14]. В последние десятилетия в исследованиях in vitro была продемонстрирована активность азитромицина в отношении B. pertussis, а в клинических исследованиях подтверждена эффективность данного препарата (таблица).
В последние десятилетия в исследованиях in vitro была продемонстрирована активность азитромицина в отношении B. pertussis, а в клинических исследованиях подтверждена эффективность данного препарата (таблица).
Согласно результатам Кокрановского систематического обзора по применению АБП для лечения и профилактики коклюша, включавшего 12 рандомизированных контролируемых исследований (общее число участников 1720), 3-дневный курс терапии азитромицином не уступал по эффективности 14-дневному курсу лечения эритромицином по клинической и микробиологической эффективности, а также частоте возникновения микробиологических рецидивов инфекции [13]. В настоящее время азитромицин включен в рекомендации Центров по контролю и профилактике заболеваний США (англ. Centers for Disease Control and Prevention, CDC) по лечению коклюша. Его необходимо назначать детям до 6 месяцев в дозе 10 мг/кг один раз в сутки в течение 5 дней; детям старше 6 месяцев — 10 мг/кг в первый день (но не более 500 мг), далее по 5 мг/кг (2–5-й дни терапии) [14].
Болезнь кошачьей царапины
Болезнь кошачьей царапины впервые была описана в 1931 г., однако ее возбудитель, Bartonella henselae, был идентифицирован только в 1983 г., что связано со значительными трудностями при культивировании данного патогена [15]. Заболевание распространено повсеместно и чаще всего поражает детей и молодых лиц, однако может встречаться и у взрослых пациентов. Типичные проявления у лиц без иммунодефицита включают возникновение через 3–10 дней на месте повреждения, нанесенного животным, красно-коричневой безболезненной папулы. Спустя 1–3 недели развивается односторонняя регионарная лимфаденопатия. Заболевание медленно прогрессирует. Состояние пациентов, как правило, удовлетворительное, наблюдаются легкие неспецифические проявления, такие как общее недомогание, потеря аппетита, боли в животе, а также мышечные или суставные боли. В 25% случае заболевание протекает бессимптомно. Диагноз устанавливается на основании данных анамнеза (контакт с кошками и наличие царапин) и серологического исследования — определение антител класса IgG к B. henselae в титре более 1:256. Длительность инфекционного процесса обычно не превышает 6 месяцев [15].
henselae в титре более 1:256. Длительность инфекционного процесса обычно не превышает 6 месяцев [15].
Несмотря на то, что болезнь кошачьей царапины у людей с сохраненным иммунитетом склонна к самоизлечению и без терапии выздоровление наступает через 2–3 месяца, было показано ускоренное разрешение лимфаденопатии (в течение 1 месяца) при лечении коротким курсом азитромицина [16–18]. У детей азитромицин назначается в течение 5 дней в дозе 10 мг/кг в первый день, а в последующие 4 дня по 5 мг/кг [18, 19].
Необходимо отметить, что к числу других антибактериальных препаратов, потенциально активных в отношении B. henselae, относятся рифампицин, доксициклин, гентамицин, ко-тримоксазол и ципрофлоксацин (монотерапия или комбинация двух препаратов) [15, 20]. Часть из них не разрешена для применения в педиатрии, другие характеризуются неблагоприятным профилем безопасности, поэтому при лечении детей целесообразно отдавать предпочтение азитромицину [21].
Кишечные инфекции
Ограниченные возможности антибактериальной терапии кишечных инфекций у детей и рост резистентности возбудителей к АБП диктуют необходимость поиска новых подходов к терапии шигеллезов у детей [22]. Одним из новых направлений является изучение эффективности азитромицина при данной нозологической форме, что базируется на фармакокинетических и фармакодинамических данных и клиническом опыте применения азитромицина у взрослых [23, 24]. Проведены и первые успешные клинические исследования его эффективности при шигеллезах у детей.
Одним из новых направлений является изучение эффективности азитромицина при данной нозологической форме, что базируется на фармакокинетических и фармакодинамических данных и клиническом опыте применения азитромицина у взрослых [23, 24]. Проведены и первые успешные клинические исследования его эффективности при шигеллезах у детей.
Во время вспышки шигеллеза в Израиле в 2003 г. было инфицировано 73 человека, среди которых 83% составили дети в возрасте от 6 месяцев до 18 лет. Всем детям с шигеллезом, подтвержденным положительной фекальной культурой, назначалась налидиксовая кислота в дозе 55 мг/кг/сутки в 4 приема внутрь в течение 5 дней. Поскольку к моменту завершения курса ее применения у 25 детей сохранялась диарея, было принято решение о замене налидиксовой кислоты азитромицином, который назначался внутрь в дозе 10 мг/кг/сутки в течение 3 дней. У всех (100%) детей, принимавших азитромицин, диарея купировалась через 48 ч после начала терапии, в то время как в группе, получавшей только налидиксовую кислоту, купирование диареи произошло лишь у 65% детей [25].
В другом исследовании, проведенном в 1998–2000 гг., участвовало 75 детей в возрасте от 6 месяцев до 5 лет с диагнозом «шигеллез». Пациенты были рандомизированы на две группы: первая получала цефиксим в дозе 8 мг/кг/сутки (максимальная доза — 400 мг/сутки) в течение 5 дней, вторая — азитромицин в дозе 12 мг/кг в первый день (максимальная доза — 500 мг), затем по 6 мг/кг (максимально — 250 мг/сутки) в течение последующих 4 дней. Проводимая терапия оказалась клинически эффективной у 93% пациентов первой группы и у 78% — второй (p = 0,1, то есть различия недостоверны). Средняя продолжительность диареи с момента начала лечения составила в среднем 2,5 дня в первой группе и около 4 дней — во второй. Эрадикация возбудителя на 3-й день терапии была достигнута у 59% пациентов, принимавших цефиксим, и у 93% пациентов, принимавших азитромицин, эти различия были статистически достоверными. На 7-й день положительный результат бактериологического исследования был получен у одного ребенка из группы азитромицина и у двух детей из группы цефиксима [26].
Таким образом, результаты описанных исследований демонстрируют клиническую и микробиологическую эффективность азитромицина при шигеллезах у детей. Простой режим дозирования, быстрые темпы клинического улучшения и достаточный уровень эрадикации шигелл, наиболее вероятно обусловленный высокими внутриклеточными концентрациями азитромицина, являются основанием к проведению дальнейших исследований, направленных на подтверждение правильности данной терапевтической стратегии.
Хламидийная инфекция у новорожденных
Chlamydia trachomatis является самым распространенным в США возбудителем микробных инфекций, передающихся половым путем. Перинатальная передача C. trachomatis происходит обычно при естественных родах, но инфекция может иметь и вторичный характер, возникая в результате повреждения оболочек плода, прямой контаминации носоглотки и легких новорожденного. Описаны случаи хламидийной инфекции у новорожденных после кесарева сечения. У 35–50% новорожденных, матери которых инфицированы хламидиями, развивается конъюнктивит и у 11–20% — пневмония. Хламидийная инфекция представляет собой наиболее частую причину неонатального конъюнктивита, развивающегося между 5-м и 12-м днями жизни.
У 35–50% новорожденных, матери которых инфицированы хламидиями, развивается конъюнктивит и у 11–20% — пневмония. Хламидийная инфекция представляет собой наиболее частую причину неонатального конъюнктивита, развивающегося между 5-м и 12-м днями жизни.
Поскольку хламидии распространяются по слезному протоку и в носоглотку, по меньшей мере, у 33% новорожденных развивается хламидийная пневмония. В тех случаях, когда признаки конъюнктивита отсутствуют, пневмония развивается у 11–20% новорожденных от инфицированных и не получавших лечение матерей [27]. C. trachomatis, может также вызывать подострую афебрильную пневмонию у детей в возрасте 1–3 месяцев.
Центрами по контролю и профилактике заболеваний США (CDC) для терапии хламидийного конъюнктивита и пневмонии у новорожденных рекомендуется применение эритромицина основание или этилсукцинат в дозе 50 мг/кг/сутки внутрь в 4 приема в течение 14 дней. Однако при этом обращается внимание на возможность возникновения у детей до 6 недель серьезного нежелательного эффекта эритромицина — гипертрофического пилоростеноза, который встречается в 8 раз чаще у детей, получающих эритромицин внутрь (но не местно), между 3-м и 13-м днями жизни [28–30]. В основе этого феномена, предположительно, лежат широко известные прокинетические свойства эритромицина. Риск развития пилоростеноза при применении других макролидов (азитромицина, кларитромицина) не установлен. Несмотря на то, что данные, касающиеся использования азитромицина при лечении хламидийной инфекции новорожденных, ограничены, существует подтверждение эффективности короткого курса азитромицина в дозе 20 мг/кг/сутки 1 раз в день внутрь в течение 3 дней для лечения хламидийной инфекции у новорожденных, то есть он может являться более безопасной альтернативой эритромицину [31, 32]. Следует отметить, что ни один другой макролидный антибиотик (кроме упомянутого выше эритромицина с сомнительным профилем безопасности у данной категории пациентов) не имеет официального одобрения для использования у новорожденных и детей первых месяцев жизни для лечения хламидийной инфекции.
В основе этого феномена, предположительно, лежат широко известные прокинетические свойства эритромицина. Риск развития пилоростеноза при применении других макролидов (азитромицина, кларитромицина) не установлен. Несмотря на то, что данные, касающиеся использования азитромицина при лечении хламидийной инфекции новорожденных, ограничены, существует подтверждение эффективности короткого курса азитромицина в дозе 20 мг/кг/сутки 1 раз в день внутрь в течение 3 дней для лечения хламидийной инфекции у новорожденных, то есть он может являться более безопасной альтернативой эритромицину [31, 32]. Следует отметить, что ни один другой макролидный антибиотик (кроме упомянутого выше эритромицина с сомнительным профилем безопасности у данной категории пациентов) не имеет официального одобрения для использования у новорожденных и детей первых месяцев жизни для лечения хламидийной инфекции.
Угревая болезнь
Угревая болезнь является наиболее распространенной дерматологической проблемой у подростков и молодых людей. В течение последних десятилетий было доказано, что системное применение АБП играет основную роль в лечении пациентов с угревой болезнью, у которых имеются воспалительные элементы. В ряде случаев системная антибактериальная терапия приводит к возникновению побочных эффектов, что вносит свой вклад в снижение комплаентности пациентов. Учитывая тот факт, что обычно назначаемыми системными антибиотиками при угревой болезни являются тетрациклины, а данная группа АБП характеризуется не вполне благоприятным профилем безопасности, целесообразным, особенно у подростков, является поиск более безопасных для применения альтернативных АБП. Азитромицин обладает противовоспалительными свойствами и предотвращает рост Propionibacterium acnes — основного патогена, вовлеченного в патогенез воспалительного процесса при угревой болезни [33].
В течение последних десятилетий было доказано, что системное применение АБП играет основную роль в лечении пациентов с угревой болезнью, у которых имеются воспалительные элементы. В ряде случаев системная антибактериальная терапия приводит к возникновению побочных эффектов, что вносит свой вклад в снижение комплаентности пациентов. Учитывая тот факт, что обычно назначаемыми системными антибиотиками при угревой болезни являются тетрациклины, а данная группа АБП характеризуется не вполне благоприятным профилем безопасности, целесообразным, особенно у подростков, является поиск более безопасных для применения альтернативных АБП. Азитромицин обладает противовоспалительными свойствами и предотвращает рост Propionibacterium acnes — основного патогена, вовлеченного в патогенез воспалительного процесса при угревой болезни [33].
По данным открытого многоцентрового несравнительного исследования, выполненного у пациентов со II степенью воспалительных форм acne vulgaris, применение азитромицина в дозе 500 мг в сутки в течение 3 последовательных дней в месяц на протяжении 3 месяцев привело к статистически достоверному уменьшению количества воспалительных элементов на различных участках лица [33].
В другом исследовании у 57 пациентов в возрасте от 13 до 41 года с умеренно выраженной угревой болезнью длительное (на протяжении 12 недель) применение азитромицина в дозе 500 мг 3 раза в неделю продемонстрировало высокую (80,7%) клиническую эффективность и хорошую переносимость (нежелательные лекарственные реакции были зарегистрированы у 11,3% пациентов), на основании чего авторы делают вывод об эффективности, безопасности и высокой комплаентности применения азитромицина при среднетяжелых формах acne vulgaris и у подростков, и у взрослых пациентов [34].
Отдельное открытое несравнительное исследование эффективности азитромицина было проведено у 52 итальянских подростков со среднетяжелыми и тяжелыми папуло-пустуллезными формами угревой болезни. Азитромицин назначался в дозе 500 мг 3 раза в неделю на протяжении 8 недель без сопутствующего местного лечения. У 90,4% пациентов отмечалось значимое улучшение (снижение более чем на 20% количества воспалительных элементов) уже в течение первых 4 недель лечения. Все пациенты завершили 8-недельный курс лечения. Максимально выраженное очищение кожи отмечалось к 8 недели лечения у 61,5% пациентов. Эффект сохранялся в течение 4 месяцев после завершения приема азитромицина. Препарат характеризовался хорошей переносимостью — нежелательные явления отмечались только у 3 пациентов (5,6%) [35].
Все пациенты завершили 8-недельный курс лечения. Максимально выраженное очищение кожи отмечалось к 8 недели лечения у 61,5% пациентов. Эффект сохранялся в течение 4 месяцев после завершения приема азитромицина. Препарат характеризовался хорошей переносимостью — нежелательные явления отмечались только у 3 пациентов (5,6%) [35].
В ходе еще одного рандомизированного двойного слепого контролируемого клинического исследования, проведенного в Иране, сравнивалась эффективность и безопасность азитромицина и доксициклина в лечении угревой болезни средней степени тяжести и изучалось влияние возраста пациента на исходы лечения [36]. В исследовании приняли участие 100 пациентов с умеренными формами acne vulgaris, которые обратились за амбулаторной помощью в дерматологическую клинику. Пациенты были рандомизированы на 2 группы А и D: группа А получала азитромицин в дозе 500 мг в сутки 4 последовательных дня в месяц на протяжении 3 последовательных месяцев; пациенты группы D принимали доксициклин в дозе 100 мг в сутки в течение 3 последовательных месяцев. Как оказалось, оба АБП были сопоставимы по клинической эффективности и безопасности при умеренно выраженных формах акне, однако доксициклин был статистически достоверно более эффективен у пациентов в возрасте старше 18 лет [36].
Как оказалось, оба АБП были сопоставимы по клинической эффективности и безопасности при умеренно выраженных формах акне, однако доксициклин был статистически достоверно более эффективен у пациентов в возрасте старше 18 лет [36].
Таким образом, азитромицин по данным целого ряда клинических исследований продемонстрировал высокую эффективность и благоприятный профиль безопасности при лечении угревой болезни у подростков и лиц молодого возраста.
Заключение: Таким образом, Сумамед® (азитромицин), обладает высокой активностью в отношении как типичных, так и атипичных бактериальных возбудителей дыхательных путей, а его фармакокинетические особенности, позволяют создавать максимальные концентрации в инфицированных тканях. Это один из эффективных и наиболее удобных АБП, применяемых в амбулаторной практике. На основании представленных данных можно сделать вывод о том, что наряду с хорошо известными традиционными показаниями к применению азитромицина, существует еще целый ряд перспективных областей для его клинического использования в педиатрии, включающих достаточно широкий перечень дополнительных клинических состояний, при которых уже получены достоверные данные об эффективности и безопасности азитромицина. Все это открывает новые возможности его использования в респираторной медицине при рецидивирующих ИДП, длительном кашле, хламидийной инфекции у новорожденных, а также угревой болезни, болезни кошачьей царапины, кишечных инфекциях.
Все это открывает новые возможности его использования в респираторной медицине при рецидивирующих ИДП, длительном кашле, хламидийной инфекции у новорожденных, а также угревой болезни, болезни кошачьей царапины, кишечных инфекциях.
Литература
- Bartholow M. Top 200 Prescription Drugs of 2009 // Pharmacy Times. May 11, 2010.
- Langtry H. D., Balfour J. A. Azithromycin: a review of its use in paediatric infectious diseases // Drugs 1998; 56: 273–297.
- Blasi F. Atypical pathogens and respiratory tract infections // Eur Respir J 2004; 24: 171–181.
- Gonzales R., Sande M. A. Uncomplicated acute bronchitis // Ann. Intern. Med. 2001; 135 (9): 839–840.
- Principi N., Esposito S., Cavagna R. et al. Recurrent respiratory tract infections in pediatric age: a population-based survey of the therapeutic role of macrolides // J Chemother 2003; 15 (1): 53–9.
- Esposito S.
 , Bosis S., Faelli N. et al. Role of atypical bacteria and azithromycin therapy for children with recurrent respiratory tract infections // Pediatr Infect Dis J 2005; 24 (5): 438–444.
, Bosis S., Faelli N. et al. Role of atypical bacteria and azithromycin therapy for children with recurrent respiratory tract infections // Pediatr Infect Dis J 2005; 24 (5): 438–444. - Aoyama T., Sunakawa K., Iwata S. et al. Efficacy of short-term treatment of pertussis with clarithromycin and azithromycin // J Pediatr 1996; 129: 761–764.
- Bace A., Zrnic T., Begovac J. et al. Short-term treatment of pertussis with azithromycin in infants and young children // Eur J Clin Microbiol Infect Dis 1999; 18 (4): 296–298.
- Bace A., Kuzmanovic N., Novac D. Clinical comparative study of azithromycin and erythromycin in the treatment of pertussis — preliminary results // ICMAS-5, Jan 26–28, Seville, 2000: abstract # 36.
- Pichichero M. E., Hoeger W. J., Casey J. R. Azithromycin for the treatment of pertussis // Pediatr Infect Dis J 2003; 22 (9): 847–9.
- Langley J. M., Halperin S. A.
 , Boucher F. D. et al. Azithromycin is as effective as and better tolerated than erythromycin estolate for the treatment of pertussis // Pediatrics 2004; 114: 96–101.
, Boucher F. D. et al. Azithromycin is as effective as and better tolerated than erythromycin estolate for the treatment of pertussis // Pediatrics 2004; 114: 96–101. - Wang K., Chalker V., Bermingham A. et al. Mycoplasma pneumoniae and respiratory virus infections in children with persistent cough in England: a retrospective analysis // Pediatr Infect Dis J. 2011; 30 (12): 1047–1051.
- Altunaiji S., Kukuruzovic R., Curtis N., Massie J. Antibiotics for whooping cough (pertussis) // Cochrane Database Syst Rev. 2005; (1): CD004404.
- Tiwari T., Murphy T. V., Moran J. National Immunization Program, CDC. Recommended antimicrobial agents for the treatment and postexposure prophylaxis of pertussis: 2005 CDC Guidelines // MMWR Recomm Rep 2005; 54 (RR-14): 1–16.
- Windsor J. J. Cat-scratch disease: epidemiology, aetiology and treatment // Br J Biomed Sci 2001; 58 (2): 101–110.
- Batts S.
 , Demers D. M. Spectrum and treatment of cat-scratch disease // Pediatr Infect Dis J 2004; 23 (12): 1161–1162.17.
, Demers D. M. Spectrum and treatment of cat-scratch disease // Pediatr Infect Dis J 2004; 23 (12): 1161–1162.17. - Vincent J. M., Demers D. M., Bass J. W. Infectious exanthems and unusual infections // Adolesc Med 2000; 11 (2): 327–58.
- Bass J. W., Freitas B. C., Freitas A. D. et al. Prospective randomized double blind placebo-controlled evaluation of azithromycin for treatment of cat-scratch disease // Pediatr Infect Dis J 1998; 17 (6): 447–452.
- Estrada D. Azithromycin and cat-scratch disease // Infect Med 1998; 15 (8): 517.
- Conrad D. A. Treatment of cat-scratch disease // Curr Opin Pediatr 2001; 13 (1): 56–9.
- Klotz S. A., Ianas V., Elliott S. P. Cat-scratch Disease // Am Fam Physician. 2011; 83 (2): 152–5.
- Jain S. K., Gupta A., Glanz B. et al. Antimicrobial-resistant Shigella sonnei: limited antimicrobial treatment options for children and challenges of interpreting in vitro azithromycin susceptibility // Pediatr Infect Dis J 2005; 24 (6): 494–497.

- Windsor J. J. Cat-scratch disease: epidemiology, aetiology and treatment // Br J Biomed Sci 2001; 58 (2): 101–110.W.
- Bhattacharya S. K., Sur D. An evaluation of current shigellosis treatment // Expert Opin Pharmacother 2003; 4 (8): 1315–1320
- Vincent J. M., Demers D. M., Bass J. W. Infectious exanthems and unusual infections // Adolesc Med 2000; 11 (2): 327–58.
- Basualdo W., Arbo A. Randomized comparison of azithromycin versus cefixime for treatment of shigellosis in children // Ped Infect Dis J 2003; 22: 374–377.
- Popovich D. M., McAlhany A. Practitioner care and screening guidelines for infants born to Chlamydia-positive mothers // NBIN 2004; 4 (1): 51–55.
- Hauben M., Amsden G. W. The association of erythromycin and infantile hypertrophic pyloric stenosis: causal or coincidental? // Drug Saf 2002; 25 (13): 929–942.
- Cooper W.
 O., Griffin M. R., Arbogast P. et al. Very early exposure to erythromycin and infantile hypertrophic pyloric stenosis // Arch Pediatr Adolesc Med 2002; 156 (7): 647–650.
O., Griffin M. R., Arbogast P. et al. Very early exposure to erythromycin and infantile hypertrophic pyloric stenosis // Arch Pediatr Adolesc Med 2002; 156 (7): 647–650. - Mahon B. E., Rosenman M. B., Kleiman M. B. Maternal and infant use of erythromycin and other macrolide antibiotics as risk factors for infantile hypertrophic pyloric stenosis // J Pediatr 2001; 139 (3): 380–384.
- Workowski K. A., Berman S. M. Centers for Disease Control and Prevention. Sexually transmitted diseases treatment guidelines, 2006 // MMWR Recomm Rep. 2006; 55 (RR-11): 1–94.
- Zar H. J. Neonatal chlamydial infections: prevention and treatment // Paediatr Drugs 2005; 7 (2): 103–110.
- Antonio J. R., Pegas J. R., Cestari T. F., Do Nascimento L. V. Azithromycin pulses in the treatment of inflammatory and pustular acne: efficacy, tolerability and safety // J Dermatolog Treat. 2008;19 (4): 210–5.
- Innocenzi D.
 , Skroza N., Ruggiero A. et al. Moderate acne vulgaris: efficacy, tolerance and compliance of oral azithromycin thrice weekly for // Acta Dermatovenerol Croat. 2008;16 (1): 13–8.
, Skroza N., Ruggiero A. et al. Moderate acne vulgaris: efficacy, tolerance and compliance of oral azithromycin thrice weekly for // Acta Dermatovenerol Croat. 2008;16 (1): 13–8. - Bardazzi F., Savoia F., Parente G. et al. Azithromycin: a new therapeutical strategy for acne in adolescents // Dermatol Online J. 2007; 13 (4): 4.36.
- Babaeinejad S., Khodaeiani E., Fouladi R. F. Comparison of therapeutic effects of oral doxycycline and azithromycin in patients with moderate acne vulgaris: What is the role of age? // J Dermatolog Treat. 2011; 22 (4): 206–10.
И. В. Андреева, кандидат медицинских наук
О. У. Стецюк, кандидат медицинских наук
НИИ антимикробной химиотерапии ГБОУ ВПО СГМА Минздравсоцразвития России, Смоленск
Контактная информация об авторах для переписки: [email protected]
Анальгетики и жаропонижающие средства, Кортикостероиды, системные, Бронходилататоры, Антибиотики, Противовирусные препараты, Кортикостероиды, ингаляционные, Противовоспалительное средство
Brodzinski H, Ruddy RM. Обзор новых и недавно обнаруженных вирусов дыхательных путей у детей. Скорая педиатрическая помощь . 2009 Май. 25 (5): 352-60; викторина 361-3. [Медлайн].
Мирон Д., Сруго И., Кра-Оз З., Кенесс Ю., Вольф Д., Амирав И. и др. Единственный возбудитель острого бронхиолита: играют ли другие организмы помимо респираторно-синцитиального вируса? Pediatr Infect Dis J . 2010 29 января (1): e7-e10. [Медлайн].
Войнов Ю.А., Рубин Б.К. Муцины, слизь и мокрота. Сундук . 2009 Февраль 135 (2): 505-12. [Медлайн].
Крейндлер Дж. Л., Джексон А. Д., Кемп П. А., Бриджес Р. Дж., Данахай Х. Ингибирование секреции хлоридов в эпителиальных клетках бронхов человека экстрактом сигаретного дыма. Am J Physiol Lung Cell Mol Physiol . 2005 Май. 288 (5): L894-902. [Медлайн].[Полный текст].
МакКоннелл Р., Берхан К., Гиллиланд Ф., Молитор Дж., Томас Д., Лурманн Ф. и др. Проспективное исследование загрязнения воздуха и симптомов бронхита у детей с астмой. Am J Respir Crit Care Med . 2003 г., 1. 168 (7): 790-7. [Медлайн]. [Полный текст].
Brieu N, Guyon G, Rodière M, Segondy M, Foulongne V. Бокавирусная инфекция человека у детей с заболеваниями дыхательных путей. Pediatr Infect Dis J . 2008 ноя.27 (11): 969-73. [Медлайн].
Pediatr Infect Dis J . 2008 ноя.27 (11): 969-73. [Медлайн].
Schildgen O, Müller A, Allander T, Mackay IM, Völz S, Kupfer B, et al. Бокавирус человека: пассажир или возбудитель острых респираторных инфекций ?. Clin Microbiol Ред. . 2008 Apr, 21 (2): 291-304, содержание. [Медлайн]. [Полный текст].
Алландер Т. Бокавирус человека. Дж. Клин Вирол . 2008 г., 41 (1): 29-33. [Медлайн].
Кохорн М., Карр С.Дж., Демерс П.А., Ленкар К., Тамбурик Л., Брауэр М.Описательные эпидемиологические особенности бронхиолита в популяционной когорте. Педиатрия . 2008 декабрь 122 (6): 1196-203. [Медлайн].
Tsai CH, Huang JH, Hwang BF, Lee YL. Табачный дым в домашних условиях и риски астмы, хрипов и бронхитических симптомов у детей на Тайване. Respir Res . 29 января 2010 г., 11:11. [Медлайн]. [Полный текст].
Respir Res . 29 января 2010 г., 11:11. [Медлайн]. [Полный текст].
Гош Р., Росснер П., Хонкова К., Досталь М., Срам Р. Дж., Герц-Пиччиотто И.Загрязнение воздуха и детский бронхит: взаимодействие с ксенобиотиками, генами иммунной регуляции и генами восстановления ДНК. Окружающая среда Инт . 2016 Февраль 87: 94-100. [Медлайн].
Бидивала А, Крылов Л.Р., Пирзада М, Патель С.Дж. Дебаты сторонников правонарушений: Затяжной бактериальный бронхит как причина хронического кашля у детей. Педиатр Энн . 2015 Август 44 (8): 329-36. [Медлайн].
Ди Филиппо П., Скапарротта А., Петрозино М.И., Аттанази М., Ди Пилло С., Кьярелли Ф. и др.Недооцененная причина хронического кашля: затяжной бактериальный бронхит. Энн Торак Мед . 2018 янв-март. 13 (1): 7-13. [Медлайн].
Escribano Montaner A, García de Lomas J, Villa Asensi JR, Asensio de la Cruz O, de la Serna Blázquez O, Santiago Burruchaga M, et al.Бактерии из жидкости бронхоальвеолярного лаважа от детей с подозрением на хроническую инфекцию нижних дыхательных путей: результаты многоцентрового перекрестного исследования в Испании. Eur J Pediatr . 2018 Февраль 177 (2): 181-192. [Медлайн].
Чанг А.Б., Оппенгеймер Дж. Дж., Вайнбергер М. М., Рубин Б. К., Грант С. К., Вейр К. и др. Ведение детей с хроническим влажным кашлем и затяжным бактериальным бронхитом: руководство CHEST и отчет экспертной комиссии. Сундук . 2017 апр.151 (4): 884-890. [Медлайн].
Сундук . 2017 апр.151 (4): 884-890. [Медлайн].
Кантар А., Чанг А.Б., Шилдс, доктор медицины, Марчант Дж.М., Гримвуд К., Григг Дж. И др. Заключение ERS о затяжном бактериальном бронхите у детей. евро Респир J . 2017 г. 50 (2): [Medline].
Брукс К., Карутерс Р.Л., Шумахер К.Р., Стрингер К.А. Проблемы фармакотерапии фонтан-ассоциированного пластического бронхита: редкое педиатрическое заболевание. Фармакотерапия . 2013 Сентябрь 33 (9): 922-34. [Медлайн].[Полный текст].
Сингхи А.К., Винот Б., Курувилла С., Сивакумар К. Пластический бронхит. Энн Педиатр Кардиол . 2015 сен-дек. 8 (3): 246-8. [Медлайн]. [Полный текст].
Zaccagni HJ, Kirchner L, Brownlee J, Bloom K. Случай пластического бронхита через 9 лет после Фонтана. Педиатр Кардиол . 2008 29 января (1): 157-9. [Медлайн].
Педиатр Кардиол . 2008 29 января (1): 157-9. [Медлайн].
Захорец М., Ковачикова Л., Мартанович П., Скрак П., Куновский П.Применение высокочастотной струйной вентиляции для снятия закупоривающих цилиндров у больных пластическим бронхитом. Pediatr Crit Care Med . 2009 Май. 10 (3): e34-6. [Медлайн].
Рубин БК. Пластический бронхит. Clin Chest Med . 2016 Сентябрь 37 (3): 405-8. [Медлайн].
Шах С.С., Дринкуотер, округ Колумбия, Кристиан КГ. Пластический бронхит: можно ли перевязать грудной проток? Энн Торак Хирург . 2006 июн. 81 (6): 2281-3.[Медлайн].
DePopas EM, Veress LA, Ahmed F, Rausch CM, Annam A, Gupta R. Чрескожное вмешательство в грудной проток для лечения пластического бронхита, связанного с паллиативной терапией по Фонтану. Педиатр Пульмонол . 2017 г. 52 (11): E97-E101. [Медлайн].
Педиатр Пульмонол . 2017 г. 52 (11): E97-E101. [Медлайн].
Министерство здравоохранения и социальных служб США. Статистика естественного движения населения и здоровья. Национальное обследование амбулаторной медицинской помощи: Резюме 1991 г. Серия 13: Данные Национального исследования здоровья № 116 .Публикация DHHS; Май 1994.
Weigl JA, Puppe W, Belke O, Neusüss J, Bagci F, Schmitt HJ. Описательная эпидемиология тяжелых инфекций нижних дыхательных путей у детей в Киле, Германия. Клинский Падиатр . 2005 сентябрь-октябрь. 217 (5): 259-67. [Медлайн].
Берхан К., Чанг СС, МакКоннелл Р. и др. Ассоциация изменений качества воздуха с симптомами бронхита у детей в Калифорнии, 1993-2012 гг. JAMA . 2016 12 апреля.315 (14): 1491-501. [Медлайн].
Уста Гук Б., Асилсой С., Дурмаз С. Оценка и лечение хронического кашля у детей в соответствии с рекомендациями Британского торакального общества: описательное, проспективное, клиническое исследование. Clin Respir J . 2013 27 ноября. [Medline].
Брантон С., Кармайкл Б.П., Колган Р., Фини А.С., Фендрик А.М., Квинтилиани Р. и др.Острое обострение хронического бронхита: согласованное руководство первичной медико-санитарной помощи. Am J Manag Care . 2004 г., 10 (10): 689-96. [Медлайн].
Stiehm ER. Четыре наиболее распространенных детских иммунодефицита. J Иммунотоксикол . 2008 г., 5 (2): 227-34. [Медлайн].
Kainulainen L, Nikoskelainen J, Ruuskanen O. Диагностические данные у 95 финских пациентов с общим вариабельным иммунодефицитом. Дж. Клин Иммунол . 2001 21 марта (2): 145-9. [Медлайн].
Nelson MR, Adamski CR, Tluczek A. Клиническая практика промежуточных тестов пота после обследования новорожденных на аномальный кистозный фиброз. J Cyst Fibros .2011 декабрь 10 (6): 460-5. [Медлайн]. [Полный текст].
Доннелли Дж. П., Баддли Дж. У., Ван Х. Использование антибиотиков при острых респираторных инфекциях в США Отделения неотложной помощи. Антимикробные агенты Chemother . 2014 Март 58 (3): 1451-7. [Медлайн].
Антимикробные агенты Chemother . 2014 Март 58 (3): 1451-7. [Медлайн].
Kronman MP, Zhou C, Mangione-Smith R. Распространенность бактерий и тенденции назначения противомикробных препаратов при острых респираторных инфекциях. Педиатрия . 2014 Октябрь 134 (4): e956-65.[Медлайн].
Фреллик М. Антибиотики назначаются детям вдвое чаще. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/831684. 15 сентября 2014 г .; Дата обращения: 16 июня 2015 г.
Ивановская В., Хек К., Мантел-Теувисс А.К., Leufkens HGM, ван Дейк Л. Назначение антибиотиков в зависимости от возраста и соблюдение рекомендаций у педиатрических пациентов в первичной медицинской помощи. Pediatr Infect Dis J . 2018 марта 37 (3): 218-223.[Медлайн].
Фреллик М. Сценарии антибиотиков при бронхите, общие, несмотря на рекомендации. Медицинские новости Medscape. Доступно на http://www.medscape.com/viewarticle/825471. 21 мая 2014 г .; Дата обращения: 16 июня 2015 г.
Камин В., Майданник В.Г., Малек Ф.А., Кизер М.Эффективность и переносимость EPs 7630 у пациентов (в возрасте 6-18 лет) с острым бронхитом. Acta Paediatr . 2010 Апрель 99 (4): 537-43. [Медлайн]. [Полный текст].
Камин В., Майданник В., Малек Ф.А., Кизер М. Эффективность и переносимость EP 7630 у детей и подростков с острым бронхитом — рандомизированное, двойное слепое, плацебо-контролируемое многоцентровое исследование лекарственного препарата на травах из корней Pelargonium sidoides. Int J Clin Pharmacol Ther .2010 Март 48 (3): 184-91. [Медлайн].
Int J Clin Pharmacol Ther .2010 Март 48 (3): 184-91. [Медлайн].
Марчант Дж, Мастерс IB, Чемпион А, Петски Х, Чанг AB. Рандомизированное контролируемое испытание амоксициллина клавуланата у детей с хроническим влажным кашлем. Грудь . 2012 августа 67 (8): 689-93. [Медлайн].
Кронин Дж., Кеннеди Ю., Маккой С., Ан Фхайли С. Н., Криспино-О’Коннелл Дж., Хайден Дж. И др. Сравнение однократной пероральной дозы дексаметазона и многодозового преднизолона при лечении обострений астмы у детей, обращающихся в отделение неотложной помощи: протокол рандомизированного контролируемого исследования. Испытания . 2012 21 августа, 13:14. [Медлайн]. [Полный текст].
Beckhaus AA, Riutort MC, Castro-Rodriguez JA. Сравнение ингаляционных и системных кортикостероидов при острой астме у детей. Систематический обзор. Педиатр Пульмонол . 2013 8 августа [Medline].
Педиатр Пульмонол . 2013 8 августа [Medline].
Ray WA, Murray KT, Hall K, Arbogast PG, Stein CM. Азитромицин и риск смерти от сердечно-сосудистых заболеваний. N Engl J Med . 2012 17 мая. 366 (20): 1881-90. [Медлайн]. [Полный текст].
Giudicessi JR, Ackerman MJ. Азитромицин и риск внезапной сердечной смерти: виновен или ложно обвинен ?. Клив Клин Дж. Мед . 2013 Сентябрь 80 (9): 539-44. [Медлайн]. [Полный текст].
Чанг А.Б., Оппенгеймер Дж. Дж., Вайнбергер М. М., Рубин Б. К., Грант С. К., Вейр К. и др. Ведение детей с хроническим влажным кашлем и затяжным бактериальным бронхитом: руководство CHEST и отчет экспертной комиссии. Сундук . 2017 Апрель 151 (4): 884-890.[Медлайн].
McConnell et al. 54 (EHP) 54 (EHP) | Поперечное сечение (n = 3676) | 4 -й , 7 -й и 10 -й класс | Бронхит у астматиков | Измерения центрального участка PM 10 (19 мкг / м 3 ), PM 2,5 (15 мкг / м 3 ), O 3 (32 частей на миллиард) и NO 2 (24 частей на миллиард) | Астматики PM 10 — 1 .4 (1,1, 1,8) PM 2,5 — 1,4 (0,9, 2,3) O 3 — 1,0 (0,6, 1,7) NO 2 — 1,3 (0,8, 2,2) Неастматики PM 10 — 0,7 (0,4, 1,0) PM 2,5 — 0,5 (0,3, 1,0) O 3 — 0,9 (0,4, 1,8) NO 2 — 0,8 (0,4, 1,7) |
| Morgenstern et al. al. 55 (AJRCCM) | Когорта продольных рождений (n = 2436) | 0–6 лет | Астматический, спастический или обструктивный бронхит | Моделируемое воздействие PM 2.5 (1 мкг / м 3 ), PM 2,5 Поглощение (0,2 ∗ 10 -5 / м), NO 2 (6,4 мкг / м 3 ) и расстояние до ближайшей дороги (& lt ; 50 м) | PM 2,5 — 1,12 (0,94, 1,29) PM 2,5 (поглощающая способность) — 1,56 (1,03, 2,37) NO 2 — 1,04 (0,67, 1,39) Dt до дороги — 1,66 (1.01, 2.59) |
| Morgenstern et al. 56 (OEM) | Когорта продольных рождений (n = 3577) | 0–2 года | Астматический, спастический или обструктивный бронхит | Смоделированное воздействие ТЧ на IQR 2.5 (1 мкг / м 3 ), PM 2,5 Поглощение (0,2 ∗ 10 -5 / м), NO 2 (5,7 мкг / м 3 ) и расстояние до ближайшей дороги (& lt ; 50 м) | Первый год PM 2,5 — 1,04 (0,90, 1,29) PM 2,5 (поглощение) — 1,14 (0,88, 1,48) NO 2 — 1,30 (1,03, 1,66) Dt до дорога — 1,12 (0,88, 1,44) Второй год PM 2,5 — 1,05 (0,92, 1,20) PM 2,5 (поглощение) — 0,85 (0.31, 2.34) NO 2 — 0,82 (0,33, 2,03) Dt до дороги — 1,23 (1,00, 1,51) |
| Brauer et al. 20 (ERJ) | Когорта продольного рождения (n = 3496) | 0–4 года | Бронхит диагностирован врачом | Измерения ТЧ с помощью ГИС 2,5 (3,3 мкг / м 3 ), NO 2 (10,6 мкг / м 3 ) и сажа (0,6 * 10 -5 / м). OR по мере увеличения IQR | PM 2,5 — 0,88 (0,66, 1,18) NO 2 — 0.90 (0,69, 1,16) Сажа — 0,90 (0,70, 1,15) |
| Герц-Пиччиотто и др. 57 | Когорта продольных родов (n = 1133) | 0–4,5 года | Острый бронхит | Измерения в центральном месте, ПАУ (100 нг / м 3 ), PM 2,5 (25 мкг / м 3 ). Приращение ∼2SD. | 0–2 года ПАУ — 1,29 (1,07, 1,54) PM 2,5 — 1,30 (1,08, 1,58) 2–4,5 года ПАУ — 1,56 (1,22, 2,00) PM 2.5 — 1,23 (0,94, 1,62) |
| Ghosh et al. 58 | Когорта продольных рождений (n = 1133) | 0–4,5 года | Острый бронхит | Измерения в центральной области, NO x (35 мкг / м 3 ) | От 0 до 2 лет — 1,31 (1,07, 1,61) 2 до 4,5 — 1,23 (1,01, 1,49) |
Клинические характеристики затяжного бактериального бронхита у китайских младенцев
Хронический кашель очень часто встречается у китайских детей 11,12,13 .Wurzel et al. 14 сообщили, что ПБД, характеризующийся длительным влажным кашлем> 4 недель и положительным по бактериальной культуре ЖБАЛ, который разрешился после лечения антибиотиками, является наиболее частой причиной хронического кашля у детей. Доннелли и др. 15 ретроспективно проанализировал 81 случай детей с ПБД и обнаружил, что двухнедельный курс лечения амоксициллином / клавулановой кислотой является эффективным противомикробным препаратом. В настоящем исследовании мы обнаружили ПБД у трех четвертей детей младше трех лет с хроническим влажным кашлем, что указывает на то, что ПБД также является важной причиной хронического влажного кашля у детей в Сучжоу, Китай.Доля ПБД у детей с хроническим кашлем была выше, чем указано в предыдущих отчетах 4,5 . Это может быть связано с относительно небольшим размером выборки из-за того, что количество пациентов в нашем исследовании было ограничено детьми с хроническим влажным кашлем, родители которых согласились на бронхоскопию.
Первоначальные диагностические критерии для ПБД включали наличие бактериальной инфекции нижних дыхательных путей. Мы диагностировали ПБД в соответствии со следующими критериями: 1) Хронический изолированный влажный кашель, который сохранялся> 4 недель без каких-либо клинических проявлений, указывающих на альтернативный диагноз и разрешение с помощью соответствующего лечения антибиотиками в течение двух недель 16,17,18,19 .2) Руководство по диагностике и лечению ПБД у китайских детей: (а) изолированный влажный кашель в течение> 4 недель; (b) положительная культура бронхоальвеолярного лаважа (БАЛ) или нейтрофилов> 3,5% в БАЛ; и (c) разрешение кашля с помощью лечения антибиотиками в течение двух недель; (г) отсутствие альтернативной этиологии 20 . 3). Ридлер и его коллеги сообщили о клеточности бронхоальвеолярного лаважа у здоровых детей. Нормальный диапазон Neu% составляет 0,6 ± 3,5, с нейтрофилами> 3,5% в БАЛ, что указывает на нейтрофильное воспаление 21 .В этом исследовании у пациентов с ПБД был влажный кашель более четырех недель без признаков острых инфекций, но никаких других патогенов обнаружено не было. Кашель разрешился после лечения антибиотиками в течение двух недель. Поэтому мы диагностировали ПБД. Причина того, что бактерии были обнаружены только у 38% детей, может заключаться в том, что большинство пациентов лечились антибиотиками в клинике, что повлияет на результат бактериального посева. Однако первоначально использование антибиотиков длилось менее одной недели и, скорее всего, было недостаточно для лечения ПБД.
Предыдущие исследования показали, что ПБД встречается в основном у детей младше трех лет, преобладает у мужчин и что ПБД сосуществует с маляцией дыхательных путей 9,22 . Данные, полученные в этом исследовании, согласуются с этими отчетами. Общие симптомы ПБД включают влажный кашель, хрипы и стридор. Во многих случаях присутствовали легочные признаки влажных хрипов и / или хрипов. Что касается фазы кашля, у пациентов с ПБД не было разницы между днем и ночью, хотя было различие между диагнозом ЦВА и UACS.Кашель, вызванный ЦВА, часто возникает ночью и / или рано утром и после тренировки. Кашель, связанный с UACS, обычно вызывается изменениями положения тела или возникает утром 6,7 . Сообщалось о высокой доле эпизодов свистящего дыхания у детей с ПБД 18 . Аналогичным образом, в нашем исследовании 86% детей с ПБД имели хрипы, что может привести к тому, что педиатры ошибочно диагностируют ПБД как бронхиальную астму. Некоторым неопытным педиатрам сложно поставить точный диагноз астмы у детей младше 3 лет.Мы диагностировали астму в соответствии с рекомендациями по диагностике и оптимальному лечению астмы у детей 23 . Бронхиальная астма диагностируется по эпизодическим хрипам и кашлю, демонстрируемым реакцией на бронходилататоры и / или ответом на ингаляционные стероиды с разрешением кашля в течение первых двух недель лечения; нет ответа на лечение антибиотиками; у пациента обычно есть атопия и семейная история астмы; и другие болезненные хрипы исключены.
В пяти (12%) наших случаях астма была ошибочно диагностирована, но лечение ингаляционными кортикостероидами не помогло.Несколько исследований 24,25,26 показали, что сосуществование ПБД с маляцией дыхательных путей и нейтрофильным воспалением в ЖБАЛ имеет сильную корреляцию с хрипом. Marchant et al. 24 сообщили, что дети с ПБД имели выраженную нейтрофилию дыхательных путей и повышенные медианные уровни воспалительных цитокинов по сравнению с детьми с кашлем, который разрешился естественным путем, или с детьми без кашля. Le Bourgeois et al. 25 сообщили, что нейтрофильно-опосредованное воспаление в дыхательных путях, по-видимому, лучше характеризует повторяющиеся хрипы у детей младше трех лет.De Schutter et al. 27 обнаружили высокие показатели бактериальной инфекции и выраженное нейтрофильное воспаление у маленьких детей с постоянным хрипом. Эти данные дают возможное объяснение отсутствия ответа на терапию ингаляционными кортикостероидами. Таким образом, при лечении детей с хроническим влажным кашлем, сопровождающимся свистящим дыханием, которые не реагируют на лечение ингаляционными кортикостероидами, клиницисты должны рассматривать ПБД в качестве возможного провоцирующего фактора и выполнять бронхоскопию.
В нашем исследовании врожденная маляция дыхательных путей, включая ларингомаляцию, трахеомаляцию, бронхомаляцию, ларинго- и бронхомаляцию, трахео- и бронхомаляцию, была обнаружена в 22 случаях (44%) с ПБД.Уровень выявления маляции был выше, чем в предыдущих отчетах 28 . Kompare et al. сообщил, что малация дыхательных путей была представлена у 74% детей с ПБД. 26 . Авторы предполагают, что малация дыхательных путей является предрасполагающей аномалией для ПБД. Коллапс дыхательных путей снижает эффективность кашля и может мешать нормальному оттоку слизистой оболочки головы 29 . Наличие трахеомаляции может ухудшить клиренс слизи и вызвать задержку трахеобронхиального секрета, что способствует сохранению инфекции нижних дыхательных путей.Сравнивая ПБД с маляцией дыхательных путей с ПБД без маляции, мы обнаружили, что дети с маляцией дыхательных путей были моложе детей без маляции. Клинические проявления, иммунная функция, клеточность и бактериальная культура BALF у пациентов с маляцией дыхательных путей не отличались от пациентов без маляции. Наши результаты показывают, что, хотя у детей с ПБД часто наблюдалась маляция дыхательных путей, сопутствующая маляция дыхательных путей не усугубляла заболевание.
В настоящем исследовании мы оценили иммунную функцию пациентов с ПБД.Хотя основные уровни иммуноглобулинов были нормальными, наблюдались аномальные различия в субпопуляциях лимфоцитов между ПБД и группой «без ПБД». Процент CD3 + и CD3 + CD4 + клеток был значительно ниже в группе PBB по сравнению с контрольной группой. Напротив, процент клеток CD19 + , CD16 + , CD56 + (естественные киллеры, NK) и клеток CD23 + был значительно повышен. Изменения субпопуляций лимфоцитов у детей с ПБД предполагают наличие иммунного нарушения, которое может быть связано с возникновением ПБД.Когда подгруппы Т-клеток, тяжесть и продолжительность кашля были проанализированы у пациентов с ПБД, чтобы оценить, существует ли значимая корреляция, мы не смогли продемонстрировать такую связь, что указывает на то, что наблюдаемые изменения в уровнях Т-клеток не усугубляли болезнь. Снижение количества CD3 + и CD3 + CD4 + вспомогательных Т-лимфоцитов влияет на способность организма удалять патогены и, вероятно, связано с устойчивыми бактериальными инфекциями в нижних дыхательных путях и продлением болезни.Клетки CD19 + , представляющие активированные В-клетки, могут опосредовать иммунный ответ, секретируя различные иммуноглобулины. Можно считать, что бактериальный инфекционный аспект ПБД и сопутствующий иммунный ответ вызывают активацию вспомогательных Т-лимфоцитов CD4 + , что, в свою очередь, приводит к активации продуцирующих антитела В-клеток. Wurzel DF et al. 14 сообщили, что повышенные уровни CD16 + и CD56 + (NK) клеток у детей с ПБД часто связаны с повышенными показателями выявления вирусов в БАЛ.NK-клетки играют роль во врожденной иммунной защите от вирусных инфекций. Однако мы не исследовали респираторные вирусные инфекции в ЖБАЛ. Причина высоких уровней NK-клеток у детей с ПБД до сих пор неясна. Механизм, связывающий ПБД с потенциальным иммунным заболеванием, требует дальнейшего изучения.
В настоящем исследовании в образцах ЖБАЛ детей с ПБД наблюдались повышенный процент нейтрофильных клеток и пониженный процент макрофагов. Эти результаты согласуются с другими отчетами 4,22,30 .Наиболее частыми возбудителями, культивируемыми из БАЛ, были Haemophilus influenzae (47,4%) и Streptococcus pneumoniae (36,8%), что согласуется с предыдущими исследованиями 4,14 . Zgherea et al. исследовал 109 детей с хроническим влажным кашлем и получил H. influenzae и S. pneumoniae из БАЛ в 49% и 20% изолятов соответственно 28 . Marchant et al. сообщил, что H. influenzae (47%) и S. pneumoniae (35%) были наиболее часто обнаруживаемыми бактериальными патогенами в ПБД 31 .Наши результаты, наряду с этими исследованиями, показывают, что нейтрофильное воспаление присутствует в ПБД и может быть связано с сохранением основных инфекций дыхательных путей. В некоторых местах в Китае нет программы вакцинации детей, которая защитила бы от этих двух бактериальных патогенов. Особенно с учетом роста устойчивости к антибиотикам следует рекомендовать программу вакцинации детей против H. influenzae и S. pneumoniae .
Действующие международные клинические руководства рекомендуют лечение антибиотиками в качестве надлежащего лечения ПБД 6,8 .Marchant et al. сообщил, что двухнедельный режим приема амоксициллина / клавуланата позволит разрешить кашель у значительного числа детей с ПБД. 32 . Доннелли и др. сообщил, что у 51% пациентов симптомы полностью исчезли после двух курсов антибиотиков, а у 13% пациентов потребовалось более шести курсов антибиотиков. 15 . В нашем исследовании 74% пациентов получали антибактериальную терапию до госпитализации. Неадекватные схемы лечения и неправильный выбор антибиотиков могут объяснить, почему лечение не удалось.После госпитализации все пациенты получали лечение антибиотиками, включая амоксициллин / клавулановую кислоту, в среднем в течение 17,4 ± 9,0 дней. В 38 случаях (76%) кашель исчез в течение двух недель приема лекарств, что указывает на хороший прогноз для ПБД. В некоторых исследованиях предполагалось, что нелеченые ПБД и / или рецидивирующие эпизоды ПБД будут прогрессировать до CSLD и бронхоэктазов. Однако доля PBB в развитии CSLD и бронхоэктазов неизвестна. В будущем необходимы более долгосрочные когортные исследования, чтобы полностью подтвердить эту гипотезу.
Настоящее исследование имеет ограничение, заключающееся в том, что мы не исследовали распространенные респираторные вирусы в ЖБАЛ. Таким образом, роль вирусов в кашле и хрипе не рассматривалась. Кроме того, время наблюдения было относительно коротким, и поэтому трудно прийти к окончательному выводу относительно исхода ПБД. Требуются дальнейшие исследования, включая обнаружение вирусов и более длительные периоды наблюдения.
Таким образом, наше исследование предоставляет доказательства того, что ПБД является важной причиной хронического влажного кашля у детей младше трех лет в Сучжоу, Китай.Клинические характеристики ПБД включали влажный кашель, который у большинства пациентов сопровождался хрипом. У детей с ПБД часто наблюдалась маляция дыхательных путей, однако сопутствующая маляция дыхательных путей не усугубляла заболевание. Наиболее частыми патогенами, культивируемыми из БАЛ пациентов, были Haemophilus influenzae и Streptococcus pneumoniae. Более того, у детей с ПБД наблюдались изменения в субпопуляциях лимфоцитов.
Отзывы пользователей азитромицина о бронхите на Drugs.com
Также известен как: Zithromax, Пакет с дозировкой азитромицина, Z-Pak
Азитромицин имеет средний рейтинг 6.2 из 10 из 169 оценок для лечения бронхита. 53% пользователей, просмотревших Азитромицин, сообщили о положительном эффекте, а 33% сообщили об отрицательном эффекте.
Фильтр по условию Все условия Бабезиоз (2) Профилактика бактериального эндокардита (2) Бактериальная инфекция (75) Бартонеллез Бронхит (181) Цервицит (2) Шанкроидная хламидийная инфекция (580) ХОБЛ, Острый (5) Муковисцидоз (1) Гонококковая инфекция, легочная пневмония, неосложненная инфекция (1) Болезнь Лайма, Migrans Erythema Chronicum (2) Mycobacterium avium-intracellulare, Профилактика Mycobacterium avium-intracellulare, Лечение (2) Микоплазменная пневмония (2) Негонококковый уретрит (1) Профит, пневмония, пневмония, воспаление легких, воспаление легких, воспаление легких, воспаление легких 36) Синусит (127) Инфекция кожи и структур (1) Инфекция кожи или мягких тканей (7) Профилактика ЗППП (1) Тонзиллит / фарингит (64) Токсоплазмоз, тиф, инфекция верхних дыхательных путей (57)
Обзор азитромицина
6.2/10 Средний рейтинг
Оценок: 169 из 181 отзыва пользователей
Сравните все 90 лекарств, используемых при лечении бронхита.
| 10 | 30% | 50 | |
|---|---|---|---|
| 9 | 13% | 22 | |
| 8 | 11% | 18 | |
| 7 | 5% | 8 | |
| 6 | 1% | 2 | |
| 5 | 7% | 11 | |
| 4 | 1% | 2 | |
| 3 | 4% | 7 | |
| 2 | 8% | 13 | |
| 1 | 21% | 36 |
Часто задаваемые вопросы
Дополнительные вопросы и ответы
Эта информация НЕ предназначена для рекомендации какого-либо конкретного лекарства.Хотя эти обзоры могут быть полезны, они не заменяют опыт, знания и суждения практикующих врачей.
Подробнее о бронхите
Центр здоровья Drugs.com
Ссылка на клинику Мэйо
Антибиотики при бронхите: плохая идея
Новое исследование показывает, что врачи не прекращают прописывать антибиотики при остром бронхите, несмотря на рекомендации (Фото: Джо Рэдл, Getty Images).
Если вы считаете, что вам нужен антибиотик при остром бронхите, вы ошибаются, но вы не одиноки.Антибиотик ставка по рецепту для взрослых с общим недугом упорно остается в диапазоне от 60% до 80%, несмотря на длительное усилие, чтобы получить их до нуля, говорится в новом докладе.
Острый бронхит — это кашель, который продолжается до трех недель, часто после простуды или гриппа. Это почти всегда вызвано вирусами. Антибиотики лечат только бактерии и приносят больше вреда, чем пользы, когда используются без надобности. Эксперты говорят, что они ничего не делают от кашля, вызванного вирусами, каким бы хакерским, слизистым или раздражающим он ни был.
«Ужасная правда об остром бронхите заключается в том, что кашель в среднем длится три недели, и не имеет значения, принимаете вы антибиотик или нет», — говорит Джеффри Линдер, специалист по внутренним болезням в Бригаме и женской больнице, Бостон. . Он является соавтором исследовательского письма, опубликованного во вторник в медицинском журнале JAMA .
Исследователи изучили записи о 3 153 посещениях кабинетов врачей и отделений неотложной помощи по поводу острого бронхита в период с 1996 по 2010 год. Они включали только взрослых, которые в остальном были здоровы, а не людей с иммунодефицитом, раком, заболеваниями легких или другими состояниями, которые могут затруднить принятие решения. -изготовление.
Результат: в среднем 71% получали антибиотики, и после возможного спада в 1999–2001 годах этот показатель со временем немного повысился. Цифры, взятые в каждый период времени, были слишком малы, чтобы давать твердые оценки по годам, но тенденция очевидна, говорит Линдер: «Мы прилагаем все усилия, но мы совсем не двигаемся вперед».
Эта неудача отражает более серьезную проблему, говорят Линдер и другие исследователи: пациенты продолжают требовать, а врачи продолжают назначать антибиотики для лечения проблем, которые они не могут вылечить.В результате пациенты страдают от ненужных побочных эффектов, таких как диарея и аллергические реакции, и играют определенную роль в развитии и распространении микробов, которые больше не реагируют на чрезмерное использование антибиотиков.
Хорошая новость заключается в том, что в связи с некоторыми заболеваниями, такими как детские ушные инфекции и ангина, количество прописанных антибиотиков снижается, говорит Линдер.
Тот факт, что показатели бронхита не так хороши, вызывает сожаление, потому что «бронхит оказывается первой причиной, по которой врачи назначают антибиотики взрослым», — говорит Ральф Гонсалес, профессор медицины Калифорнийского университета в Сан-Франциско. .Гонсалес, который не участвовал в новом исследовании, говорит, что обучение врачей и пациентов оказалось трудным, несмотря на кампании федеральных центров по контролю и профилактике заболеваний и других.
Для пациентов, по его словам, «существует культурное поверье», что бронхит излечим с помощью антибиотиков. А бронхит может быть неприятной болезнью, говорит он: «Невозможно страдать в тишине, потому что вы все время кашляете». По его словам, лекарства от кашля и другие методы лечения не работают особенно хорошо, поэтому напряженные, занятые взрослые отчаянно пытаются получить облегчение и ошибочно считают антибиотики быстрым решением.
Врачи, в свою очередь, беспокоятся о пропавшей пневмонии, которую иногда лечат антибиотиками, — говорит Гонсалес. Но, по его словам, тщательный осмотр почти всегда может исключить это у здоровых людей. Вот почему, по его словам, приобретать антибиотики по телефону — особенно плохая идея.
Итак, что делать, если у вас бронхит? По данным Американской академии семейных врачей, лечение для взрослых включает:
• Отдых, жидкости и увлажнители
• Безрецептурные обезболивающие
• Лекарства от кашля (если кашель сухой)
• Ингаляционные бронходилататоры — лекарства обычно используется при астме — если хрипы сопровождаются кашлем.
Прочтите или поделитесь этой историей: https://www.usatoday.com/story/news/nation/2014/05/20/antibiotics-bronchitis-study/9323165/
Mycoplasma pneumoniae Infections — HealthyChildren.org
Некоторые Легочные инфекции, включая многие случаи легкой пневмонии (также называемой ходячей пневмонией), вызываются организмом под названием Mycoplasma pneumoniae. Он передается от человека к человеку с выделениями, такими как мокрота из дыхательных путей, и имеет инкубационный период от 2 до 3 недель.Передача этого организма обычно происходит при тесном контакте. Вспышки произошли и распространены в летних лагерях и колледжах, а также внутри домашних хозяйств среди членов семьи.
Хотя M pneumoniae инфекции редко встречаются у детей младше 5 лет, они являются основной причиной пневмонии у детей школьного возраста и молодых людей. Эпидемии этой болезни в общинах происходят каждые 4-7 лет.
Признаки и симптомы
Инфекция M pneumoniae вызывает симптомы, обычно легкие.У некоторых детей со временем они могут ухудшиться. Наиболее частые симптомы —
- Бронхит
Инфекции верхних дыхательных путей, включая боль в горле, а иногда и инфекции уха
У детей с этой инфекцией также может быть высокая температура, длительная слабость, а в некоторых случаях — головные боли и сыпь. Их кашель может измениться с сухого на мокрый. В редких случаях у детей может развиться круп и инфекция носовых пазух (синусит).
Когда звонить педиатру
Если эти симптомы, включая лихорадку, длятся более нескольких дней, обратитесь к педиатру.
Как ставится диагноз?
Ваш педиатр проведет медицинское обследование вашего ребенка. Врач может назначить анализ крови на антитела к M pneumoniae или холодовым агглютининам, , которые представляют собой особый тип антител. Разрабатываются специальные тесты для выявления микроорганизмов в пробах из горла и дыхательных путей, но они пока недоступны.
Лечение
В большинстве случаев бронхит и заболевания верхних дыхательных путей, связанные с инфекциями M pneumoniae , протекают в легкой форме и проходят самостоятельно без лечения антибиотиками. Однако антибиотики, такие как эритромицин, азитромицин или доксициклин, могут быть назначены при более серьезных симптомах, связанных с пневмонией и ушными инфекциями.
Каков прогноз?
Эта инфекция часто вызывает хрипы у детей с астмой или реактивными дыхательными путями.Большинство людей полностью выздоравливают от этой инфекции, даже если не используются антибиотики. Смертность довольно низкая.
Информация, содержащаяся на этом веб-сайте, не должна использоваться вместо медицинской помощи и рекомендаций вашего педиатра. Ваш педиатр может порекомендовать различные варианты лечения в зависимости от индивидуальных фактов и обстоятельств.
Антибиотики при бронхиолите у детей до двух лет
Вопрос
Мы рассмотрели доказательства влияния антибиотиков на клинические исходы у детей с бронхиолитом.
Фон
Бронхиолит — серьезное респираторное заболевание, поражающее младенцев. Это чаще всего вызывается респираторно-синцитиальным вирусом (РСВ) и является наиболее частой причиной госпитализации детей младше шести месяцев. У младенцев обычно наблюдаются насморк, кашель, одышка и признаки затрудненного дыхания, которые могут стать опасными для жизни. Несмотря на вирусную причину, часто назначают антибиотики. Лица, назначающие лекарства, могут ожидать положительного эффекта от противовоспалительных эффектов, связанных с некоторыми антибиотиками, или беспокоиться о вторичной бактериальной инфекции, особенно у детей, которые очень плохо себя чувствуют и нуждаются в интенсивной терапии.Мы хотели выяснить, улучшают ли антибиотики клинические исходы у детей с бронхиолитом.
Характеристики исследования
Эти данные актуальны на июнь 2014 г. Мы выявили семь испытаний (824 участника), в которых сравнивали антибиотики с плацебо или без антибиотиков у детей с бронхиолитом. В двух из этих исследований также сравнивали внутривенные и пероральные антибиотики.
Ключевые результаты
Нашим основным результатом была продолжительность симптомов / признаков (продолжительность дополнительной потребности в кислороде, сатурация кислорода, хрипы, крепитация (потрескивание), лихорадка).Вторичные исходы включали продолжительность госпитализаций / время до выписки из больницы, повторную госпитализацию, осложнения / нежелательные явления (включая смерть) и рентгенологические (рентгенологические) данные.
Мы включили семь исследований с 824 участниками. Четыре исследования сообщили о продолжительности дополнительной потребности в кислороде и не продемонстрировали существенной разницы в продолжительности использования кислорода при сравнении антибиотиков с плацебо. Мы объединили три исследования, сравнивающих азитромицин и плацебо, и снова не продемонстрировали существенной разницы между антибиотиками и плацебо в продолжительности потребности в кислороде.В большинстве включенных исследований не сообщалось о первичных исходах, таких как хрип, крепитация и лихорадка. Одно исследование с высоким риском систематической ошибки показало неоднозначные результаты по влиянию антибиотиков на хрипы, но никаких различий по другим показателям симптомов. Одно исследование не обнаружило разницы в продолжительности лихорадки, а одно исследование не обнаружило разницы в наличии лихорадки на второй день.
Что касается вторичных исходов, в шести включенных исследованиях не было обнаружено различий между антибиотиками и плацебо в отношении продолжительности болезни или продолжительности пребывания в больнице.Что касается продолжительности пребывания в больнице, мы объединили данные трех исследований, сравнивающих использование азитромицина и плацебо в качестве промежуточного итога в рамках общего анализа влияния антибиотиков на пребывание в больнице. Эти комбинированные результаты аналогичным образом не показали разницы между антибиотиками (азитромицином) и плацебо. Одно небольшое исследование с высоким риском систематической ошибки показало, что трехнедельный курс кларитромицина значительно снизил вероятность повторной госпитализации по сравнению с плацебо. Однако это сокращение повторных госпитализаций не было воспроизведено в более недавнем исследовании, в котором 97 детей рандомизировали для получения однократной большой дозы азитромицина или плацебо.Не было зарегистрировано смертей ни в одной из групп любого из семи включенных испытаний, и ни одно из исследований не сообщало конкретно о побочных эффектах антибиотиков. Только в двух исследованиях были сделаны общие замечания о том, что при использовании антибиотиков не было обнаружено никаких побочных эффектов. Радиологические данные не были представлены как исход ни в одном из включенных исследований.
Качество доказательств
Этот обновленный обзор 2014 г. стал более сильным благодаря включению двух новых рандомизированных контролируемых испытаний (РКИ).В этих двух исследованиях участвовали еще 138 участников в группе антибиотиков и 143 участника в группе плацебо.

 Еще два дополнительных дня понадобится для закрепления эффекта — это придется делать даже в том случае, если симптомы заболевания полностью устранятся
Еще два дополнительных дня понадобится для закрепления эффекта — это придется делать даже в том случае, если симптомы заболевания полностью устранятся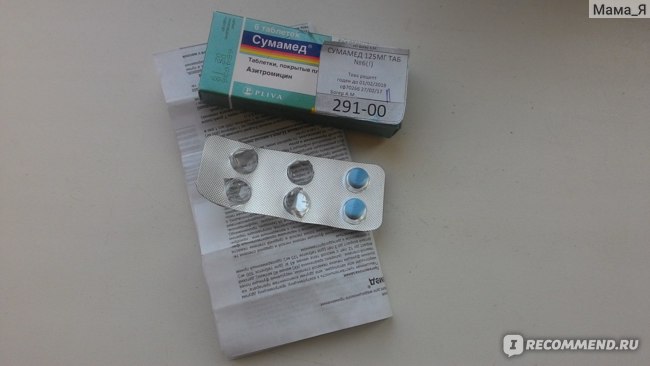 В некоторых случаях частота приема может быть увеличена до трех раз в день
В некоторых случаях частота приема может быть увеличена до трех раз в день Для выведения некоторых микроорганизмов может назначаться вместе с дополнительными лекарственными препаратами
Для выведения некоторых микроорганизмов может назначаться вместе с дополнительными лекарственными препаратами Этот же антибиотик выпускается в форме суспензии, которую можно давать детям начиная с двух месяцев
Этот же антибиотик выпускается в форме суспензии, которую можно давать детям начиная с двух месяцев Разница в цене: азитромицин дешевле сумамеда
Разница в цене: азитромицин дешевле сумамеда Лекарства широко применяются в лечении гайморита у малышей. Для них продаются препараты в форме суспензии с добавлением фруктовых наполнителей для придания приятного вкуса.
Лекарства широко применяются в лечении гайморита у малышей. Для них продаются препараты в форме суспензии с добавлением фруктовых наполнителей для придания приятного вкуса. , Boucher F. D. et al. Azithromycin is as effective as and better tolerated than erythromycin estolate for the treatment of pertussis // Pediatrics 2004; 114: 96–101.
, Boucher F. D. et al. Azithromycin is as effective as and better tolerated than erythromycin estolate for the treatment of pertussis // Pediatrics 2004; 114: 96–101. , Demers D. M. Spectrum and treatment of cat-scratch disease // Pediatr Infect Dis J 2004; 23 (12): 1161–1162.17.
, Demers D. M. Spectrum and treatment of cat-scratch disease // Pediatr Infect Dis J 2004; 23 (12): 1161–1162.17.
 O., Griffin M. R., Arbogast P. et al. Very early exposure to erythromycin and infantile hypertrophic pyloric stenosis // Arch Pediatr Adolesc Med 2002; 156 (7): 647–650.
O., Griffin M. R., Arbogast P. et al. Very early exposure to erythromycin and infantile hypertrophic pyloric stenosis // Arch Pediatr Adolesc Med 2002; 156 (7): 647–650.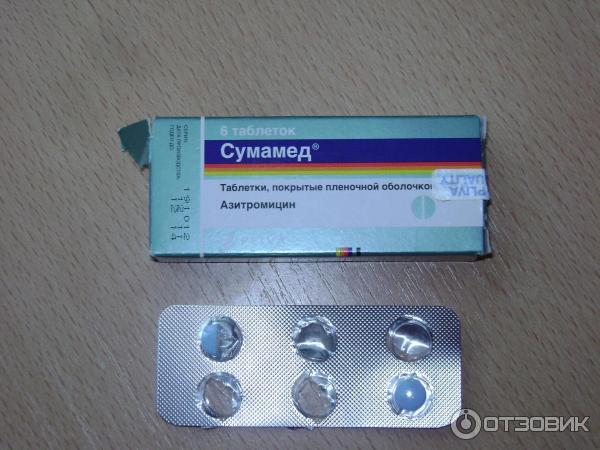 , Skroza N., Ruggiero A. et al. Moderate acne vulgaris: efficacy, tolerance and compliance of oral azithromycin thrice weekly for // Acta Dermatovenerol Croat. 2008;16 (1): 13–8.
, Skroza N., Ruggiero A. et al. Moderate acne vulgaris: efficacy, tolerance and compliance of oral azithromycin thrice weekly for // Acta Dermatovenerol Croat. 2008;16 (1): 13–8.