Синехии в полости матки беременность: Внутриматочные синехии | Полезное от клиники «Геном» в Калининграде
Внутриматочные синехии | Полезное от клиники «Геном» в Калининграде
Женское бесплодие во многих случаях обусловлено маточной патологией, которая препятствует наступлению беременности. Одна из них — внутриматочные синехии (спайки). При этом заболевании различные участки внутренней поверхности органа соединяются между собой, образуя тяжи. В итоге, происходит заращение полости матки и её деформация. Внутриматочные синехии приводят к нарушению менструального цикла, являются основной причиной невынашивания беременности, ранних родов, безуспешной имплантации и отрицательных исходов ЭКО.
Внутриматочные синехии провоцируют патологию развития плаценты: она может прирасти к маточной стенке. Из-за высокого риска не выносить ребенка лучше планировать беременность после рассечения внутриматочных синехий.
Первые публикации с подробным описанием заболевания появились в 1948 году. Автором статей был Джозеф Ашерман, поэтому внутриматочные синехии принято называть также «синдром Ашермана».
Формированию спаечного процесса в матке способствуют повреждения базального слоя эндометрия, которые происходят, чаще всего, в результате механических травм во время хирургических вмешательств. Если травме сопутствует инфекция, то слизистый слой повреждается еще сильнее. Эпителий, пытаясь восстановить прежнюю целостность, начинает разрастаться, вовлекая в этот процесс другие волокна. Таким образом, образуются тяжи, которые постепенно стягивают стенки матки.
Внутриматочные синехии часто появляются в первый месяц после родов или прерывания беременности, так как в это время происходит активное восстановление эндометрия на фоне обширной раневой поверхности.
Симптомы синдрома Ашермана, а также успех проводимой терапии, зависят от степени заращения маточной полости. В большинстве случаев, заболевание проходит без явных проявлений.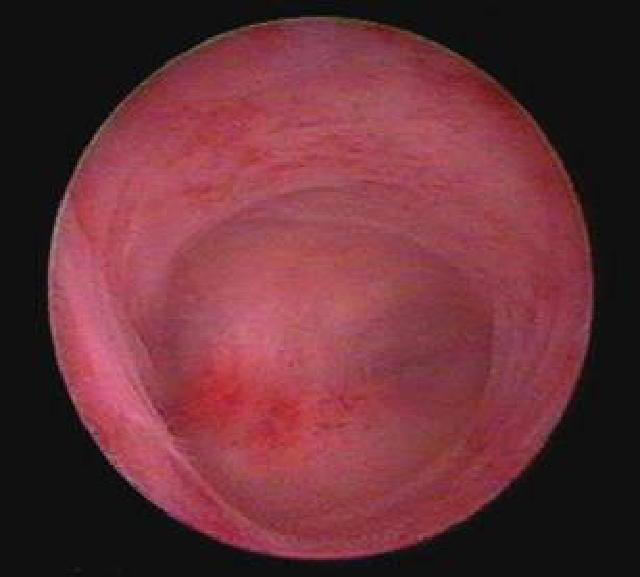 Обнаруживается оно случайно, когда пациентка обращается к врачу по причине бесплодия.
Обнаруживается оно случайно, когда пациентка обращается к врачу по причине бесплодия.
Основным симптомом заболевания является менструальная дисфункция, при которой уменьшается объём кровопотери (гипоменорея) или менструации прекращаются в течение нескольких циклов (аменорея). Возможно также нарушение оттока крови из маточной полости, из-за чего она начинает скапливаться в органе (гематометра). Такое явление приводит к различным осложнениям. Женщина при этом может чувствовать слабость, головокружение, боль.
Своевременное обращение к специалисту позволяет, как правило, устранить патологию и восстановить репродуктивную функцию. Особое внимание при решении проблем внутриматочных синехий уделяется профилактике рецидива, так как в 60% случаев процесс формирования спаек возобновляется.
«Золотым стандартом» решения проблемы внутриматочных синехий является гистероскопия, при которой можно рассмотреть внутреннюю поверхность матки изнутри. Спайки при этом визуализируются в виде бессосудистых тяжей светлых оттенков различной длины и плотности, которые располагаются между стенками матки, в цервикальном канале.
Удалить внутриматочные синехии возможно только путем рассечения. После такого хирургического вмешательства требуется повторный гистероскопический контроль. Он должен показать, что синехий нет, свободны углы матки, около которых расположены фаллопиевы трубы. Предотвратить образование новых спаек помогает введение внутриматочной спирали (типа петли Липпса), хотя бы на один месяц. Далее, для восстановления нормального строения и функционирования эндометрия, применяют циклическую гормональную терапию на протяжении 3-6 месяцев.
Беременность после устранения проблемы синехий следует планировать только после восстановления эндометрия и проведения терапии, направленной на исключение инфекционной составляющей и воссоздание правильной гормональной функции. В этом случае, вероятность осложнений будет минимальна.
Внутриматочные Синехии При Беременности: Классификация
Каким образом может произойти механическое повреждение эндометрия?
Причинами нарушения целостности базального слоя маточного эндометрия могут быть:
- аборт;
- роды с задержкой отделения последа;
- замершая беременность и дальнейшее выскабливание;
- тазовые хирургические операции;
- внутриматочные инъекции и контрацептивы;
- инфицирование
Последний фактор можно считать производным от образования раневой поверхности, так как вероятность развития инфекции и воспаления возрастает в разы на фоне незащищённости слизистой.
Различают три вида внутриматочных спаек в зависимости от их строения:
- лёгкие, напоминающие плёнку, которые рассекаются гистероскопом;
- средние, с включением в фиброзную ткань мышечных волокон;
- тяжёлые, приводящие к сращению стенок матки и трудно поддающиеся рассечению
Основными симптомами синдрома Ашера являются боли и изменившийся характер менструаций, которые становятся короткими и малокровными. Уровень болезненности зависит от степени заращения и сужения матки.
Таких степеней три:
- первая — синехии тонкие, занимают до 25% объёма матки, не затрагивая устья труб и дно матки;
- вторая — занято до 75% объёма матки, частично закрыты устья труб и дно, стенки матки не слипшиеся;
- третья — занято более 75% полости матки
Особенности ваших болевых ощущений могут достаточно точно указать на место сосредоточения синехий. Например, чувство болезненной тяжести внизу живота при плохом оттоке крови во время менструации говорит о том, что спайки у вас находятся в самом низу матки близко к цервикальному каналу.
Последствиями развития синдрома Ашера могут стать:
- маточное или трубное бесплодие, повторные выкидыши;
- задержка роста плода;
- скопление менструальной крови в нижнем отделе матки;
- скопление гноя в полости матки в результате инфицирования;
- внематочная беременность;
- хронические боли в тазовой области;
- рак матки в предклимактерическом или постклимактерическом периоде
Диагностировать синехии может гистероскопия, гистеросальпингография или ультразвуковое исследование.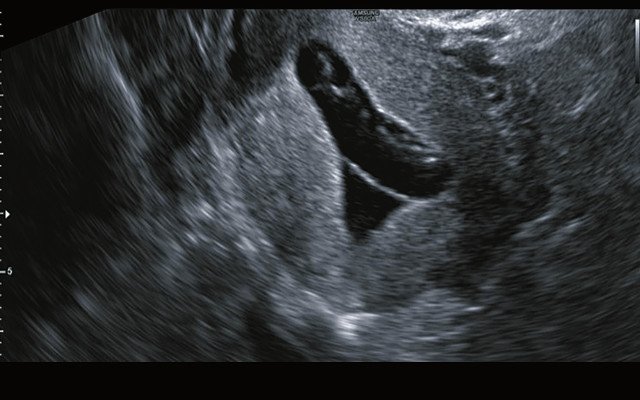
Внутриматочные синехии лечатся исключительно хирургическим путём. Иссечение спаек проводится с помощью гистероскопа. Визуальный контроль во время такой операции позволяет избежать травматизации и сохранить эндометрий стенок матки для последующей нормализации менструаций и восстановления ваших детородных возможностей. Сложность и длительность операции, её результат находятся в прямой зависимости от вида спаек (лёгкие, средние, тяжёлые) и степени заращения полости матки.
Очень важным этапом в предоперационной подготовке является подбор медикаментозных средств, которые препятствуют росту новых клеток эндометрия и его созреванию. Это делается для того, чтобы свести к минимуму возможность случайно травмировать созревший качественный эндометрий во время оперативного вмешательства. После операции для лучшего заживления желательно пройти курс физиотерапии. Как правило, назначается до трёх курсов, начиная с окончания первой послеоперационной менструации.
Следующие за операцией полгода вы должны регулярно посещать своего врача, внимательно контролировать овуляцию и восстановление эндометрия. Если вашей проблемой было бесплодие, а его истинной причиной – синехии, то вскоре можете ожидать наступление беременности.
Аблялимова Альбина Шевкетовна, Врач — акушер-гинеколог, врач УЗДКлиника женского и мужского здоровья
Синехии – это спайки, то есть сращения соединительной ткани, в полости матки. По своей структуре они могут быть пленкообразными (на начальных этапах) или плотными. В результате формирования синехий нарушается функция эндометрия, снижается вероятность зачатия, возрастает риск невынашивания беременности. Почти у половины женщин со вторичным бесплодием его причина заключается именно в наличие синехий в матке. Спаечная болезнь значительно повышает риск развития воспаления слизистой матки – эндометрита.
Спайки образуются на фоне хронических воспалительных изменений в стенках матки. Провоцируют их образование травмы базального слоя эндометрия.
Провоцируют их образование травмы базального слоя эндометрия.
Причины:
- травматичные роды
- кесарево сечение
- аборт
- диагностическое выскабливание
- лучевая терапия при онкопатологиях матки и яичников
- применение внутриматочной спирали дольше рекомендованного срока
Риск образования спаечных изменений в матке увеличивается при наличии хронических гинекологических заболеваний, которые чаще всего развиваются при заражении инфекциями, передающимися половым путем.
Избыточное разрастание соединительной ткани провоцирует формирование плотных сращений между стенками матки. Со временем они могут распространяться на устья труб, а в тяжелых случаях заполняют почти всю полость матки. Спаечный процесс также может затрагивать брюшную полость.
Поначалу спайки в полости матки никак себя не проявляют. Возможны периодические боли внизу живота и более болезненные, чем раньше, менструации.
При более выраженных изменениях возможно уменьшение объема менструальных выделений, при этом их продолжительность увеличивается.
Самый же главный симптом спаек – это проблемы с зачатием. Даже если беременность и наступает, то часто прерывается самопроизвольным выкидышем на ранних сроках. И так может повторяться неоднократно.
В особо тяжелых случаях, когда в нижних отделах матки происходит сращение, а верхние отделы эндометрия функционируют нормально, может развиться гематометра: менструальная кровь не получает выхода наружу, а матка пытается безуспешно ее вытолкнуть. В результате у женщины появляются сильные спазмообразные боли внизу живота.
Можно ли избавиться от спаек консервативным путем? Да, но только на самых ранних этапах, когда только образуются тонкие фибриновые пленки. В этом случае врач назначает лечение, направленное на устранение причины патологических изменений и восстановление микроциркуляции в тканях матки. В результате фибриновые пленки могут исчезнуть. Но, к сожалению, очень мало женщин обращается за помощью на ранних этапах формирования синехий. Как правило, пациентки идут к доктору только тогда, когда процесс уже запущен и помочь может лишь оперативное вмешательство.
В этом случае врач назначает лечение, направленное на устранение причины патологических изменений и восстановление микроциркуляции в тканях матки. В результате фибриновые пленки могут исчезнуть. Но, к сожалению, очень мало женщин обращается за помощью на ранних этапах формирования синехий. Как правило, пациентки идут к доктору только тогда, когда процесс уже запущен и помочь может лишь оперативное вмешательство.
Эвакуация плодного яйца на фоне внутриматочных синехий Текст научной статьи по специальности «Клиническая медицина»
УДК 618.14-007.66: 089.888.14: 618.214-072.1
эвакуация плодного яйца на фоне внутриматочных
синехий
Рушанья Исмагиловна Габидуллина1*, Станислав Евгеньевич Савельев3, Наиль Адгамович Габитов2, Ольга Николаевна Михайлова2, Ляйсан Индусовна Сирматова2, Наиля Равилевна Назмутдинова4
1Казанский государственный медицинский университет, г. Казань, Россия;
2Городская клиническая больница №7, г. Казань, Россия;
3Городская клиническая больница №16, г. Казань, Россия; 4Казанский (Приволжский) федеральный университет, г. Казань, Россия
Поступила 26.09.2016; принята в печать 06.10.2016.
Реферат DOI: 10.17750/KMJ2016-967
Синдром Ашермана — спорная тема в гинекологии без чёткого консенсуса относительно лечения. Данная патология характеризуется образованием сращений в полости матки. Основной причиной этого расстройства является травма беременной матки, особенно после аборта, в послеродовом периоде или после замершей беременности. Синдром Ашермана имеет клинические проявления в виде нарушений менструального цикла и бесплодия. Беременность может осложняться преждевременными родами, предлежанием плаценты и её врастанием. Появление метода гистероскопии изменило диагностику и лечение при внутриматочных синехиях, и гистероскопия служит наиболее ценным инструментом в настоящее время. Адгезиолизис при гистероскопии стал предпочтительным методом лечения в сочетании с курсом эстрогенов. В статье представлено клиническое наблюдение бессимптомного течения синдрома Ашермана у 29-летней женщины. Биполярная гистерорезекция синехий в сочетании с кюретажем оказалась эффективным и безопасным методом лечения.
Синдром Ашермана имеет клинические проявления в виде нарушений менструального цикла и бесплодия. Беременность может осложняться преждевременными родами, предлежанием плаценты и её врастанием. Появление метода гистероскопии изменило диагностику и лечение при внутриматочных синехиях, и гистероскопия служит наиболее ценным инструментом в настоящее время. Адгезиолизис при гистероскопии стал предпочтительным методом лечения в сочетании с курсом эстрогенов. В статье представлено клиническое наблюдение бессимптомного течения синдрома Ашермана у 29-летней женщины. Биполярная гистерорезекция синехий в сочетании с кюретажем оказалась эффективным и безопасным методом лечения.
Ключевые слова: синдром Ашермана, внутриматочные синехии, гистероскопия.
evacuation of embryo in the presence of intrauterine adhesions
R.I. Gabidullina1, S.E. Savel’ev3, N.A. Gabitov2, O.N. Mikhaylova2, L.I. Sirmatova2, N.R. Nazmutdinova4
‘Kazan state medical university, Kazan, Russia;
2City clinical hospital №7, Kazan, Russia;
3City clinical hospital №16, Kazan, Russia;
4Kazan federal university, Kazan, Russia
Asherman syndrome is a controversial topic in gynecology without a clear consensus for treatment. This pathology is characterized by adhesions in the uterine cavity. The main cause of this disorder is injuries to the gravid uterus especially in abortion, during postnatal period or after missed miscarriage. Menstrual disorders and infertility are characteristic clinical features of Asherman syndrome. Pregnancy may be complicated with premature labor, placenta previa and placenta accreta. Introduction of hysteroscopy has changed diagnosis and management of intrauterine synechiae and it is therefore considered the most valuable tool nowadays. Preferred treatment method is hysteroscopic lysis of adhesions combined with estrogens. A clinical case of asymptomatic Asherman syndrome in a 29 year old female is presented in the article. Bipolar hysteroscopic resection of synechiae in combination with curettage was proved to be an effective and safe method of treatment.
Introduction of hysteroscopy has changed diagnosis and management of intrauterine synechiae and it is therefore considered the most valuable tool nowadays. Preferred treatment method is hysteroscopic lysis of adhesions combined with estrogens. A clinical case of asymptomatic Asherman syndrome in a 29 year old female is presented in the article. Bipolar hysteroscopic resection of synechiae in combination with curettage was proved to be an effective and safe method of treatment.
Keywords: Asherman syndrome, intrauterine synechiae, hysteroscopy.
Внутриматочные синехии до настоящего времени остаются актуальной проблемой в акушерстве и гинекологии. Впервые внутриматочные спайки были описаны Fritsch в 1854 г., однако их клиническую значимость показал Asherman в 1948 г. Иосиф Ашерман представил результаты наблюдения за 29 женщинами с аменореей и стенозом внутреннего зева шейки матки после родов [4]. С тех пор «синдром Ашермана» стал общепринятым термином, обозначающим внут-риматочные синехии [5].
Беременная матка более подвержена развитию сращений, однако любая травма эндометрия, даже в небеременном состоянии, может вызвать их образование, поэтому в настоящее время этот термин включает все случаи спаечного процесса в полости матки, независимо от причин.
Внутриматочные синехии обычно ассоциированы с одним или несколькими клиническими проявлениями, такими как аменорея или другие нарушения менструального цикла, невынашива-
Адрес для переписки: [email protected]
нием беременности и бесплодием. Беременность у женщин с синдромом Ашермана может осложняться абортами, преждевременными родами, предлежанием плаценты и её приращением [5].
За последние два десятилетия внедрение гистероскопии изменило принципы диагностики и лечения синдрома Ашермана..jpg) В настоящее время гистероскопия служит золотым стандартом диагностики и лечения внутриматочных сращений [15, 17]. Адгезиолизис во время гистероскопии позволяет достичь успешного анатомического восстановления полости матки в 57,8-97,5% случаев [7].
В настоящее время гистероскопия служит золотым стандартом диагностики и лечения внутриматочных сращений [15, 17]. Адгезиолизис во время гистероскопии позволяет достичь успешного анатомического восстановления полости матки в 57,8-97,5% случаев [7].
В статье представлено клиническое наблюдение за пациенткой с бессимптомным течением синдрома Ашермана, когда внутриматочные синехии были выявлены при неудачной попытке медикаментозного прерывания беременности.
Пациентка М. 29 лет поступила в гинекологическое отделение Городской клинической больницы №7 г. Казани с жалобами на незначительные мажущие кровянистые выделения в течение 2 нед после медикаментозного аборта,
‘ 2s 1
Рис. 1. Ультразвуковое исследование органов малого таза пациентки М. Деформированное плодное яйцо в правом трубном углу полости матки. Внутриматоч-ные синехии
Рис. 3. Гистерорезекция синехий в правом трубном углу матки
Рис. 5. Гистероскопия. Полость матки после адге-зиолизиса
выполненного на сроке 5-6 нед беременности.
Менструации с 12 лет, установились сразу, по 5-6 дней через 28 дней, регулярные, безболезненные. Замужем, предохраняется барьерным методом (с помощью презерватива). В анамнезе 2 беременности, завершившиеся срочными родами. Беременности и роды протекали без осложнений. Имеет 2 здоровых детей. Абортов и других внутриматочных вмешательств не было. Гинекологические заболевания и туберкулёз отрицает. Экстрагенитальные заболевания не выявлены. Гемотрансфузионный и аллергический анамнез не отягощён.
При ультразвуковом исследовании органов малого таза в полости матки визуализировалось деформированное плодное яйцо с неравномерно утолщённой хориальной оболочкой, неровным внутренним контуром. В просвете плодного 968
В просвете плодного 968
Рис. 2. Гистероскопия. Частичная окклюзия устья левой маточной трубы
/
С1 *
ъ
Рис. 4. Гистероскопия. Визуализация плодного яйца после адгезиолизиса
яйца определялось гиперэхогенное включение (вероятно, эмбрион) без кровотока. Эндометрий с неровным контуром за счёт втяжений, неоднородной структуры с гиперэхогенными включениями (синехии; рис. 1).
С учётом клинической картины и результатов ультразвукового исследования была произведена вакуум-аспирация содержимого полости матки, однако аспират оказался скудным, без элементов плодного яйца. При последующей гистероскопии визуализировать плодное яйцо в полости матки не удалось вследствие выраженных внутриматочных сращений, выявлены неполная внутриматочная перегородка и частичная окклюзия левой маточной трубы (рис. 2).
В соответствии с классификацией С. March, R. Izrael (1981) [12] определена II степень спаечного процесса. В связи с этим после получения добровольного информированного письменного согласия, в условиях развёрнутой операционной под внутривенной анестезией проведена гисте-рорезекция синехий в правом трубном углу матки (рис. 3) биполярным электродом с помощью системы Versopoint (США) и гистерорезектоско-па фирмы Storz (Германия).
После адгезиолизиса удалось визуализировать плодное яйцо (рис. 4), которое было удалено методом кюретажа.
В завершение операции выполнена гистеро-резекция внутриматочной перегородки, полностью восстановлена полость матки нормальных размеров (рис. 5).
5).
Длительность операции составила 20 мин. Расход 0,9% раствора натрия хлорида 800,0 мл. Дефицит жидкости минимальный. Кровопотеря во время операции 50 мл.
Послеоперационный период протекал без осложнений. Сразу после операции была начата терапия трансдермальным эстрадиолом с добавлением в последующем во вторую фазу цикла микронизированного прогестерона.
Пациентка была выписана на 4-е сутки после операции в удовлетворительном состоянии с рекомендациями по приему эстроген-гестаген-ных препаратов для профилактики рецидива внутриматочных сращений.
На фоне эстроген-гестагенной гормональной терапии у пациентки восстановилась менструальная функция. При обследовании через 3 мес по результатам ультразвукового исследования восстановилась нормальная толщина эндометрия, эхографических признаков внут-риматочных синехий нет. С учётом необходимости контрацепции через 3 мес пациентке была предложена гормональная контрацепция препаратом, содержащим аналог натурального эстрадиола.
Синдром Ашермана — одна из самых дискуссионных тем в гинекологии. Самая высокая частота этого заболевания (19%) была зафиксирована в Израиле, Греции и Южной Америке, а также в некоторых европейских странах [8]. В Российской Федерации доля женщин с внутри-маточными синехиями варьирует от 3 до 13% [1]. Внедрение метода гистероскопии, позволившего визуализировать полость матки, показало, что сращения встречаются значительно чаще, чем было принято считать ранее [3].
До настоящего времени нет консенсуса относительно патогенеза заболевания. Методом электронной микроскопии выявлены серьёзные нарушения эндометрия на субклеточном уровне, такие как потеря рибосом, набухание митохондрий вследствие сосудистых и гипокси-ческих изменений [6]. Изучаются вопросы нарушения кровоснабжения эндометрия и миомет-рия, влияния цитокинов в слизистой оболочке матки, генетический фактор [3, 6, 16].
Изучаются вопросы нарушения кровоснабжения эндометрия и миомет-рия, влияния цитокинов в слизистой оболочке матки, генетический фактор [3, 6, 16].
Исследование факторов риска возникновения внутриматочных синехий показало, что в основе лежит ятрогенное повреждение эндометрия. Наиболее высокий риск развития вну-триматочных спаек ассоциирован с выскабливанием полости матки после выкидыша и в промежуток между 2-й и 4-й неделями после родов [3]. Наложение компрессионных швов при послеродовом кровотечении в последующем также способствует формированию внутрима-точных синехий [9].
Синдром Ашермана всегда следует исключать при наличии нарушений менструального цикла, бесплодии, невынашивании беременности, аномалиях расположения и прикрепления плаценты. Так, у больных с бесплодием внутри-маточные синехии обнаруживают более чем в
половине случаев [2].
В связи с этим нам представился интересным случай бессимптомного течения заболевания. Женщина в анамнезе имела 2 родов, спайки были обнаружены лишь при неудачной попытке прерывания беременности. У пациентки не были нарушены менструальная и репродуктивная функции. Завершились в срок самопроизвольными родами 2 беременности. В течении родов и послеродовом периоде женщина осложнений не отмечала. Отрицала она также любые внутриматочные вмешательства. В соответствии с медицинскими документами и результатами обследования влияние туберкулёза было исключено. В силу её профессии пациентке регулярно ежегодно проводили медицинское обследование.
Визуализация полости матки методом гистероскопии позволила поставить правильный диагноз. В левом трубном углу матки синехии выглядели как нежная плёнка с проходящими в них сосудами. Справа определялись плотные белесоватые тяжи, обусловливавшие частичное заращение полости матки.
К сожалению, до настоящего времени не принята единая классификация внутриматоч-ных синехий. Наиболее удобной и часто используемой является классификация С. March, R. Izrael (1981) [12]:
— I степень (минимальные спайки) — вовлечено менее 1/4 объёма полости матки, тонкие спайки, дно и устья труб свободны;
— II степень (умеренные спайки) — вовлечено от 1/4 до 3/4 объёма полости матки, слипания стенок нет, присутствуют только спайки, дно и устья труб частично закрыты;
— III степень (обширные спайки) — вовлечено более 3/4 объёма полости матки.
Выявленный нами спаечный процесс в полости матки классифицировался как умеренный.
Учитывая наличие плодного яйца и перегородки в полости матки, для лечения пациентки был выбран метод биополярной гистерорезек-ции. В ходе операции удалось добиться полного восстановления полости матки.
Дискуссионным остаётся вопрос эвакуации плодного яйца в подобных случаях. Удаление с помощью электрической энергии гистероре-зектоскопа, по данным литературы, приводит к выраженным термическим повреждениям эндометрия. Удаление остатков трофобластической ткани под контролем гистероскопа при помощи гистерорезектоскопической петли без использования тока вызывает меньшую травматизацию [13]. Однако подобная процедура увеличивает время манипуляции, что создает риск гипергидратации. В связи с этим было принято решение применить кюретаж на этапе эвакуации плодного яйца.
Особого внимания заслуживает выбор метода реабилитации пациентки с целью восстановления менструальной и репродуктивной функций, предотвращения рецидива синехий.
По данным ряда авторов, краткосрочное размещение в полости матки инородных предметов (таких, как шары, катетеры, внутриматочные системы) препятствует формированию внутри-маточных синехий [7]. Однако, учитывая риск перфорации матки, восходящей инфекции и дискомфорта для женщины, остановили выбор на медикаментозной терапии.
Однако, учитывая риск перфорации матки, восходящей инфекции и дискомфорта для женщины, остановили выбор на медикаментозной терапии.
Применение эстроген-гестагенной терапии с целью стимулирования быстрого роста эндометрия оказалось эффективным в ряде наблюдений и позволило восстановить не только менструальную функцию, но и фертильность [10, 11]. Менструальная функция у наблюдаемой пациентки успешно восстановилась. Через 3 мес ультразвуковые признаки внутриматочных си-нехий, такие как неровные контуры эндометрия, прерывистое М-эхо [14], не визуализировались. В связи с тем, что женщина нуждалась в контрацепции, целесообразным посчитали использование комбинированного перорального контрацептива, содержащего аналог натурального эстрадиола.
Таким образом, течение синдрома Ашерма-на может быть бессимптомным. Мы согласны, что оптимальным методом лечения внутрима-точных сращений тяжёлой степени служит гис-терорезекция с использованием биполярного электрода. Методика безопасна, малотравматична, эффективна. Пациенткам репродуктивного периода после адгезиолизиса целесообразно назначение эстроген-гестагенных препаратов для профилактики образования повторных си-нехий в полости матки.
ЛИТЕРАТУРА
1. Бесплодный брак. Современные подходы к диагностике и лечению. Руководство. Под ред. Г.Т. Сухих, Т.А. Назаренко. М.: ГЭОТАР-Медиа. 2010; 784 с. [Besplodnyy brak. Sovremenne podkhody k diagnostike i lecheniyu. Rukovodstvo. (Infertile marriage. Current approaches to diagnosis and treatment: a guide.) Ed. by G.T. Sukhikh, T.A. Nazarenko. Moscow: GEOTAR-Media. 2010; 784 р. (In Russ.)]
2. Попов Э.Н., Корсак В.С., Исакова Э.В., Забелки-на О.И. Диагностика патологии полости матки у больных, страдающих трубно-перитонеальной формой бесплодия. Ж. акушерства и жен. бол. 2005; (3): 5053. [Popov E.N., Korsak V.S., Isakova E.V., Zabelkina O.I.
Ж. акушерства и жен. бол. 2005; (3): 5053. [Popov E.N., Korsak V.S., Isakova E.V., Zabelkina O.I.
The diagnostics of pathology in uterine cavity in patients with tubal and peritoneal type of infertility. Zhurnal akusherstva i zhenskikh bolezney. 2005; (3): 50-53. (In Russ.)]
3. Al-Inany H. Intrauterine adhesions: an update. Acta Obstet. Gynecol. Scand. 2001; 11: 986-993.
4. Asherman J.G. Amenorrhoea traumatic (atretica). J. Obstet. Gynaecol. Br. Emp.1948; 55 (1): 23-30.
5. Bhandari S., Bhave P., Ganguly I. et al. Reproductive outcome of patients with Asherman’s syndrome: A SAIMS experience. J. Reprod. Infertil. 2015; 16 (4): 229-235.
6. Chen Y., Chang Y., Yao S. Role of angiogenesis in endometrial repair of patients with severe intrauterine adhesion. Int. J. Clin. Exp. Pathol. 2013; 11: 1343-1350.
7. Conforti A., Alviggi C., Mollo A. et al. The management of Asherman syndrome: a review of literature. Reprod. Biol. Endocrinol. 2013; 11: 118.
8. Hooker A.B., Lemmers M., Thurkow A.L. Systematic review and meta-analysis of intrauterine adhesions after miscarriage: prevalence, risk factors and long-term reproductive outcome. Hum. Reprod. Update. 2014; 20 (2): 262-278.
9. Kim T., Ahn K.H., Choi D.S. A randomized, multi-center, clinical trial to assess the efficacy and safety of alginate carboxymethylcellulose hyaluronic acid compared to carboxymethylcellulose hyaluronic acid to prevent postoperative intrauterine adhesion. J. Minim. Invasive Gynecol. 2012; 19 (6): 731-736.
10. Magos A. Hysteroscopic treatment of Asherman’s syndrome. Reprod. Biomed Online. 2002; 11 (3): 46-51.
Reprod. Biomed Online. 2002; 11 (3): 46-51.
11. March C.M. Management of Asherman syndrome. Reprod. Biomed Online. 2011; 1: 63-76.
12. March C.M., Israel R. Gestational outcome following hysteroscopic lysis of adhesions. Fertil. Steril. 1981; 36 (4): 455-459.
13. Reddy S., Rock J.A. Surgical management of complete obliteration of the endometrial cavity. Fertil. Steril. 1997; 11: 172-174.
14. Soares S.R., Barbosa dos Reis M.M., Camargos A.F. Diagnostic accuracy of sonohysterography, transvaginal sonography, and hysterosalpingography in patients with uterine cavity diseases. Fertil. Steril. 2000; 11: 406-411.
15. Song D., Xia E., Xiao Y. et al. Management of false passage created during hysteroscopic adhesiolysis for Asherman’s syndrome. J. Obstet. Gynaecol. 2016; 36 (1): 87-92.
16. Tao Z., Duan H. Expression of adhesion-related cytokines in the uterine fluid after transcervical resection of adhesion. Zhonghua Fu Chan Ke Za Zhi. 2012; 11: 734-737.
17. Yu D., Wong Y.M., Cheong Y. et al. Asherman syndrome — one century later. Fertil. Steril. 2008; 89 (4): 759-779.
Современные возможности в лечении синдрома Ашермана | Макаренко Т.А., Никифорова Д.Е.
Статья посвящена современным возможностям в лечении внутриматочных синехий (синдрома Ашермана)
Внутриматочные синехии, или синдром Ашермана (СА), — патологическое состояние, характеризующееся образованием спаек и выростов эндометрия с его склерозом и фиброзом. Заболевание названо в честь Д. Ашермана – гинеколога, подробно описавшего и исследовавшего данную патологию. Внутриматочные спайки (синехии) представляют собой соединительнотканные сращения, спаивающие стенки матки и вызывающие ее деформацию.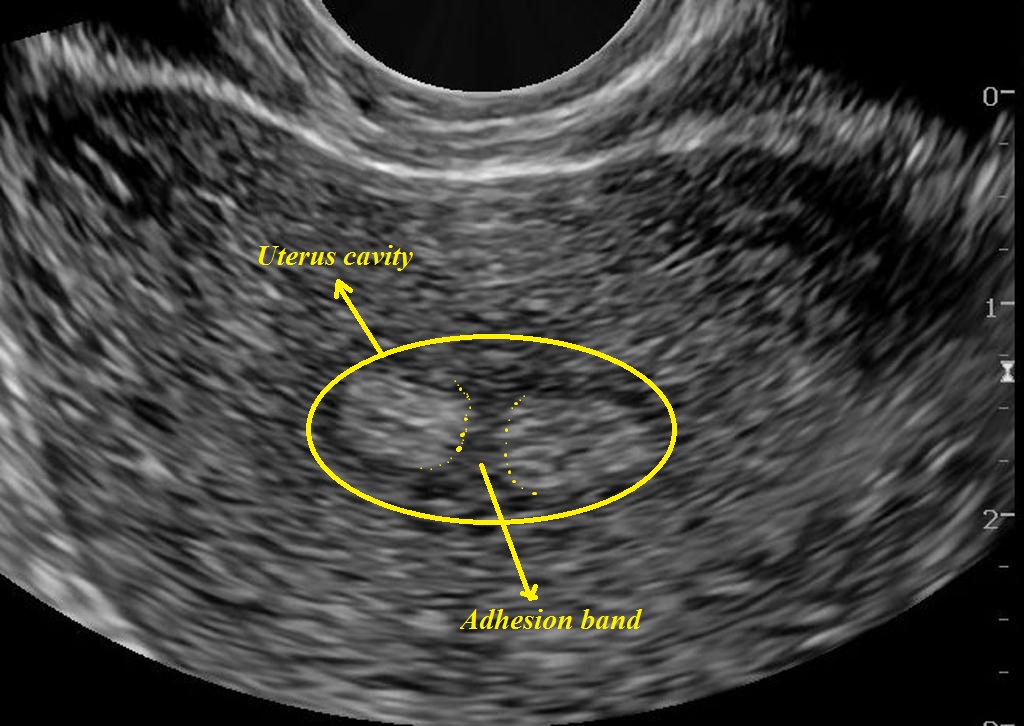 При наличии синехий нормальный эндометрий подвергается атрофической трансформации [1].
При наличии синехий нормальный эндометрий подвергается атрофической трансформации [1].Истинное понятие СА включает в себя нарушение менструальной (гипоменорея, аменорея) и детородной функций, обусловленное наличием внутриматочных синехий [2]. Основными клиническими проявлениями этой патологии являются: альгодисменорея, гипоменорея, в тяжелых случаях – аменорея; гематометра, или гематосальпингс; привычное невынашивание беременности, повторные выкидыши, вторичное бесплодие. СА может сопутствовать эндометриоз различной степени тяжести [3]. В 61,5% случаев внутриматочные синехии являются причинами бесплодия [4]. Бесплодие и гипоменорея – наиболее частые клинические проявления СА (55,1% и 32,1% случаев соответственно) [4].
Наиболее частой причиной СА служат предшествующие механические травмы базального эндометрия. Травмирование эндометрия может происходить вследствие хирургического прерывания беременности, использования внутриматочных контрацептивов, диагностических выскабливаний полости матки при маточных кровотечениях или полипах эндометрия, операций на полости матки (миомэктомия, метропластика, конизация шейки матки). Повреждение эндометрия может усугубляться присоединением инфекции во время раневой фазы с развитием эндометрита [5]. Чем больше период задержки плодных оболочек после родов или выкидыша, тем выше вероятность возникновения заболевания. Также имеет значение число процедур: после однократного выскабливания полости матки риск составляет около 16%, а 3 и более процедуры увеличивают вероятность возникновения СА до 32% [3].
В диагностике внутриматочных синехий данные гинекологического исследования неспецифичны. УЗИ малого таза при СА малоинформативно: эхоскопическая картина может быть представлена нечеткими контурами эндометрия, в случае гематометры – анэхогенным образованием в полости матки. Проведение гидросонографии позволяет более четко определять наличие внутриматочных сращений. Гистеросальпингография выявляет одиночные либо множественные дефекты наполнения, имеющие лакунообразную форму и различные размеры.
 При плотных множественных внутриматочных синехиях полость матки на рентгенограмме выглядит многокамерной, с мелкими, соединяющими отдельные камеры протоками. Однако нередко гистеросальпингография сопровождается ложноположительными результатами из-за наличия в матке слизи, искривлений, обрывков эндометрия.
При плотных множественных внутриматочных синехиях полость матки на рентгенограмме выглядит многокамерной, с мелкими, соединяющими отдельные камеры протоками. Однако нередко гистеросальпингография сопровождается ложноположительными результатами из-за наличия в матке слизи, искривлений, обрывков эндометрия.«Золотым стандартом» диагностики внутриматочных синехий является гистероскопия. При гистероскопии внутриматочные синехии определяются как белесоватые бессосудистые тяжи разной плотности и длины, соединяющие стенки матки, обнаруживается облитерация или деформация полости матки.
Целью лечебных мероприятий при СА служит малотравматичное устранение внутриматочных сращений с последующим восстановлением менструальной функции и фертильности. На первом этапе показано проведение гистероскопии с целью рассечения спаек под визуальным контролем. Во избежание перфорации матки рекомендуется использовать тонкие офисные гистероскопы, т. к. у таких пациенток имеется полная или частичная атрезия цервикального канала, которая делает невозможными любые хирургические манипуляции без предварительного рассечения синехий цервикального канала при помощи эндоскопических ножниц.
Разделение синехий в зависимости от их плотности производится тубусом гистероскопа, эндоскопическими ножницами, щипцами, гистерорезектоскопом, лазером. Нельзя разрушать синехии вслепую при помощи выскабливания стенок полости матки и цервикального канала кюреткой, т. к. это наносит дополнительную травму уже скомпрометированного эндометрия! Для исключения перфорации матки используется контроль с помощью УЗИ или лапароскопии.
После операционного этапа пациентке с СА назначается циклическая гормонотерапия эстрогенами и гестагенами, направленная на стимуляцию восстановления эндометрия и его циклической трансформации. Назначение комбинированных оральных контрацептивов при этой патологии нецелесообразно, поскольку данная группа препаратов способствует атрофическим изменениям эндометрия.

При инфекционной этиологии СА производится бактериологическое и вирусологическое исследование содержимого полости матки (биоптат, материал вакуумной биопсии) с последующей антибактериальной терапией.
Даже после самого грамотного (бережного и тщательного разрушения) внутриматочных синехий риск рецидивов остается высоким. Средняя частота возникновения рецидива после оперативного лечения внутриматочных синехий – 28% [1].
Для профилактики рецидива в полость матки после операции вводят гелеобразные наполнители, препятствующие контакту стенок и образованию спаек. Примером такого противоспаечного барьера может служить изделие медицинского назначения Антиадгезин (АО «Нижфарм»), представляющий собой гель из высокоочищенной натриевой соли гиалуроновой кислоты, полученной без использования генномодифицированных микроорганизмов [6]. Терапевтический эффект геля Антиадгезин связан с созданием искусственного временного барьера между поврежденными тканями, что обеспечивает эффективное разделение поверхностей на время их заживления. После аппликации геля Антиадгезин в области операционного поля он прилипает к анатомическим поверхностям, не растекаясь, и образует вязкое смазывающее покрытие, которое обеспечивает скольжение соседних поврежденных поверхностей и предупреждает их слипание. Антиадгезин является биодеградируемым покрытием, которое разделяет соприкасающиеся поверхности только на период критической фазы раневого заживления и послеоперационного спайкообразования, продолжающийся в течение 7 дней, не влияя при этом на нормально протекающие процессы регенерации. После применения гель полностью рассасывается [6].
Средние показатели эффективности лечения коррелируют с частотой наступления беременности. При легкой степени заболевания беременность наблюдается у 93% пациенток, при средней — у 78%. Лечение тяжелой степени СА дает возможность забеременеть 57% женщин. Однако рождение здорового ребенка наблюдается в 81, 66 и 32% случаев соответственно тяжести заболевания [1].

Таким образом, внутриматочные синехии и СА как крайне тяжелый их вариант являются многокомпонентной проблемой, требующей комплексного подхода. Тактика ведения таких женщин должна включать диагностический модуль (с использованием преимущественно тонких офисных гистероскопов), щадящую внутриматочную хирургию с введением в полость матки противоспаечных барьеров и послеоперационную реабилитацию с использованием гормональных препаратов, направленных на стимуляцию пролиферации эндометрия, а также на профилактику рецидивов спаечного процесса.
Клинический пример № 1
Пациентка П., 30 лет, поступила в клинику г. Красноярска с жалобами на гипоменорею, постепенно перешедшую в аменорею, вторичное бесплодие. В анамнезе – выскабливание полости матки по поводу неразвивающейся беременности. По результатам УЗИ органов малого таза: эндометрий неравномерной толщины, М-ЭХО до 13 мм с гиперэхогенными фрагментами. Пациентка поступила для планового проведения гистероскопии. Нами был использован офисный гистероскоп B.I.O.H (Storz). При проведении цервикоскопии выявлена полная атрезия цервикального канала за счет грубых синехий. С использованием эндоскопических ножниц с большими техническими сложностями проведено рассечение синехий цервикального канала, гистероскоп был продвинут к полости матки. При осмотре: полость матки резко уменьшена, в виде туннеля визуализируется левое маточное устье. Для исключения аномалии развития половых органов было решено провести лапароскопию, при этом визуализировано тело матки нормальных размеров и формы, обе маточные трубы – без видимой патологии, на обоих яичниках и брюшине малого таза – множественные очаги эндометриоза. Последние коагулированы биполярным электродом. При проведении последующей гистероскопии было выполнено рассечение поперечной синехии полости матки с помощью эндоскопических ножниц (крайне редкий вариант формирования спайки в полости матки). Анатомия полости матки была восстановлена: оба маточных устья стали визуализироваться, полость матки – чуть больше нормы. Эндометрий очень тонкий, с участками фиброзирования и резко усиленным сосудистым рисунком. После адгезиолизиса в полость матки было введено 5 г геля Антиадгезин. Для профилактики формирования СА в послеоперационном периоде была назначена циклическая гормональная терапия на 3 менструальных цикла с использованием препаратов для менопаузальной гормональной терапии, а также курс введения противоспаечного геля Антиадгезин № 5 с интервалом от 3 до 7 дней. В последующем у пациентки отмечено восстановление менструальной функции. Через 3 мес. при проведении контрольной офисной гистероскопии полость матки имела нормальную анатомию, синехии отсутствовали, эндометрий соответствовал фазе менструального цикла. В настоящее время пациентка планирует спонтанную беременность.
Эндометрий очень тонкий, с участками фиброзирования и резко усиленным сосудистым рисунком. После адгезиолизиса в полость матки было введено 5 г геля Антиадгезин. Для профилактики формирования СА в послеоперационном периоде была назначена циклическая гормональная терапия на 3 менструальных цикла с использованием препаратов для менопаузальной гормональной терапии, а также курс введения противоспаечного геля Антиадгезин № 5 с интервалом от 3 до 7 дней. В последующем у пациентки отмечено восстановление менструальной функции. Через 3 мес. при проведении контрольной офисной гистероскопии полость матки имела нормальную анатомию, синехии отсутствовали, эндометрий соответствовал фазе менструального цикла. В настоящее время пациентка планирует спонтанную беременность.
Клинический пример № 2
Пациентка К., 32 года, обратилась в профессорскую клинику г. Красноярска в мае 2016 г. с жалобами на вторичное бесплодие. В анамнезе 3 беременности: в 2012 г. при сроке беременности 30–31 нед. проведено экстренное кесарево сечение по поводу преждевременной отслойки нормально расположенной плаценты. Ребенок умер. Далее дважды имели место неразвивавшиеся беременности: в 2013 г. в сроке 8–9 нед. и в 2014 г. в сроке 10 нед., по поводу чего пациентке были проведены выскабливания полости матки. Все беременности возникали спонтанно.
По результатам УЗИ органов малого таза (на 7-й день менструального цикла): эхографически определяются 2 М-эха: справа – высотой 5 мм, слева – 4 мм. Справа эндометрий неравномерной толщины, с гиперэхогенными фрагментами. Ультразвуковое заключение: двурогая матка. Синехии в полости матки? Хронический эндометрит?
Пациентка поступила для проведения лапароскопии и гистероскопии. При проведении лапароскопии: в полости малого таза визуализирована одна матка, широкая, чуть больше нормальных размеров. Область рубца на матке и придатки – без видимой патологии. Спаек в полости малого таза не выявлено. При проведении хромосальпингоскопии – обе маточные трубы свободно проходимы для контраста. Далее была проведена гистероскопия. Первоначально с целью диагностики нами был использован офисный гистероскоп B.I.O.H (Storz). При проведении цервикоскопии – цервикальный канал без особенностей. Полость матки разделена на 2 гемиполости за счет очень широкой внутриматочной перегородки, практически доходящей до внутреннего зева. В правой гемиполости имеются множественные линейные синехии, частично облитерирующие ее, но устье правой маточной трубы свободно. Левая гемиполость несколько меньше правой, устье левой трубы свободно. Область рубца на матке – без особенностей (ниш и деформаций нет).
Далее была проведена гистероскопия. Первоначально с целью диагностики нами был использован офисный гистероскоп B.I.O.H (Storz). При проведении цервикоскопии – цервикальный канал без особенностей. Полость матки разделена на 2 гемиполости за счет очень широкой внутриматочной перегородки, практически доходящей до внутреннего зева. В правой гемиполости имеются множественные линейные синехии, частично облитерирующие ее, но устье правой маточной трубы свободно. Левая гемиполость несколько меньше правой, устье левой трубы свободно. Область рубца на матке – без особенностей (ниш и деформаций нет).
С использованием эндоскопических ножниц выполнено рассечение синехий в правой гемиполости матки. Далее проведено расширение цервикального канала до № 10 расширителями Гегара. В полость матки введен монополярный гистерорезектоскоп (Storz). При помощи электрода (прямой петли) внутриматочная перегородка полностью рассечена. При контрольном осмотре: полость матки нормальных размеров, устья обеих маточных труб свободные. Эндометрий высотой 2–3 мм (соответствует дню менструального цикла), но с резко усиленным сосудистым рисунком (по типу «земляничного поля»).
По завершении операции в полость матки было введено 3 г геля Антиадгезин. Для профилактики формирования СА в послеоперационном периоде были назначены циклическая гормональная терапия на 2 менструальных цикла с использованием препаратов для менопаузальной гормональной терапии, а также курс введения противоспаечного геля Антиадгезин № 3 с интервалом 5–7 дней. Через 2 мес. при проведении контрольной офисной гистероскопии полость матки имела нормальную анатомию, синехии отсутствовали, эндометрий соответствовал фазе менструального цикла. В настоящее время пациентке разрешено планирование беременности.
Таким образом, внутриматочные синехии (и как крайне тяжелый их вариант – СА) являются многокомпонентной проблемой, требующей комплексного подхода. Тактика ведения таких женщин должна включать диагностический модуль (с использованием преимущественно тонких офисных гистероскопов), щадящую внутриматочную хирургию и послеоперационную реабилитацию с использованием гормональных препаратов, направленных на стимуляцию пролиферации эндометрия, а также профилактику рецидивов спаечного процесса в полости матки при помощи внутриматочного использования современных противоспаечных барьеров (примером которых является Антиадгезин). И только комплексный подход, направленный на все звенья патогенеза, позволит излечить таких пациенток, избежать рецидива и вернуть менструальную и фертильную функции.
И только комплексный подход, направленный на все звенья патогенеза, позволит излечить таких пациенток, избежать рецидива и вернуть менструальную и фертильную функции.
.
ОПЫТ ПРИМЕНЕНИЯ АУТОПЛАЗМЫ, СОДЕРЖАЩЕЙ ТРОМБОЦИТЫ, В ЛЕЧЕНИИ СИНЕХИЙ ПОЛОСТИ МАТКИ | Цыганкова
ОПЫТ ПРИМЕНЕНИЯ АУТОПЛАЗМЫ, СОДЕРЖАЩЕЙ ТРОМБОЦИТЫ, В ЛЕЧЕНИИ СИНЕХИЙ ПОЛОСТИ МАТКИЦыганкова О.Ю., Кропмаер К.П., Кравченко Е.Н.
ФГБОУ ВО Омский государственный медицинский университет, г. Омск, Россия
ОПЫТ ПРИМЕНЕНИЯ АУТОПЛАЗМЫ, СОДЕРЖАЩЕЙ ТРОМБОЦИТЫ, В ЛЕЧЕНИИ СИНЕХИЙ ПОЛОСТИ МАТКИ
Внутриматочные синехии (ВМС)
по-прежнему представляют собой большую медико-социальную проблему. Прогноз в отношении репродуктивной функции и качества
дальнейшей жизни при гинекологических операциях во многом определяется
возможным спаечным процессом. Пусковым механизмом формирования ВМС является
травма базального слоя эндометрия, которая может быть вызвана различными
факторами, включая внутриматочные вмешательства. В настоящее время «золотым
стандартом» диагностики и лечения ВМС является гистероскопия (ГС) и их
разделение.
Для профилактики образования
спаек традиционно используются заместительная гормонотерапия с целью ускоренной
пролиферации нормального эндометрия, специальные внутриматочные устройства или
введение баллонных катетеров, противоспаечные барьеры. Однако остаётся высокий
риск рецидива, а при наступении беременности – развитие её осложнений.
Применение аутоплазмы, содержащей тромбоциты, в лечении синехий полости матки
способствует снижению риска рецидива ВМС после их разделения, восстановлению
менструальной и репродуктивной функций.
Ключевые слова: внутриматочные синехии; гистерорезектоскопия; аутоплазма, содержащая тромбоциты
Tsygankova O. Yu., Kropmaer K.P.,
Kravchenko E.N
Yu., Kropmaer K.P.,
Kravchenko E.N
Omsk State Medical University, Omsk, Russia
EXPERIENCE OF USING AUTPLASMA CONTAINING PLATELETS IN THE TREATMENT OF SYNECHIA OF THE UTERINE CAVITY
The problem of intrauterine synechia (IUS) is still a major medical and social problem. The prognosis for reproductive function and the quality of later life during gynecological operations is largely determined by the possible adhesive process. The trigger for the formation of IUS is trauma to the basal layer of the endometrium, which can be caused by various factors, including intrauterine interventions. Currently, the «gold standard» for the diagnosis and treatment of IUS is hysteroscopy and their separation. To prevent the formation of adhesions, hormone replacement therapy is traditionally used to accelerate the proliferation of the normal endometrium, special intrauterine devices or the introduction of balloon catheters, anti-adhesion barriers. However, there remains a high risk of relapse, and when pregnancy occurs, the development of its complications. The use of autoplasma containing platelets in the treatment of synechia of the uterine cavity helps reduce the risk of relapse of the IUD after separation, restoration of menstrual and reproductive functions.
Key words: intrauterine synechia; hysteroresectoscopy; autoplasma, containing platelets
Корреспонденцию адресовать:
ЦЫГАНКОВА Ольга Юрьевна
644099, г. Омск,
ул. Ленина, д. 12, ФГБОУ ВО ОмГМУ
Минздрава России
Тел: 8 (3812) 23-02-93
E-mail: [email protected]
Сведения об авторах:
ЦЫГАНКОВА Ольга Юрьевна
канд. мед. наук, ассистент, кафедра акушерства и
гинекологии ДПО, ФГБОУ ВО ОмГМУ Минздрава России, г. Омск, Россия
Омск, Россия
E-mail: [email protected]
КРОПМАЕР Кирилл Петрович
канд. мед. наук, ассистент, кафедра акушерства
и гинекологии ДПО, ФГБОУ ВО ОмГМУ Минздрава России, г. Омск, Россия
КРАВЧЕНКО
Елена Николаевна
доктор мед. наук, профессор, зав. кафедрой акушерства и
гинекологии ДПО, ФГБОУ ВО ОмГМУ Минздрава России, г. Омск, Россия
E-mail: [email protected]
Information about authors:
TSYGANKOVA Olga Yuryevna
candidate of medical
sciences, assistant, department of obstetrics and gynecology of further
professional education, Omsk State Medical University, Omsk, Russia
E-mail: [email protected]
KROPMAER Kirill Petrovich
candidate of medical
sciences, assistant, department of obstetrics and gynecology of further
professional education, Omsk State Medical University, Omsk, Russia
KRAVCHENKO
Elena Nikolaevna
doctor of medical sciences,
professor, head of the department of obstetrics and gynecology of further
professional education, Omsk State Medical University, Omsk, Russia
E-mail: [email protected]
Проблема репродуктивного
здоровья женщин является приоритетной не только медицинской, но и социальной
задачей. Количество операций на органах малого таза в гинекологических
стационарах неуклонно растет. Пациентки репродуктивного возраста оперируются не
только по поводу ургентных состояний, но все чаще подвергаются плановым
органосохраняющим оперативным вмешательствам в связи с изолированными или
сочетанными гиперпластическими процессами (эндометриоз, миома матки,
гиперплазия эндометрия), а также для установления причины бесплодия [1, 2].
По данным отечественных и
зарубежных авторов, распространенность бесплодия достигает 10-15 %, в
некоторых регионах России – 20 %, а частота самопроизвольного выкидыша в
первом триместре беременности сохраняется на уровне 16 %. Снижение женской
фертильности имеет множество причин, среди которых на долю маточного фактора
бесплодия в изолированном или сочетанном варианте приходится 24-62 %.
Известно, что частота встречаемости патологических изменений эндометрия при
бесплодии достигает 88 %, при неэффективных попытках ЭКО – 77,5 % [3].
Снижение женской
фертильности имеет множество причин, среди которых на долю маточного фактора
бесплодия в изолированном или сочетанном варианте приходится 24-62 %.
Известно, что частота встречаемости патологических изменений эндометрия при
бесплодии достигает 88 %, при неэффективных попытках ЭКО – 77,5 % [3].
Маточный фактор является в
настоящее время ведущей причиной женского бесплодия, составляя, по данным
различных авторов, от 20 до 72 %. Несмотря на достижения современной
медицины, маточное бесплодие до сих пор остается одним из сложнейших
патологических состояний с учетом трудности его диагностики и лечения, а также
возможности восстановления репродуктивной функции.
Этиологическими и патогенетическими факторами маточного бесплодия
могут являться: перенесенные воспалительные заболевания полости матки,
эндометриоз, внутриматочные манипуляции и оперативные вмешательства, такие как
выскабливание стенок полости матки при прерывании беременности, хирургические
аборты, гистерорезектоскопии, лечебные и диагностические гистероскопии и т.д. Негативным
последствием внутриматочных вмешательств, несмотря на их органосохраняющий
эффект и малоинвазивность, в 20 % случаев является формирование синехий
(спаек) в полости матки. Чем обширнее площадь повреждения эндометрия, тем выше
вероятность развития спаек и более выраженный спаечный процесс следует ожидать
в будущем [4].
Внутриматочными
синехиями называют спайки (сращения), образовавшиеся между отдельными участками
эндометрия, которые влекут за собой частичное или полное заращение полости
матки [5]. Впервые внутриматочные синехии, возникшие после выскабливания
полости матки, были описаны в конце XIX века Heinrich Fritsch, но их
клиническую значимость доказал Asherman в 1948 г. на примере пациентки с
вторичной аменореей после травматичных родов. В настоящее время термин «синдром
Ашермана» является собирательным понятием и часто используется в случаях
диагностики любых видов внутриматочных синехий [6]. Понятие синдрома Ашермана
включает в себя нарушение менструальной (гипоменорея, аменорея) и детородной
функций, обусловленное наличием внутриматочных сращений. Основными клиническими
проявлениями этой патологии выступают: альго- и дисменорея, гипоменорея, в
тяжелых случаях – аменорея; формирование гематометры и/или гематосальпинкса [1].
Несмотря на то, что о внутриматочных синехиях известно больше века, эта
проблема до сих пор остается нерешенной, в связи с чем в современной
гинекологии продолжается разработка способов профилактики, диагностики и
лечения данной патологии [7].
Причиной образования
сращений в полости матки, как правило, является механическая травма базального
слоя эндометрия [5]. Роль инфекции в развитии внутриматочных синехий остаётся
спорной. В то время как одни авторы считают, что инфекции не причастны к
формированию внутриматочных синехий, другие утверждают, что основной причиной
данной патологии является именно инфекция, особенно при гистологически
подтвержденном хроническом или подостром эндометрите, даже без клинической
картины (лихорадки, лейкоцитоза, гнойных выделений) [8].
Ряд авторов утверждают,
что критический период, в течение которого появляются спайки, составляет 3-5 дней
после операции. Этот процесс усиливается рядом факторов, которые нарушают
физиологический фибринолиз: ишемия, посттравматическое воспаление, наличие
крови, инородные тела. Спайки могут вовлекать различные слои как эндометрия,
так и миометрия. Во многих случаях передняя и задняя стенки матки адгезируются
между собой, в других случаях спайки образуются только локально. Сращения этих
тканей гистероскопически проявляются характерной картиной: эндометриальные
спайки схожи с окружающей здоровой тканью, миофибриальные спайки встречаются
наиболее часто, характеризуются поверхностным тонким слоем эндометрия с
множественными железами. Количество спаек определяет степень тяжести процесса:
легкая, умеренная или тяжелая. Внутриматочные синехии могут быть тонкими или
плотными, возможно фиброзированными [6, 8]. В зависимости от степени заращения
полости матки внутриматочные синехии проявляются гипоменструальным синдромом
или аменореей (маточная форма). Нарушения менструальной функции остаются общими
клиническими проявлениями данной патологии. Также клинические проявления тесно
связаны с такими патологическими изменениями, как глубина фиброза и
расположение спаек.
Особенностью
маточной формы аменореи является сохранение у пациентки субъективного ощущения
циклических изменений, а выполняемые у неё гормональные исследования
(определение гонадотропинов, эстрадиола и прогестерона) указывают на сохранение
функции яичников и адекватной гипофизарной регуляции [5]. При обструктивной
аменорее у пациенток отмечаются циклический дискомфорт или боли внизу живота,
гематометра и даже гематосальпинкс. Отмечается также дисменорея и бесплодие. По сравнению с аменореей и
бесплодием, невынашивание беременности относится к более легким осложнениям
внутриматочных синехий. Возможные этиологические факторы включают в себя:
уменьшение полости матки, отсутствие достаточного количества нормальной ткани
эндометрия для имплантации и поддержки плаценты, неполноценную васкуляризацию
функционирующего эндометрия вследствие фиброза и т.д. В исследовании Schenker J.G.,
Margalioth E.J. [8] наблюдались 165 беременностей
у женщин с нелеченой формой синдрома Ашермана. Частота спонтанного выкидыша
составила 40 %, преждевременных родов 23 %, своевременные роды
произошли в 30 % случаев, патологическое прикрепление плаценты наблюдалось
у 13 % женщин, внематочная беременность – у 12 % больных.
Пациентки с внутриматочными
синехиями могут также жаловаться на боли различной интенсивности внизу живота,
усиливающиеся в дни менструации. Болевой синдром оказывается более интенсивным
при локализации сращений в нижней трети матки и канале шейки матки, поскольку
при этом возникают затруднения с оттоком менструальной крови. Если отток
менструальной крови не нарушен, боль не выражена. Боль также отсутствует при
полной облитерации полости матки, поскольку в таких случаях отсутствует
циклическая десквамация функционального слоя эндометрия, сопровождаемая
менструальным кровотечением. У женщин со слабовыраженными внутриматочными
синехиями беременность может наступить, однако у 1/3 из них в последующем
происходят самопроизвольные выкидыши, у 1/3 преждевременные роды, ещё у 1/3
имеется патология плаценты (плотное прикрепление, предлежание). При более
выраженных внутриматочных сращениях возникает стойкое бесплодие, причинами
которого являются: облитерация полости устьев маточных труб; уменьшение площади
функционального эндометрия и снижение его рецептивности из-за прогрессирующих
атрофических изменений, проявляемых в виде феномена тонкого эндометрия; создание
механических препятствий для имплантации плодного яйца [5, 8].
Предположить
наличие внутриматочных сращений можно на основании характерных
клинико-анамнестических данных (указание пациенткой на предшествующие
внутриматочные манипуляции, наличие у неё признаков гипоменструального синдрома
или аменореи) и по результатам стандартного ГСГ. Окончательный диагноз
внутриматочных синехий устанавливают при выполнении гистероскопии.
При выполнении
ГСГ сращения на рентгенограммах выглядят как одиночные и множественные дефекты
наполнения полости матки, которые могут иметь вид полос, сохраняющихся на
протяжении всего исследования. Полость матки может быть деформирована частично
или полностью вплоть до полной её облитерации, когда контрастируется лишь канал
шейки матки. Следует принять во внимание, что небольшие синехии при ГСГ не
визуализируются. В целом чувствительность ГСГ при диагностике внутриматочных
синехий, по усреднённым данным, колеблется от 36 до 89 % [5].
В настоящее
время «золотым стандартом» диагностики и лечения ВМС является гистероскопия.
При гистероскопии синехии определяются как белесоватые бессосудистые тяжи –
сращения между стенками матки различной плотности и протяженности, нередко
уменьшающие объем полости матки, а иногда полностью ее облитерирующие. Синехии
могут располагаться также в цервикальном канале, вызывая его заращение и
препятствуя доступу в полость матки и оттоку содержимого из нее. Нежные синехии
выглядят как тяжи бледно-розового цвета в виде паутины, иногда видны проходящие
в них сосуды. Более плотные сращения определяются как плотные белесоватые тяжи,
располагающиеся, как правило, по боковым стенкам, реже – по центру полости
матки.
Множественные
поперечные синехии обуславливают частичное заращение полости матки с множеством
полостей различной величины в виде углублений (отверстий). Иногда эти отверстия
ошибочно принимают за устья маточных труб [9]. При выполнении гистероскопии
целесообразно оценивать тяжесть процесса внутриматочного спайкообразования,
поскольку от этого зависит прогноз эффективности намечаемой терапии по критерию
её влияния на репродуктивные исходы у инфертильных женщин с такой патологией [5].
К настоящему
времени накоплен большой опыт применения различных методов профилактики
образования внутриматочных синехий. В послеоперационном периоде после
внутриматочных вмешательств для профилактики образования спаек традиционно
используется терапия натуральными эстрогенами в комбинации или без прогестинов
с целью ускоренной пролиферации нормального эндометрия, специальные
внутриматочные устройства или введение баллонных катетеров, противоспаечные
барьеры. Однако, последние анализы накопленного клинического материала
свидетельствуют о недостаточной эффективности предложенных методов лечения с
целью профилактики образования внутриматочных синехий и не обладают должной эффективностью
[1, 4, 8, 10].
В течение
многих лет разрабатываются способы внутриматочного воздействия, обладающие
главным образом и противовоспалительным, и иммуномодулирующим эффектом, поэтому
они более приемлемы в практике для осуществления в последующем репродуктивной
функции. Это и потребовало поиска новых подходов к решению проблемы лечения синехий
полости матки и дальнейших научно-практических исследований.
Нами была
запатентована методика лечения тонкого эндометрия с использованием аутоплазмы,
содержащей тромбоциты. Аутоплазма, содержащая тромбоциты, вводилась внутриматочно
в количестве 0,5-1 мл и парацервикально на глубину 0,5 см, в подслизистый
слой объёмом по 1,5 мл с одной и с другой стороны на 17 и 19 часах [11].
Не являющаяся токсичной или иммунореактивной, аутоплазма, содержащая
тромбоциты, ускоряет естественные механизмы регенерации благодаря наличию в
тромбоцитах факторов роста. Кроме того, аутоплазма, содержащая тромбоциты,
модулирует и регулирует функцию первичных факторов роста. Упомянутое свойство
отличает факторы роста тромбоцитарной аутоплазмы от рекомбинантных факторов
роста, каждый из которых отвечает за отдельный механизм регенерации.
В качестве препаратов заместительной гормонотерапии (эстрогенов)
использовались трансдермальные формы эстрогенов (Дивигель), которые обладают
рядом преимуществ перед оральным приёмом эстрадиола ввиду высокой (по сравнению
с оральным приемом) биодоступности и возможности легкого варьирования дозы.
Доза подбиралась индивидуально под контролем ультразвукового исследования
(величина М-эхо эндометрия). Эстрогены назначались по 21-дневной схеме, в
течение последних десяти дней их сочетали с прогестинами (дидрогестерон 10-20 мг/сут,
микронизированный прогестерон 200 мг/сут).
Внутриматочное и
парацервикальное введение аутоплазмы, содержащей тромбоциты, проводилось
непосредственно после проведения гистерорезектоскопии и далее дважды на фоне заместительной
гормонотерапии в каждом менструальном цикле в позднюю фазу пролиферации (9-й
или 10-й дни) менструального цикла и через 72 часа в течение трёх-шести
менструальных циклов. Несомненным преимуществом аутоплазмы,
содержащей тромбоциты, является усиление кровоснабжения слизистой оболочки тела матки, а
также сочетание противовоспалительного действия с улучшением ростовых функций,
что позволяет проводить лечение с соблюдением принципа «пролиферация без
воспаления». Контрольная гистероскопия проводилась через шесть месяцев лечения.
Клинический пример № 1
Пациентка С., 40 лет,
поступила в отделение гинекологии с жалобами на отсутствие беременности в
течение 3-х лет, гипоменструальный синдром.
Из анамнеза: беременность,
замершая три года назад. Обследована, получала курс противовоспалительной,
антибактериальной терапии. Со временем отмечала менструации более скудные и
короткие, болезненные. По УЗИ: матка не увеличена, диффузно неоднородная,
эндометрий 3,2 мм, уменьшен с учётом дня цикла. При проведении гистерорезектоскопии
обнаружено: полость матки деформирована за счёт внутриматочных синехий в
средней трети ближе к левой стенке матки. Эндометрий не выражен, не соответствует
фазе менструального цикла. Петлевым электродом проведено рассечение и иссечение
синехий. Устья маточных труб не визуализируются. По данным гистологического
исследования: Хронический эндометрит. После рассечения синехий в полость матки
и подслизистую парацервикально вводилась аутоплазма, содержаая тромбоциты, и
далее в каждом менструальном цикле на фоне заместительной гормонотерапии в
течение 3-х месяцев.
Пациентка отмечала
восстановление нормального менструального цикла. По данным УЗИ, патологии
полости матки не обнаружено. При проведении контрольной офисной ГС полость
матки имела нормальную форму, устье правой маточной трубы визуализировалось без
особенностей, устье левой маточной трубы визуализировалось нечётко. Эндометрий
соответствовал фазе менструального цикла. Через 6 мес. после лечения и
проведения гистероскопии наступила спонтанная беременность, которая закончилась
срочными родами в 36 недель беременности.
Клинический пример № 2
Пациентка Р., 29 лет, поступила
в отделение гинекологии с жалобами на отсутствие беременности в течение 8-ми
лет. Из анамнеза: послеродовый период последней беременности осложнился остатками
плацентарной ткани, гематометрой, подозрением на эндометрит, в связи с чем
производились неоднократные диагностические выскабливания с гистологическим
контролем. Менструальный цикл не восстановился, в течение шести лет отмечала
аменорею.
По
ультразвуковому исследованию: матка отклонена вправо, не увеличена, миометрий
умеренно диффузно-неоднородный. Эндометрий не выражен в области дна, в средней
и нижней трети определяется образование толщиной 2,4-3,3 мм повышенной
эхогенности. Контуры эндометрия на границе с миометрием нечёткие, структура
однородная. Полость матки не расширена, удвоена в области дна (седловидная
форма?). Правый и левый яичники без особенностей.
При проведении
гистерорезектоскопии обнаружено: полость матки неправильной формы, представлена
каналом, отклоняющимся влево. Эндометрий сохранён в пределах этого канала. Определяется
устье правой маточной трубы. Определяется ход, соединяющий нижнюю треть полости
матки с фрагментом правого маточного сегмента. Выполнено рассечение синехий с
помощью петлевого электрода, сформирована треугольная форма полости матки.
Правое устье не определяется, эндометрий в области правого маточного угла
сохранён. Выполнена биопсия эндометрия. После рассечения синехий в полость
матки и подслизистую парацервикально вводилась аутоплазма, содержащая
тромбоциты, и далее в каждом менструальном цикле на фоне заместительной
гормонотерапии в течение шести месяцев. Постепенно восстановились менструации:
сперва скудные, в течение 1-2-х дней, с постепенным увеличением до 4-5-ти дней.
В настоящее время пациентка жалоб не предъявляет, планирует беременность.
Клинический пример № 3
Куликова Е.Л., 41 года,
поступила в отделение гинекологии с жалобами на болезненные менструации,
нарушение менструального цикла в течение шести месяцев. Из анамнеза: около года
назад был выявлен полип эндометрия по ультразвуковому исследованию, выполнялась
гистероскопия, с выскабливанием полости матки. По гистологии железистый полип
эндометрия. Хронический эндометрит. Лечение по результату гистологии не
проводилось. На контрольном УЗИ через 6 месяцев обнаружены гиперэхогенные
образования размером 9,2-3,8 и 6,8-4,2 мм, аваскулярные. С диагнозом полип
эндометрия была направлена в отделение гинекологии.
При проведении
гистерорезектоскопии обнаружено: полость матки неправильной формы деформирована
по правой стенке и в дне матки, имеются плотные синехии. Эндометрий не выражен,
не соответствует фазе менструального цикла. Устье правой трубы определяется, левой
– облитеривано. Петлевым электродом проведено рассечение и иссечение синехий. После
рассечения синехий с лечебной и профилактической целью в полость матки и
подслизистую парацервикально вводилась аутоплазма, содержаая тромбоциты. В
дальнейшем проводились курсы противовоспалительного лечения и дальнейшее
введение тромбоцитарной аутоплазмы в течение трёх менструальных циклов.
Пациентка
отмечала восстановление нормального менструального цикла. По данным
контрольного УЗИ через 3 месяца, патология полости матки не обнаружена.
При проведении контрольной ГС полость матки имеет правильную форму, устье
правой маточной трубы визуализировалось без особенностей, устье левой маточной
трубы визуализировалось нечетко. Эндометрий соответствует фазе менструального
цикла.
Клинический пример № 4
Пациентка Н., 32 года, поступила в гинекологическое отделение с жалобами на болезненные скудные менструации, привычное невынашивание беременности. Из анамнеза: после срочных родов послеродовый период осложнился эндометритом, в связи с чем было произведено выскабливание стенок полости матки. Менструальный цикл восстановился через 2 мес. по типу гипоменореи. Через год на сроке 7-8 нед. диагностирована неразвивающаяся беременность, по поводу которой выполнено выскабливание стенок полости матки. Через 6 мес. по ультразвуковому исследованию выявлены синехии полости матки. Выполнена гистерорезектоскопия (ГРС), рассечение синехий. В последующем через месяц выполнялась повторная ГС с повторным рассечением внутриматочных синехий и с последующим введением аутоплазмы, содержащей тромбоциты, с повторным введением в последующих циклах. Через 3 мес. наступила спонтанная беременность, которая при доношенном сроке закончилась плановым кесаревым сечением в связи с краевым расположением плаценты.
ВЫВОДЫ
Применение аутоплазмы, содержащей тромбоциты, у женщин с
синехиями полости матки показало, что метод оказывает положительное воздействие
в целях улучшение клинической картины, восстановления нормальной менструальной
функции и осуществления репродуктивных планов.
Таким образом, данная
терапия может быть рекомендована к использованию в практике акушера-гинеколога
при патологии полости матки, сопровождающейся хроническим эндометритом и
образованием внутриматочных синехий. Такой способ лечения является достаточно эффективным,
малоинвазивным, простым и безопасным методом лечения, не требующим сложного
оборудования. Обеспечивает пациенткам низкую степень болезненности и отсутствие
осложнений.
Информация о финансировании и конфликте интересов
Исследование не имело
спонсорской поддержки.
Авторы декларируют
отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией
настоящей статьи.
ЛИТЕРАТУРА / REFERENCES:
1. Molotkov
AS, Popov EN, Sudakov DS, Aivazian TA, Alexandrova LA, Dymarskaya YuR The
experience of intrauterine use of an anti-adhesion gel based on hyaluronic acid
for the prevention of Asherman’s syndrome in patients with pathology of the
uterine cavity and severe forms of endometriosis. Journal of Obstetrics and Women’s Diseases. 2017; 66(6): 13-14.
Russian
(Молотков А.С., Попов Э.Н., Судаков Д.С., Айвазян Т.А., Александрова Л.А.,
Дымарская Ю.Р. Опыт внутриматочного применения противоспаечного геля на основе
гиалуроновой кислоты для профилактики синдрома Ашермана у пациенток с
патологией полости матки и тяжёлыми формами эндометриоза //Журнал акушерства и
женских болезней. 2017. Т. 66, № 6. С. 13-14)
2. Popov EN,
Aivazian TA, Alexandrova LA, Sudakov DS, Vorobyova DD Re-search of the
functional morphology of myometrium in reproductive age women with multiple
proliferative dis-eases of uterus and isolated uterine leiomyoma. Eastern European Scientific Journal.
2016; 1(5): 117-123. Russian (Попов Э.Н., Айвазян Т.А., Александрова Л.А.,
Судаков Д.С., Воробьева Д.Д. Оценка функциональной морфологии миометрия у
женщин репродуктивного возраста с сочетанными пролиферативными заболеваниями
матки и изолированной лейомиомой матки //Eastern
European Scientific Journal. 2016. Т. 1, № 5. P. 117-123)
3. Kuznetsova
IV, Sheveleva TV, Pobedinskaya OS, Uspenskaya YuB, Gilels AV. Application of
human placental hydrolyzate in therapy of insufficient proliferation of the
endometrium. Ginekologiya. 2013; 3: 29-33. Russian (Кузнецова И.В., Шевелева Т.В.,
Побединская О.С., Успенская Ю.Б., Гилельс А.В. Применение гидролизата плаценты
человека в терапии недостаточной пролиферации эндометрия //Гинекология. 2013. № 3.
С. 29-33)
4. Tikhomirov
AL, Gevorkian AL, Sarsaniya SI. The risks of adhesions during surgical
interventions in gynecology and their prevention. Reproduction
problems.
2016; 22(6): 66-73. Russian (Тихомиров
А.Л., Геворкян М.А., Сарсания С.И. Риски спаечного процесса при хирургических
вмешательствах в гинекологии и их профилактика //Проблемы репродукции. 2016. T. 22. № 6. C. 66-73)
5. Krasnopolskaya
KV, Ershova IYu, Fedorov AA. Thin endometrium. Infertility treatment in women
with endometrial hypoplasia. M.: GEOTAR-Media. 2020; 112. Russian (Краснопольская К.В., Ершова И.Ю., Федоров А.А. Тонкий эндометрий. Лечение бесплодия у женщин с гипоплазией эндометрия. – М.: ГЭОТАР-Медиа, 2020. 112 с.)
6. Makarenko
TA, Nikiforova DE, Ulyanova IO. Intrauterine synechia: features of surgical
treatment and prevention of relapse. Medical Council. 2018; 7: 2-3. Russian
(Макаренко Т.А., Никифорова Д.Е., Ульянова И.О. Внутриматочные синехии:
особенности хирургического лечения и профилактика рецидивов //Медицинский
совет. 2018. № 7. С. 2-3)
7. Klyucharov IV, Khasanov AA. Surgical microhysteroscopy with intrauterine synechia. Actual problems of medicine. 2012; 1: 94. Russian (Ключаров И.В., Хасанов А.А. Хирургическая
микрогистероскопия при внутриматочных синехиях //Актуальные проблемы медицины.
2012. Т. 1. С. 94)
8. Popov AA,
Manannikova TN, Alieva AS, Fedorov AA. Intrauterine synechia: a century later. Russian Medical Journal. 2017; 12: 3.
Russian
(Попов А.А., Мананникова Т.Н., Алиева А.С., Федоров А.А. Внутриматочные синехии:
век спустя //РМЖ. 2017. № 12. С. 3)
9. Stefanescu
A., Marinescu B. Diagnostic hysteroscopy – a retrospective study of 1545 cases.
Maedica (Buchar). 2012; 7(4): 309-314
10. Di Spiezio
Sardo A, Spinelli M, Bramante S. Efficacy of a polyethylene oxide-sodium
carboxymethylcellulose gel in prevention of intrauterine adhesions after
hysteroscopic surgery. J Minim Invasive
Gynecol. 2011; 18(4): 462-469. DOI: 10.1016/j.jmig.2011.04.007
11. Patent na
izobretenie RUS 2646508 04.04.2017 /A method for the treatment of thin
endometrium //Kravchenko EN, Cygankova OJu, Kropmaer KP. Russian (Патент на изобретение
RUS 2646508 04.04.2017 /Способ лечения тонкого эндометрия
//Кравченко Е.Н., Цыганкова О.Ю., Кропмаер К.П.)
Статистика просмотров
Загрузка метрик …
Ссылки
- На текущий момент ссылки отсутствуют.
Центр акушерства, гинекологии и перинатологии имени В.И.Кулакова — Внутриматочные синехии – это спайки в полости матки, от единичных на фоне «тонкого» эндометрия, до множественных и грубых, занимающих всю полость матки (синдром Ашермана). Синехии встречаются у 5-40% пациенток после перенесенного эндометрита и операций на матке: удаления узлов миомы со вскрытием ее полости, прерывания беременности, диагностического выскабливания, удаления полипов. Основной причиной возникновения синехий считается механическая травма базального слоя эндометрия, а инфекция служит вторичным фактором. В плане возможного травмирования слизистой оболочки матки наиболее опасными считаются прерывания беременности и первые 4 нед после родов. С целью профилактики образования синехий и лечения, если они все же сформировались, используются: антибактериальная и гормонотерапия, физиотерапия. Вот о возможностях последней мы и хотим рассказать. У пациентка К., 29 лет, при планировании самостоятельной беременности по данным УЗИ был выявлен полип эндометрия. В 2015 году проведены хирургическая гистероскопия, полипэктомия, выскабливание полости матки. В послеоперационном периоде проведен курс антибактеральной терапии. При контрольном УЗИ через 3 месяца выявлены внутриматочные синехии на фоне «тонкого» эндометрия. Пациентка обратилась в Центр им. В.И. Кулакова, где повторно сделана хирургическая гистероскопия, разрушение внутриматочных синехий и назначен первый курс физиолечения в сочетании с гормональной терапией. Через 2 месяца — повторный интенсивный курс физиотерапии. Через 4 месяца после окончания физиотерапии пациентка забеременела. В июле 2017 года — своевременные самостоятельные роды, родился здоровый мальчик. Этот клинический случай свидетельствует об эффективности физиолечения, индивидуально подобранного и проведенного в условиях гинекологического отделения восстановительного лечения. #centrkulakova #синехии #восстановление #бытьздоровой #будумамой
Центр акушерства, гинекологии и перинатологии имени В.И.Кулакова is on Facebook. To connect with Центр акушерства, гинекологии и перинатологии имени В.И.Кулакова, join Facebook today.
Причины возникновения синехий матки и лечение для зачатия ребенка
Синехии матки представляют собой спайки или рубцовые ткани, образующиеся в полости матки. Они классифицируются в зависимости от их местоположения и протяженности.
Обычно они покрывают небольшую часть полости матки и не мешают фертильности или нормальному развитию беременности; однако иногда они могут занимать слишком много места и заставлять стенки матки слипаться.
Основные симптомы маточных синехий
Фактическая частота маточных синехий неизвестна, поскольку они обычно бессимптомны, когда они маленькие.Однако, если они серьезны, они могут вызвать:
- Аменорею или отсутствие менструации
- Гипоменорею (короткие или скудные менструации)
- Бесплодие
- Повторяющееся невынашивание беременности (повторяющиеся выкидыши)
