Сепсис у новорожденных: Перинатальные заболевания как ведущая причина летальных исходов у детей | #09/19
Перинатальные заболевания как ведущая причина летальных исходов у детей | #09/19
В современном здравоохранении для улучшения охраны здоровья и снижения детской смертности был принят «Глобальный консенсус в отношении охраны здоровья матери, детей и новорожденных» [1]. Этот документ включает систему мероприятий как со стороны государства в целом, так и со стороны здравоохранения. Одним из аспектов Глобальной стратегии является улучшение регистрации летальных исходов в детском возрасте. В настоящее время около 30% летальных исходов приходится на возраст от 0 до 5 лет. Именно этот возрастной период является самым главным резервом для снижения показателя детской смертности [2, 3]. При этом смертность и заболеваемость у детей полностью взаимосвязанные понятия. От предотвратимых причин умирают около 40% детей первых месяцев жизни [4, 5]. Подавляющее количество детей умирают в возрасте до 1 года, что составляет 55–65% от показателя смертности в возрасте от 0 до 14 лет [6].
Самыми частыми причинами смерти новорожденных во всем мире являются асфиксия, неонатальный сепсис, врожденные пороки развития, инфекционные заболевания [9]. Большинство из этих причин относятся к заболеваниям плода и новорожденного. Согласно Международной классификации болезней 10-го пересмотра (МКБ-10) эти заболевания представляют класс XVI, который объединяет отдельные состояния, возникшие в перинатальном периоде. Следует подчеркнуть, что даже если заболевания и летальный исход возникли позднее, то эти нозологические единицы относятся к классу XVI (рубрики Р00-Р96). Поэтому для достижения цели снижения детской смертности необходимо учитывать и анализировать ведущие причины летальных исходов, в первую очередь заболеваний, возникших в перинатальном периоде.
Отдельные состояния, возникшие в перинатальном периоде, отличаются от заболеваний других классов этиологией, патофизиологией и клинической симптоматикой. Приводим основные особенности заболеваний, возникших в перинатальном периоде.
Приводим основные особенности заболеваний, возникших в перинатальном периоде.
Согласно современным литературным сведениям внутриутробные инфекции и неонатальный сепсис являются чаще всего основной причиной заболеваемости и смертности у новорожденных [7, 10, 11]. Врожденная пневмония, как отдельная нозологическая единица, в равной степени встречается в странах как с низким, так и высоким уровнем детской смертности [12, 13]. Врожденные инфекции любой этиологии напрямую связаны с особенностями течения беременности. Практически во всех случаях в материнском анамнезе имеются указания на неблагоприятные факторы в различные периоды гестации. При этом наиболее частой причиной рождения ребенка с инфекционным заболеванием является плацентарная недостаточность инфекционного генеза. При инфекционном поражении плода в плаценте определяются диффузные изменения в виде амнионита, трансмурального мембранита, фуникулита. В случаях плацентарной недостаточности инфекционного генеза микробный спектр матери самый многообразный.:max_bytes(150000):strip_icc()/level-2-nicu-getty-Alvis-Upitis-56a765b33df78cf772958db0.jpg)
В зависимости от сроков манифестации бактериального сепсиса можно определить период инфицирования новорожденного. Если сепсис возникает до 72 часов жизни (ранний сепсис), то инфицирование новорожденного произошло до родов или в родах. Если сепсис развивается после 3-го дня жизни (поздний сепсис), то инфицирование ребенка возможно как в родах, так и после рождения [8, 16]. Диагноз сепсиса у подавляющего числа новорожденных до недавнего времени выставлялся на основании подозреваемой и/или документированной инфекции в сочетании с синдромом системной воспалительной реакции (SIRS — systemic inflammatory response syndrome) [17–19].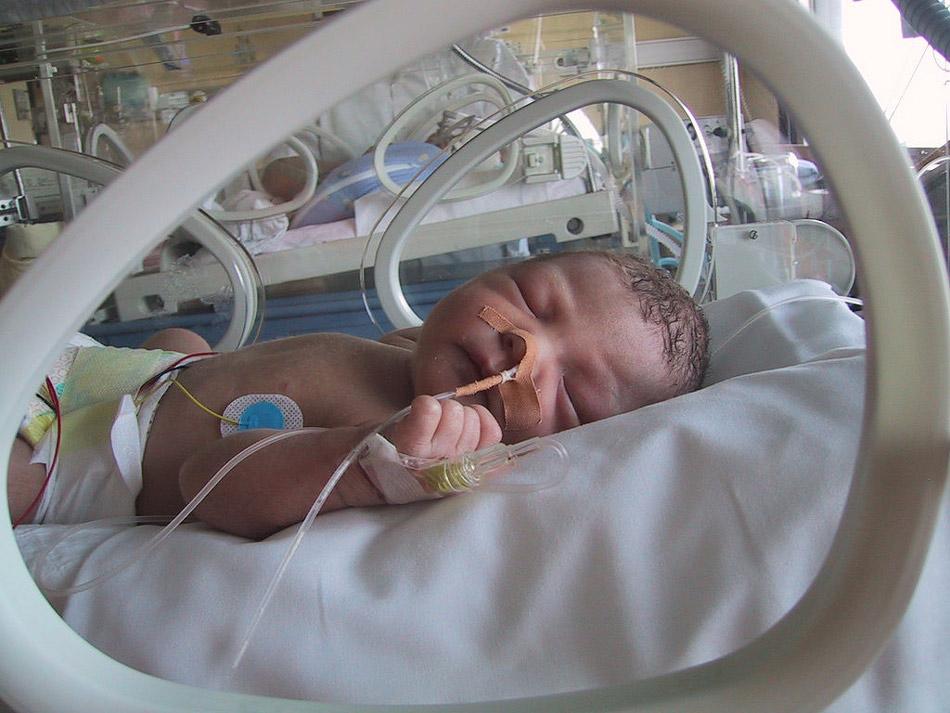
Большой удельный вес в заболеваемости и смертности детей периода новорожденности занимают врожденные инфекции небактериальной этиологии.
Перинатальные заболевания неинфекционной природы представлены церебральной лейкомаляцией, бронхолегочной дисплазией (БЛД), внутричерепными кровоизлияниями (ВЧК) нетравматическими и травматическими, синдромом дыхательных расстройств (СДР), некротизирующим энтероколитом, асфиксией, гемолитической болезнью новорожденного, аспирацией мекония и др.
Церебральная лейкомаляция является одним из вариантов гипоксически-ишемического повреждения головного мозга у новорожденных.![]()
Увеличение выживаемости глубоко недоношенных детей в последние годы привело к появлению новых заболеваний и состояний, которые стали оказывать влияние на дальнейший прогноз жизни и здоровья. Одним из таких заболеваний является БЛД, возникшая в перинатальном периоде. Это полиэтиологическое заболевание незрелых легких, возникшее в результате интенсивной терапии СДР или пневмонии. В настоящее время выделяют две основные формы БЛД недоношенных: «новая (постсурфактантная) БЛД» и «старая (классическая) БЛД». Фенотипы этих вариантов БЛД кардинально отличаются по различным критериям (этиологии, патогенезу, патоморфологии, гестационному возрасту, респираторной терапии, тяжести заболевания и др.) [28].
Одними из неинфекционных заболеваний, возникшими в перинатальном периоде, являются ВЧК нетравматические и травматические. Нетравматические ВЧК являются прерогативой недоношенных детей, что связано с незрелостью головного мозга, особенностями его васкуляризации и потерей автономности мозгового кровотока на фоне критических состояний [29]. У доношенных детей причиной ВЧК нетравматических чаще всего является тяжелая хроническая или острая гипоксия. В основе ВЧК травматического генеза всегда лежит нарушение целостности тканей головного мозга, возникшее во время родов. В последние годы отмечено уменьшение количества родовых травм, в связи с увеличением количества кесаревых сечений.
У доношенных детей причиной ВЧК нетравматических чаще всего является тяжелая хроническая или острая гипоксия. В основе ВЧК травматического генеза всегда лежит нарушение целостности тканей головного мозга, возникшее во время родов. В последние годы отмечено уменьшение количества родовых травм, в связи с увеличением количества кесаревых сечений.
У глубоко недоношенных детей в связи с незрелостью легочной ткани возникает первичный дефицит сурфактанта, что является причиной СДР в раннем неонатальном периоде [16]. Современные перинатальные технологии позволяют большинству таких детей сохранить жизнь. Тем не менее в силу крайней степени морфофункциональной незрелости ребенка или тяжелого сопутствующего заболевания может наступить и летальных исход.
Еще одним заболеванием, возникшим в перинатальном периоде, является некротизирующий энтероколит. Это заболевание получило термин «болезнь выживших недоношенных». В основе его лежит сочетание неспецифического воспаления, ишемии кишечной стенки и незрелости механизмов защиты [30].
Наряду с описанными заболеваниями, возникшими в перинатальном периоде, летальность может быть также обусловлена гемолитической болезнью новорожденных, аспирацией мекония и некоторыми другими состояниями.
Целью настоящего исследования было изучить нозологические единицы летальных исходов у детей, относящихся к заболеваниям перинатального периода, для выработки направлений совершенствования медицинской помощи и снижения летальности.
Материалы и методы исследования
Представлен ретроспективный анализ медицинских карт стационарных больных, протоколов патологоанатомических вскрытий, результатов морфологического исследования плаценты и протоколов комиссий по изучению летальных исходов детей, умерших в отделении реанимации и интенсивной терапии (ОРИТ) для новорожденных за 10 лет (2008–2018 гг. ). Стационар, в котором проводилось исследование, относится к учреждениям третьего уровня оказания медицинской помощи новорожденным, находящимся в критическом состоянии, детям с очень низкой и экстремально низкой массой тела при рождении или требующим хирургической помощи. Медицинская помощь детям в ОРИТ осуществляется на основании Приказа Министерства здравоохранения Российской Федерации от 12 ноября 2012 г. № 909н «Об утверждении Порядка оказания медицинской помощи детям по профилю «анестезиология и реаниматология». ОРИТ является структурным подразделением областной детской клинической больницы. Возраст пациентов, поступающих в ОРИТ неонатологического профиля, составлял от 0 до 28 суток жизни.
). Стационар, в котором проводилось исследование, относится к учреждениям третьего уровня оказания медицинской помощи новорожденным, находящимся в критическом состоянии, детям с очень низкой и экстремально низкой массой тела при рождении или требующим хирургической помощи. Медицинская помощь детям в ОРИТ осуществляется на основании Приказа Министерства здравоохранения Российской Федерации от 12 ноября 2012 г. № 909н «Об утверждении Порядка оказания медицинской помощи детям по профилю «анестезиология и реаниматология». ОРИТ является структурным подразделением областной детской клинической больницы. Возраст пациентов, поступающих в ОРИТ неонатологического профиля, составлял от 0 до 28 суток жизни.
При статистической обработке материала проводилось определение среднего арифметического и среднеквадратичного отклонения некоторых показателей (M ± m). В последующем оценивалась значимость различий средних величин по t-критерию Стьюдента.
За период с 2008 по 2018 г. летальный исход был зарегистрирован у 186 детей. Из них у 146 (78,5%) пациентов основное заболевание кодировалось (согласно МКБ-10) по классу XVI (отдельные состояния, возникшие в перинатальном периоде). Перинатальные заболевания, ставшие причиной летального исхода у детей ОРИТ, представлены на рис. По другим классам МКБ-10 летальный исход был зарегистрирован у 21,5% пациентов. Класс XVII — врожденные аномалии (пороки развития), деформации и хромосомные нарушения (Q00-Q99) — встречался в 18,3% случаев (34 пациента). Класс I — некоторые инфекционные и паразитарные заболевания (А00-А99) — встречался в 2,1% (4 пациента) и класс IX — болезни системы кровообращения — в 1,1% (2 пациента).
Из них у 146 (78,5%) пациентов основное заболевание кодировалось (согласно МКБ-10) по классу XVI (отдельные состояния, возникшие в перинатальном периоде). Перинатальные заболевания, ставшие причиной летального исхода у детей ОРИТ, представлены на рис. По другим классам МКБ-10 летальный исход был зарегистрирован у 21,5% пациентов. Класс XVII — врожденные аномалии (пороки развития), деформации и хромосомные нарушения (Q00-Q99) — встречался в 18,3% случаев (34 пациента). Класс I — некоторые инфекционные и паразитарные заболевания (А00-А99) — встречался в 2,1% (4 пациента) и класс IX — болезни системы кровообращения — в 1,1% (2 пациента).
Таким образом, в случаях летального исхода в ОРИТ преобладающей группой являются перинатальные заболевания (78,5%), относящиеся к классу XVI. В связи с этим нами было решено изучить именно эти нозологические единицы, возникшие в перинатальном периоде для выработки возможного совершенствования медицинской помощи детям и снижения летальности.
Результаты исследования и обсуждение
При перинатальных заболеваниях неонатальная летальность составила 62,4% (91 пациент), постнеонатальная летальность — 37,6% (55 пациентов). Из всех умерших детей с перинатальными заболеваниями недоношенных было 85,6% (125 пациентов), доношенных — 14,4% (21 ребенок).
Выявлено, что в 50% случаев (73 пациента) летальный исход произошел в результате бактериального сепсиса новорожденных (P36) и врожденной пневмонии (P23). Характеристика детей, умерших от бактериального сепсиса и врожденной пневмонии, приведена в табл. 1.
Из группы пациентов с бактериальным сепсисом и врожденной пневмонией 68 детей (93%) были недоношенные, 5 детей (7%) — доношенные. Как видно из табл. 1, среднее значение массы тела соответствовало низкой массе тела при рождении (менее 2500 г), а гестационный возраст соответствовал пациентам с очень низкой массой тела при рождении (менее 1500 г).
При бактериальном сепсисе новорожденных в 64% случаев определялись воспалительные изменения в плаценте, а при врожденной пневмонии в 88% случаев. Внутриутробное развитие плода при плацентарной недостаточности инфекционного генеза в большинстве случаев осложнялось истмико-цервикальной недостаточностью и преждевременными родами (91%).
Внутриутробное развитие плода при плацентарной недостаточности инфекционного генеза в большинстве случаев осложнялось истмико-цервикальной недостаточностью и преждевременными родами (91%).
У значительной части обследованных пациентов (40%) с бактериальным сепсисом и врожденной пневмонией этиологию заболевания определить не удалось (табл. 1). Однако при отрицательных посевах острое воспаление в плаценте (гнойный хориоамнионит, периваскулит, фуникулит) присутствовало у 30% случаев.
В случаях идентификации возбудителя (табл. 1) грамположительная флора обнаруживалась у 19 пациентов, грамотрицательная — у 17. При врожденной пневмонии грамположительная флора встречалась у 2 пациентов, грамотрицательная в 6 случаях. Лабораторные исследования для исключения атипичных возбудителей при врожденной пневмонии не проводились.
В 11,3% случаях бактериального сепсиса и 10% случаев врожденной пневмонии определялось фоновое заболевание — врожденное иммунодефицитное состояние (на секции выявлялся не классифицируемый тип иммунодефицита). Во всех этих случаях летальный исход был непредотвратимым.
Во всех этих случаях летальный исход был непредотвратимым.
На основании тщательного анализа медицинских карт стационарных больных и протоколов комиссий по изучению летальных исходов было выявлено, что при сепсисе непредотвратимость летального исхода составляла 90,6%, при врожденной пневмонии (85%).
В 15% случаев (22 пациента) причиной летального исхода были перинатальные инфекционные заболевания, кодирующие по другим рубрикам (характеристика детей, умерших от перинатальных инфекций, представлена в табл. 2). Из них: перинатальные инфекции неуточненные (P39.9) — 9 пациентов; врожденная цитомегаловирусная инфекция (P35.1) — 8; перинатальные инфекции уточненные (P39.8) — 4; синдром врожденной краснухи (P35.0) — 1.
У пациентов с летальным исходом в результате перинатальной инфекции неуточненной (P39.9) клинический диагноз был выставлен на основании наличия TORCH-синдрома, который встречался у 8 детей. В одном случае у ребенка с массой тела при рождении 930 г данный синдром отсутствовал. При этом 7 пациентов были недоношенными, а 2 — доношенными.
При этом 7 пациентов были недоношенными, а 2 — доношенными.
Из 8 случаев летального исхода от врожденной цитомегаловирусной инфекции (P35.1) диагноз у 7 пациентов был верифицирован только при патологоанатомическом исследовании. При жизни в 3 случаях были получены отрицательные результаты лабораторной диагностики для исключения этой инфекции; у 2 детей на основании имеющейся симптоматики был ошибочно поставлен диагноз бактериального сепсиса; у 2 детей не проводилось лабораторное исследование. В этой группе пациентов 7 детей были недоношенными и 1 — доношенный.
В результате перинатальной инфекции уточненной (P39.8) умерло 4 ребенка. Этиология инфекционного процесса была следующей: врожденный микоплазмоз (3 пациента), врожденный токсоплазмоз (1 пациент). Следует отметить, что при жизни у всех пациентов отмечался TORCH-синдром, но этиологический диагноз был поставлен только на основании посмертного морфологического исследования.
У 1 ребенка с перинатальной инфекцией при жизни на основании анамнеза, специфических клинических проявлений был поставлен диагноз «синдром врожденной краснухи» (P35. 0). Впоследствии этот клинический диагноз подтвердился при патологоанатомическом исследовании.
0). Впоследствии этот клинический диагноз подтвердился при патологоанатомическом исследовании.
У всех пациентов, умерших от перинатальных инфекций (неуточненные и уточненные, врожденная цитомегаловирусная инфекция, синдром врожденной краснухи), на секции были выявлены множественные поражения систем органов (интерстициальная пневмония, гепатит, менингоэнцефалит и др.). На основании данных патоморфологического исследования и изучения медицинских карт стационарных больных, протоколов комиссий по изучению летальных исходов был сделан вывод, что летальный исход был непредотвратимый.
Таким образом, самой частой причиной летальных исходов детей в ОРИТ были перинатальные инфекционные заболевания (65% случаев).
В 35% случаев летальный исход произошел от перинатальных заболеваний неинфекционной природы: церебральная лейкомаляция (Р91.2) — 16 пациентов; БЛД (Р27.2) — 14; ВЧК нетравматические (Р52) — 7; СДР (Р22) — 6; некротизирующий энтероколит (Р77) — 4; асфиксия тяжелая (Р21) — 1; ВЧК травматическое (Р10) — 1; гемолитическая болезнь плода и новорожденного (Р55) — 1; аспирация мекония (Р24) — 1.
Характеристика детей, умерших в результате церебральной лейкомаляции и БЛД, представлена в табл. 3.
В результате ретроспективного анализа выявлено, что у 81% детей с церебральной лейкомаляцией и у 71% детей с БЛД отмечалась тяжелая сопутствующая патология, которая взаимно отягощала течение основного заболевания (табл. 3).
У детей, умерших в результате церебральной лейкомаляции, отмечалась в анамнезе внутриутробная хроническая гипоксия, низкая оценка по шкале Апгар при рождении (через 1 минуту 3,6 ± 2,3; через 5 минут 6,3 ± 2,3) и критические состояния в неонатальном периоде. Основные клинические неврологические синдромы при церебральной лейкомаляции были следующие: атрофическая водянка головного мозга (9 пациентов), коматозное состояние (7 детей).
У пациентов с БЛД длительность искусственной вентиляции легких составляла 54 ± 26 дней. На основании фенотипа БЛД было выявлено, что новая форма встречалась у 5 пациентов. При этом летальный исход у них произошел от комбинированного основного заболевания из 2 конкурирующих (БЛД и крайняя незрелость или БЛД и гипоксически-ишемическая энцефалопатия). У 9 пациентов отмечалась классическая форма БЛД. Летальный исход при этом был непосредственно связан с основным заболеванием (БЛД), и на секции определялся диффузный пневмосклероз. Следует отметить, что при БЛД в 100% случаев отмечалась постнеонатальная летальность, и у всех детей летальный исход был непредотвратимым.
У 9 пациентов отмечалась классическая форма БЛД. Летальный исход при этом был непосредственно связан с основным заболеванием (БЛД), и на секции определялся диффузный пневмосклероз. Следует отметить, что при БЛД в 100% случаев отмечалась постнеонатальная летальность, и у всех детей летальный исход был непредотвратимым.
В 7 случаях летальный исход был обусловлен ВЧК нетравматическими. Все пациенты с нетравматическим генезом ВЧК были недоношенными, срок гестации составлял 26 ± 2 недели, масса тела 868 ± 263 г, и летальный исход у них отмечен в неонатальном периоде. У 4 детей было диагностировано внутрижелудочковое кровоизлияние II степени (интравентрикулярное), у 3 детей внутрижелудочковое кровоизлияние III степени (интравентрикулярное + перивентрикулярное). На основании анализа медицинских карт и протоколов комиссий по изучению летальных исходов был сделан вывод, что в 5 случаях летальный исход был непредотвратимым, в 2 случаях — предотвратимым. В 1 случае причиной смерти ребенка было травматическое кровоизлияние. Родовая травма в данном случае была обусловлена аномалией родовой деятельности.
Родовая травма в данном случае была обусловлена аномалией родовой деятельности.
В 6 случаях причиной летального исхода у недоношенных был СДР, обусловленный первичным дефицитом сурфактанта. Все пациенты были недоношенными, гестационный возраст составлял 28 ± 3 недели, масса тела 1472 ± 747 г. Смерть у всех пациентов произошла в неонатальном периоде. В 2 случаях летальный исход был предотвратимым в силу возникновения у детей побочных проявлений интенсивной терапии.
У 4 пациентов летальный исход произошел от некротизирующего энтероколита. Все дети умерли в неонатальном периоде, из них 3 ребенка были недоношенные и 1 — доношенным. Среднее значение гестационного возраста было 32 ± 3 недели, масса тела 1474 ± 592 г. Характер поражения желудочно-кишечного тракта при некротизирующем энтероколите был следующим. У 2 пациентов летальный исход отмечен на ранних стадиях поражения пищеварительной системы, и его причиной был синдром полиорганной недостаточности. В 2 случаях смерть пациентов произошла в результате перфорации кишечника с развитием перитонита. В одном случае при некротизирующем энтероколите летальный исход был предотвратимым.
В одном случае при некротизирующем энтероколите летальный исход был предотвратимым.
По одному случаю зарегистрирован летальный исход в результате тяжелой асфиксии, аспирации мекония и гемолитической болезни новорожденных. Во всех случаях летальный исход был предотвратимым. У 1 доношенного пациента причиной смерти была асфиксия тяжелой степени, у второго — аспирация мекония. В обоих случаях смерть предотвратимая (при проведении реанимационных мероприятий возникло смертельное побочное осложнение — синдромы утечки воздуха из легких). Причиной летального исхода у 1 доношенного пациента была гемолитическая болезнь новорожденного по резус-фактору, которая осложнилась билирубиновой энцефалопатией, что и явилось причиной смерти.
Выводы
- Ведущей причиной летальных исходов в ОРИТ стационара для новорожденных были заболевания, возникшие в перинатальном периоде (78,5%). Подавляющее число среди умерших пациентов составили недоношенные дети (85,6%). При перинатальных заболеваниях неонатальная летальность была 62,4%, постнеонатальная — 37,6%.
 От предотвратимых причин умерло 13% пациентов. При определении статистических различий средних величин массы тела при рождении и гестационного возраста (t-критерий Стьюдента) сравниваемые величины оказались статистически не значимы (p > 0,05).
От предотвратимых причин умерло 13% пациентов. При определении статистических различий средних величин массы тела при рождении и гестационного возраста (t-критерий Стьюдента) сравниваемые величины оказались статистически не значимы (p > 0,05). - В 65% случаев причиной летальных исходов были перинатальные инфекционные заболевания, в 35% — неинфекционные заболевания. Среди инфекционных перинатальных заболеваний в 50% случаев летальный исход произошел от бактериального сепсиса и врожденной пневмонии, что представляется главным резервом для снижения детской смертности. При инфицировании новорожденных до родов или в родах в большинстве случаев выявлялись воспалительные изменения в плаценте. В 64% случаях бактериального сепсиса инфицирование пациента произошло после рождения.
- Для совершенствования медицинской помощи и снижения летальности необходимо изменение системных факторов, в основе которых лежит улучшение состояние здоровья беременных женщин в плане инфекционных заболеваний.
 Кардинальное изменение этой ситуации находится за рамками полномочий врачей педиатров, и большое значение имеет улучшение жизненного уровня матерей. Для предупреждения инфекций, связанных с оказанием медицинской помощи детям, необходимо неукоснительное соблюдение санитарно-эпидемиологических требований, изложенных в СанПиН (2.1.3.2630–10).
Кардинальное изменение этой ситуации находится за рамками полномочий врачей педиатров, и большое значение имеет улучшение жизненного уровня матерей. Для предупреждения инфекций, связанных с оказанием медицинской помощи детям, необходимо неукоснительное соблюдение санитарно-эпидемиологических требований, изложенных в СанПиН (2.1.3.2630–10). - С учетом превалирования бактериального сепсиса (36%) среди всех причин летальных исходов и имеющихся обновленных ключевых положений этого заболевания необходимо внедрение новых критериев сепсиса, разработанных Третьим международным консенсусом по определению сепсиса и септического шока. Использование этих критериев и внедрение шкалы pSOFA у детей позволит своевременно распознавать сепсис, проводить раннюю интенсивную терапию и снизить летальность.
Литература
- Keeping promises, measuring result: Commission on information and accountability for women’s and children’s health — WHO, 2011.
- Прометнов Д. В., Спиридонова Е. А., Румянцев С. А. и др. Причины смертности детского населения (обзор литературы) // Медицинский вестник Юга России. 2013; 2: 13–19.
- Баранов А. А. Состояние здоровья детей в Российской Федерации // Педиатрия. 2012; 91 (3): 9–14.
- Alkema L., You D. Child mortality estimation: a comparison of UN IGME and IHME estimates of levels and trends in under five mortality rates and deaths // PLOS Medicine. 2012; 9 (8): e 1001288.
- Zobari M., Moslemi L., Abbasi E. et al. A study of frequency and causes of one month to 5-year-old child mortality and its affecting factors // International Journal Medicine. 2012; 1 (2): 33–36.
- Ильин А. Г., Романова Т. А., Акиньшин В. И. и др. Анализ младенческой смертности в Белгородской области за 2005–2007 гг. // Вопросы современной педиатрии. 2008; 7 (3): 125.
- Rajaratnam J. K., Marcus J. R., Flaxman A. D. et al. Neonatal, postneonatal, childhood and under-5 mortality for 187 countries, 1970–2010. A systematic analysis of progress towards Millennium Development Goal 4 // Lancet. 2008; 375.
- Самсыгина Г. А. О предрасполагающих факторах и факторов риска развития неонатального сепсиса и о современных подходах его лечения // Педиатрия. 2012; 91 (3): 32–37.
- Black R. E., Cousens S., Johnson H. L. et al. Child health epidemiology reference group of WHO and UNICEF. Global, regional and national causes of child mortality in 2008: A systematic analysis // Lancet. 2010; 375 (9730): 1969–1987.
- Перепелица С. А. Этиологические и патогенетические факторы развития внутриутробных инфекций у новорожденных (обзор) // Общая реаниматология. 2018; 14 (3): 54–67.
- Wynn J. L. Defining neonatal sepsis // Curr. Opin. Pediatr. 2016; 28 (2): 135–140.
- Zaidi A. K., Ganatra H. A., Syed S. at al. Effect of cause managements of neonatal mortality due to sepsis and pneumonia // BMC Public Health. 2011; 11 (Supl 3).
- Lawn J. E., Blencowe H., Oza S. et al. Every newborn: progress, priorities, and potential beyond survival // Lancet. 2014; 384 (9938): 189–205.
- Тирская Ю. И., Белкова Т. Н., Рудакова Е. Б. и др. Врачебная тактика при внутриутробных инфекциях // Акушерство и гинекология. 2011; 8: 42–47.
- Madan I., Romero R., Kusanovic J. P. et al. The frequency and clinical significance of intra-amniotic infection and/or inflammation in women with placenta previa and vaginal bleeding: an unexpected observation // J. Perinat. Med. 2010; 38 (3): 275–279.
- Володин Н. Н. (ред.). Неонатология. Национальное руководство. М.: ГЭОТАР-Медиа, 2008. 749 с.
- Bone R. C. Тoward an Epidemiology and Natural History of SIRS // JAMA. 1992; 268 (24): 3452–3455.
- Bone R. С. Toward a theory regarding the pathogenesis of the systemic inflammatory response syndrome: what we do and do not know about cytokine regulation // Crit. Care Med. 1996; 24 (1): 163–172.
- Angus D. C., van der Poll T. Severe sepsis and septic shock // N. Engl. J. Med. 2013; 369 (9): 840–851.
- Руднов В. А., Кулабухов В. В. Сепсис-3: обновленные ключевые положения, потенциальные проблемы и дальнейшие практические шаги // Вестник анестезиологии и реаниматологии. 2016; 13 (4): 4–11.
- Singer M., Deuschman C. S., Seymour C. W. et al. The Third International Consensus definitions for Sepsis and Septic Shock (Sepsis-3) // JAMA. 2016; 315 (8): 801–810.
- Лекманов А. У., Миронов П. И., Руднов В. А. и др. Современные дефиниции и принципы терапии сепсиса у детей // Вестник анестезиологии и реаниматологии. 2018; 15 (4): 61–69.
- Matics T. J., Sanchez-Pinto L. N. Adaptation and validation of a pediatrics sequential organ failure assessment score and evaluation of the Sepsis-3 definitions in critically ill children // JAMA Pediatr. 2017; 171 (10): pp.e172352.
- Кирилочев О. К., Кибирова А. И., Каширская Е. И. Современное состояние проблемы цитомегаловирусной инфекции у новорожденных // Астраханский медицинский журнал. 2015; 10 (2): 6–17.
- Khwaja O., Volpe J. J. Pathogenesis of cerebral white matter injury of prematurity // Arch. Dis. Child Fetal. Neonatal. Ed. 2008; 93 (2): 153–161.
- Kubota Т., Okumura A., Hayakawa F. et al. Relation between the data of cyst formation observable on ultrasonography and the timing of injury determined by serial electroencephalography in preterm infants with periventricular leucomalacia // Brain and Development. 2001; 23 (6): 390–394.
- Kohelet D., Shochat R., Luskya A. et al. Risk factors for seizures in very low birthweight infants with periventricular leukomalacia // Journal of child neurology. 2006. 21 (11): 965–970.
- Овсянников Д. Ю. Система оказания медицинской помощи детям, страдающим бронхолегочной дисплазией. Руководство для практикующих врачей / Под ред. проф. Л. Г. Кузьменко. М.: МДВ, 2010. 152 с.
- Volpe J. J. Neurology of the newborn. Philadelphia: WB. Sounders, 2008. 1094 p.
- Neu I., Walker W. A. Necrotizing enterocolitis // N. Engl. J. Med. 2011; 364 (3): 255–264.
О. К. Кирилочев*, 1, доктор медицинских наук, профессор
И. З. Китиашвили*, доктор медицинских наук, профессор
З. Г. Тарасова**, кандидат медицинских наук
* ФГБОУ ВО АсГМУ МЗ РФ, Астрахань
** ГБУЗ АО ОДКБ им. Н. Н. Силищевой, Астрахань
1 Контактная информация: [email protected]
DOI: 10.26295/OS.2019.51.48.010
Перинатальные заболевания как ведущая причина летальных исходов у детей/ О. К. Кирилочев, И. З. Китиашвили, З. Г. Тарасова
Для цитирования: Лечащий врач № 9/2019; Номера страниц в выпуске: 46-51
Теги: врожденные инфекции, летальный исход, внутриутробная гипоксия
Сепсис у новорожденных: факторы риска
Само слово «сепсис» произошло от греческого «sepsis», что может переводиться как «гниение» или «заражение крови». Сепсис — это воспалительная реакция организма на бактериальную, вирусную или грибковую инфекции. Возбудителями заболевания могу быть различные патогенные и условно-патогенные микроорганизмы: стафилококк, стрептококк, пневмококк, сальмонелла, синегнойная палочка и ряд других опасных для человека микроорганизмов.
Как и почему
Факторы риска развития сепсиса у новорожденных могут быть как со стороны матери, так и со стороны плода, могут возникнуть во время беременности, родов или после них.
Вот перечень основных неблагоприятных факторов:
- Многочисленные аборты, которые предшествовали этой беременности. Такие «чистки» сопровождаются повреждениями тканей матки, что может послужить входными дверьми для всевозможных инфекций;
- Длительный и болезненный токсикоз на протяжении более месяца;
- Болезни и скрытые инфекции во время беременности: цистит, пиелонефрит, болезни желудочно-кишечного тракта. Именно поэтому так важно подойти к планированию беременности со всей осторожностью и скрупулезностью. Как минимум, стоит сдать анализы на инфекции, передающиеся половым путем, произвести оценку гормонального фона организма;
- Кольпиты любые, но чаще вызванные стрептококком;
- Подтекание, раннее излитие околоплодных вод, зеленые воды, длительный безводный промежуток времени — более 12 часов;
- Высок риск развития сепсиса у недоношенных детей или младенцев с низкой массой тела (особенно меньше 1,500 кг). Именно поэтому таких новорожденных держат под специальным «колпаком» до достижения ими удовлетворительного состояния;
- Наличие патологий у ребенка;
- Осложнения в родах, которые привели к асфиксии новорожденного, потребовавшие экстренных мер от медицинских работников и последующего отлучения ребенка от груди на длительное время;
- Нарушение целостности кожных покровов новорожденного;
- Пороки развития;
- Инфекционные заболевания матери на последнем месяце беременности, антибактериальная терапия;
- Повышения температуры тела у матери во время родов или сразу после них;
- Многоплодная беременность.
«Ворота» для инфекции
«Входными воротами» для инфекции в организм малыша могут служить: слизистые оболочки, среднее ухо, легкие, пупочная ранка, места интубаций, инъекций, кровоподтеки и микротравмы.
По статистике, мальчики чаще подвергаются этому заболеванию, нежели девочки.
Если ребенок получает грудное молоко, то его сопротивление сепсису в разы сильнее, так как оно содержит в себе антитела, способные бороться с микробами.
Неонатальный сепсис — Ветеринарная клиника «Колибри»
Сепсис — это тяжелая форма воспалительной реакции в всем организме. Даже для взрослых людей и животных такое состояние крайне опасно и имеет высокий процент смертности. У новорожденных из-за особенностей организма и несовершенства собственной иммунной системы сепсис часто заканчивается гибелью.
В большинстве случаев сепсис развивается как следствие бактериальной инфекции (самостоятельной при наличии очага или присоединяющейся вторично на фоне другой болезни или процесса).
Наиболее частые причины развития неонатального сепсиса у щенков и котят:
- Гипоксия в процессе родов в разы увеличивает риск развития неонатального сепсиса в первую неделю жизни. При затяжных родах у новорожденного может развиться гипоксия — кислородное голодание из-за длительного нахождения в родовых путях или матке, когда материнский кровоток и плацента уже перестают обеспечивать малыша достаточным количеством кислорода. Такие новорожденные требуют особого контроля — привес, температура, дыхание и т.д.
- Гипотермия — переохлаждение. Тяжелая гипотермия, температура тела ниже 34 градусов, может привести к остановке перистальтики кишечника. При атонии бактерии очень быстро проникают через стенку кишечника в брюшную полость, могут вызывают перитонит и, как следствие, сепсис.
- Диарея — у малышей при тяжелом воспалении кишечника часто развивается перитонит.
- Аспирационная пневмония.
- Пуповинная инфекция. Важно помнить, что наружный пуповинный канатик продолжается внутрь брюшной полости сосудами и связками и контактирует с мочевым пузырем, кишечником, печенью. Это идеальный путь для молниеносного распространения инфекции. Для обработки и перевязывания пуповины используйте стерильные нитки, антисептики, следите за пупком у малышей в первые дни жизни.
- Повреждения кожи. Травмы, проведение операций по купированию хвостов, ушей в антисанитарных условиях, даже подкожное введение жидкости может стать причиной сепсиса.
- Проблемы матери: мастит, метрит, желудочно-кишечные расстройства, вылизывание послеродовых выделений щенками /котятами, наличие зубного камня (инфекции в полости рта может стать причиной не только сепсиса, но и офтальмии новорожденных — гнойное воспаление под неоткрывшимися веками) и т.д. Про болезни неонатов можно посмотреть тут.
- Контаминация при контакте с человеком. Хозяин может быть носителем бактериальной инфекции, опасной для новорожденных (например, при хронических заболеваниях полости носоглотки), поэтому все общение с малышами до возраста 2-3 недель лучше проводить в одноразовых медицинских перчатках.
Симптомы сепсиса у новорожденных неспецифичны:
- постепенное снижение или внезапное отсутствие сосательного рефлекса, снижение привеса, отвес;
- длительный плач, беспокойство, судороги;
- слабость, вялость;
- неспособность держать температуру тела, переохлаждение;
- желудочно-кишечные расстройства — диарея;
- одышка;
- поражение периферических участков кожи — некрозы кончиков ушей, хвоста, пальчиков, отеки подкожной клетчатки;
- бессимптомное молниеносное течение приводит к внезапной гибели, симптомы заметить почти невозможно.
Прижизненная диагностика сепсиса у новорожденных щенков и котят часто затруднена. Симптомы не специфичны и могут имитировать другие болезни. Картина крови тоже не показательна. Быстрое течение порой не дает возможность провести адекватную диагностику. Поэтому у новорожденных, погибших с признаками сепсиса, крайне важно проводить патологоанатомическое вскрытие с отбором тканей на гистологическое, вирусологическое и микробиологическое исследование. Понимание причины развития сепсиса у одного малыша может спасти остальной помет/пометы в питомнике.
К сожалению, сепсис не имеет специфического лечения. У новорожденных он протекает очень тяжело и непредсказуемо. Лечение осложняется и тем, что не все препараты и антибиотики допустимо использовать в неонатальном возрасте. А каскад патологических процессов, который запускается при сепсисе, требует непрерывного контроля пациента и частой смены тактики терапии. Терапия направлена на стабилизацию работы всех систем организма и борьбу с инфекцией. Пациент с сепсисом — это пациент, который нуждается в стационарном лечении.
Несмотря на всю тяжесть заболевания, шанс спасти малыша есть. И в неонатальном стационаре мы делаем все возможное, чтобы этот шанс реализовать.
Особенности иммунитета у новорожденных детей с локализованными и генерализованными формами бактериальных инфекций | Хаертынов
1. Lawn J.E., Cousens S., Zupan J.T. Lancet Neonatal Survival Steering. 4 million neonatal deaths: when? Where? Why? Lancet 2005; 365: 9462: 891-900.
2. Атауллаханов Р.И., Гшщбург А.Л. Иммунитет и инфекция: динамичное противостояние живых систем. Педиатрия 2005; 4: 47—61. (Ataullahanov R.I., Gincburg A.L. Immunity and dynamic confrontation of living systems. Pediatriya2005; 4: 47-61.)
3. Самсыгина Г.А. О предрасполагающих факторах и факторах риска развития неонатального сепсиса и о современных подходах его лечения. Педиатрия 2012; 91: 3: 32—37. (Samsygina G.A. About predisposing factors and risk factors for neonatal sepsis and modern approaches its treatment. Pe-diatriya2012; 91: 3:32-37.)
4. Melville J.M., Moss L.J.M. The immune consequences of preterm birth. Front Neurosci 2013; 7: doi: 10.3389/ fnins.2013.00079
5. ХаертыновХ.С., БойчукС.В., АнохинВ.А. идр. Показатели активности апоптоза лимфоцитов крови у детей с неонатальным сепсисом. Гены и клетки 2014; 9: 3: 267—271. (Khaertynov H.S., Boichuk S.V., Anohin VA. et al. Activity rates of apoptosis of lymphocytes in children with neonatal sepsis. Geny ikletki2014; 9: 3: 267-271.)
6. Correa-Rocha R., Perez A., Lorente R. et al. Preterm neonates show marked leucopenia and lymphopenia that are associated with increased regulatory T-cell values and diminished IL-7. PediatRes 2012; 71: 5: 590-597.
7. Hotchkiss R.S., Monneret G., Payen D. Sepsis-induced immu-nosuppression: from cellular dysfunctions to immunotherapy. Immunology 2013; 13: 862-874.
8. Romani L. Immunity to fungal infections. Nature Rev Immunol 2011; 11:275-288.
9. Souza-Lonseca-Guimaraes E, Parlato M., Lifting С et al. NK cell tolerance to TLR agonists mediated by regulatory T cells after polymicrobial sepsis. J Immunol 2012; 188: 5850-5858.
10. Самсыгина L.A. Неонатальный сепсис. М: Союз педиатров России 2014; 173. (Samsygina GA. Neonatal sepsis. Moscow: SoyuzpediatrovRossii2014; 173.)
11. van den Berg J. P., WesterbeekE.A.M., van derKlisL.R.M. etal. Transplacental transport of IgG antibodies to preterm infants:
12. a review of the literature. Early Hum 2011; 87: 67—72.
13. Drifte G., Dunn-Siegrist L., Lissieres P. et al. Innate immune functions of immature neutrophils in patients with sepsis and severe systemic inflammatory response syndrome. Crit Care Med2013; 41: 820-832.
14. Boomer J.S., Lo K., Chang K.C. Immunosuppression in Patients Who Die of Sepsis and Multiple Organ Failure. JAMA 2011; 306: 23: 2594-2605.
15. Hotchkiss R.S., Linsley K.W., Swanson P.E. et al. Sepsis-induced apoptosis causes progressive profound depletion of В and CD4+ T lymphocytes in humans. J Immunol 2001; 166: 6952-6963.
16. Hotchkiss R.S., Linsley K.W., Swanson P.E. etal. Depletion of dendritic cells, but not macrophages, in patients with sepsis. J Immunol 2002; 168: 2493-2500.
17. Huang L.E, Yao Y.M., Dong N. et al. Association between regulatory T cell activity and sepsis and outcome of severely burned patients: a prospective, observational study. Crit Care 2010; 14: R3.
18. Venet E, Pachot A., Debard A.L. et al. Human CD4+CD25+ regulatory T lymphocytes inhibit lipopolysaccharide-induced monocyte survival through a Fas/Fas ligand-dependent mechanism. J Immunol 2006; 177: 6540-6547.
19. EelmetKA., Hall M.W., Clark R.S. etal. Prolonged lymphopenia, lymphoid depletion, and hypoprolactinemia in children with nosocomial sepsis and multiple organ failure. J Immunol 2005; 174: 3765-3772.
20. Hotchkiss R.S., Swanson P.E., Freeman B.D. et al. Apoptotic cell death in patients with sepsis, shock, and multiple organ dysfunction. Crit Care Med 1999; 27: 1230-1251.
21. Loti P., Be Felice C, Occhini R. et al. Spleen depletion in neonatal sepsis and chorioamnionitis. Am J Clin Pathol 2004; 122: 765-771.
22. Hotchkiss R.S., SchmiegR.L., Swanson P.E. etal. Rapid onset of intestinal epithelial and lymphocyte apoptotic cell death in patients with trauma and shock. Crit Care Med 2000; 28: 3207-3217.
23. Kasten K.R., Lschop J., Adediran S.G. et al. T cells are potent early mediators of the host response to sepsis. Shock 2010; 34: 4: 327-336.
«Мы умерли от сепсиса». Как матери погибших новорожденных добиваются наказания для персонала роддомов
В конце 2016 года москвичка Олеся Сафонова с мужем приехала на праздники к свекрови в Брянск. Она была на четвертом месяце беременности, ждала девочек-двойняшек. Местные медики с учетом состояния Олеси посоветовали ей не отправляться в дальнюю дорогу и оставаться рожать в городе. Роды прошли в Брянском перинатальном центре 8 апреля 2017 года — через месяц после того, как учреждение открыл президент Владимир Путин. Спустя две недели одна из девочек умерла от пневмонии. Затем Сафонова узнала о гибели еще как минимум десяти новорожденных в том же Центре и разыскала 16 женщин, которые считают брянских медиков виновными в болезни или смерти своего ребенка. Следственный комитет возбудил уголовное дело о халатности.
«Четыре месяца беременности у меня было, на новогодние каникулы с мужем приехали в Брянск к свекрови. У меня заболел живот. Меня положили в первую больницу на сохранение. Я пролежала недели две-три на сохранении, и они решили меня зашивать, потому что шейка матки укоротилась. Новый год я справляла в больнице. В конце января мне поставили кольцо, разгружающий пессарий. Сказали, что двойня, тяжело очень, надо подстраховаться.
Потом я легла уже в перинатальный центр на сохранение, уже перед родами готовились. Собиралась рожать я в областном роддоме, уже договорилась. Муж меня повез в областной роддом, они сказали: «У нас приказ: до 34 недель всех, кто рожает, мы отправляем в перинатальный центр». Перинатальный должны были заполнить. И мы на своей машине с мужем поехали в перинатальный центр.
8-9 мая у меня должны были быть роды. А родила я на целый месяц раньше. В 33 недели и четыре дня. Девочки — два килограмма и два сто. 8 апреля, это была суббота.
Пошли воды, дежурила молоденькая девочка. Она меня посмотрела на кресле, сделала тесты. Сказала: «Да, воды, но ждем до понедельника, сохраняем, потому что надо чтобы кесарево было планово». Я позвонила своему врачу, у которого платно состояла, и она мне сказала: «Скорей беги на пост, они не имеют права». Как она мне объяснила, ребенок через шесть часов без вод умрет. Я побежала на пост, мне попались там взрослые женщины, сразу пришел заведующий отделением, самого [депутата облдумы и главрача городской больницы №1 Константина] Воронцова сын кесарил меня. Посмотрел, а у меня уже начинались схватки. Сделали анестезию эпидуральную, наркоз в спину. И они меня режут, а я все чувствую, плачу. А руки, ноги привязаны. Они первую девочку достали, Дашу, мне показали. А мне больно. Они: «Что ты притворяешься? Не может быть, пошевели ногой. Ты ничего не чувствуешь до пояса». А я беру и пальцами шевелю, представляете. И у меня такое ощущение было, как будто у меня по животу совковой лопатой по косточкам гребут, ужасная просто боль.
Я стала задыхаться, перепугалась очень. И анестезиолог Геннадий Рухля попался очень опытный, хороший. Стоял надо мной, брал мне маску с воздухом, не отходил ни на минуту. А я не могу, я и ртом хватаю воздух, и носом, у меня нет воздуха. Я слышу, что артерию какую-то передавили. Когда вторую девочку достали, у меня чуть-чуть воздух пошел.
После этого две недели я в палате лежала. Девочки первые два дня были в реанимации. Потом Дашу перевели уже на выздоровление, сказали, выпишут скоро, через неделю. А Ксюша, которая сейчас девочка живая, оставалась [в реанимации]. У нее была масочка на носике, она не могла раздышаться сама. Они больше напор делали, что выживет Даша, а не Ксюша. А получилось наоборот все.
8 апреля я родила, 21-го Даша умерла. У меня был нервный срыв. Я стала заикаться, у меня все болячки вылезли, я заболела. За Ксюшей я уже как коршун, я уже не отходила от нее ни на минуту. Я даже кушать не отходила, мне муж все приносил.
У Даши открыли окно и через несколько дней пневмония. Если хорошая такая вентиляция, они хвастаются, почему везде открыты окна всегда были? Мне сказали: не придумывайте, это специальные кувезы, даже если они открыты, они поддерживают температуру матки. Я подошла к своей Даше с мужем — она девочка-лед. Я устроила скандал.
Второй раз прихожу, опять эта смена — Даша лежит на животе, а у нее пупок еще не зажил и она лежит, уперлась носиком и орет. А я ее перевернуть не могу, потому что у нее датчики, чтобы пульс, сердце отслеживать на аппаратах. Мне сказали, это приказ заведующей — три часа на животе, три часа на спине. Я пошла к заведующей, устроила скандал. Я понимаю, ребенка выкладывать на 10-15 минут на живот, когда пуповина зажила. Ей две недели от роду. У нее в пуповине была трубочка, глюкоза туда поступала.
Они вообще сразу не нашли, что это пневмония. Сперва они сказали, что это колит кишечника. Я прихожу к девочке, а у нее зонд был во рту, с этого зонда кровь. И они только через несколько дней поняли, что это пневмония. Эта же узистка у моей Ксюши не нашла желчный пузырь. Она делала УЗИ, девочка поела только, говорит: «Я не увидела желчного пузыря, у вас наверное нет желчного пузыря». Вы представляете, так сказать?
Окно открывала Горбачева Луиза Ивановна. Антибиотики неправильно колола и диагнозы неправильно ставила — Артемьева Людмила Валерьевна. Уголовное дело заведено, а они работают дальше.
В перинатальном ребенку занесли также [грибковую инфекцию], у нее чуть ли не пошел сепсис. Она перестала писаться, у нее органы все стали отказывать, и мы умерли от сепсиса, от заражения.
В самом центре я находилась до 8 апреля три недели и выписали меня со второй девочкой 5 мая. Я такого ужасного отношения нигде не видела. Они даже не подходят к тебе. На кнопку нажимаешь, а они: «Что ты на кнопку нажимаешь, что тебе тут?». Я просила молокоотсосы, и много девочек просили, а их запрещают давать. Первые роды, у меня грудь как камень стала. Пока я не разревелась, не сказала «что мне делать», [не давали]. Для чего их закупили? Для чего президент выделял деньги?
11 июня «Брянская газета» написала о временном закрытии перинатального центра. Один из источников издания рассказал, что, вероятно, новорожденные в центре заражаются внутрибольничной инфекцией.
«Официально в приказе говорится, что его закрыли на профмойку — на чистку вентиляции. Истинную причину от нас, разумеется, скрывают», — подтвердил второй собеседник газеты. Еще один источник рассказывал об экстренном совещании у замгубернатора Николая Щеглова, на котором обсуждалась смертность в центре.
В тот же день ситуацию прокомментировал главврач перинатального центра Александр Кулаченко. Он настаивал на официальной версии: учреждение закрыли из-за «регламентных работ» для проверки оборудования. Главврач заверил, что все скончавшиеся за три месяца младенцы имели экстремально низкую массу тела, те или иные заболевания либо сниженный иммунитет.
«Это неправда. Меня нашли 16 девочек. Самый маленький вес — 1 200, а максимальный — 4 100. Это что дети с экстремальной массой тела?» — говорит Олеся Сафонова. Экстремально низкой массой новорожденного признается вес менее 1 000 грамм. 4 июля центр в Брянске возобновил работу.
На меня вышла анонимно девочка, сотрудница перинатального центра. Она говорит, что набирали всех молоденьких девочек, им по 21 году, все с областей, все неопытные. Оборудование немецкое. И на это оборудование документы все на нерусском языке. Как они могут им пользоваться? Говорит, приехал какой-то мужчина из Москвы, сутки побыл, отстажировал нас и все. Получается, на этом оборудовании не умеют работать.
Тут в Брянске каждый друг другу брат, сват, кум. Они стали меня унижать, что я подняла такую шумиху. Все бы молчали, а тут москвичка приехала, как они говорили, и на уши всех подняла. Они не хотят никак за это ответить. Я собираюсь дальше бороться. Это моя дочь. Да, я ее не верну. Но это моя дочь. Она два часа у меня на руках умирала, за что ребенка так мучили? Я записала видеообращение. Я создала группу: «Перинатальный центр — убийца детей», и меня сами стали находить девочки, стали звонить. Над каждой историей я ревела. Я нашла 16 девочек. И у всех идет пневмония, золотистый стафилококк и грибы кандида.
Меня допросили и девочек. Очных ставок не было. Подписала документы на медицинскую экспертизу. У меня своя, у них будет своя. Но это все опять через Брянск, экспертизу будут делать те же врачи, которые между собой братья-сестры. Что там будет?».
В августе 2014 года жительница Усолья-Сибирского Анна Березовская на 25 неделе беременности родила четвертого ребенка — девочку. Не дождавшись консультации в Иркутске, она оказалась в усольском роддоме. Местные врачи, утверждает Анна, спровоцировали преждевременные роды и открыто говорили, что ей стоит смириться с потерей ребенка и не «мучить нас и себя». После рождения девочка прожила еще 20 дней. Три года Березовская добивается уголовной ответственности для усольских врачей. Дело о халатности возбуждали и прекращали семь раз. По словам Анны, она — не первая роженица, чей ребенок погиб в усольском роддоме. Весной 2017 года Березовская собрала митинг, на который пришли около 20 человек. Другие пострадавшие не готовы открыто говорить о пережитом.
«У меня открытие пошло шейки матки, мне установили акушерский пессарий, чтобы предотвратить преждевременные роды. Поставили. При ношении акушерского пессария допускается небольшие кровотечения, так у большинства мамочек. У меня кровить начало. 14 августа меня отвезли в роддом на скорой, назначили лечение и потом опять начало кровить, незначительно. На что мне [акушер-гинеколог Людмила] Линкевич и [дежурный врач отделения патологии беременных Светлана] Сорокопуд вытащили это кольцо, сказали: «Зачем тебе четвертый, отдай ребеночка богу, хватит мучить нас и себя». Они сказали: «У тебя будет поздний выкидыш».
На следующий день у меня начались схватки, через несколько часов я родила девочку. 730 грамм. Ребенок 20 дней прожил и умер. Ребенок пережил две транспортировки. 18 августа я родила, 20-го ее перевезли в Ангарск в перинатальный центр. И через две недели ее перевели уже в Иркутск. У нас в Усолье оснащения не было даже [для] интенсивной терапии, для детей недоношенных. У них нет ни второго этапа выхаживания детей, ни неонатолога на тот момент, он не присутствовал при родах. Но они сделали документы, что он у них якобы был.
Шансы были бы, если она родилась в Иркутске. Я не доехала до туда. Не успела. У меня запись была на 18 августа — на консультацию. В Иркутске без записи не принимают.
У нее была двухсторонняя пневмония. В Иркутске проводят такие операции таким детям, делают на третий-четвертый день, и они выживают. В моем случае ребенку [операцию] хотели сделать только на 21-й день, когда уже были серьезные осложнения по здоровью. В Ангарск приезжал кардиохирург, консультировал, но операцию в условиях ангарского стационара он провести не мог. Потому что не было оборудования. В Иркутск ее перевели за два дня до смерти. 7 сентября будет три года, как ребенок умер. Мне говорили, что девочка сильная, боролась до последнего. Но слишком поздно.
Я считаю, что вина здесь наших усольских, им было просто все равно, они надеялись на то, что ребенок уже родится мертвый либо умрет в течение суток и будет считаться мертворожденный. Не имели права принимать роды в Усолье у меня, срок был 25 недель. По какой причине приняли, неизвестно. Почему в Иркутск не перевели, тоже неизвестно. То есть нарушения есть, но все — Следственный комитет, прокуратура — на это закрывают глаза.
В Усольском роддоме все зависит, как я считаю, от смены. Я же там тоже рожала — троих детей первых. Первую, конечно, проблемную девочку родила. Ребенок — инвалид. Двоих — девочку и сына — родила без проблем. А в этот раз получилось так: роды прошли очень рано. Еще бы две-три недели я бы доносила ее, ребеночек бы сто процентов выжил. А здесь родила с экстремально низкой массой тела — 730 грамм.
Когда на митинг собирала, очень много людей писало в «Одноклассники». И фигурируют одни и те же врачи. Прошлым летом девушка пишет, что у нее умер уже доношенный ребенок — у ребенка было двойное обвитие, ребенка выдавливали, ребенок родился мертвый, умер в утробе. Еще у одной девушки осенью прошлого года роды принимали, тоже выдавливали, Патхудинов (был лечащим врачом Березовской — МЗ) ей на живот лег: ребенок родился с травмами, он проходил лечение, но выжил.
Случаев очень много, но люди начали забывать, кто-то успокоился и не хочет воевать с ними. Потому что видят наглядный пример.
В Минздраве Иркутской области «Медиазоне» сообщили, что в 2013 году в усольском роддоме шесть новорожденных умерли «от внутриутробных инфекций и врожденных пороков развития», а в 2015 и 2017 годах зарегистрировано по одному случаю смерти новорожденных. В 2012, 2014 и 2016 году в роддоме таких случаев не было.
На форуме «Мамапедия» несложно найти возмущенные отзывы о работе врачей усольского роддома.
Елена: «Ужасные впечатления остались после родов в январе 2016 г. в этом роддоме. Халатность Линкевич Л.Ф. и медсестер ужасает. Ребеночек застрял. Капельки не помогла. Его выдавливали из меня. Ругая и крича, что я сейчас убью своего ребенка, если не буду правильно тужиться. А вот на мой неоднократный вопрос как правильно тужиться, никто толком не ответил «как-как, тужься и все». В итоге у ребёночка смещение швейных позвонков, у меня надорванное горло из-за того, что не так тужилась».
Дмитрий: «Рожала моя жена, кормят хорошо но роды приняли ужасно! Промучилась сутки родила с разрывами как она мне рассказывала когда у нее кровь лилась ручьем ей зачем-то давили на живот не знаю зачем, после чего её зашили и начали чистить мало того что после того как зашили так ещё и без всякого наркоза. ну все вроде бы ничего выписали приехали домой под вечер температура 39 Теперь лежит под капельницами как сказал врач в гинекологии занесли инфекцию. Больше детей планировать я так думаю не будем».
Сорокопуд перевели в гинекологи штатные в поликлинику, [дежурного врача] Ильина уволили — сейчас опять приняли на работу, Патхудинова уволили — опять приняли на работу. То есть врачи к ним не идут, они этих, которые халтурят, опять берут на работу. То есть ничего не меняется.
Полгода я бегала по всем инстанциям — они мне отказывали, отказывали. Пока я не дозвонилась до Москвы, написала им письмо. Они возбудили дело 30 ноября 2015 года. Потом месяц-два проходят, они его закрывают. Они семь раз закрывали уголовное дело. «Нет состава преступления». Город Усолье-Сибирское — это маленький городок. Среди следователей есть друзья, родственники этих врачей. Я не могу объяснить это по-другому.
Проводились и очные ставки. Мои показания все подтверждают, даже врачи. Это хамство, что они на очных ставках вытворяли. Все они говорят, что сами виноваты. У Линкевич и Патхудинова на очных ставках одна фраза: «Че вы к нам претесь-то все, езжайте в Иркутск, Ангарск — рожайте там»».
Предотвратить сепсис у недоношенных младенцев может помочь грудное молоко
Вашингтон, 17 мар 2020 — LIVE24. Исследователи из Медицинского факультета Вашингтонского университета в Сент-Луисе и клинике Майо обнаружили, что молекула, которую называют эпидермальным фактором роста, в грудном молоке способна активизировать рецепторы на клетках кишечника, тем самым предотвратить распространение кишечных бактерий. Такие микробы могут вызвать у новорожденного ребенка сепсис, сообщает med-heal.ru.Ученые также выяснили, что грудное молоко с наиболее высоким уровнем эпидермального фактора роста, особенно с первых дней лактации после рождения ребенка, наиболее эффективно предотвращает проникновение опасных бактерий в кровоток.
«Поздний сепсис представляет собой серьезную проблему у недоношенных детей. Эти исследования дают лучшее понимание принципа развития сепсиса, а также определения лучшего инструмента для борьбы с данным заболеванием», — поделился доктор медицинских наук Вашингтонского университета Родни Д. Ньюберри.
В исследовании за основу брался сепсис с поздним началом, который, как правило, отмечается через 72 часа и спустя 60 дней после рождения ребенка. Именно на него приходится около 26% смертей среди недоношенных детей. Примерно 10% новорожденных, которые были рождены недоношенными и имеют поздний сепсис, а также от 30% до 50% тех, у кого только развивается инфекция, умирают. Большая доля усилий, направленных на предотвращение позднего сепсиса, имеет прямую зависимость от улучшения асептических методов. Среди них стоит назвать обеспечение того, чтобы на коже ребенка отсутствовали бактерии, а также чтобы внутривенные линии и другие спасательные трубки не имели потенциально опасной для ребенка инфекции.
Как отметил Ньюберри, изначально идея заключалась в том, что дети стали септическими от внутривенных инъекций и что бактерии попали внутрь организма через повреждения кожи. В процессе исследования ученый совместно с доктором философии Кэтрин А. Кнуп задавались вопросом, какую роль играют кишечные бактерии при сепсисе, развивающемся у новорожденных, особенно в том случае, когда подобные микробы перемещаются в кровотоке.
В результате оказалось, что виновниками распространения инфекции являются кишечные клетки, которые также называют кубковыми клетками. Данные клетки выделяют слизь, чтобы помочь предотвратить заражение, однако они также выделяют бактерии через незрелую кишечную оболочку премии. Именно из-за данных процессов бактерии способны попасть в кровоток.
В процессе исследования ученые давали новорожденным мышатам специальный раствор, который содержит бактерии Escherichia coli, которые были выделены из кровотока ребнка с поздним сепсисом. После этого малышей кормила либо их мать, либо другая мышь, которая родила раньше. В итоге выяснилось, что у последней в молоке содержится меньше эпидермального фактора роста.
В результате инфекция крови произошла у тех мышат, которых кормила мать в течение более длительных периодов времени, следовательно, у их кормилицы был более низкий уровень эпидермального фактора в молоке.
Доктор медицинских наук подытожил, что эпидермальный фактор роста можно добавлять в донорское грудное молоко, либо же смесь, в которой он содержится в меньших количествах. Если сравнивать с антибиотиками данный метод, то стоит сказать, что первые убивают все бактерии, а молоко с достаточной концентрацией эпидермального фактора роста нацелено именно на данную инфекцию.
Новорожденного ждали кишечная палочка, сепсис, а затем коронавирус. Он все равно выжил
Автор фото, Sheree Murray
Подпись к фото,Арчи родился недоношенным
Родившийся в Англии недоношенный ребенок справился с кишечной палочкой, переболел сепсисом и в довершение заразился коронавирусом, но и от него тоже вылечился. Родители называют его своим маленьким бойцом.
Его мать Шири Мюррей родила Арчи 1 декабря 2020 года на 25-й неделе беременности. Он весил всего 765 г. В пять недель у него появилась кишечная палочка, после чего у ребенка развился сепсис, а спустя несколько недель врачи сообщили его родителям, что у мальчика был выявлен Covid-19.
Его пришлось изолировать на 10 дней, и для матери это показалось вечностью.
После рождения Арчи не мог самостоятельно дышать, и, как рассказала Мюррей, они с отцом мальчика Робертом очень переживали, пока врачи минут 40 боролись за его жизнь.
Родители четыре дня не могли потрогать своего ребенка, но, по словам Мюррей, когда ей наконец разрешили взять его руку в свою, это стало самым волшебным моментом в ее жизни.
Теперь каждый день 21-летняя девушка проводит с сыном в больнице в городе Бернли.
Автор фото, Sheree Murray
Подпись к фото,Родители не могут посещать Арчи вместе из-за пандемии
Она сказала, что новость о положительном тесте сына на Covid-19 сильно ее шокировала, потому что вирус убивает и здоровых людей, а ее ребенок и без того был ослаблен болезнями.
«Я была до смерти испугана», — сказала она.
По словам девушки, когда ей разрешили взять Арчи на руки после 10 дней изоляции, она почувствовала, что снова может дышать.
«Я была на седьмом небе от счастья!» — поделилась она.
Автор фото, Sheree Murray
Подпись к фото,Когда маме наконец разрешили взять руку Арчи в свою, это стало самым волшебным моментом в ее жизни
Сейчас Арчи весит 1,36 кг и чувствует себя лучше, чем когда-либо. Родители могут навещать его, но из-за пандемии вынуждены это делать по отдельности.
Его полное имя — Арчи Терри Марсель Эвард. Терри его назвали в честь умершего дедушки, а Марселем из-за значения имени (маленький воин).
«Мне кажется, я бы могла взорваться от счастья — так сильно я им горжусь. Не описать словами, как я хочу поскорее забрать его домой», — рассказала Мюррей.
детей | Сепсис Альянс
Сепсис может поразить кого угодно и когда угодно, но чаще он поражает людей, находящихся в самых трудных жизненных ситуациях, как очень старых, так и очень молодых. В результате дети, особенно недоношенные и младенцы, могут быть более восприимчивыми к развитию сепсиса. Сепсис, который иногда неправильно называют заражением крови, является смертельной реакцией организма на инфекцию. Сепсис убивает и выводит из строя миллионы и требует раннего подозрения и быстрого лечения для выживания.
Сепсис и септический шок могут быть результатом инфекции в любом месте тела, например пневмонии, гриппа или инфекций мочевыводящих путей. Во всем мире одна треть людей, у которых развивается сепсис, умирает. Многие из тех, кто выживает, остаются с последствиями, меняющими жизнь, такими как посттравматическое стрессовое расстройство (ПТСР), хроническая боль и усталость, дисфункция органов (органы не работают должным образом) и / или ампутации.
Тысячи детей во всем мире пострадали
В США более 75 000 детей ежегодно заболевают тяжелым сепсисом.Это составляет около 200 человек в день, и это число ежегодно увеличивается на 8%. Почти 7000 из этих детей умирают — это больше, чем те, кто умирает от детских онкологических заболеваний. Сепсис в развивающихся странах еще более серьезен, вызывая гораздо больше смертей.
Многие дети, пережившие сепсис, остаются с долгосрочными проблемами. Более чем у 1 из 3 выживших детей (34%) наблюдаются изменения когнитивных навыков еще через 28 дней после выписки из больницы. Почти половина из них возвращается в больницу хотя бы один раз после переживания сепсиса.
В развивающихся странах намного больше детей заболевает сепсисом и намного больше детей умирают. Сепсис может возникнуть в результате инфекций, которые возникают в результате антисанитарных условий при рождении, материнских инфекций, передаваемых новорожденным, или предотвратимых инфекций, которые могут быть более распространены в странах с ограниченными вакцинациями и медицинским обслуживанием.
Как и взрослый, у ребенка может развиться сепсис в результате любого типа инфекции.
Вот еще несколько фактов и статистики:
Если вы подозреваете сепсис, позвоните 9-1-1 или обратитесь в больницу и скажите своему медицинскому работнику: «МЕНЯ ОБЕСПЕЧИВАЕТ СЕПСИС.”
Хотели бы вы поделиться своей историей о сепсисе или прочитать о других людях, перенесших сепсис? Посетите «Лики сепсиса», где вы найдете сотни историй выживших и дань уважения тем, кто умер от сепсиса.
Обновлено 9 августа 2020 г.
Причины и симптомы сепсиса у новорожденных
Иммунная система человеческого тела отвечает за защиту организма от внешних агентов, которые могут вызвать инфекцию.Иммунная система новорожденного довольно слаба, и для ее развития требуется время, что оставляет новорожденного уязвимым для нескольких возможных инфекций. Именно по этой причине медицинские работники следят за тем, чтобы ребенок не подвергался воздействию каких-либо потенциальных инфекций.
Что такое сепсис?
Если ребенок заразится инфекцией, иммунная система отреагирует борьбой с возбудителями. Однако в случае сепсиса иммунная система реагирует ненормально и начинает атаковать здоровые клетки и ткани организма.
При неонатальном сепсисе нормальная реакция иммунной системы резко усиливается, вызывая состояние крови, потенциально опасное для здоровья ребенка. Он включает в себя производство чрезмерного количества лейкоцитов для борьбы с инфекцией. Обычно это происходит до того, как ребенку исполнится 90 дней.
Что вызывает сепсис у новорожденных?
Первичная инфекция сепсиса обычно имеет бактериальную природу, но в редких случаях она также может быть вызвана вирусной или грибковой инфекцией. Он почти всегда передается от беременной матери к ребенку, однако может (реже) передаваться из ближайшего окружения.
Бактерии, которые, как известно, вызывают сепсис у новорожденных, включают E.coli , Streptococcus группы B , Neisseria meningitidis , Salmonella , Haemophilus influenzae типа b и Listeria monocytogenes . Семейство вирусов простого герпеса также может вызывать инфекцию. Существующее заболевание также может вызвать сепсис.
Каковы симптомы сепсиса?
В зависимости от типа и тяжести инфекции неонатальный сепсис может проявляться различными симптомами.Некоторые из них перечислены ниже.
- Пониженный аппетит и нежелание есть. Не пьет более 8 часов.
- Склонность к рвоте после кормления.
- Высокая температура тела, выше 100,4 градусов по Фаренгейту.
- Повышенная раздражительность и капризное поведение.
- Летаргические движения или вялые движения.
- Изменение частоты сердечных сокращений, возможно как более высокое, так и более низкое значение в зависимости от стадии инфекции.
- Проблема с дыханием.
- Изменение тона кожи, бледная кожа с пятнами.
- Глаза и кожа могут пожелтеть из-за желтухи. Глаза могут иметь запавший вид.
- Уменьшение мочеиспускания — отсутствие мочеиспускания более 12 часов.
- Вздутие в области живота.
- Выбухание родничка.
- Снижение артериального давления.
- Снижение количества тромбоцитов.
Если у новорожденного обнаруживается более двух из этих симптомов, рекомендуется проконсультироваться с врачом.Поскольку сепсис — это быстро прогрессирующее состояние, отсроченное лечение может нанести непоправимый вред росту и развитию ребенка.
Факторы риска развития сепсиса
Осложнения во время беременности и после родов могут создать условия высокого риска неонатального сепсиса. К ним относятся предыдущая инфекция беременной матери или последующая инфекция, которую подхватывает ребенок. У ребенка может развиться любое из этих состояний, что в конечном итоге приведет к сепсису.
- Пневмония (легочная инфекция)
- Аппендицит
- Перитоит (инфекция слизистой оболочки желудка)
- Инфекция мочевыводящих путей
- Холецистит (инфекция желчного пузыря)
- Холангит (инфекция желчных протоков)
- Целлюлит (кожная инфекция)
- Менингит (инфекция головного мозга)
- Энцефалит (инфекция нервной системы)
- Остеомиелит (инфекция костей)
- Эндокардит (сердечная инфекция)
- Грипп
Сепсис может быть вызван бактериальной, вирусной или грибковой инфекцией.Однако большинство зарегистрированных случаев сепсиса вызвано пневмонией, инфекцией брюшной полости, почечной инфекцией и бактериемией или инфекциями кровотока.
Осложнения сепсиса
Иммунная система помогает изолировать инфекцию и ограничить ее распространение в уже пораженных тканях. Некоторое количество лейкоцитов перемещается в инфицированную ткань для борьбы с корневым возбудителем инфекции. Последующий биологический процесс включает отек пораженной ткани и называется воспалением.
Слабая иммунная система не может изолировать инфекцию, позволяя ей распространиться на другие органы и ткани. Это подавляет иммунную систему, и воспаление распространяется по всему телу. Набухание тканей и органов замедляет кровоток, поэтому кислород не достигает тканей и в конечном итоге приводит к падению артериального давления.
Полиорганная недостаточность последует, если ее вовремя не выявить и не лечить. Падение артериального давления известно как септический шок .Это критическое состояние, которое может привести к летальному исходу, если врач не назначит антибиотики и большое количество внутривенных жидкостей для вымывания и борьбы с инфекцией в крови.
Если поставить диагноз вовремя и правильно лечить, ребенок полностью выздоровеет от неонатального сепсиса. Однако в случае септического шока выживаемость составляет менее пятидесяти процентов. Кроме того, тяжелый сепсис подвергает ребенка большему риску инфекций в будущем.
Список литературы
Дополнительная литература
Неонатальный сепсис | BMJ
- Фейт Ким, научный сотрудник неонатальной и перинатальной медицины1,
- Ричард А. Полин, профессор педиатрии1,
- Томас А. Хувен, доцент педиатрии2
- 1 Департамент педиатрии, Колледж Вагелос Колумбийского университета врачей и хирургов, Нью-Йорк, США
- 2 Департамент педиатрии, Медицинская школа Университета Питтсбурга, Питтсбург, Пенсильвания, США
- Переписка с Т.А. Хувен Томас.hooven {at} chp.edu
Что вам нужно знать
Наиболее частыми ранними признаками сепсиса у младенцев являются лихорадка или переохлаждение, тахипноэ, летаргия или новые сообщения родителей о плохом питании. Рассмотрим сепсис у младенцев с очевидным изменением психического статуса, тонуса или перфузии, а также
Неонатальный сепсис может проявляться малозаметными признаками, но может быстро прогрессировать до мультисистемной органной недостаточности и менингита, что приводит к высокой смертности и заболеваемости.Направляйте младенцев с подозрением на сепсис в отделение неотложной помощи для обследования
Хотя неспецифические тесты, такие как общий анализ крови и маркеры воспаления, часто получают при первоначальной оценке, наиболее важным тестом является посев крови не менее 1 мл крови, взятой перед введением антибиотиков
10-дневный доношенный ребенок направлен в отделение неотложной помощи своим педиатром по поводу тахипноэ и недостаточного грудного вскармливания.Он родился в результате несложных вагинальных родов и был выписан домой после безболезненного пребывания в яслях больницы. Мать и ребенок легко начали кормить грудью, и он хорошо кормил каждые два-три часа. Однако примерно с полуночи мать сообщает, что он сонный и его трудно кормить. У него нет диуреза шесть часов. Его педиатр сообщил о тахипноэ с частотой дыхания 80 вдохов в минуту и расширением носа. Его уровень глюкозы в крови составлял 55 мг / дл (3 ммоль / л), а ректальная температура — 36.5 ° С. В отделении неотложной помощи ему сделали люмбальную пункцию, сделали посев крови и начали принимать ампициллин и цефтриаксон. Одиннадцать часов спустя его посев крови дает положительный результат на Streptococcus agalactiae (Streptococcus группы B или GBS).
Что такое неонатальный сепсис?
Неонатальный сепсис или заболевание, вызванное системной бактериальной инфекцией, является основной причиной детской заболеваемости и смертности. В исследовании «Глобальное бремя болезней» 2015 г. определено, что неонатальный сепсис является третьей по частоте причиной новорожденных…
Причины, симптомы, диагностика и лечение
Сепсис — это потенциально опасное для жизни состояние, при котором иммунная система чрезмерно реагирует на инфекцию.Эта чрезмерная реакция вызывает повреждение органов и других тканей тела.
Любой младенец или ребенок с симптомами сепсиса должен доставить их в отделение неотложной помощи. Без своевременной медицинской помощи это состояние может привести к серьезным осложнениям и даже смерти.
В этой статье мы описываем некоторые симптомы и причины сепсиса, а также предоставляем информацию о том, как врачи диагностируют и лечат это состояние. Мы также обсуждаем некоторые факторы, которые могут увеличить риск развития сепсиса у ребенка, и даем общие советы по профилактике.
Раннее выявление и своевременное лечение сепсиса снижает риск серьезных осложнений и смерти.
Симптомы сепсиса могут быть разными, но они будут включать один или несколько из следующих:
Некоторые из вышеперечисленных симптомов часто встречаются у младенцев и не обязательно являются признаком сепсиса. Однако, если ребенок выглядит больным и проявляет один или несколько из вышеперечисленных симптомов, важно как можно скорее обратиться за медицинской помощью.
Сепсис — это чрезмерная реакция иммунной системы на какую-либо инфекцию в организме.
По данным Центров по контролю и профилактике заболеваний (CDC), большинство случаев сепсиса вызвано бактериальной инфекцией. Однако сепсис также может возникать в ответ на вирусную, грибковую или паразитарную инфекцию.
В отчете о клиническом случае за 2016 год отмечается, что большинство случаев сепсиса вызвано инфекцией дыхательных путей или кровотока.
Дети в возрасте до 1 года подвергаются повышенному риску развития сепсиса, особенно если они родились преждевременно или их биологическая мать заразилась инфекцией во время беременности.
К другим факторам риска сепсиса относятся ослабленная иммунная система или хроническое заболевание, например:
Сепсис — это неотложная медицинская помощь для любого, включая младенцев. Родитель или опекун, подозревающий, что у их ребенка сепсис, должны немедленно отвезти их в отделение неотложной помощи для специализированной помощи.
Лечение сепсиса первой линии — это внутривенные (IV) антибиотики, которые помогают бороться с инфекцией. Ребенок должен получить их в течение 1 часа после прибытия в больницу.
Кроме того, врач назначит лечение, которое поможет стабилизировать состояние ребенка и снизить риск дальнейших осложнений. Эти методы лечения могут включать в себя одно или несколько из следующего:
- Внутривенные жидкости и электролиты
- лекарства для сердца
- лекарства от артериального давления
- аппараты ИВЛ для облегчения дыхания
- лекарства для успокоения ребенка
Лечение сепсиса может потребуется время и может потребоваться пребывание в больнице на несколько недель.В некоторых случаях может потребоваться лечение в отделении интенсивной терапии.
Врач проведет диагностические тесты для определения основной причины сепсиса. Знание причины — ключ к правильному лечению.
Некоторые диагностические тесты, которые врачи могут использовать для диагностики основных инфекций, включают:
В некоторых случаях врачи могут проводить медицинские визуализационные тесты для выявления повреждений органов и других тканей тела. Примеры таких тестов:
У всех младенцев может развиться сепсис, хотя некоторые из них подвергаются более высокому риску, чем другие.
Факторы риска включают:
- младше 1 года
- преждевременные роды
- биологическая мать ребенка, перенесшая инфекцию во время беременности
- , имеющая ослабленную иммунную систему или другое основное заболевание, повышающее их восприимчивость к инфекциям
- с нарушением функции нескольких органов
По прибытии в отделение неотложной помощи родители или опекуны должны ожидать ответа на вопросы о истории болезни ребенка и любых симптомах, которые у них были.
Медицинская бригада немедленно введет жидкости и лекарства для внутривенного введения, прежде чем приступить к диагностическим тестам.
Продолжительность пребывания детей с сепсисом в больнице варьируется. Согласно крупномасштабному исследованию 2014 года, средняя продолжительность пребывания в больнице составляет около 17 дней. Однако некоторым детям может потребоваться больше времени для восстановления. Тем, кому требуется более длительный период восстановления, возможно, придется оставаться в больнице более месяца.
Ранняя медицинская помощь повысит шансы ребенка на выживание и сократит общее время восстановления.
Однако для полного выздоровления от сепсиса потребуется время, и ребенок может продемонстрировать изменения в поведении после возвращения домой из больницы. Эти изменения могут включать:
После сепсиса некоторые дети могут продолжать испытывать физические и эмоциональные симптомы. Некоторые возможные долгосрочные последствия сепсиса включают:
У младенцев часто наблюдаются долгосрочные последствия сепсиса. В исследовании детского сепсиса 2019 года отмечается, что почти четверть детей, выздоравливающих после сепсиса, испытывают ухудшение качества жизни, связанного со здоровьем.
Любой, кто замечает признаки сепсиса у своего ребенка или ребенка, находящегося на его попечении, должен немедленно доставить его в отделение неотложной помощи. Сепсис может вызвать быстрое ухудшение здоровья. Без своевременной медицинской помощи состояние может быть фатальным.
В исследовании 2014 г. сообщалось о 14% -ной смертности среди детей с тяжелым сепсисом, но авторы отметили, что этот показатель был выше в подгруппе участников моложе 1 года.
Поскольку сепсис возникает в результате инфекции, родители и опекуны должны регулярно наблюдать за своим ребенком на предмет признаков инфекции или болезни.Некоторые общие признаки инфекции у младенцев включают:
- плохое питание
- необычная раздражительность
- постоянный плач
- недостаток энергии
- пониженная или повышенная температура
- кожная сыпь или изменение цвета кожи
- затрудненное дыхание
A родитель или опекун, подозревающий, что у их ребенка может быть инфекция, должны отвезти их к врачу. Раннее лечение инфекций поможет снизить риск сепсиса.
Ребенку с сепсисом потребуется срочная медицинская помощь, чтобы снизить риск осложнений и смерти.
Тяжелые осложнения могут развиваться быстрее у детей с ослабленной иммунной системой или хроническим заболеванием. Тем не менее, всем младенцам необходимо срочное лечение, независимо от их общего состояния здоровья.
При своевременном и соответствующем лечении большинство младенцев выздоравливает от сепсиса в течение нескольких недель. Однако некоторые могут продолжать демонстрировать поведенческие изменения, завершая выздоровление дома.
Единственный гарантированный способ избежать сепсиса — это предотвратить все инфекции, которые могут вызвать это состояние.Хотя это маловероятно, родители и опекуны могут предпринять шаги, чтобы снизить риск заражения своего ребенка. Примеры включают:
- обеспечение чистоты и гигиены окружающей среды ребенка
- стерилизация и лечение любых открытых ран и закрытие их до полного заживления
- контроль любых основных заболеваний, которые могут повысить риск развития инфекций или сепсиса у ребенка.
- наблюдение за ребенком на предмет ранних признаков инфекции
- обеспечение того, чтобы ребенок получил все рекомендованные вакцины против инфекций, которые могут привести к сепсису
- обеспечение адекватного питания для повышения шансов ребенка бороться с инфекциями
Сепсис у младенцев — это медицинское чрезвычайная ситуация.Без своевременного лечения состояние может привести к тяжелым осложнениям и даже смерти.
Родители и опекуны должны ознакомиться с признаками сепсиса у младенцев и маленьких детей. Если ребенок выглядит больным и проявляет какие-либо признаки сепсиса, человек должен немедленно доставить его в ближайшее отделение неотложной помощи.
Не всегда можно предотвратить инфекции, вызывающие сепсис. Однако родители и опекуны могут предпринять шаги, чтобы снизить риск развития инфекций у своего ребенка.К ним относятся обеспечение чистой и гигиеничной среды проживания, обеспечение ребенку всех необходимых прививок от инфекционных патогенов и наблюдение за ранними признаками инфекции.
Сепсис (для родителей) — Nemours KidsHealth
[Перейти к содержанию] Открыть поиск- для родителей
- Родительский сайт
- Sitio para padres
- Общее Здравоохранение
- Рост и развитие
- Инфекции
- Заболевания и состояния
- Беременность и младенец
- Питание и фитнес
- Эмоции и поведение
- Школа и семейная жизнь
- Первая помощь и безопасность
- Врачи и больницы
- Видео
- Рецепты
- Закрыть для родителей навиг.
- для детей
- Детский сайт
- Sitio para niños
- Как устроен организм
- Половое созревание и взросление
- Как оставаться здоровым
- Остаться в безопасности
- Рецепты и кулинария
- Проблемы со здоровьем
- Болезни и травмы
- Расслабьтесь и расслабьтесь
- Люди, места и вещи, которые помогают
- Чувства
- Ответы экспертов Q&A
- Фильмы и другое
- Закрыть детское навигатор
- для подростков
- Подростковый сайт
- Sitio para adolescentes
- Кузов
- Разум
- Сексуальное здоровье
- Еда и фитнес
- Заболевания и состояния
- Инфекции
- Наркотики и алкоголь
- Школа и работа
- Спорт
- Ответы экспертов (вопросы и ответы)
Диагностика неонатального сепсиса: клиническая и лабораторная проблема | Клиническая химия
Оценка тестов на неонатальный сепсис важна, поскольку инфекция может представлять очень серьезную угрозу для ребенка.Необходимо срочно узнать, есть ли у ребенка сепсис, чтобы как можно быстрее начать лечение. Для подтверждения диагноза может потребоваться время, и диагностические тесты используются для быстрого определения статуса инфекции. Эти тесты не идеальны. В некоторых реальных случаях инфекции результаты тестов будут отрицательными, тогда как у некоторых младенцев без инфекции результаты тестов будут положительными. Потенциальная полезность теста будет зависеть, прежде всего, от клинического состояния ребенка. Если ребенок действительно очень болен, тест не даст много дополнительной информации.Точно так же, если ребенок явно здоров, будет достаточно клинического обследования, и положительный результат теста не приведет к значительному увеличению вероятности инфицирования ребенка. Диагностический тест, вероятно, будет наиболее полезен в ситуациях, когда клиническая картина оставляет у врача сомнения в отношении статуса инфекции. Таким образом, результат диагностического теста необходимо оценивать в свете клинического состояния малыша.
Существует обширная литература по отдельным лабораторным тестам или комбинациям тестов, а также тестам, используемым вместе с факторами риска и / или клиническими признаками для диагностики неонатального сепсиса.Во многих случаях результаты оценок были противоречивыми. Есть несколько возможных объяснений расхождений в результатах, и цель этого обзора — обновить читателей по теме и поднять вопросы, которые следует решить в будущем.
Основы физиологии неонатальной инфекции
На протяжении всей беременности и до разрыва плодных оболочек плод относительно защищен от микробной флоры матери хориоамниотическими оболочками, плацентой и плохо изученными антибактериальными факторами околоплодных вод (1).Однако существует много способов, которыми инфекционные агенты могут попасть к плоду или новорожденному и вызвать инфекцию. Процедуры, нарушающие целостность содержимого матки, такие как амниоцентез (2), шейный серкляж (3), трансцервикальный забор проб ворсин хориона (4) или чрескожный забор крови (2) (5), могут позволить проникновение организмов кожи или влагалища, вызывая амнионит и вторичную инфекцию плода. Некоторые бактерии, в частности Treponema pallidum и Listeria monocytogenes , могут достигать плода через кровоток матери, несмотря на плацентарные защитные механизмы, вызывая трансплацентарную инфекцию.Этот процесс встречается нечасто, но он приводит либо к врожденной инфекции, похожей на инфекции, вызванные определенными вирусами или Toxoplasma , либо к мертворождению в результате обширной инфекции.
Первоначальная колонизация новорожденного обычно происходит после разрыва материнской оболочки (1). В большинстве случаев младенец заселяется микрофлорой родовых путей во время родов. Однако, особенно если разрыв плодных оболочек длится более 24 часов, влагалищные бактерии могут подниматься и в некоторых случаях вызывать воспаление плодных оболочек, пуповины и плаценты (6) (7).Инфекция плода может возникнуть в результате аспирации инфицированных околоплодных вод (8), что приведет к мертворождению, преждевременным родам или неонатальному сепсису (2) (7) (9) (10). Из инфицированных околоплодных вод чаще всего выделяют анаэробные бактерии, стрептококки группы B, Escherichia coli и генитальные микоплазмы (2) (9). Заражение матери во время родов, особенно генитальная инфекция, является основным путем передачи инфекции от матери (1) (11) и может играть важную роль в развитии инфекции у новорожденного.Возможна трансплацентарная гематогенная инфекция во время или незадолго до родов (включая период отделения плаценты), хотя более вероятно, что младенец инфицирован во время прохождения через родовые пути. Наконец, бактерии могут быть занесены после рождения из окружающей среды, окружающей ребенка, в детской или дома.
Многие акушерские осложнения до и во время родов связаны с повышенным риском инфицирования новорожденных. Среди них — преждевременное начало родов, длительный разрыв плодных оболочек, инерция матки при удалении больших щипцов и гипертермия матери (12).
Сложное оборудование для респираторной и нутритивной поддержки в сочетании с инвазивными методами обеспечивает жизнеобеспечение больного младенца. Артериальные и венозные пупочные катетеры, центральные венозные катетеры, периферические артериальные и венозные канюли, постоянные мочевые катетеры, инфузии гипералиментации и вспомогательная вентиляция легких предоставляют огромные возможности для относительно невирулентных патогенов, чтобы вызвать инфекцию и вторгнуться в хозяина (12).
Преходящая бактериемия может сопровождать процедуры, травмирующие кожу и слизистые оболочки.Бактериемия была выявлена у младенцев, которым выполнялось эндотрахеальное отсасывание; бактериемия присутствовала сразу после процедуры, но результаты посева были отрицательными через 10 мин (13). Вторжение в кровоток может последовать за размножением микроорганизмов в верхних дыхательных путях или других очагах. Как только бактерии получают доступ к кровотоку, хозяин активирует механизмы для устранения микробного нарушителя. Обычно организм эффективно очищается системой моноцитов-макрофагов после опсонизации антителом и комплементом.Таким образом, бактериемия вызывает только кратковременное заболевание. Иногда, однако, в зависимости от возраста пациента, вирулентности и количества бактерий в крови, нутритивного и иммунологического статуса хозяина, а также времени и характера терапевтического вмешательства устанавливается системная воспалительная реакция, которая может прогрессировать независимо. исходной инфекции (14) (15).
Перинатальные и послеродовые инфекции
Инфекции, которые проявляются в начале первой недели жизни, обычно связаны с микроорганизмами, передаваемыми от матери к младенцу, и имеют эпидемиологию, отличную от эпидемиологии инфекций, приобретенных позднее в неонатальном периоде (16).Не существует временной точки, которая бы четко отделяла инфекции, передающиеся от матери, от инфекций, передаваемых через окружающую среду (17). Тем не менее, эпидемиологические исследования неонатальных инфекций обычно разделяют так называемые инфекции с ранним началом и инфекции с поздним началом на сроке между 3 и 7 днями жизни, исходя из предположения, что инфекции с ранним началом предположительно передаются перинатально от матери, а инфекции с поздним началом. приобретаются постнатально из источника окружающей среды (16) (17) (18) (19) (20) (21) (22) (23) (24) (25) (26).Следовательно, отчет о новом тесте для диагностики неонатального сепсиса должен быть критически оценен с учетом произвольных временных точек, используемых для отделения инфекций материнского происхождения от послеродовых инфекций. Послеродовой возраст, используемый в качестве основы для диагностики заболевания с ранним или поздним началом, может иметь поразительное влияние на концентрацию аналитов в отдельных случаях. Это не менее важно для элементов управления. Только тогда, когда временные точки для разделения двух моделей болезни будут единообразными, можно ожидать согласованности во всех исследованиях.Мы далеки от этого. В последнее десятилетие во многих исследованиях даже не проводилось различий между ранним и поздним началом инфекции, и, что еще более разочаровывающе, они изучали точность современных лабораторных тестов в группах новорожденных с разным постнатальным возрастом (27) (28). ) (29). Эти различия могут изменить диагностические характеристики конкретного теста и затруднить сравнение опубликованных отчетов (30).
Системный ответ на инфекцию у новорожденных
Неонатальный сепсис, сепсис новорожденных и неонатальный сепсис — это термины, которые использовались для описания системной реакции на инфекцию у новорожденных.Нет единого мнения о правильном использовании этих терминов, т.е. о том, следует ли ограничивать их использование бактериальными инфекциями, положительными посевами крови или тяжестью заболевания (31).
В 1991 году Американский колледж грудных врачей и Общество реаниматологов созвали консенсусную конференцию в попытке предоставить концептуальную и практическую основу для определения системной воспалительной реакции на инфекцию, которая представляет собой прогрессирующий повреждающий процесс, который подпадает под обобщенный термин «сепсис» включает также связанную с сепсисом органную дисфункцию (32).Термин синдром системной воспалительной реакции (SIRS) используется для описания клинического синдрома, характеризующегося двумя или более из следующих признаков: (a) лихорадка или гипотермия, (b) тахикардия, (c) тахипноэ или гипервентиляция, и (d) аномальных белых кровяных телец или увеличение незрелых форм. SIRS может быть результатом различных иммунологических, эндокринологических, травматических, хирургических, химиотерапевтических и инфекционных поражений (32) (33). Сепсис считается системной реакцией на возможную инфекцию.Доказательства бактериемии или инфекционного очага не требуется (32) (33). Когда сепсис сопровождается дисфункцией органов, гипоперфузией или гипотонией, сепсис считается тяжелым. Септический шок возникает, когда гипотензия развивается, несмотря на адекватное восполнение жидкости. Наконец, при наличии измененной функции органа у остро больного пациента, настолько серьезной, что гомеостаз не может поддерживаться без вмешательства, диагностируется синдром полиорганной дисфункции. Совсем недавно группа экспертов и лидеров общественного мнения пересмотрела руководящие принципы по сепсису 1991 г. и обнаружила, что помимо расширения списка признаков и симптомов сепсиса для отражения клинического опыта у постели больного, нет никаких доказательств, подтверждающих изменение определений (34).
Однако применение приведенных выше терминологических рекомендаций к новорожденным с сепсисом требует тщательной оценки (т. Е. Возрастных контрольных значений артериального давления, частоты сердечных сокращений, частоты дыхания и количества лейкоцитов). Кроме того, применение системы стадирования (включая сепсис, тяжелый сепсис, септический шок и синдром полиорганной дисфункции) может быть не лучшим подходом к стратификации заболевания или риска у новорожденного. Ранние аномалии органов могут не проявляться, поэтому более ранние стадии развития синдрома не могут быть идентифицированы.Более того, часто молниеносное или быстрое течение болезни у новорожденного может ограничить описанную выше систему стадирования лишь моментальным снимком этого динамического процесса.
В настоящее время критерии неонатального сепсиса обычно включают документацию об инфицировании новорожденного с серьезным системным заболеванием, при котором неинфекционные объяснения патофизиологического состояния исключены или маловероятны. Однако даже культура не свободна от ошибок, потому что она может быть ложно стерильной, как предполагают посмертные культуры (35), или из-за низкого выхода, вызванного недостаточным объемом образца, периодической бактериемии или бактериемии низкой плотности или подавления роста бактерий путем ранее (т.е., во время родов) введение антибиотиков. Теоретически это привело бы к недостаточной представленности действительно инфицированных новорожденных. С другой стороны, лишь в нескольких исследованиях определения сепсиса были достаточно строгими, чтобы отличить контаминанты культур от настоящих системных инфекций. Десять лет назад Pourcyrous et al. (36) признали, что 83% посевов крови, дающих организмы с низкой или сомнительной вирулентностью, были результатом контаминации во время сбора. Во всех этих случаях антибиотикотерапия не применялась или была неадекватной по общепринятым стандартам, но клинические курсы протекали без осложнений.Если термин «подтвержденный посевом» сепсис используется для обозначения младенцев, у которых клинические признаки инфекции и / или отклонения в лабораторных результатах полностью объясняются выходом типичной кожной флоры или флоры верхних дыхательных путей из одного посева крови, необходимо указать, , в этой ситуации клинические признаки и отклонения в лабораторных результатах были устранены с помощью специфической противомикробной терапии или ухудшились без нее (37). Такой подход, полностью учитывающий клиническое течение, должен быть более плодотворным и привести к однозначному стандартному критерию.
Столкнувшись с этими вопросами и, как было обнаружено в исследованиях сепсиса у взрослых пациентов, часть неонатологической литературы отказалась от положительных культур как критического момента «золотого стандарта». Однако следует подчеркнуть, что не существует универсального согласия в отношении определения неонатальной клинической септицемии. В последние годы некоторые авторы предположили, что наличие только одного клинического признака (совместимого с инфекцией) вместе со значением С-реактивного белка (СРБ)> 10 мг / л является достаточным для диагностики раннего и позднего начала. неонатальная клиническая септицемия (38) (39).Другие отнесли младенцев с только материнским фактором (факторами) риска инфицирования к группе сепсиса «для разработки критериев, которые являются актуальными и достаточно простыми для клинической практики» (40). В других исследованиях наличие двух или трех категорий (по системе органов) клинических признаков инфекции у младенца считалось убедительным подтверждением диагноза сепсиса (41) (42) (43). Однако в публикациях по неонатологии отсутствуют данные о том, насколько распространен данный клинический признак у всех когда-либо оцениваемых младенцев (а не у младенцев с положительными культурами или младенцев с определенным типом инфекции).Таким образом, за исключением клинического сценария новорожденного с явными признаками инфекции, такими как септический шок, возможность того, что младенцам только с клиническими признаками инфекции мог быть поставлен неверный диагноз, является неотъемлемой частью всех исследований такого рода ( 37). В отличие от нашего настаивания на необходимости однозначного и единообразного стандартного критерия для установления положительного и отрицательного на культуру сепсиса, некоторые авторы считают значение СРБ> 10 мг / л в сочетании с отношением незрелых нейтрофилов к общему количеству нейтрофилов> 0. .25 в качестве критерия для начала антибактериальной терапии даже у младенцев без симптомов инфекции (44).
В заключение, может показаться, что отсутствие общепринятого стандартного определения привело к тому, что авторы создали свои собственные определения, соответствующие целям их собственных конкретных исследований. Однако эти определения должны быть четкими в отношении типа ребенка (определяемого сроком беременности и массы тела при рождении), возраста ребенка, культурного статуса, статуса симптомов и тяжести заболевания.
Тяжесть заболевания новорожденных
Несмотря на то, что степень тяжести болезни — известное медицинское понятие, иногда ее трудно оценить.Важной особенностью заболеваемости новорожденных является ее интегративный и глобальный характер. Индивидуальные характеристики (например, гипогликемия, трудности с пероральным кормлением и судороги) не отражают общее состояние здоровья и заболеваемости новорожденных. До недавнего времени вес при рождении, гестационный возраст и оценка по шкале Апгар часто считались достаточными косвенными показателями заболеваемости при рождении. Хотя стратификация веса при рождении и гестационного возраста может быть адекватной для некоторых целей, они не учитывают полностью различия в тяжести заболевания.Шкала Апгар была первоначально разработана для выявления новорожденных, нуждающихся в немедленном сердечно-легочном вмешательстве (45) (46) (47) (48), и определяется преимущественно по острым внутриродовым событиям. Низкие баллы по шкале Апгар могут фактически отражать гестационный возраст, массу тела при рождении, седативный эффект или врожденные пороки развития (47).
В последние годы были разработаны два основных показателя тяжести неонатальной тяжести: шкала неонатальной острой физиологии (SNAP) и индекс клинического риска для младенцев (CRIB). И SNAP, и CRIB сосредоточены на измерении и оценке физиологических нарушений, следуя примеру оценки острой физиологии и хронического здоровья в отделениях интенсивной терапии для взрослых (49) и детского риска смертности в педиатрических отделениях интенсивной терапии (50).Обоснование этого состоит в том, что, независимо от заболевания или диагноза, отклонения от физиологической нормы увеличивают вероятность неблагоприятного исхода и что чем больше расстройства, тем выше риск. Общая тяжесть может быть представлена взвешенной суммой нарушений по всем системам органов (51).
CRIB был разработан для упрощения сбора данных. Он использует 12-часовой базовый период от рождения (52). В популяции с гестационным возрастом ≤31 недели большинство заболеваний адекватно фиксируется путем отбора проб только трех показателей дыхательной / метаболической систем (наихудший базовый дефицит и самая высокая и самая низкая соответствующая потребность в кислороде).Протокол SNAP, впервые описанный в 1993 г. (53), использует наихудшие зарегистрированные значения 26 обычно измеряемых физиологических переменных (включая 8, которые могут быть оценены по высоким или низким значениям) в течение первых 24 часов пребывания в отделении интенсивной терапии новорожденных (NICU). Он был проспективно подтвержден в нескольких отделениях интенсивной терапии интенсивной терапии, охватывающих очень разные группы населения, и, как было обнаружено, имеет высокую корреляцию с другими показателями тяжести заболевания (53) (54) (55) (56). Исходя из этого, SNAP-Perinatal Extension (SNAP-PE) фиксирует физиологические оценки SNAP, комбинируя их с дополнительной оценкой для трех мощных рисков перинатальной смертности (т.е., вес при рождении, низкий балл по шкале Апгар и малый для гестационного возраста), все это не связано с физиологическим расстройством (57). Таким образом, оценка SNAP-PE представляет собой комбинированный физиологический и перинатальный показатель риска смерти.
В качестве шкалы тяжести заболевания новорожденных первого поколения, SNAP подходит для исследования результатов, но является громоздким для рутинного клинического использования из-за количества и сложности его элементов. С другой стороны, CRIB трудно применить к младенцам, родившимся вне больницы.Недавно пересмотренный SNAP-II оценивает шесть пунктов, охватывающих шесть систем (pH, температуру, артериальное давление, оксигенацию, диурез, наличие множественных припадков), но имеет эффективность, эквивалентную показателям SNAP и CRIB для младенцев с очень низкой массой тела при рождении. и более крупные младенцы (58).
Лабораторные испытания
Стандартный стандарт: общие положения
Нормальный стандарт в контексте лабораторных испытаний относится к тому, что статистики обычно называют нормальным диапазоном.Однако его не следует путать с нормальным (гауссовым) распределением. Нормальное распределение — это симметричное распределение, в котором интервал, определяемый средним значением ± 1,96 стандартного отклонения, включает центральные 95% значений. Распределение большинства клинических индексов не приближается к нормальному распределению, и этот простой интервал не может использоваться для определения интервала, который включает центральные 95% значений клинического индекса. Нормальный диапазон или нормальный стандарт — это интервал, который относится к распределению индекса у здоровых людей; нормальный диапазон включает центральные 95% этих значений.С точки зрения статистики, нормальный диапазон можно определить как интервал между 2,5-м и 97,5-м процентилями распределения индекса у здоровых людей. Если этот интервал используется в контексте диагностического теста, он по определению имеет специфичность 95% (специфичность составляет 97,5%, только если один хвост распределения считается положительным результатом теста). Нормальный диапазон не дает информации о чувствительности теста.
нормальные (и ненормальные) диапазоны у новорожденного
При рождении плод совершает резкий переход из защитной среды матки во внешний мир; Новорожденный ребенок должен претерпеть серьезные физиологические изменения, чтобы пережить этот переход (59).Поэтому неудивительно, что многие физиологические и метаболические процессы постоянно меняются в течение первых нескольких дней жизни. Эти изменения сильно влияют на различные виды лабораторных показателей (например, гормоны, биохимические показатели, иммунологические продукты и цитокины), а средние референсные значения в раннем неонатальном периоде отличаются от тех, которые измеряются в более поздние периоды (60) (61). Следовательно, анализ надежности лабораторных тестов при диагностике неонатального сепсиса должен учитывать тот факт, что постнатальный возраст может существенно повлиять на интерпретацию того, что составляет нормальное (и не менее важно аномальное) значение лабораторного теста (60).
Практически все опубликованные руководства подчеркивают необходимость справочных значений. К сожалению, на этом соглашение заканчивается. В этом контексте никакое обсуждение вопроса не будет полным без рассмотрения интерпретации двух лабораторных средств, работа которых приобрела почти ритуальное качество: СРБ и полный анализ крови (ОАК).
В большинстве опубликованных отчетов верхние пределы СРБ в неонатальном периоде были получены у неинфицированных пациентов с симптомами (62) (63) (64) (65) (66) (67) (68) (69) (70). ) (71) (72).Таким образом, исследований верхних пределов СРБ у здоровых новорожденных немного (73) (74) (75) (76). Более того, большинство этих исследований здоровых новорожденных были поперечными и основывались на небольших выборках с широким диапазоном постнатального возраста. Gutteberg et al. (73), которые определили (радиальной иммунодиффузией) концентрации CRP у 16 практически здоровых новорожденных в неустановленное время отбора проб в течение первого месяца жизни, получили нормальные верхние пределы 97,5-го перцентиля для CRP, составляющие ~ 5 мг / л. В исследовании Forest et al.(74), 69 новорожденных, отмеченных как «очевидно здоровые новорожденные» в соответствии с их нормальным послеродовым течением, несмотря на их первоначальную госпитализацию в отделение интенсивной терапии, были взяты в неустановленное время от рождения до 6-й недели жизни. Из них 68 имели концентрацию CRP (по данным иммуноферментного анализа) <10 мг / л. В исследовании Schouten-Van Meeteren et al. (75), 95% из 38 практически здоровых новорожденных, у которых были взяты образцы в период между 12 и 24 часами после рождения, имели концентрацию CRP ≤10 мг / л (по данным иммуноферментного флуоресцентного поляризационного анализа).Тем не менее менее известно, что частота ложноположительных результатов для этих методов у практически здоровых новорожденных в течение первых 30 дней жизни составляет 8% для CRP (30). Кроме того, отсутствие данных о последующем наблюдении (или исходе) было заметным недостатком в литературе, посвященной «грудным детям с непристойной чистотой».
Мы следовали этим принципам в недавнем продольном исследовании, в котором изучалась картина ответа на СРБ у здоровых новорожденных в трех фиксированных неонатальных возрастах: 0, 24 и 48 ч (76). Нас не интересовало установление диапазонов СРБ для идеальной популяции здоровых младенцев (т.д., доношенных детей без факторов риска), но при установке диапазонов, которые могут быть важны для повседневного опыта врачей. Референсные интервалы СРБ, которые мы установили при рождении (95-й процентиль, 5,0 мг / л), через 24 часа (95-й процентиль, 14,0 мг / л) и через 48 часов жизни (95-й процентиль, 9,7 мг / л), включали новорожденных, которые не обязательно не имели в анамнезе материнских и интранатальных осложнений, но чей послеродовой клинический курс от рождения до 4-недельного последующего визита не был примечателен, что подразумевает, следовательно, отсутствие необходимости лечения (включая антимикробное лечение) на протяжении всего периода исследования.
Наиболее часто цитируемым исследованием неонатального клинического анализа крови является исследование Manroe et al. (77). В период от 0 до 24 часов, критическое время принятия решения для большинства неонатальных «обследований на сепсис» (78), Manroe et al. построили свои графики на 108 младенцах, отобранных методом поперечного сечения. Конверты 10-го и 90-го процентилей определяли визуальным осмотром. Неудобно думать, что многие из нас уже давно безоговорочно принимают эти нормы. Из исследования Schelonka et al. (78), нормальные диапазоны лейкоцитарных индексов у 193 здоровых доношенных новорожденных без выявленных перинатальных факторов риска инфицирования были через 4 часа жизни значительно шире, чем те, которые описаны ранее Manroe et al.(77) в течение первых 24 часов жизни. Таким образом, если применить эталонные интервалы Manroe et al. (77) к здоровым доношенным детям, огромное число из них можно было бы назвать подверженными чрезвычайно высокому риску сепсиса. Оставляя в стороне методологические аспекты, важно помнить, что фактический физический отбор проб может привести к резким изменениям в результатах общего анализа крови. Хорошо задокументировано, что общий анализ крови зависит от возраста ребенка (77) (78) (79) (80), от того, является ли образец артериальным или венозным (81), и от того, сильно ли ребенок плачет (81).Это означает, что для данного младенца значение теста не является статическим; существует значительная индивидуальная изменчивость. В этом контексте вызывает беспокойство мысль о том, что многие из нас безоговорочно приняли очень популярный индекс, соотношение незрелых: общее количество нейтрофилов, хотя этот тест может значительно варьироваться между наблюдателями. Поскольку сегментированные и ленточные нейтрофилы существуют в континууме клеточного созревания, использование дискретных границ является искусственным и подвержено предвзятости наблюдателя.В 1993 г. Колледж американских патологов обследовал 6600 гематологов в рамках упражнения по идентификации нейтрофилов (82). Из-за плохой воспроизводимости идентификации палочкоядерных нейтрофилов в этой большой выборке Колледж больше не проверяет лабораторные навыки по дифференцировке сегментированных и палочковых нейтрофилов (82).
Принимая во внимание такое динамическое поведение, нужны ли нам также возрастные пороговые значения для дифференциации симптоматических новорожденных с инфекцией от новорожденных без инфекции? В 1980 г. Филип и Хьюитт (83) предложили для простоты применять те же лабораторные пороговые значения для маркеров, которые используются для диагностики или исключения неонатального сепсиса, в течение первой послеродовой недели.Спустя два десятилетия появились даже обновленные систематические обзоры точности современных лабораторных тестов для диагностики сепсиса у новорожденных, которые подтверждают это утверждение (29). Возможно, наиболее удивительным является то, что такие методологические недостатки также преследуют самые последние применения CRP. Филип и Миллс (84) рекомендовали, чтобы в любом неонатальном возрасте значение СРБ ≥10 мг / л при наличии одного (или нескольких) клинических признаков или одного (или нескольких) факторов риска инфицирования должно было быть основным. клинический способ перевода новорожденного из детского сада в отделение интенсивной терапии и начала противомикробной терапии.Franz et al. (38) (39), с другой стороны, рассматривали обычное значение CRP> 10 мг / л при наличии одного (или нескольких) клинических признаков, совместимых с инфекцией, как критерий для постановки диагноза клинического сепсис в любом неонатальном возрасте у новорожденных в отделении интенсивной терапии. На этом фоне мы недавно показали (85), что неспособность распознать конкретные пороговые значения с помощью данного теста для каждой временной точки оценки в течение первых 48 часов жизни может затруднить интерпретацию того, что составляет «истинно отрицательный» и « истинно положительное значение »в диагностике неонатальной инфекции.
роль новых маркеров
В последние годы поиск диагностических тестов на сепсис у новорожденных обратился к цитокинам, а также к другим веществам, связанным с воспалительной реакцией, в некоторых случаях индуцированной цитокинами, в качестве возможных индикаторов инфекции. Несколько новых маркеров остаются многообещающими, из которых наиболее интенсивно изучается интерлейкин (IL) -6. Кроме того, прокальцитонин (ПКТ), по-видимому, является многообещающим средством диагностики неонатального сепсиса.
Данные, относящиеся к референсным интервалам для новых маркеров, очень ограничены. Недавно мы показали, что как ИЛ-6, так и ПКТ представляют собой естественные колебания в ближайшем послеродовом периоде (76) (86), что требует очень осторожной корректировки в пределах нормы. Это может объяснить противоречивые точки отсечения для аномальных значений, которые были зарегистрированы для этих двух маркеров (28) (38) (87) (88) (89) (90) (91) (92). Мы также показали, что для определения «физиологических» концентраций как ИЛ-6, так и ПКТ следует принимать во внимание некоторые мешающие факторы (76) (86).Следует отметить, что кинетика IL-6 в течение первых 48 часов жизни у здоровых младенцев отличается у недоношенных новорожденных по сравнению с кинетикой у доношенных новорожденных, что свидетельствует о влиянии гестационного возраста на значения IL-6 в течение первого периода жизни. 48 ч жизни (76).
Сообщения в литературе о полезности новых индикаторов инфекций противоречивы. В недавнем исследовании мы (85), как и другие (28) (88), обнаружили, что чувствительность к IL-6, как и к ПКТ, низкая, в диапазоне 70–80% при рождении, что, безусловно, является самым высоким показателем. критическая точка принятия решения при обследовании новорожденного, чтобы исключить сепсис.Однако в послеродовой период, хотя чувствительность к ИЛ-6 со временем снижается, чувствительность ПКТ (а также СРБ) увеличивается, что делает серийные измерения полезными в тех ситуациях, когда необходимо решить, как долго лечить. . Поскольку чувствительность этих маркеров меняется со временем, их использование требует определенных значений отсечки для каждой временной точки оценки в течение первых 48 часов жизни. Мы также показали, что концентрации ИЛ-6 и ПКТ в раннем неонатальном периоде могут по-разному относиться к клиническим осложнениям в перинатальном периоде (85).
влияние тяжести заболевания и статуса риска на маркеры
Надежность большинства лабораторных тестов для дифференциальной диагностики инфекционного и неинфекционного системного воспалительного ответа была оценена в самых разных группах больных новорожденных со смешанными диагнозами и состояниями и дала противоречивые результаты (30). В этой ситуации, поскольку инфекционные, а также неинфекционные диагнозы и сами состояния могут различаться по степени тяжести, некоторые различия в опубликованных отчетах могут отражать различия в исходной серьезности и статусе риска, независимо от наличия инфекции.Клиническая тяжесть в отделениях интенсивной терапии различается в широких пределах: от тяжелобольных младенцев с недостаточностью полиорганной системы до умеренно больных доношенных детей с преходящими проблемами, связанными с процессом родов, или здоровых недоношенных младенцев, которым требуется техническая поддержка до достижения зрелости. К сожалению, основная проблема литературы о диагностической ценности лабораторных средств для диагностики неонатальной инфекции заключается в том, что в ней не удается оценить влияние общей тяжести заболевания на данный маркер.
Поэтому мы недавно оценили влияние тяжести заболевания на CRP, IL-6 и PCT для диагностики сепсиса в течение первых 48 часов жизни у тяжелобольных новорожденных, поступивших в отделение интенсивной терапии (85). С этой целью мы использовали оценки как SNAP, так и SNAP-PE. Мы обнаружили, что CRP, IL-6 и PCT увеличиваются при наличии бактериальной инфекции и что их увеличение не зависит от тяжести заболевания. Однако мы также обнаружили, что тяжесть заболевания может влиять на концентрацию ИЛ-6, поскольку среди детей без инфекции, чем выше тяжесть заболевания, тем выше концентрация ИЛ-6 после рождения.Из вышеизложенного ясно, что диагностическая ценность некоторых лабораторных средств, таких как IL-6, может изменяться в зависимости от физиологической степени тяжести и индексов риска.
Методологические вопросы
общие соображения
Значение клинического индекса, наблюдаемого у пациента, может быть полезным подспорьем для диагностики, если распределение значений среди здоровых людей существенно отличается от распределения в истинных случаях заболевания. С одной стороны, если два распределения идентичны, очевидно, что значение, наблюдаемое для одного пациента, не может предоставить информацию о диагнозе, и тест бесполезен.С другой стороны, если два распределения не перекрываются, значение отсечения между двумя распределениями может обеспечить определенный диагноз.
Наиболее распространенная ситуация состоит в том, что два распределения перекрываются, и тест не может дать точного определения болезненного состояния пациента. Фактически, одно значение может использоваться как граница между положительным и отрицательным результатом теста, а количественное значение индекса сводится к дихотомии. Тест обычно оценивается путем расчета его чувствительности и специфичности.Чувствительность теста — это вероятность того, что пациент с заболеванием или состоянием будет идентифицирован тестом как положительный. Специфичность — это вероятность отрицательного результата теста у здорового человека. Эти две вероятности можно оценить, применив тест к выборке известных случаев и другой выборке известных здоровых людей. Однако чувствительность и специфичность не представляют прямого интереса для клиницистов, когда они сталкиваются с клинической проблемой постановки диагноза для отдельного пациента.Клиницисты хотели бы знать, есть ли у их пациентов заболевание, но, к сожалению, они не могут быть уверены в этом. Эта неопределенность также измеряется вероятностью. Эпидемиологические исследования можно использовать для оценки распространенности заболевания в конкретных клинических условиях. Это вероятность того, что человек заболел до того, как будет проведен диагностический тест, и часто называется априорной вероятностью заболевания. Предположим, что тест применяется к пациенту и результат теста положительный.Теперь врач должен с еще большей уверенностью верить в то, что пациент болен. Эта степень уверенности измеряется вероятностью, называемой прогностической ценностью положительного теста, которую можно оценить по чувствительности, специфичности и распространенности заболевания в клинических условиях.
Это грубое упрощение рассуждений, используемых клиницистом, столкнувшимся с проблемой постановки диагноза отдельному пациенту. Например, предположим, что тест был оценен, и обнаружено, что прогностическая ценность положительного теста составляет 70%.То есть человек с положительным тестом имеет 70% вероятность заболеть заболеванием. Что это может сказать врачу, у пациента которого положительный результат теста, о статусе заболевания? Это, конечно, не означает, что врач считает, что у пациента есть 70% шанс заболеть этим заболеванием. Это значение, 70%, основано на информации, полученной от выборки пациентов «этого типа». Для оценки отдельного пациента доступно гораздо больше информации, которая будет собрана врачом в истории болезни.Положительный результат теста будет лишь одной дополнительной информацией. Если у пациента есть важные признаки и симптомы заболевания до теста, его или ее априорная вероятность будет высокой, а положительный результат теста может почти подтвердить диагноз. С другой стороны, если у пациента мало или совсем нет признаков заболевания, положительный результат теста не означает высокой вероятности того, что у пациента заболевание. Диагностический тест потенциально будет наиболее полезен для пациентов, состояния и истории болезни которых предполагают, что у них может быть заболевание.
На основании обзора диагностических тестов бактериальных инфекций в младенчестве (27) был сделан вывод, что эти диагностические тесты могут иметь ограниченное применение при отсутствии другой релевантной клинической информации о пациенте. Действительно, авторы обзора предполагают, что, когда врач сталкивается с младенцем с возможной серьезной инфекцией, лечение может быть начато немедленно с помощью антибиотиков. Очевидно, что результат теста не повлияет на решение о начале лечения, если уже имеются убедительные доказательства инфекции.Точно так же при отсутствии признаков инфекции врач может не начинать лечение, даже если тест был положительным. Тест, скорее всего, будет полезен, когда история болезни и состояние пациента оставляют у врача серьезные сомнения относительно наличия инфекции, и в этом случае диагностический тест может использоваться как правило принятия решения: начать лечение, если тест положительный; отложить лечение, если результат теста отрицательный.
точность лабораторных методов
Учитывая возросшую мобильность пациентов, сопоставимые (истинные) результаты анализов имеют важное значение для рационального и экономичного диагностического подхода в лабораторной медицине (93).С точки зрения лабораторной практики, однако, при изучении всех опубликованных на сегодняшний день данных о лабораторных средствах диагностики неонатального сепсиса становится очевидным, что различия в лабораторных методах также частично являются причиной противоречивых мнений о надежности данный тест в неонатальном периоде. Опять же, обсуждение этого вопроса не будет полным без рассмотрения различных методов, используемых для измерения CRP, наиболее часто используемого маркера для выявления новорожденных с сепсисом.
Первоначальный тест представлял собой простой тест преципитации, обычно в микрокапиллярной пробирке, в котором высота осадителя определяла количество присутствующего CRP. Сравнение реакций, полученных разными исследователями с использованием метода капиллярной трубки, выявило сильно различающиеся результаты в зависимости от чувствительности коммерческой антисыворотки, используемой в анализе (94). Только в начале 1980-х годов стали коммерчески доступны быстрые и надежные количественные иммуноанализы, в которых использовались моноклональные CRP-специфические антитела.Некоторые исследователи использовали иммуноанализы, которые позволяли прямую визуализацию комплекса CRP-антитело посредством агглютинации частиц (т.е. агглютинации латекса) или преципитации (т.е. радиальной иммунодиффузии, иммунотурбидиметрии, нефелометрии). Другие исследователи использовали иммуноанализы, в которых использовался маркер для обнаружения (например, RIA, метод иммуноферментного анализа). Хотя тест на агглютинацию предметных стекол является быстрым и удобным и до сих пор используется некоторыми исследователями (95), он является только полуколичественным и зависит от реагентов (96).
Исследования, сравнивающие полностью автоматизированные турбидиметрические и нефелометрические методы определения СРБ с более ранними анализами, показали превосходную точность, гораздо большую скорость, чувствительность и воспроизводимость. Однако эти методы анализа по-прежнему имеют ограниченную чувствительность, и до недавнего времени концентрации CRP ниже ~ 10 мг / л не могли быть точно измерены, что привело к широкому распространению этого значения или даже выше в качестве верхнего предела эталона для «здоровых». интервал. Это удовлетворительно для некоторых целей в общей медицине, потому что выраженные острофазовые реакции, характеризующие бактериальные инфекции, ишемический некроз ткани и наиболее активные воспалительные состояния, обычно приводят к гораздо более высоким значениям CRP.Однако для новорожденных контрольные значения, связанные со здоровьем, ниже обычных пороговых значений. Кроме того, новорожденные могут быть неспособны производить большое количество белков острой фазы и реагировать на инфекцию меньшим увеличением CRP, чем взрослые.
Клиническая потребность в высокочувствительных анализах CRP была впервые признана в неонатальной педиатрической практике (71), и их недавняя разработка обещает дальнейшее повышение диагностической точности неонатальной инфекции. Однако перед внедрением новых тестов в повседневную неонатальную практику референтные интервалы CRP, устанавливаемые с помощью недавно разработанных тестов, необходимо сравнить с традиционными.В этом контексте требуются дальнейшие усилия по стандартизации, чтобы гарантировать, что высокочувствительные анализы CRP имеют необходимую точность при низких концентрациях CRP (97), особенно при рождении, когда верхние контрольные пределы CRP опускаются ниже обычных пороговых значений 3-5 мг / л. . С другой стороны, другой вопрос, заслуживающий обсуждения, — это возможность недооценки с помощью высокочувствительных анализов истинной концентрации CRP из-за эффекта прозоны (97). Таким образом, перед введением высокочувствительного анализа CRP в качестве стандартного индикатора более серьезного воспаления необходимо дальнейшее исследование для улучшения согласованности в более высоком диапазоне между различными методами.
Дополнительные потенциальные предостережения возникают из-за типа анализа, используемого для количественной оценки биомаркера. Например, использование разных типов анализов и разных антител в иммуноанализах на фактор некроза опухоли-α (TNF-α) может быть причиной расхождений между значениями TNF-α (98). Различные иммуноанализы, доступные для TNF-α, измеряют свободный (биоактивный) или связанный плюс свободный (общий) TNF-α. Таким образом, иммуноанализы могут обнаруживать не только биоактивный TNF-α, но также неактивные фрагменты, мономеры и полимеры; Связывание TNF-α с его растворимыми рецепторами (p55 или p75) также может мешать его определению с помощью иммуноанализа (98).Другие исследователи предпочли измерять TNF-α с помощью биоанализа (например, клеточная линия фибросаркомы мыши WEHI 164), потому что он может лучше отражать активность цитокина (то есть количество биоактивного TNF-α) in vivo, чем иммуноанализ (99).
Еще одним важным моментом является то, что методы должны воспроизводиться во времени и пространстве, а время оборота должно быть достаточным для удовлетворения требований клинической практики. Некоторые методы имеют автоматическое разбавление, тогда как другие требуют ручного разбавления, приготовленного в автономном режиме. В большинстве исследований диагностической ценности цитокинов в выявлении или исключении новорожденных с сепсисом использовался ручной иммуноферментный анализ (41) (100) (101).Для этого метода обычно требуется 2–4 часа. Несмотря на то, что ручной метод определения цитокинов быстрее, он не является клинически практичным, поскольку технические специалисты, компетентные в анализе цитокинов с помощью ELISA, должны быть доступны 24 часа в сутки. Даже если бы это было возможно, ошибка между наблюдателями была бы проблемой. Разработка легкодоступных автоматических анализов с быстрым временем выполнения важна для потенциально широкого клинического применения цитокинов.
Одна редко обсуждаемая проблема заключается в том, что только в последних отчетах представлены методы расчета показателей диагностической точности или проведения сравнений, сопровождаемых статистическими показателями их точности (т.е., 95% доверительные интервалы) (40) (85). Проблема является критической из-за относительно небольшого количества пациентов в каждом отчете, что, как следствие, может иметь большие доверительные интервалы.
Можем ли мы чему-нибудь научиться из определенных потенциальных методологических проблем, упомянутых выше? Из приведенного выше обсуждения ясно, что большие различия между исследованиями по методам (и результатам) исключают какой-либо значимый синтез, такой как метаанализ, всех опубликованных исследований. Как недавно предложил Эскобар (102), пора начать обсуждать методы, которые мы используем для измерения производительности тестов, а не просто то, как работает данный тест.Этот вопрос был предметом недавнего отчета о стандартах отчетности по диагностической точности (STARD) (103). Важной частью плана STARD является оценка его влияния на отчетность об исследованиях. Независимо от того, является ли отчет STARD шагом в правильном направлении к полному и точному сообщению об исследованиях диагностической точности у новорожденных, это новый сложный рубеж исследований.
Список литературы
1Klein JO. Бактериальный сепсис и менингит.Remington JS Klein JO ред.
Инфекционные болезни плода и новорожденного
2001
:943
-998 WB Saunders Philadelphia. .2Гиббс Р.С., Дафф П. Прогресс в патогенезе и лечении клинической интраамниотической инфекции.
Am J Obstet Gynecol
1991
;164
:1317
-1326,3Чарльз Д., Эдвардс WR. Инфекционные осложнения цервикального серкляжа.
Am J Obstet Gynecol
1981
;141
:1065
-1071.4Фейгин М., Амиэль А., Канети Х., Бен-Нун И., Бейт Ю. Фульминантный сепсис, вызванный β-гемолитическими стрептококками группы B, после трансцервикального отбора проб ворсинок хориона [Письмо].
Clin Infect Dis
1993
;17
:142
-143,5Wilkins I., Mezrow G, Lynch L, Bottone EJ, Berkowitz RL. Амнионит и опасный для жизни респираторный дистресс после чрескожного забора пуповинной крови.
Am J Obstet Gynecol
1989
;160
:427
-428.6Берниршке К. Пути и типы инфекции у плода и новорожденного.
Am J Dis Child
1960
;99
:714
-721,7St. Geme JW, Jr, Murray DL, Carter J, Hobel CJ, Leake RD, Anthon BF и др. Перинатальная бактериальная инфекция после длительного разрыва амниотических оболочек: анализ риска и лечение.
J Pediatr
1984
;104
:608
-613,8Blanc WA. Пути внутриутробного и раннего неонатального инфицирования: вирусный плацентит, бактериальный и грибковый хориоамнионит.
J Pediatr
1961
;59
:473
-496,9Hillier SL, Krohn MA, Kiviat NB, Watts DH, Eschenback DA. Микробиологические причины и неонатальные исходы, связанные с хориоамнионной инфекцией.
Am J Obstet Gynecol
1991
;165
:955
-961,10Йодер П.Р., Гиббс Р.С., Бланко Д.Д., Кастанеда Ю.С., Сент-Клер П.Дж. Проспективное контролируемое исследование материнских и перинатальных исходов после доношенной внутриамниотической инфекции.
Am J Obstet Gynecol
1983
;145
:695
-701,11Prober CG. Клинический подход к инфицированному новорожденному. Лонг СС Пикеринг Л.К. Пробер CG ред.
Принципы и практика детских инфекционных болезней
1997
:603
-606 Черчилль Ливингстон Нью-Йорк. .12Sáez-Llorens X, McCracken GH, Jr. Перинатальные бактериальные заболевания. Фейгин RD Cherry JD ред.
Учебник детских инфекционных болезней
1998
:892
-926 WB Saunders Philadelphia..13Freedman RM, Baltimore R. Fatal Streptococcus viridans сепсис и менингит: связь с мониторингом электродов на черепе плода.
J Perinatol
1990
;10
:272
-274.14Саез-Льоренс X, Маккракен Г. Х., младший. Синдром сепсиса и септический шок в педиатрии: современные концепции терминологии, патофизиологии и лечения.
J Pediatr
1993
;123
:497
-508,15Саес-Льоренс Х, Лагрутта Ф.Острая фаза реакции хозяина при бактериальных инфекциях у детей.
Pediatr Infect Dis J
1993
;12
:83
-87,16Baltimore RS. Неонатальные внутрибольничные инфекции.
Семин Перинатол
1998
;22
:25
-32,17Харрис Дж.А.С., Гольдманн Д.А. Инфекции, приобретенные в питомнике: эпидемиология и борьба. Remington JS Klein JO ред.
Инфекционные болезни плода и новорожденного
2001
:1371
-1418 WB Saunders Philadelphia..18Столл Б.Дж., Гордон Т., Коронес С.Б., Шанкаран С., Тайсон Дж. Э., Бауэр С. Р. и др. Ранний сепсис у новорожденных с очень низкой массой тела при рождении: отчет Национального института здоровья детей и развития человека неонатальной исследовательской сети.
J Pediatr
1996
;129
:72
-80,19Столл Б.Дж., Гордон Т., Коронес С.Б., Шанкаран С., Тайсон Дж. Э., Бауэр С. Р. и др. Поздний сепсис у новорожденных с очень низкой массой тела при рождении: отчет Сети неонатальных исследований Национального института здоровья ребенка и человеческого развития.
J Pediatr
1996
;129
:63
-71.20Hauth JC, Меренштейн, Великобритания. Инфекционный контроль. Hauth JC Merenstein GB eds.
Руководство по перинатальной помощи
1997
:251
-277 Американская академия педиатрии и Американский колледж акушеров и гинекологов Elk Grove Village, IL. .21Бейкер CJ. Стрептококковые инфекции группы B.
Clin Perinatol
1997
;24
:59
-70.22Schrag SJ, Zywicki S, Farley MM, Reingold AL, Harrison LH, Lefkowitz LB, et al. Стрептококковая инфекция группы В в эпоху антибиотикопрофилактики во время родов.
N Engl J Med
2000
;342
:15
-20,23Вендел Г.Д., младший, Левено К.Дж., Санчес П.Дж., Джексон Г.Л., Макинтайр Д.Д., Сигел Д.Д. Профилактика неонатальной стрептококковой инфекции группы B: комбинированный протокол в родах и новорожденных.
Am J Obstet Gynecol
2002
;186
:618
-626.24Schrag SJ, Zell ER, Lynfield R, Roome A, Arnold KE, Craig AS, et al. Популяционное сравнение стратегий профилактики стрептококковой инфекции группы B с ранним началом у новорожденных.
N Engl J Med
2002
;347
:233
-239,25Towers CV, Briggs GG. Дородовое применение антибиотиков и ранний неонатальный сепсис: следующие 4 года.
Am J Obstet Gynecol
2002
;187
:495
-500,26Столл Б.Дж., Хансен Н., Фанаров А.А., Райт Л.Л., Карло В.А., Эренкранц Р.А. и др.Изменения в патогенных микроорганизмах, вызывающие ранний сепсис у младенцев с очень низкой массой тела при рождении.
N Engl J Med
2002
;347
:240
-247.27Fowlie PW, Schmidt B. Диагностические тесты на бактериальную инфекцию от рождения до 90 дней — систематический обзор.
Arch Dis Child Fetal Neonatal Ed
1998
;78
:F92
-F98.28Mehr S, Doyle LW. Цитокины как маркеры бактериального сепсиса у новорожденных: обзор.
Pediatr Infect Dis J
2000
;19
:879
-887.29Малик А., Хуэй С.П., Пенни Р.А., Кирпалани Х. Помимо полного подсчета клеток крови и С-реактивного белка. Систематический обзор современных диагностических тестов неонатального сепсиса.
Arch Pediatr Adolesc Med
2003
;157
:511
-516,30Weinberg GA, Powel KR. Лабораторные средства диагностики неонатального сепсиса. Remington JS Klein JO ред.
Инфекционные болезни плода и новорожденного
2001
:1327
-1344 WB Saunders Philadelphia..31Gotoff SP. Инфекции новорожденного. Behrman RE Kliegman RM Jenson HB eds.
Учебник педиатрии Нельсона
2000
:538
-552 У. Б. Сондерс Филадельфия. .32. Члены Комитета по консенсусной конференции Американского колледжа грудных врачей / Общества реаниматологов. Консенсусная конференция Американского колледжа грудных врачей / Общества реаниматологов: определения сепсиса и органной недостаточности и руководящие принципы использования инновационных методов лечения сепсиса.
Crit Care Med
1992
;20
:864
-874,33Angus DC, Wax RS. Эпидемиология сепсиса: обновленная информация.
Crit Care Med
2001
;29
(Suppl):S109
-S116.34Леви М.М., Финк М.П., Маршалл Дж.С., Абрахам Э., Ангус Д., Кук Д. и др. 2001 SCCM / ESICM / ACCP / ATS / SIS Международная конференция по определениям сепсиса.
Crit Care Med
2003
;31
:1250
-1256.35Сквайр Э., Фавара Б., Тодд Дж. Диагностика неонатальной бактериальной инфекции: гематологические и патологические данные в летальных и нефатальных случаях.
Педиатрия
1979
;64
:60
-64,36Pourcyrous M, Bada HS, Korones SB, Baselski V, Wong SP. Значение серийных ответов C-реактивного белка при неонатальной инфекции и других заболеваниях.
Педиатрия
1993
;92
:431
-435,37Benitz WE, Han MY, Madan A, Ramachandra P.Серийные уровни С-реактивного белка в сыворотке при диагностике неонатальной инфекции.
Педиатрия
1998
;102
:e41
.38Франц А.Р., Крон М., Поландт Ф., Штайнбах Г. Сравнение прокальцитонина с интерлейкином 8, С-реактивным белком и дифференциальным подсчетом лейкоцитов для ранней диагностики бактериальных инфекций у новорожденных.
Pediatr Infect Dis J
1999
;18
:666
-671,39Franz AR, Steinbach G, Kron M, Pohlandt F.Снижение ненужной антибиотикотерапии у новорожденных с использованием интерлейкина-8 и С-реактивного белка в качестве маркеров бактериальных инфекций.
Педиатрия
1999
;104
:447
-453,40Nupponen I, Andersson S, Järvenpää A-L, Kautiainen H, Repo H. Экспрессия нейтрофилов CD11b и циркулирующий интерлейкин-8 как диагностические маркеры для раннего неонатального сепсиса.
Педиатрия
2001
;108
:e12
.41Buck C, Bundschu J, Gallati H, Bartmann P, Pohlandt F. Интерлейкин-6: чувствительный параметр для ранней диагностики неонатальной бактериальной инфекции.
Педиатрия
1994
;93
:54
-58.42Мессер Дж., Эйер Д., Донато Л., Галлати Х., Матис Дж., Симеони У. Оценка интерлейкина-6 и растворимых рецепторов фактора некроза опухоли для ранней диагностики неонатальной инфекции.
J Pediatr
1996
;129
:574
-580.43Панеро А., Пасифико Л., Росси Н., Манкузо Г., Стеганьо М., Кьеза С. Интерлейкин 6 у новорожденных с ранним и поздним началом инфекции.
Pediatr Infect Dis J
1997
;16
:370
-375,44Грелла MJ. С-реактивный белок для определения продолжительности антибактериальной терапии у младенцев с подозрением на сепсис [Письмо].
Педиатрия
1997
;100
:900
.45Апгар В. Предложение по новому методу оценки состояния новорожденного.
Curr Res Anesth Analg
1953
;32
:260
-267,46Шмидт Б., Кирпалани Х., Розенбаум П., Кадман Д. Сильные и слабые стороны шкалы Апгар: критическая оценка.
J Clin Epidemiol
1988
;41
:843
-850,47Jepson HA, Talashek ML, Tichy AM. Оценка по шкале Апгар: эволюция, ограничения и рекомендации по выставлению оценок.
Дата рождения
1991
;18
(Дополнение 2):S83
-S92.48Маррин М., Паес Б.А. Асфиксия при рождении: имеет ли оценка по шкале Апгар диагностическое значение?
Obstet Gynecol
1988
;72
(Дополнение 1):S120
-S123.49Knaus WA, Zimmerman JE, Wagner DP, Draper EA, Lawrence DE. APACHE-оценка острой физиологии и хронического здоровья: система классификации, основанная на физиологии.
Crit Care Med
1981
;9
:591
-597,50Pollack MM, Ruttimann UE, Getson RR.Оценка педиатрического риска смертности (PRISM).
Crit Care Med
1988
;16
:1110
-1116,51Ричардсон Д., Тарнов-Морди В.О., Ли СК. Корректировка рисков для улучшения качества.
Педиатрия
1999
;103
(Дополнение 1):S255
-S265.52. Международная неонатальная сеть. CRIB (индекс клинического риска для младенцев) — инструмент для оценки начального неонатального риска и сравнения эффективности неонатальных отделений интенсивной терапии.
Ланцет
1993
;342
:193
-198,53Ричардсон Д.К., Грей Дж. Э., Маккормик М.С., Уоркман К., Гольдманн Д.А. Оценка для неонатальной острой физиологии: индекс физиологической тяжести для неонатальной интенсивной терапии.
Педиатрия
1993
;91
:617
-623,54Эскобар Г.Дж., Фишер А., Ли Д.К., Кремерс Р., Армстронг М.А. Оценка острой физиологии новорожденных: валидация в трех отделениях интенсивной терапии новорожденных Kaiser Permanente.
Педиатрия
1995
;96
:918
-922,55Petridou E, Richardson DK, Dessypris N, Malamitsi-Puchner A, Mantagos S, Nicolopoulos D, et al. Прогнозирование исходов в отделениях интенсивной терапии новорожденных Греции с использованием шкалы неонатальной острой физиологии (SNAP).
Педиатрия
1998
;101
:1037
-1044,56Поллак М.М., Кох М.А., Бартель Д.А., Рапопорт I, Дханиредди Р., Эль-Мохандес А.А. и др. Сравнение моделей прогнозирования риска неонатальной смертности у младенцев с очень низкой массой тела при рождении.
Педиатрия
2000
;105
:1051
-1057,57Ричардсон Д.К., Фиббс К.С., Грей Дж. Э., Маккормик М.С., Уоркман-Дэниелс К., Гольдманн Д.А. Вес при рождении и тяжесть болезни: независимые предикторы неонатальной смертности.
Педиатрия
1993
;91
:969
-975,58Ричардсон Д.К., Коркоран Д.Д., Эскобар Г.Дж., Ли СК. SNAP-II и SNAPPE-II: упрощенные оценки тяжести заболевания новорожденных и риска смертности.
J Pediatr
2001
;138
:92
-100.59Behrman RE, Shiono PH. Факторы неонатального риска. Fanaroff AA Martin RJ eds.
Неонатально-перинатальная медицина
2002
:17
-26 Сент-Мосби-Луи, Миссури. .60Van Lente F, Pippenger CE. Детская лаборатория неотложной помощи.
Pediatr Clin North Am
1987
;34
:231
-246.61Мизуно С. Гранулоцитарный колониестимулирующий фактор и неонатальная инфекция [Письмо].
J Pediatr
1997
;130
:844
-845.62Mathers NJ, Pohlandt F. Диагностический аудит C-реактивного белка при неонатальной инфекции.
Eur J Pediatr
1987
;146
:147
-151,63Айнбендер Э., Кабату Э., Гусман Д.М., Свит А.Ю. С-реактивный белок в сыворотке крови и проблемы новорожденных.
J Pediatr
1982
;101
:438
-440,64Speer CH, Bruns A, Gahr M. Последовательное определение CRP, α 1 -антитрипсина и гаптоглобина при неонатальной сепсисе.
Acta Paediatr Scand
1983
;72
:679
-683,65Pourcyrous M, Bada HS, Korones SB, Barrett FF, Jennings W., Lockey T. Реагенты острой фазы при неонатальной бактериальной инфекции.
J Perinatol
1991
;11
:319
-325.66Бергер С., Юлингер Дж., Гельфи Д., Блау Н., Фанкони С. Сравнение количества С-реактивного белка и лейкоцитов с дифференциалом у новорожденных с риском сепсиса.
Eur J Pediatr
1995
;154
:138
-144.67Sabel K-G, Wadsworth C. C-реактивный белок (CRP) в ранней диагностике неонатальной сепсиса.
Acta Paediatr Scand
1979
;68
:825
-831,68Шайн Б., Гулд Дж., Кэмпбелл С., Хиндоча П., Уилмот Р.П., Вуд CBS. С-реактивный белок сыворотки у здоровых и инфицированных новорожденных.
Clin Chim Acta
1985
;148
:97
-103,69Schmidt BK, Kirpalani HM, Corey M, Low DE, Philip AGS, Ford-Jones EL.Коагулазонегативные стафилококки как истинные патогены у новорожденных: когортное исследование.
Pediatr Infect Dis J
1987
;6
:1026
-1031,70Расин А., Абрибат Д., Энсергейкс Г., Лукас Й, Пук Дж. Б.. Значение анализа С-реактивного белка для ранней диагностики неонатальной инфекции в родильном отделении больницы общего профиля и педиатрическом отделении.
Ann Pediatr (Париж)
1989
;36
:253
-257,71Васунна А., Уайтлоу А., Галлимор Р., Хокинс П.Н., Пепис МБ.С-реактивный белок и бактериальная инфекция у недоношенных детей.
Eur J Pediatr
1990
;149
:424
-427.72Ishibashi M, Takemura Y, Ishida H, Watanabe K, Kawai T. Кинетика С-реактивного белка у новорожденных: применение высокочувствительного аналитического метода для ее определения [Техническое описание].
Clin Chem
2002
;48
:1103
-1106.73Gutteberg TJ, Haneberg B, Jorgensen T. Лактоферрин в отношении белков острой фазы в сыворотке крови новорожденных с тяжелыми инфекциями.
Eur J Pediatr
1984
;142
:37
-39.74Forest JC, Larivière F, Dolcé P, Masson M, Nadeau L. C-реактивный белок как биохимический индикатор бактериальной инфекции у новорожденных.
Clin Biochem
1986
;19
:192
-194.75Schouten-Van Meeteren NYN, Rietveld A, Moolenaar AJ, Van Bel F. Влияние перинатальных условий на продукцию C-реактивного белка.
J Pediatr
1992
;120
:621
-624.76Кьеза С., Синьор Ф, Ассумма М., Буффон Е, Трамонтоцци П., Осборн Дж. Ф. и др. Серийные измерения С-реактивного белка и интерлейкина-6 в ближайшем послеродовом периоде: референсные интервалы и анализ материнских и перинатальных факторов.
Clin Chem
2001
;47
:1016
-1022,77Манро Б.Л., Вайнберг А.Г., Розенфельд К.Р., Браун Р. Анализ крови новорожденных при оценке здоровья и болезни. I. Референтные значения для нейтрофильных клеток.
J Pediatr
1979
;95
:89
-98.78Эскобар GJ. Неонатальное «обследование на сепсис»: личные размышления о развитии научно обоснованного подхода к инфекциям новорожденных в организациях управляемой медицинской помощи.
Педиатрия
1999
;103
(Дополнение 1):S360
-S373.79Schelonka RL, Yoder BA, desJardins SE, Hall RB, Butler TJ. Количество периферических лейкоцитов и лейкоцитарные индексы у здоровых новорожденных доношенных детей.
J Pediatr
1994
;125
:603
-606.80Щелонка Р.Л., Йодер Б.А. Подсчет и дифференциал лейкоцитов: его использование и неправильное использование.
Contemp Pediatr
1996
;13
:124
-141,81Кристенсен Р.Д., Ротштейн Г. Подводные камни при интерпретации количества лейкоцитов новорожденных.
Am J Clin Pathol
1979
;72
:608
-611,82Шелонка Р.Л., Йодер Б.А., Холл РБ. Подсчет полосовых нейтрофилов у новорожденных [Письмо: Ответ].
J Pediatr
1995
;126
:505
-506.83Филип АГС, Хьюитт-младший. Ранняя диагностика неонатального сепсиса.
Педиатрия
1980
;65
:1036
-1041,84Филип АГС, Миллс ПК. Использование C-реактивного белка для минимизации воздействия антибиотиков: опыт работы с младенцами, изначально поступившими в детские ясли.
Педиатрия
2000
;106
:e4
,85Кьеза К., Пеллегрини Г., Панеро А., Осборн Дж. Ф., синьор Ф, Ассумма М. и др. С-реактивный белок, интерлейкин-6 и прокальцитонин в ближайшем послеродовом периоде: влияние тяжести заболевания, статуса риска, антенатальных и перинатальных осложнений и инфекции.
Clin Chem
2003
;49
:60
-68,86Ассумма М., Синьор Ф, Пасифико Л., Росси Н., Осборн Дж. Ф., Кьеза С. Концентрации прокальцитонина в сыворотке у доношенных матерей и их здоровых потомков: долгосрочное исследование.
Clin Chem
2000
;46
:1583
-1587,87Гендрел Д., Ассикот М., Раймонд Дж., Мулен Ф., Франсуаль С., Бадуаль Дж и др. Прокальцитонин как маркер ранней диагностики неонатальной инфекции.
J Pediatr
1996
;128
:570
-573,88Monneret G, Labaune JM, Isaac C, Bienvenu F, Putet G, Bienvenu J. Уровни прокальцитонина и С-реактивного белка при неонатальных инфекциях.
Acta Paediatr
1997
;86
:209
-212,89Lapillonne A, Basson E, Monneret G, Bienvenu J, Salle BL. Отсутствие специфичности прокальцитонина для диагностики сепсиса у недоношенных детей [Письмо].
Ланцет
1998
;351
:1211
-1212.90Sachse C, Dressler F, Henkel E. Повышенный уровень прокальцитонина в сыворотке у новорожденных без инфекции [Краткое техническое описание].
Clin Chem
1998
;44
:1343
-1344.91Петцольд Л., Гибурденш Дж., Буассино С., Бенуа Дж. Ф., Лутон Д., Демелье Дж. Ф. и др. Приложение прокальцитонина для диагностики материнских инфекций.
Ann Biol Clin (Париж)
1998
;56
:599
-602.92Maire F, Héraud MC, Loriette Y, Normand B, Bègue RJ, Labbé A.Intérêt de la procalcitonine dans les néonatales.
Arch Pédiatr
1999
;6
:503
-509,93Müller MM. Внедрение справочных систем в лабораторной медицине.
Clin Chem
2000
;46
:1907
-1909.94Феликс Н.С., Накадзима Х., Каган Б.М. С-реактивный белок сыворотки при инфекциях в течение первых шести месяцев жизни.
Педиатрия
1966
;37
:270
-277.95Мануча В., Русиа Ю., Сикка М., Фариди М.М.А., Мадан Н. Полезность гематологических параметров и С-реактивного белка в выявлении неонатального сепсиса.
J Детский педиатр
2002
;38
:459
-464.96Hanson LA, Jodal U, Sabel K-G, Wadsworth C. Диагностическая ценность С-реактивного белка.
Pediatr Infect Dis
1983
;2
:87
-89,97Робертс В.Л., Моултон Л., Ло Т.К., Фэрроу Г., Купер-Андерсон М., Сэвори Дж. И др.Оценка девяти автоматизированных методов высокочувствительного С-реактивного белка: значение для клинических и эпидемиологических приложений. Часть 2.
Clin Chem
2001
;47
:418
-425,98Whiteside TL. Измерения цитокинов и интерпретация анализов цитокинов при заболеваниях человека.
J Clin Immunol
1994
;14
:327
-339,99Beckmann I, Visser W, Struijk PC, van Dooren M, Glavimans J, Wallenburg HC.Циркулирующая биоактивная молекула фактора некроза опухоли-α, рецепторы фактора некроза опухоли-α, фибронектин и молекула адгезии клеток фактора некроза опухоли-α VCAM-1 при неосложненной беременности.
Am J Obstet Gynecol
1997
;177
:1247
-1252.100de Bont ES, Martens A, van Raan J, Samson G, Fetter WP, Okken A и др. Диагностическая ценность плазменных уровней фактора некроза опухоли α (TNF α) и интерлейкина-6 (IL-6) у новорожденных с сепсисом.
Acta Paediatr
1994
;83
:696
-699.101Küster H, Weiss M, Willeitner AE, Detlefsen S, Jeremias I, Zbojan J, et al. Антагонист рецептора интерлейкина-1 и интерлейкин-6 для ранней диагностики неонатального сепсиса за 2 дня до клинических проявлений.
Ланцет
1998
;352
:1271
-1277.102Escobar GJ. Влияние системной воспалительной реакции на биохимические маркеры неонатальной бактериальной инфекции: свежий взгляд на старые искажающие факторы [От редакции].
Clin Chem
2003
;49
:21
-22.103Bossuyt PM, Reitsma JB, Bruns DE, Gatsonis CA, Glasziou PP, Irwig LM, et al. На пути к полному и точному отчету об исследованиях диагностической точности: инициатива STARD.
Clin Chem
2003
;49
:1
-6.© 2004 Американская ассоциация клинической химии
| Понятия | Заболевание или синдром ( T047 ) |
| SnomedCT | 41229001, 206376005 |
| Английский | СЕПСИС новорожденных, сепсис новорожденных, сепсис новорожденных, сепсис новорожденных, сепсис новорожденных, сепсис новорожденных, сепсис новорожденных (диагностика), сепсис новорожденных, сепсис, неонатальный, сепсис новорожденных, сепсис новорожденных, сепсис новорожденных, сепсис новорожденных, сепсис новорожденных, сепсис новорожденных сепсис новорожденных, сепсис новорожденных, сепсис новорожденных, сепсис новорожденных, сепсис новорожденных, сепсис новорожденных, сепсис новорожденных, сепсис новорожденных (заболевание), сепсис новорожденных, сепсис новорожденных, сепсис новорожденных (заболевание), новорожденный; сепсис, сепсис; новорожденный |
| Итальянский | Сепси новорожденных |
| голландский | сепсис новорожденных, Pasgeborene; сепсис, сепсис; Pasgeborene, сепсис новорожденных |
| французский | Сепсис новорожденных, ETAT SEPTIQUE DU NOUVEAU-NE, Etat septique néonatal |
| немецкий | Sepsis neonatorum, SEPSIS NEUGEBORENES, Sepsis Neugeborenes |
| Испанский | Сепсис новорожденных, сепсис новорожденных, сепсис рецидивирующего нацидо, сепсис речевого нацидо (трасторно), речевой сепсис нацидо, сепсис неонатальный (трасторный), сепсис новорожденных, сепсис новорожденных |
| Японский | 新生 児 敗血症, シ ン セ イ ジ ハ イ ケ ウ |
| Португальский | СЕПСИС НЕОНАТАЛЬНЫЙ, Sépsis neonatal |
| Чешский | Новорозенецкий сепс |
| Венгерский | újszülöttkori sepsis, Sepsis neonatorum |

 От предотвратимых причин умерло 13% пациентов. При определении статистических различий средних величин массы тела при рождении и гестационного возраста (t-критерий Стьюдента) сравниваемые величины оказались статистически не значимы (p > 0,05).
От предотвратимых причин умерло 13% пациентов. При определении статистических различий средних величин массы тела при рождении и гестационного возраста (t-критерий Стьюдента) сравниваемые величины оказались статистически не значимы (p > 0,05). Кардинальное изменение этой ситуации находится за рамками полномочий врачей педиатров, и большое значение имеет улучшение жизненного уровня матерей. Для предупреждения инфекций, связанных с оказанием медицинской помощи детям, необходимо неукоснительное соблюдение санитарно-эпидемиологических требований, изложенных в СанПиН (2.1.3.2630–10).
Кардинальное изменение этой ситуации находится за рамками полномочий врачей педиатров, и большое значение имеет улучшение жизненного уровня матерей. Для предупреждения инфекций, связанных с оказанием медицинской помощи детям, необходимо неукоснительное соблюдение санитарно-эпидемиологических требований, изложенных в СанПиН (2.1.3.2630–10).