Постгипоксическая энцефалопатия – Постгипоксическая энцефалопатия — симптомы и лечение
Постгипоксическая энцефалопатия — симптомы и лечение
Энцефалопатия – это патология, при которой происходит поражение мозга и гибель нейронов. Нередко она возникает при нарушении кровотока черепно-мозговой коробки и при недостаточном поступлении кислорода в кровь. Постгипоксическая энцефалопатия диагностируется у новорожденных и имеет не воспалительный характер.
У детей заболевание появляется из-за того, что во время внутриутробного развития было кислородное голодание. Патология может развиться и у взрослого человека, хотя это и происходит достаточно редко. Болезнь можно заподозрить по характерным симптомам, после чего нужно начать профессиональное лечение.
Характеристика патологии
Постгипоксическая энцефалопатия не появляется из-за инфекции или воспаления, но при этом она ведёт к дистрофии тканей головного мозга. Поражение происходит из-за того, что наблюдалась острая нехватка кислорода. Из-за гипоксии нервные клетки, которые называются нейронами, находились в гипоксическом шоке. Из-за нарушения они погибают, что ведёт к различным расстройствам в работе ЦНС.
Нельзя однозначно сказать, какие отклонения будут у конкретного пациента. Многое зависит от того, какая область мозга получила ущерб. Может быть нарушено ощущение и восприятие, встречаются неполадки с работой внутренних органов, у больных бывают расстройства двигательной функции.
Кислородное голодание может возникнуть по разным причинам. Например, после удушения или из-за сильной кровопотери. Независимо от того, затронула патология взрослого человека или ребёнка, нужно своевременно предпринять меры. При отсутствии лечения могут наступить серьёзные и необратимые осложнения.
Виды
Перинатальная гипоксическая энцефалопатия включает в себя различные виды патологии. При диагностике важно выделить конкретный тип, чтобы было понятно, какое лечение потребуется начать.
Заболевание имеет следующие виды:
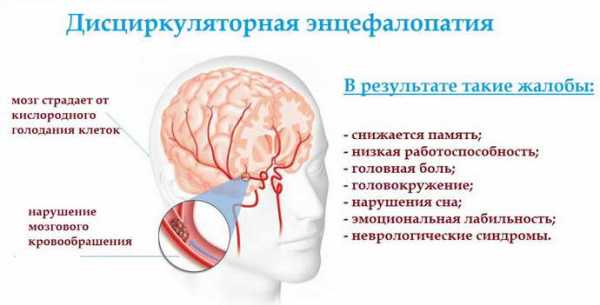
- Дисциркуляторная постгипоксическая энцефалопатия. Поражение мозга происходит в том случае, если нарушено кровоснабжение. Подобное бывает при высоком внутричерепном давлении, сосудистой дистонии, гипертонии и остеохондрозе.
- Ишемическая энцефалопатия. Она выявляется в том случае, когда присутствует плохое кровоснабжение головы, имеются деструктивные процессы, которые происходит в конкретных очагах. Подобная форма нередко возникает у курильщиков, у любителей алкоголя и у людей, постоянно переживающих стрессы.
- Резидуальный тип. Данный диагноз ставится, если из-за полученных травм возникают инфекции и воспаление, а также ухудшается кровообращение. Для этого вида характерны следующие симптомы: постоянная головная боль, нарушения психики, ухудшение интеллекта, проблемы с обучаемостью. Чаще всего данная форма выявляется у детей, которые получили травмы при родах.
- Лучевая энцефалопатия. Болезнь начинается из-за того, что на черепно-мозговую коробку было оказано негативное воздействие ионизирующего излучения.
- Токсический вид. Возникает при отравлении мозга ядовитыми веществами. Может быть при интоксикации химическими лекарствами, алкоголем и при инфекциях. Если мозг сильно отравляется, тогда могут начаться припадки эпилепсии.
- Энцефалопатия смешанного генеза. У человека наблюдается множество симптомов, из-за чего невозможно без проведения анализов и обследований предположить диагноз.
При гипоксической энцефалопатии важно своевременно предпринять меры, потому как без лечения она будет прогрессировать. Если поначалу симптомы не сильно тревожат пациента, то со временем они усиливаются и мешают поддерживать нормальный образ жизни. По этой причине требуется своевременная диагностика, которая позволит не допустить необратимые осложнения.
Симптомы
Признаки энцефалопатии зависят во многом от того, на какой стадии находится болезнь, а также какие причины её вызвали. Следует знать распространённые симптомы для того, чтобы вовремя заподозрить патологию головного мозга.
При лёгкой тяжести болезни отмечаются следующие признаки:
- Незначительно повышен тонус мышц.
- Наблюдается слабый рефлекс сосания у новорожденных.
- Присутствует повышенная раздражительность или плаксивость.
- Ребёнок спит больше положенного и выглядит вялым.
Как правило, на протяжении первой недели данные симптомы должны пропасть у ребёнка. В этом случае родителям не стоит переживать, но в любом случае нужно обратиться к врачу.

Симптомы болезни средней тяжести:
- Судороги.
- Отсутствие сосательного и хватательного рефлекса.
- Сильная вялость малыша.
- Остановка дыхания, которая проходит за короткое время.
- Гипотония мышц.
Достаточно сложно сделать точный прогноз при энцефалопатии средней степени тяжести. Негативные признаки могут полностью пропасть за первые две недели жизни. Также они могут ухудшиться, причём усиление симптомов наблюдается даже после периода ремиссии. Лечение должно проходить исключительно в условиях стационара, если родители хотят достичь положительного эффекта.

При тяжёлой патологии наблюдаются следующие проявления:
- Ребёнок не реагирует на внешние раздражители.
- Малыш находится в коме, либо в ступоре.
- Часто останавливается дыхание, из-за чего приходится подключать к малышу специальный аппарат для поддержания дыхательной функции.
- Нет реакции на свет, при этом зрачки постоянно расширены.
- Может присутствовать отек мозга, при котором повышается артериальное давление и вздувается родничок.
- Наблюдается аритмия.
При тяжёлой форме гипоксической энцефалопатии у новорожденного могут быть нарушения работы разных органов. Лечение осуществляется исключительно под врачебным контролем. Если родители не обратятся в больницу, тогда есть большая вероятность летального исхода.
У взрослых людей может присутствовать боль в голове, нарушение сознания, бесконтрольное испражнение, сниженная активность, постоянная сонливость. Также может наблюдаться нарушение координации, судороги и постоянная тошнота. Ишемическая энцефалопатия и другие виды патологии не должны проходить без контроля врача.
Только доктор сможет однозначно сказать, насколько опасно состояние пациента в конкретном случае. Если без лечения не обойтись, тогда доктор обязательно его назначит.
Причины
Постгипоксическая энцефалопатия является достаточно распространённым заболеванием. Причины появления зависят от того, когда именно появилась патология. Если проблема диагностирована у новорожденного, тогда можно выделить следующие провоцирующие факторы.
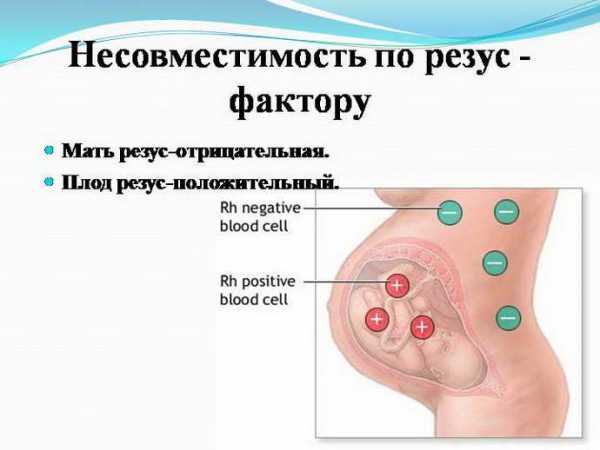
Недостаток кислорода мог возникнуть из-за сердечной недостаточности у матери, либо из-за сахарного диабета 1 и 2 типа. При приёме никотина, спиртных напитков или наркотиков во время беременности можно наблюдать различные отклонения у плода, в том числе энцефалопатию. Причиной патологии также становится несовместимость резус-фактора эмбриона и матери. Недостаток кислорода нередко наблюдается при многоплодной беременности.
Заболевание часто диагностируется у детей, которые были рождены позже назначенного срока, либо появились на свет недоношенными. Заболевание может появиться непосредственно в процессе родов. Оно возникает из-за значительной кровопотери, пережатия шеи пуповиной, неправильного положения младенца, либо из-за стимуляции родового процесса.
Если же энцефалопатия была приобретённой в первую неделю жизни, тогда причиной этому может быть порок сердца, либо патология дыхания. Если говорить о взрослых людях, то у них болезнь появляется из-за плохого обеспечения мозга кровью, удушения, серьёзной травмы головы и инфаркта. Имеет место быть наследственный фактор, поэтому, если у родственников диагностировали энцефалопатию, тогда стоит внимательнее относиться к своему здоровью и при появлении симптомов проверяться у врача.
Как проходит диагностика
Перед лечением перинатальнойгипоксической энцефалопатии специалисты проводят диагностику. Она необходима для того, чтобы можно было поставить однозначный диагноз. При помощи специальных обследований можно понять, какой патологией были вызваны симптомы. Также важно определить её вид и степень тяжести, от этого зависит схема терапии.
Для начала врач обращает внимание на имеющиеся симптомы. Если они напоминают энцефалопатию, тогда он направляет на исследования. Может потребоваться пройти электроэнцефалографию, чтобы выявить имеющиеся нарушения. Вполне возможно, что есть отклонения от нормативов альфа-ритма, либо имеются признаки эпилептической активности.
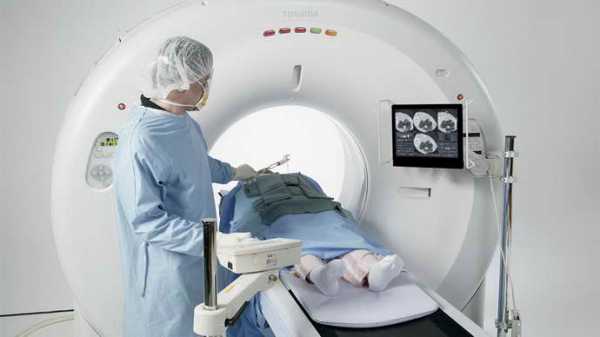
Необходимо провести компьютерную томографию для того, чтобы изучить состояние черепно-мозговой коробки. При исследовании можно обнаружить дилатацию желудочков мозга, а также диффузно-атрофические изменения. Специалист может направить на магнитно-резонансную томографию с целью обнаружить ишемический очаг в сером или белом веществе.
В дополнение могут назначить анализ крови, мочи и кала, но данные анализы мало о чём расскажут при подозрениях на постгипоксическую энцефалопатию. Они позволят проанализировать общее состояние человека и наличие других отклонений. При необходимости доктор может повторно назначить все анализы и исследования, чтобы проверить эффективность лечения.
Принципы терапии
При выявлении гипоксической энцефалопатии назначают комплексные меры для того, чтобы добиться наилучшего результата. Используются лекарственные препараты, а также немедикаментозное лечение.
Если у пациента патология хотя бы средней тяжести, ему придётся остаться в стационаре. Терапия будет достаточно длительной, поэтому придётся запастись терпением.
Проводится тщательный контроль над невралгическими расстройствами для устранения негативных последствий. Необходимо решить проблемы, вызванные отклонениями в кровоснабжении. Речь идёт про ишемию, пережатие сосудов, гипертензию. Важно позаботиться о лечении расстройств сердечно-сосудистой системы. При необходимости проводится коррекция химической составляющей крови.
Врачи назначают антигипоксанты, такие как Мексикор, Неотон и Актовегин. Рекомендуется использовать ноотропные средства, стимуляторы обмена веществ и антиоксиданты. Кроме медикаментов, добавляются в рацион продукты, которые содержат клетчатку, витамин E и C. Подойдёт виноград, киви, орехи и ягоды красного цвета. Данные продукты можно использовать только для взрослых людей и детей, которым они уже разрешены по возрасту.
Пациентам рекомендовано больше отдыхать и проводить время на свежем воздухе. Перенапряжение в период болезни не допустимо, потому как оно может лишь усугубить ситуацию. По разрешению врача можно выполнять умеренную физическую нагрузку, благодаря которой будет усиливаться кровоток, и увеличиваться объём постигаемого кислорода в мозг.
Состояние пациента обязательно должен контролировать врач, потому как нужно следить за эффективностью лечения. При необходимости придётся пересмотреть методы лечения.
Прогноз
При появлении постгипоксической ишемической энцефалопатии, либо иной формы недуга сложно сделать прогноз. Многое зависит от степени тяжести болезни, от методов лечения, а также от своевременности терапии. Если возникли осложнения, тогда становится сложнее однозначно сказать, чем закончится заболевание.
Когда судороги и иные неврологические симптомы сохраняются больше двух недель, врачи делают неблагоприятный прогноз. Есть риск, что ребёнок будет отставать в развитии. Также возможна кома, проблемы с дыханием и отёк мозга. В такой ситуации существует вероятность летального исхода.

Когда заболевание лёгкой степени тяжести, симптомы проходят самостоятельно в течение недели. Состояние ребёнка должно нормализоваться, а каких-либо отклонений появиться не должно. Если же правильное лечение при средней степени тяжести отсутствовало, тогда может появиться ДЦП, гидроцефалия головного мозга, а также задержка умственного развития и эпилептические припадки.
Постгипоксическая ишемическая энцефалопатия у взрослых приводит к тому, что после лечения может наблюдаться головокружение, повышенная утомляемость, депрессия, а также проблемы со сном. Могут быть расстройства памяти, ухудшение умственной активности, а также патология речи. Чтобы не допустить данных негативных проявлений, следует своервеменно лечить недуг.
Постгипоксическая энцефалопатия – это серьёзное заболевание, которое может при отсутствии терапии закончиться неблагоприятно. Нередко возникновение патологии можно предотвратить, если вести активный образ жизни, во время беременности заботиться о своём здоровье и состоянии плода, а также стараться избегать стрессовых ситуаций. При появлении характерных симптомов важно сразу обращаться к врачу.
nevrology.net
что это такое, признаки, лечение
Постгипоксическая энцефалопатия – состояние, которое характеризуется изменением структуры мозговой ткани и нарушением функций мозга вследствие перенесенного кислородного голодания. Прогрессирование дегенеративных изменений в мозговом веществе коррелирует с задержкой умственного и физического развития детей. Последствия повреждения тканей ЦНС в перинатальный период – основная причина развития неврологических нарушений у пациентов раннего детского возраста. Одно из осложнений – ДЦП (церебральный паралич). Распространенность ПЭП (перинатальная энцефалопатия) гипоксического генеза составляет около 5% случаев среди общего числа новорожденных.
Характеристика патологии
Перинатальная ишемическая энцефалопатия – повреждение мозга органического типа, связанное с дефицитом кислорода в клетках нервной ткани. Чаще кислородное голодание спровоцировано недостаточностью мозгового кровотока. Последствия патологического процесса не ограничиваются характерной симптоматикой в первые месяцы жизни.
Кислородное голодание мозговой ткани в период внутриутробного развития или в ходе родового процесса сказывается на функционировании мозга в дальнейшем. У детей, перенесших состояние гипоксии, часто возникают неврологические нарушения и изменение структуры мозговой ткани, что обнаруживается в ходе нейровизуализации.
Распространенное последствие – синдром церебральной гипертензии (стойкое повышение значений внутричерепного давления). Тяжесть последствий определяется характером и степенью повреждения мозга. При незначительных изменениях структуры мозгового вещества, нарушения у новорожденных детей в будущем могут проявляться неусидчивостью, невозможностью концентрировать внимание, гиперактивностью. При повреждениях тяжелой степени высока вероятность развития ДЦП.
Гипоксическая энцефалопатия у взрослых развивается на фоне перенесенных эпизодов кислородного голодания, которые ассоциируются с кратковременной остановкой дыхания или сердечной деятельности (терминальные состояния). Апноэ (кратковременное прекращение дыхания) возникает на фоне бронхиальной астмы или коклюша. Гипоксическое состояние у взрослых часто развивается при недостаточности мозгового кровотока, спровоцированной патологиями сердца или питающих мозг артерий.
Распространенные этиологические факторы, вызывающие гипоксические состояния у взрослых: асфиксия (удушье) из-за попадания в дыхательные пути инородных тел, утопление, паралич мускулатуры дыхательной системы вследствие отравления ядами или наркотическими веществами. Спровоцировать гипоксическое состояние может аллергическая реакция, сопровождающаяся отеком Квинке и сужением дыхательных путей.
Причины возникновения
Выявление причин гипоксии в перинатальный период сопряжено с трудностями. Обычно возникновение патологии связывают с осложнением течения беременности или родов. В 30% случаев новорожденным детям с гипоксически-ишемическими изменениями головного мозга ставят ошибочный диагноз.

Гипоксия ассоциируется с изменением реологических характеристик крови и с повреждением всех структур мозга, в том числе клеток нервной ткани и элементов кровеносной системы. Паталогические процессы приводят к масштабным органическим повреждениям, которые чаще носят диффузный характер.
Возникшие нарушения влияют на адаптацию организма младенца к окружающей среде, определяют степень тяжести течения заболевания и прогноз. Фетоплацентарная недостаточность, протекающая в хронической форме, и маловодие становятся причиной патологии в 15% случаев. Причины перинатальной энцефалопатии гипоксического генеза в 85% случаев связаны с болезнями, перенесенными матерью в период гестации:
- Анемия (дефицит гемоглобина, транспортирующего кислород в ткани), протекающая в хронической форме.
- Респираторно-вирусные инфекции.
- Артериальная гипертензия, носящая устойчивый характер.
- Соматические болезни, патологии ЦНС, протекающие в хронической форме.
В патогенезе немаловажную роль играет наследственная предрасположенность. В большинстве случаев у родителей и родственников грудничков с признаками поражения мозга гипоксической этиологии выявлялись цереброваскулярные патологии разных форм и генеза, в анамнезе многих из них значился инсульт.
Основные факторы, провоцирующие перинатальные поражения ЦНС у детей грудного возраста: внутриутробные инфекции (10%), эндокринные нарушения (8%), повреждения травматической природы (7%). Среди этиологических факторов, влияющих на развитие патологии у новорожденных, особое место занимает асфиксия, связанная с внутриутробной инфекцией, внутричерепным повреждением или родовой травмой.
Родовые травмы чаще ассоциируются с неправильным предлежанием плода или слабостью родовой деятельности (недостаточность интенсивности, длительности, периодичности сокращения мышц, выстилающих стенки матки). Токсико-гипоксическая энцефалопатия у взрослых и детей развивается на фоне отравления фармакологическими средствами и другими токсическими веществами.
Симптоматика
Симптомы ГИЭ у новорожденного обнаруживаются при помощи тестирования по шкале Апгар. Нередко в околоплодных водах обнаруживаются следы мекония (первые фекалии). Умеренная степень гипоксии может проявляться у новорожденного незначительно. Позже изменения, в том числе неврологический дефицит, обнаруживаются во время осмотра неврологом или планового УЗИ-исследования.

В некоторых случаях младенцу сразу требуется интенсивная терапия. Обычно наблюдаются клинические синдромы:
- Угнетения. Вялость, апатия, гиподинамия, мышечная гипотония, ослабление рефлексов.
- Коматозный. Врожденные рефлексы не возникают на болевые, световые и другие раздражители, атония (отсутствие тонуса мышц), отсутствие двигательной активности.
- Судорожный. Судороги тонико-клонического или тонического типа.
Признаки гипоксически-ишемической энцефалопатии у новорожденных выявляются в ходе инструментальной диагностики и визуального осмотра. Течение заболевания варьируется у разных пациентов. Обычно патология сопровождается оживлением рефлексов, повышенной нервной возбудимостью (спонтанная моторная активность, оживление коленных рефлексов, тремор конечностей). Параллельно выявляются признаки церебральной гипертензии:
- Набухание, выпирание родничка.
- Запрокидывание головы в направлении назад.
- Беспричинный, частый плач.
- Снижение аппетита, отказ от еды.
- Нарушение сна.
- Увеличение диаметра черепа.
- Горизонтальный нистагм.
- Косоглазие сходящегося (зрительная ось отклонена в направлении к носу) типа.
- Мышечная дистония (патологическое сокращение мышц, сопровождающееся непроизвольными движениями).
Для пациентов характерны периоды остановки дыхания во время сна (эпизоды апноэ), апатия, вялость. Пониженная концентрация гемоглобина, характерная для гипоксически-ишемического поражения головного мозга у новорожденных, усугубляет течение церебральной гипертензии. Длительно текущий патологический процесс провоцирует развитие тканевого отека. Клиническая картина (по данным нейросонографии) включает:
- Кровоизлияния перивентрикулярной (в области желудочковой системы) локализации (40% случаев).
- Расширение желудочков (20% случаев).
- Ишемическое поражение подкорковых (базальных) ядер (10% случаев).
- Изменения диффузного типа в мозговой ткани – ишемическое поражение мозгового вещества в области желудочковой системы, отек паренхимы (структуры, образованные нейронами).
Перивентрикулярное кровоизлияние в сочетании с ишемическим поражением подкорковых ядер выявляется с частотой около 16%. Перивентрикулярное кровоизлияние в сочетании с гидроцефалией и ишемией базальных ядер диагностируется с частотой 14%. Подобные нарушения свидетельствуют о функциональной недостаточности мозга и нарушении мозгового кровотока.
Гипоксическое состояние, спровоцированное отравлением фармацевтическими средствами, нейротропными ядами и другими токсическими веществами, у детей и взрослых сопровождается симптомами, обусловленными специфическим действием ядов и нарушением нервной регуляции на фоне повреждения нервных структур.
Основные признаки: расстройство сознания, протекающее по типу психоза, сбои в работе вегетативной системы, психомоторное возбуждение, судорожный синдром. Первичное нарушение сознания стремительно прогрессирует, трансформируясь в дефицитные формы (сопор, кома). Обычно при этом ослаблена или отсутствует реакция зрачка на свет.
Диагностика
Уровень сознания взрослых пациентов, перенесших гипоксию токсического генеза, оценивают по шкале Глазго, тяжесть нарушения интеллекта по шкале MMSE. Состояние и функциональность нервной системы определяется при помощи неврологических тестов и методов инструментальной диагностики. Лабораторные анализы показывают повышенную концентрацию малонового диальдегида и молочной кислоты в сыворотке крови. Для диагностики перинатальной гипоксически-ишемической энцефалопатии применяют инструментальные методы:
- УЗИ, нейросонография.
- Эхоэнцефалография, электроэнцефалография.
- МРТ, КТ.
- Реоэнцефалография.
- Церебральная ангиография.
В ходе инструментальной диагностики выявляются внутрижелудочковые кровоизлияния, повреждение мозговой ткани ишемического генеза преимущественно перивентрикулярной локализации, отек мозга. Анализ крови показывает снижение уровня гемоглобина – анемию разной степени тяжести.

Методы лечения
Лечение острого периода гипоксии у новорожденных предполагает проведение интенсивной терапии, которая включает аппаратную вентиляцию легких, применение препаратов антиоксидантного действия, корректоров тканевого метаболизма, антиконвульсантов. Параллельно проводится медикаментозная терапия, направленная на снижение проницаемости сосудистой стенки и устранение эффекта дегидратации.
Хирургическое лечение (перивентрикулярное шунтирование) показано при выраженном гидроцефальном синдроме в сочетании с перивентрикулярными кровоизлияниями. Восстановительное лечение младенцев проводится методом индуцированной гипотермии. Процедура представляет собой терапевтическое воздействие на показатели температуры тела новорожденного.
Основная цель – уменьшение риска развития ишемических процессов после перенесенного состояния кислородного голодания, связанного с эпизодом недостаточности кровообращения. Клинические исследования подтвердили уменьшение проявлений неврологической симптоматики после индуцированной гипотермии. Порядок проведения процедуры:
- Поддержание температуры тела новорожденного ребенка на уровне 33,5°С.
- Длительность воздействия – 72 часа.
- Начало процедуры – спустя 6 часов после рождения.
Один из передовых методов лечения, направленных на предотвращение ПЭП – внутривенное введение стволовых клеток (мононуклеарная фракция), полученных из пуповинной крови. Терапия способствует восстановлению клеток нервной ткани, стимулирует работу иммунной системы.
Лечение взрослых пациентов с диагнозом токсико-гипоксическая энцефалопатия на фоне отравления ядовитыми веществами проводится с учетом вида химического соединения, которое спровоцировало нарушения. Особое место занимает экстренная детоксикационная терапия, в том числе гемосорбция, гемофильтрация, плазмаферез, гемодиализ.
Прогноз и профилактика
Из-за серьезных последствий для здоровья ребенка большое значение приобретает профилактика гипоксически-ишемических процессов в период внутриутробного развития и профилактика асфиксии во время родов. Прогноз при гипоксических состояниях зависит от степени тяжести повреждений мозговых структур и выраженности неврологических нарушений.
Диагноз ГИЭ в младенческом возрасте коррелирует с такими патологиями, как мозговая дисфункция, ДЦП, эпилепсия. У взрослых постгипоксическая энцефалопатия становится причиной развития неврологического дефицита, ухудшения когнитивных способностей, слабоумия.
Просмотров: 40
golovmozg.ru
Что такое постгипоксическая энцефалопатия | Здоровье вашей головы
Гипоксия – это кислородное голодание. Более всего губительная гипоксия для головного мозга, так как он потребляет большое количество кислорода по сравнению с остальными тканями. В первую очередь повреждается кора головного мозга. Глубина повреждения мозгового вещества зависит от продолжительности бескислородного периода, от чего и будет зависеть дальнейший прогноз для восстановления мозговой деятельности и жизни человека в целом. Постгипоксическая энцефалопатия – поражение головного мозга, вызванное остановкой или недостаточностью системного кровообращения.
Различные отделы мозга по-разному реагируют на понижение содержания кислорода в крови. Например, наиболее чувствительны к гипоксии гиппокампальные структуры, кора головного мозга и мозжечка. Ствол головного мозга и подкорковые структуры менее подвержены кислородному голоданию.
Гипоксия головного мозга может возникнуть по разнообразным причинам: инсульт, инфаркт, механическая асфиксия (удушение), в послеоперационный период, особенно после оперативных вмешательствах на головном мозге, его сосудах, сердце, при геморрагическом шоке и т. д.
Основные проявления от легкого к тяжелому
Около половины пациентов перенесших, по тем или иным причинам клиническую смерть имеют стойкие неврологические нарушения. У 60-75% пациентов, даже с эффективной реанимацией в короткие сроки наблюдается различная выраженность проявления постгипоксической энцефалопатии. Считается, что для мозга губительная гипоксия более 4-5 минут.
Кратковременная клиническая смерть принесет лишь незначительные нарушения памяти, которые со временем самостоятельно регрессируют.
Еще более продолжительная гипоксия способствует развитию эпилептических припадков, миоклоний (судорожное подергивание определённых групп мышц), нарушений интеллектуально-мнестической деятельности до степени деменции (слабоумия), а также различные очаговые неврологические симптомы. Наиболее частыми проявлениями очаговой неврологической симптоматики при постгипоксической энцефалопатии будут глазодвигательные нарушения, псевдобульбарный и бульбарный синдромы (нарушение глотания, фонации и дикции), а также различные парезы и параличи.
В головном и спинном мозге существуют «слабые» зоны, их называют водораздельными или пограничными – это участки головного мозга, кровоснабжение которых осуществляется на стыке сосудистых бассейнов. Очень часто поражается зона на стыке кровоснабжения передней и средней мозговых артерий тогда возникает верхняя параплегия (полная обездвиженность в руках).
Редкие варианты постгипоксической энцефалопатии
Постгипоксическая кинетическая миоклония (синдром Ланса-Адамса)- проявляется сразу после восстановления сознания. Любое произвольное движение, сопровождается миоклониями. Помимо провокации действием, они могут провоцироваться шумом, светом и т. д. при этом интеллектуальные функции не страдают. Человек не может самостоятельно встать на ноги при сохранной мышечной силе, так как при вертикализации утрачивается мышечный тонус.
Отставленная постгипоксическая энцефалопатия – внезапно прерывает период улучшения. Состояние пациента, после перенесенной клинической смерти или механической асфиксии поначалу кажется стабильным. Но через определенный промежуток времени возникает общемозговая симптоматика в виде спутанности, апатии или психомоторного возбуждения. В очаговой симптоматике чаще всего превалируют симптомы поражения подкорковых ядер, что проявляется синдромом паркинсонизма (ригидность мышечного тонуса, походка мелкими шажками, согбенная поза и т. д.). Симптоматика неуклонно прогрессирует
Диагностика постгипоксической энцефалопатии
Важную роль играет анамнез – факт гипоксии и ее продолжительность. При выполнении ЭЭГ таким пациентам, могут обнаруживаться различные изменения в зависимости от тяжести состояния: от дезорганизации ритма, до признаков эпилептической активности. По данным СКТ головного мозга – будет расширение желудочковой системы и диффузные атрофические процессы. По результатам МРТ головного мозга можно определить типичные очаги ишемии в белом и сером веществе мозга.
Принципы лечения
При возникновении постгипоксической энцефалопатии лечение должно быть комплексным. В первую очередь направленное на восстановление функции мозга, для этого применяются вазоактивные препараты, нейрометаболиты, ноотропные средства, витаминотерапия. При развитии судорожного синдрома, миоклоний обязательно подбирается противосудорожная терапия. Помимо данных направлений обязательна лечебная физкультура ежедневно, по — возможности дыхательная гимнастика и т. д.
Адекватный водно-электролитный баланс, при необходимости его восполнение осуществляется путем инфузий. Терапия сопутствующих заболеваний. К сожалению, в большинстве случаев, несмотря на проводимые эффективные лечебные мероприятия, пациенты, перенесшие относительно длительную гипоксию остаются инвалидами.
Похожие записи
moyagolova.ru
Энцефалопатия — Википедия
Материал из Википедии — свободной энциклопедии
Энцефалопа́тия и энце́фалопати́я[3], также органи́ческое пораже́ние головно́го мо́зга[4] (от др.-греч. ἐγκέφαλος — головной мозг + πάθος — болезнь или страдание[5]) — общее название для невоспалительных (в отличие от энцефалита) заболеваний головного мозга. Энцефалопатия бывает врождённая и приобретённая (например, органические поражения головного мозга, связанные с отравлениями, инфекциями, алкоголизмом, травмами, гиповитаминозами, сосудистыми заболеваниями головного мозга, нехваткой витамина В₁). Энцефалопатия — заболевание, при котором дистрофически изменяется ткань мозга, что приводит к нарушению его функции.
Причины энцефалопатии:
Симптомы энцефалопатии[править | править код]
Симптомы энцефалопатии носят самый разнообразный характер.
Самыми частыми из симптомов энцефалопатии считаются:
Больные с подобными симптомами энцефалопатии часто жалуются на быструю утомляемость, раздражительность, рассеянность, слезливость, плохой сон, общую слабость.
При этом при их осмотре отмечается апатия, вязкость мысли, многословие, сужение круга интересов и критики, дневная сонливость, трудность произношения некоторых слов и другие симптомы энцефалопатии.
Диагностика энцефалопатии использует методики:
Лечение энцефалопатии носит длительный курсовой характер с учётом тяжести и стажа заболевания, а также возраста и сопутствующих болезней у пациента.
Диагностика энцефалопатии строится с учётом:
- Неврологического статуса
- Психологического статуса
- Результатов анализов:
- Данных МРТ головного мозга
Таких курсов лечения, которые проводятся как амбулаторно, так и в условиях стационара, требуется от 2 до 3 в течение года, в зависимости от тяжести энцефалопатии.
Методы лечения энцефалопатии:
Указанные методики лечения и лечебные действия применяются в зависимости от тяжести проявлений и причин энцефалопатии у пациента.
В каждом конкретном случае медикаментозная терапия назначается индивидуально в зависимости от:
- Причины, вызвавшей энцефалопатию
- Степени тяжести заболевания
- Преобладающих симптомов
ru.wikipedia.org
Постгипоксическая энцефалопатия — виды, симптомы, причины

Постгипоксическая энцефалопатия имеет особые группы риска, чаще всего патологией страдают новорожденные дети.
Диагностируется заболевание и у более старшей категории, не зависимо от возраста и гендерной принадлежности.
Термин «энцефалопатия» означает дистрофическое разрушение ткани мозга, а «постгипоксическая» указывает на развитие этого процесса после кислородного голодания.
Виды постгипоксической энцефалопатии
В зависимости от причины, по которой возникла гипоксия, выделяют следующие виды патологического процесса:
- Уровень кислорода в циркулирующей крови падает в результате нарушения первичной диффузии, т. е. прохождении воздуха из легочных альвеол в кровь. Такое нарушение может наблюдаться при сбоях в дыхании и/или работе сердца.
- При геморрагической анемии, когда в крови недостаточно гемоглобина для транспорта кислорода внутри организма, возникает гипоксическое состояния.
- Недостаточное поступление кислорода к плоду во время родов может привести к развитию энцефалопатии у новорожденного.
- Кислородное голодание тканей вследствие ишемии.
- Шоковые состояния на поздних стадиях, терминальные (преагония, агония) и коматозные состояния, а так же клиническая смерть могут привести к развитию постгипоксической энцефалопатии.
- Отравление эндо- и экзотоксинами.
Гипертензия может приводить к гибели нейронов мозга. Гипертензивная энцефалопатия — тяжелое заболевание, которое может закончиться летальным исходом.
При длительном употреблении алкоголя возникает поражение клеток мозга. О том, что такое алкогольная энцефалопатия и какими последствиями опасно заболевание, читайте тут.
Не вылеченные в детском возрасте патологии могут проявляться и у взрослых. Перинатальная энцефалопатия может привести к ишемической болезни сердца, а также повысить риск развития инсульта. Подробно о заболевании читайте в этой теме.
Стадии болезни
Начальный этап патологии, протекает практически бессимптомно и не диагностируется. Общий генез заболевания характерен как для младенцев, так и для взрослых:
- Компенсаторная стадия — инактивируются альтернативные процессы окисления в клетках головного мозга и включаются сукцинатоксидазное окисление без участия кислорода, однако на долго такой компенсации не хватает, и наступает следующая стадия.
- Декомпенсация — гипоксическое подавление работы нервных рецепторов. Компенсаторные системы организма изнашиваются и из-за кислородного голодания начинают проявляться первые заметные симптомы заболевания.
- Терминальная стадия — наступает гибель клеток головного мозга, что можно вызвать летальные исход.
МКБ-10
По МКБ-10 постгипоксическая энцефалопатия классифицируется как гипоксически-ишемическая энцефалопатия, что указывает на ишемию, как на причину развития гипоксии.
Причины возникновения
 Причиной может послужить осложнение родов, при несвоевременном отхождении плаценты, которая препятствует нормальному дыханию плода или при обматывании пуповины вокруг шеи ребенка.
Причиной может послужить осложнение родов, при несвоевременном отхождении плаценты, которая препятствует нормальному дыханию плода или при обматывании пуповины вокруг шеи ребенка.
Если же гипоксией во время родов страдает мать, например у нее произошла остановка работы сердца и дыхания, то неизбежно будет страдать плод, если вовремя не извлечь его из материнского организма.
Развитию гипоксии может способствовать сильная кровопотеря, которая влечет за собой шоковое состояние и последующие терминальные состояния. При этом происходить резкое снижение поступления кислорода сначала из-за кровопотери и спазма сосудов, затем из-за угнетения работы дыхательного центра, что наиболее опасно. Именно поэтому пострадавшим от сильных травм назначается кислородная терапия, как первая помощь.
Стоит отметить, что к возникновению терминальных состояний может приводить не только кровопотеря, но и другие тяжелые травмы и болезни.
Энцефалопатия может возникать из-за генетической предрасположенности. В таких случаях нужно пристально следить за свои здоровьем и при малейших нарушениях проходить обследования.
При продолжительной гипоксии с длительным развитием повреждений ЦНС, иногда диагностируются психические нарушения, такие как: делирия («белой горячки»), потеря памяти и ориентации, подмена событий реальных — на вымышленные, слабоумие.
Симптомы
Диагностировать патологию, можно в момент развития только таких форм как:- острая
- подострая
- хроническая.
Молниеносная форма заболевания может вызвать летальный исход, в течение минимального времени — до 2-х минут. Стремительность течения гипоксии, не позволяет в такие короткие сроки выявить явные клинические симптомы.
Острая форма — проявляется недостаточностью сразу всех систем организма, и в первую очередь страдают отделы ЦНС, дыхательной и сердечно-сосудистой, происходить падение артериального давления, уменьшается сила а затем и частота сердечных сокращений, ослабевает дыхание. В случае если на этом этапе гипоксия не ликвидируется, то органная недостаточность отягощается и переходит в кому.

Гипоксия у ребенка при родах
Подострая и хроническая формы выделяются гипоксическим синдромом. Он представлен в первую очередь симптомами со стороны отдела ЦНС (головокружение, судороги, сонливость, головная боль), так как головной мозг более чувствителен к недостатку кислорода, в силу чего в его тканях стремительно возникают очаги некрозов, кровоизлияний и иных вариантов гибели клеток. Из-за этих нарушений на фоне дефицита кислорода, на начальном этапе гипоксии развивается эйфория, возбужденное состояние, повышенная двигательная активность. Собственное состояние не оценивается критически.
Далее это приводит к угнетению коры головного мозга и проявляется такими симптомами как:

- гиперсомния;
- снижение тонуса активности;
- головная боль, головокружение, рвотные позывы;
- шум в ушах, пассивность и заторможенность;
- расстройство сознания;
- бесконтрольное опорожнение мочи и кала;
- нарушение двигательной координации;
- судорожные состояния.
Судорожные приступы развиваются постепенно. Начинаются с мышц лица, затем переходят на руки, ноги, и потом на живот. Судороги провоцируются внешними факторами, например светом, шумом, испугом и т. д.
Лечение постгипоксической болезни
Методология терапевтических мероприятий, направленна на:
- Борьбу с нарушенным кровообращением: возобновление объёма циркулирующей крови, терапию гипотензии, исключение защемления сосудов.
- Лечение расстройств неврологического характера: контроль работы восстановленных участков мозга.
- Терапию симптоматики, которая развилась на фоне гипоксии головного мозга: нарушения работы сердца и других жизненно важных органов.
- Нормализацию гипоэргоза и химических показателей крови.
 Чтобы привести показатели крови в норму, назначают антигипоксанты.
Чтобы привести показатели крови в норму, назначают антигипоксанты.
К ним относится:
- Неотон;
- Мексикор;
- Актовегин;
- комбинированный препарат Цитофлавин.
Также показанием к применению относятся ноотропные средства, для стимуляции обмена веществ, антиоксиданты.
Помимо медикаментов, нужно употреблять больше продуктов, богатых на витамин Е, С, клетчатку. Такими свойствами обладает виноград, орехи, киви, красные ягоды. Не рекомендовано пить напитки с содержанием алкоголя.
У беременных могут обостряться имеющиеся заболевания или возникать патологии, к которым имеется предрасположенность. Энцефалопатия беременных возникает на фоне изменений в организме будущей мамы.
О симптомах и лечении дисметаболической энцефалопатии расскажем в этой статье.
Нужно стараться больше отдыхать, часто гулять на свежем воздухе, избегать нервных перенапряжений. Такие меры значительно улучшают состояние нервных клеток, что очень важно для выздоровления. Также положительно сказывается на состоянии здоровья умеренная физическая активность.
Видео на тему
neuro-logia.ru
Гипоксически ишемическая энцефалопатия: причины, стадии, лечение, последствия
Рейтинг автора
Автор статьи
Терапевт, образование: Северный медицинский университет. Стаж работы 10 лет.
Написано статей
Особенности патологии
Дефицит кислорода неизбежно отражается на функционировании организма. Гипоксически-ишемическая энцефалопатия у новорожденных случается часто: как у доношенных деток, так и недоношенных. У 10% младенцев, перенесших ее, в дальнейшем ставят диагноз «ДЦП». Именно поэтому будущая мать должна чаще бывать на свежем воздухе и точно соблюдать рекомендации врача, чтобы снизить риск гипоксии до минимума.
У взрослых частой причиной патологии становятся травмы или имеющиеся серьезные заболевания. Если при приступе удушья помощь не будет оказана вовремя, то есть серьезный риск летального исхода или инвалидности. Немаловажную роль играет и степень тяжести патологии, чем она выше, тем меньше шансов у человека на возврат к полноценной жизни.
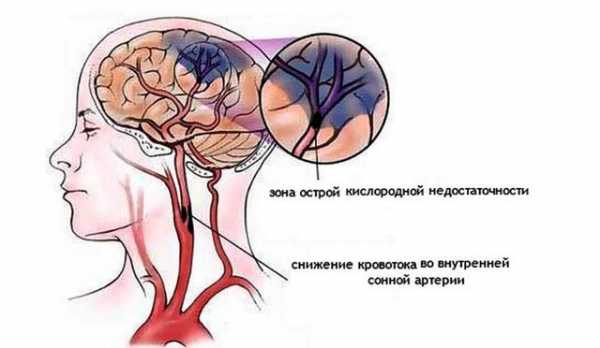
Когда наступает кислородное голодание в важнейшей части центральной нервной системы, это приводит к дефициту этого вещества в клетках мозга, что замедляет кровоток и все метаболические процессы. При таком недостатке питания нейроны мозга в некоторых участках органа начинают отмирать, приводя к неврологическим нарушениям.
Ускоряет процесс отек мозга, возникающий также из-за сбоя в кровообращении. Давление растет, и клетки начинают быстрее гибнуть. Чем быстрее проходит процесс, тем больше шансов на то, что повреждения будут необратимыми.
Причины возникновения
Гипоксическая энцефалопатия у взрослых и у детей возникает по разным причинам. Их важно знать, чтобы принять все меры для ее предупреждения.
У взрослых
Гипоксическая ишемическая энцефалопатия возникает на фоне нехватки кислорода, к чему приводят следующие причины:
- состояние удушья;
- удушение;
- сбой дыхательной системы любого рода происхождения;
- наркотическая зависимость, передозировка;
- патологии кровеносной системы, приводящие к ее непроходимости или разрыву;
- цианид, окись углерода — отравление;
- длительное пребывание в задымленном месте;
- травма трахеи;
- остановка сердца;
- болезни, приводящие к параличу мышечной ткани дыхательной системы.
Острая гипоксическая энцефалопатия наступает, если кислород не поступал в организм несколько минут. Это тяжелое течение патологии, которое чаще всего заканчивается летальным исходом. Зафиксированы единичные случаи, когда люди выживали, но для них это заканчивалось тяжелой формой серьезных психических болезней.
У новорожденных
Причиной такого состояния у только родившегося ребенка может быть:
- удушье во время родов из-за слабой родовой деятельности;
- преждевременный родовой процесс или с патологическими факторами, такими как выпадение пуповины;
- болезни инфекционного генеза у матери;
- ряд физических факторов от грязного воздуха до радиационного излучения.
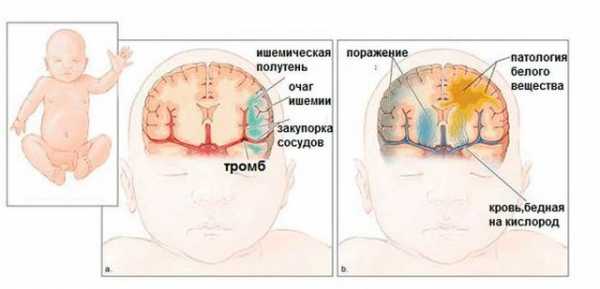
Именно асфиксия у грудничков является самым частым фактором, приводящим к ГИЭ. Врачи выделяют следующие факторы риска для ее возникновения:
- гипотония острой формы у роженицы;
- недоразвитость легких, что приводит к недостатку кислорода в крови;
- сложности в работе сердца;
- травмирование плода узким тазом матери или из-за проблем с пуповиной;
- сложности в родовой деятельности, травма, стресс;
- гипоксия;
- родовое кровотечение;
- халатность медицинского персонала;
- отслойка плаценты;
- изменение формы черепа плода из-за давления;
- родовая травма, разрыв матки;
- низкое предлежание плаценты.
Степени тяжести и характерные симптомы
Гипоксически-ишемическая энцефалопатия имеет 3 степени тяжести, для которых характерны свои проявления. По ним врачи часто дают предварительную характеристику повреждений мозговой деятельности и приблизительный прогноз.
Легкая степень
При такой степени у больного будет:
- расширен зрачок и широко открыты веки;
- отсутствовать концентрация внимания;
- нарушена координация движений, блуждающее поведение;
- выявлена либо сонливость, либо гипервозбудимость;
- высокая степень раздражительности;
- отсутствовать аппетит;
- нарушено мозговое кровообращение.
Средняя степень
Неврология при ней будет более выражена, т. к. нарушение насыщения мозга кислородом более длительное:
- у малыша спонтанные крики без причины;
- защитный и опорный рефлекс либо ослаблен, либо отсутствует вовсе;
- признаки мышечной слабости;
- опущение верхнего века;
- увеличение давления цереброспинальной жидкости;
- метаболический ацидоз крови;
- невралгические приступы;
- сбой в глотательном процессе.
Тяжелая степень
Поражение в таких случаях более тяжелое, что проявляется в:
- судорожности;
- синюшности кожи;
- потере сознания;
- гипертензии;
- отсутствии двигательных возможностей;
- косоглазии;
- коме или прекоме;
- отсутствии реакции зрачков на свет;
- сбое дыхательного процесса с сильной аритмией;
- тахикардии.

ПЭП — это разновидность гипоксически-ишемической энцефалопатии у детей раннего возраста. Ее диагностируют как сразу после рождения, так и на первом году жизни. Развивается ПЭП как внутриутробно, в процессе родовой деятельности, так и в первые 10 дней с момента рождения.
Она может быть трех степеней тяжести с характерной симптоматикой и протекать в острой форме — до месяца, в раннем восстановлении функций — до 4 месяцев, при позднем восстановлении — до 2 лет.
Диагностика
Перинатальный синдром ишемии на фоне гипоксии мозга начинают диагностировать, делая визуальный осмотр ребенка. Так же и со взрослыми. Несмотря на все достижения медицины, уникальный тест, позволяющий точно выявить ГИЭ, до сих пор не придуман. Все лабораторные методики направлены на выявление того, насколько сильно поврежден мозг и текущее состояние всего организма.
Какими будут исследования, зависит от симптомов, и как они развивались. Для расшифровки анализов есть специальные биомаркеры, которые дают полную картину о степени ГИЭ. Для исследования нужна кровь больного.
Нейровизуализацию проводят с помощью:
- нейросонографа и/или МРТ, томографа, показывающего внутренние повреждения мозга и изменения в нем;
- доплерографа, фиксирующего работу мозгового кровотока;
- электронейромиографа для определения чувствительности волокон периферии нервной системы.
Дополнительного могут использовать:
- электроэнцефалограф для выявления задержки развития на ранней стадии и есть ли эпилепсия;
- видеомониторинг для изучения двигательной активности малышей.

При необходимости пострадавшего осматривает окулист, чтобы определить состояние зрительных нервов и глазного дна, а также на наличие болезней генетического типа в этой области.
Лечение и уход
За пострадавшими должен быть особый уход, а за детьми, перенёсшими ГИЭ, он строится на контроле за:
- температурой в помещении — не более 25 градусов;
- его комфортной позой, поэтому тугое пеленание под запретом;
- тем, чтобы свет был мягким и приглушенным;
- тишиной;
- кормлением, которое должно быть с контактом «кожа к коже» и согласно потребностям малыша;
- дыханием, при сбое в котором подключают специальный аппарат.
Терапию проводят:
- Хирургически, для восстановления и улучшения кровообращения в мозгу. Чаще всего для этих целей используют эндоваскулярную методику, которая не нарушает целостность тканей.
- Медикаментозно, выбирая препараты в зависимости от того, насколько тяжелая степень поражения и ее клинической картины.
- На антиконвульсантах, которые купируют судороги. Обычно это Фенобарбитал, дозировку которого подбирают индивидуально. Внутривенный способ самый быстрый. Но сам препарат противопоказан при сверхчувствительности, тяжелой форме гипоксической и гиперкаптической дыхательной недостаточности, проблемах с почкам и печенью, при беременности. Может быть использован Лоразепам, у него аналогичное воздействие и список противопоказаний.
- На сердечно-сосудистых средствах, чтобы увеличить системное сопротивление сосудов и сократительную функцию миокарда, что приводит к повышенному сердечному выбросу. Все средства этой группы влияют на почки, а при передозировке побочные эффекты предсказать сложно. Чаще всего используют Допамин, Добутамин.
Дальнейшее наблюдение
Из стационара выписывают только после прохождения полного курса физической терапии и комплексной оценки нервно-психического развития. Чаще всего после выписки пациенты не требуют специфического ухода, но регулярные осмотры в клинике обязательны, особенно для детей.
Если болезнь была тяжелой, то ребенок будет наблюдаться в специальном центре, где ему будет помогать врач по нервно-психическому развитию.
Лечение судорожности зависит от симптоматики центральной нервной системы и результатов исследований. Выписывают только с легким отклонением от нормы или вовсе в ее пределах. Фенобарбитал убирают постепенно, но обычно его пьют после выписки не менее 3 месяцев.
Прогноз и последствия
У взрослых прогноз зависит от степени поражения мозга патологией. Самыми частыми последствиями перинатальной ГИЭ являются:
- задержка в развитии ребенка;
- дисфункции мозга в плане внимания, сосредоточенности на обучении;
- нестабильная работа внутренних систем организма;
- эпилептические припадки;
- гидроцефалия;
- вегетососудистая дистония.

Не нужно думать, что это приговор, даже разлад в центральной нервной системе корректируют, обеспечивая нормальную жизнь пациентам. Треть людей с этим расстройством излечивается полностью.
Профилактика
Если речь идет о взрослых, то все профилактические мероприятия должны быть направлены на полный отказ от вредных привычек. При этом нужно регулярно заниматься спортом, избегая чрезмерных нагрузок, правильно питаться, проходить регулярные медицинские осмотры, чтобы выявить опасные патологии на ранней стадии для их успешного купирования.
От травм никто не застрахован, но если более осторожно себя вести, то и их можно минимизировать.
Снизить риск ГИЭ у новорожденного может только его мама еще в период беременности. Для этого нужно:
- строго следить за режимом дня и личной гигиеной;
- отказаться от никотина и алкоголя даже в минимальной дозировке;
- проходить вовремя обследования у врачей и диагностику, особенно у невролога;
- доверить роды только квалифицированному персоналу.
Гипоксически-ишемическая энцефалопатия опасная болезнь, но ее можно предотвратить, и даже вылечить, но только если помощь была оказана вовремя и в дальнейшем врачебные рекомендации не нарушаются.
golovaum.ru
Перинатальная гипоксическая энцефалопатия | Бондаренко Е.С., Зыков В.П.
Перинатальная гипоксическая энцефалопатия является частым осложнением патологии беременности и родов и диагносцируется у новорожденных до 5% случаев [1]. Перинатальные повреждения мозга составляют более 60% всей патологии нервной системы детского возраста, непосредственно участвуют в развитии таких заболеваний, как детский церебральный паралич, эпилепсия, минимальная мозговая дисфункция.
Факторы риска. Этиология и патогенез гипоксической энцефалопатии
Для распознавания клинических признаков перинатальной гипоксии необходимо учитывать факторы риска, предрасполагающие к ее развитию [8]:
• Пограничный возраст матери (моложе 20 и старше 35 лет)
• Преждевременная отслойка плаценты
• Предлежание плаценты
• Преэклампсия
• Преждевременные или поздние роды
• Окрашивание околоплодных вод меконием
• Брадикардия, тахикардия плода, приглушение тонов сердца плода
• Многоплодие
• Длительный безводный промежуток
• Диабет матери
• Любые заболевания матери во время беременности
• Прием матерью потенциально опасных для плода препаратов
Среди причин нарушений вентиляции легких и оксигенации крови выделяют периферическую и центральную гипоксию. В периферической гипоксии принимает участие патология дыхательных путей или альвеолярного кровотока, в центральной гипоксии основой является нарушение функции дыхательного центра.
Этиология гипоксии
| Периферическая | Центральная |
| 1. Респираторный | 1. Пониженное давление |
| дистресс-синдром | у матери |
| 2. Аспирация околоплодных | 2. Анемия матери |
| вод | |
| 3. Пневмоторакс | 3. Артериальная гипертензия |
| (с родовой травмой) | |
| 4. Бронхолегочная | 4. Плацентарная |
| дисплазия | недостаточность |
| 5. Врожденные аномалии (синдром Пьера — Робена) |
5. Пороки развития мозга |
Гипоксия приводит к нарушению окислительных процессов, развитию ацидоза, снижению энергетического баланса клетки, избытку нейромедиаторов, нарушению метаболизма глии и нейронов. Ацидоз увеличивает проницаемость сосудистой стенки с развитием межклеточного отека и нарушением церебральной гемодинамики. В условиях гипоксии нарушается перекисное окисление липидов с накоплением агрессивных свободных радикалов, гидроперекисей, которые оказывают деструктивное действие на мембраны нейронов. Нарушения церебральной гемодинамики ишемическо-геморрагического характера являются следствием тяжелой гипоксии мозга.
В антенатальном периоде основным этиологическим фактором гипоксии является плацентарная недостаточность [2,9]. Трофическая недостаточность протекает с нарушением всасываемости и усвоением питательных веществ через плаценту, дефицитом транспорта кислорода и углекислоты, что проявляется синдромом задержки развития плода, внутриутробной гипотрофией, незрелостью легких и сурфактанта. Установлено, что снижение маточно-плацентарного кровотока служит объективным показателем гипоксического поражения мозга [4]. Дефицит сурфактанта и дыхательная аноксия служат основными патогенетическими факторами церебральной гипоксии недоношенных и новорожденных от больных диабетом матерей. В патогенезе дефицита сурфактанта новорожденных лежит вторичный гиперинсулинизм плода, который развивается в ответ на гликемию матери. Инсулин тормозит синтез лецитина — основного элемента сурфактанта, недостаток которого препятствует разлипанию альвеол, что и приводит к нарушению вентиляции легких.
Таким образом, компенсация диабета беременных является профилактикой дыхательного дисстресс-синдрома новорожденных и гипоксической энцефалопатии [15]. В неонатальном периоде причиной церебральной гипоксии и ишемии может быть выраженный интрапульмональный шунт. В патогенезе гипоксии мозга значительную роль играют гипоксическая кардиопатия новорожденных и надпочечниковая недостаточность. Гипогликемия и дефицит запаса гликогена рассматриваются как факторы, обусловливающие повышенную ранимость мозговой ткани к гипоксии новорожденных, особенно недоношенных с низкой массой тела.
Морфология гипоксической энцефалопатии
Головной мозг в норме поглощает пятую часть кислорода, поступающего в организм. У детей раннего возраста доля мозга в использовании кислорода составляет почти половину, что обеспечивает высокий уровень метаболизма окислительных процессов. В зависимости от длительности гипоксии в мозге развиваются изменения от локального отека до некрозов с геморрагическим пропитыванием. В ряде исследований было показано, что имеется различная чувствительность мозговых структур к гипоксии, которая зависит от особенностей метаболизма и кровоснабжения. Наиболее чувствительными к гипоксии являются зона Зоммера аммонова рога и перивентрикулярная область смежного кровоснабжения между передней, средней и задней мозговыми артериями. При сочетании гипоксии и ишемии возникают очаги некрозов в коре, зрительном бугре, полосатом теле, мозжечке. Выделяют следующие стадии морфологических гипоксических изменений в головном мозге: I стадия — отечно-геморрагическая, II стадия — энцефальный глиоз, III стадия — лейкомаляция (некроз), IV стадия — лейкомаляция с кровоизлиянием. Первые две стадии острой гипоксии являются курабельными, имеется возможность восстановления метаболизма нейронов и глии, III и IV стадии ведут к необратимой гибели нейронов. При антенатальной гипоксии наблюдаются дистрофия нейронов, пролиферация глии, явления склерозирования, кистозные полости на местах мелких очагов некрозов.
Клиника гипоксической энцефалопатии
В клинической картине гипоксической энцефалопатии выделяют три периода — острый (1-й месяц жизни ребенка), восстановительный (с 1-го месяца до 1 года, а у недоношенных незрелых детей до 2 лет) и исход [12].
В остром периоде по степени тяжести выделяются легкая форма поражений нервной системы, отражающая преходящие нарушения гемоликвородинамики; форма средней тяжести с отечно-геморрагическими изменениями, глиозом, единичными лейкомаляциями; тяжелая форма, характерная для генерализованного отека мозга, множественных лейкомаляций и кровоизлияний. Для определения степени тяжести и выраженности нарушений мозгового кровообращения применяется шкала Апгар.
В остром периоде выделяют 5 клинических синдромов: повышение нервно-рефлекторной возбудимости, судорожный, гипертензионно-гидроцефальный, синдром угнетения, коматозный. Обычно наблюдается сочетание нескольких синдромов. Особенностью острого периода является доминирование общемозговых нарушений без выраженных локальных симптомов. При легкой форме поражения мозга (оценка по шкале Апгар 6 — 7 баллов) характерным является синдром повышенной нервно-рефлекторной возбудимости. Основными проявлениями синдрома являются усиление спонтанной двигательной активности, беспокойный поверхностный сон, удлинение периода активного бодрствования, трудность засыпания, частый немотивированный плач, оживление безусловных врожденных рефлексов, мышечная дистония, повышение коленных рефлексов, тремор конечностей и подбородка. У недоношенных синдром нервно-рефлекторной возбудимости в 94% случаев является клиническим признаком понижения порога судорожной готовности, что подтверждается данными электроэнцефалографии (ЭЭГ) [12]. Больные, у которых, по данным ЭЭГ, имеется снижение порога судорожной готовности, должны рассматриваться в группе риска по судорожному синдрому.
Среднетяжелая форма гипоксической энцефалопатии (оценивается по шкале Апгар 4 — 6 баллов) проявляется гипертензионно-гидроцефальным синдромом и синдромом угнетения.
Для гипертензионно-гидроцефального синдрома характерным является увеличение размеров головы на 1 — 2 см по сравнению с нормой (или окружностью грудной клетки), раскрытие сагитального шва более 0,5 см, увеличение и выбухание большого родничка. Типичной является брахиоцефалическая форма головы с увеличенными лобными буграми или долихоцефалическая — с нависающим кзади затылком. Отмечается симптом Грефе, симптом «заходящего солнца», непостоянный горизонтальный нистагм, сходящее косоглазие. Выявляется мышечная дистония, больше в дистальных отделах конечностей в виде симптома «тюленьих лапок» и «пяточных стопок». У большинства детей, особенно в первые дни жизни, эти явления сочетаются с пароксизмами вздрагиваний, спонтанным рефлексом Моро, нарушением сна, симптомом Арлекино, общим и локальным цианозом. Развитие гипертензионно-гидроцефального синдрома на 3 — 5-й день жизни может являться признаком перивентрикулярного кровоизлияния. Гипертензионно-гидроцефальный синдром может быть изолированным, но чаще сочетается с синдромом угнетения или коматозным синдромом. Синдром угнетения проявляется вялостью, гиподинамией, снижением спонтанной активности, общей мышечной гипотонией, гипорефлексией, угнетением рефлексов новорожденных, снижением рефлексов сосания и глотания. Наблюдаются локальные симптомы в виде расходящегося и сходящегося косоглазия, нистагм, асимметрия и отвисание нижней челюсти, асимметрия мимической мускулатуры, бульбарные и псевдобульбарные симптомы. Синдром характеризует течение острого периода гипоксической энцефалопатии и в конце первого месяца жизни обычно исчезает. В остром периоде синдром угнетения может являться предвестником отека мозга и развития коматозного синдрома.
Коматозный синдром является проявлением тяжелого состояния новорожденного, по шкале Апгар оценивается 1 — 4 балла. В клинической картине выявляются выраженная вялость, адинамия, мышечная гипотония до атонии, врожденные рефлексы не выявляются, зрачки сужены, реакция на свет незначительная или отсутствует. Нет реакции на болевые раздражители, «плавающие» движения глазных яблок, горизонтальный и вертикальный нистагм, сухожильные рефлексы угнетены. Дыхание аритмичное, с частыми апное, брадикардия, тоны сердца глухие, пульс аритмичный, артериальное давление низкое. Могут отмечаться приступы судорог с преобладанием тонического компонента. Тяжелое состояние сохраняется 10 — 15 дней, отсутствуют рефлексы сосания и глотания. Появление в остром периоде гидроцефалии с выбуханием и напряжением большого родничка, расхождением черепных швов, протрузией глазных яблок, быстрым ростом головы свидетельствует о внутричерепном кровоизлиянии.
Судорожный синдром в остром периоде, как правило, сочетается с синдромом угнетения или коматозным. Возникает в результате гипоксического отека мозга, гипогликемии, гипомагнемии или внутричерепных кровоизлияний. Проявляется в первые дни жизни тонико-клоническими или тоническими судорогами. Наряду с этим наблюдаются локальные клонические судороги или гемиконвульсии. Судорожные припадки у новорожденных отличаются кратковременностью, внезапным началом, отсутствием закономерности повторения и зависимости от состояния сна или бодрствования, режима кормления и других факторов. Судороги наблюдаются в виде мелкоамплитудного тремора, кратковременной остановки дыхания, тонического спазма глазных яблок по типу пареза взора вверх, имитации симптома «заходящего солнца», нистагма, автоматических жевательных движений, пароксизмов клонуса стоп, вазомоторных реакций. Эти судороги по своему характеру иногда напоминают спонтанные движения ребенка, что затрудняет диагностику.
Восстановительный период гипоксической энцефалоратии включает следующие синдромы: повышение нервно-рефлекторной возбудимости, гипертензионно-гидроцефальный, вегетовисцеральных дисфункций, двигательных нарушений, задержки психомоторного развития, эпилептический.
Синдром повышенной нервно-рефлекторной возбудимости в восстановительном периоде имеет два варианта течения. При благоприятном варианте течения отмечается исчезновение или уменьшение выраженности симптомов повышенной нервно-рефлекторной возбудимости в сроки от 4 — 6 месяцев до 1 года. При неблагоприятном варианте, особенно у недоношенных, может развиться эпилептический синдром.
Гипертензионно-гидроцефальный синдром имеет два варианта течения:
1) гипертензионно-гидроцефальный синдром с благоприятным течением, при котором наблюдается исчезновение гипертензионных симптомов при задержке гидроцефальных;
2) неблагоприятный вариант гипертензионно-гидроцефального синдрома, входящий в симптомокомплекс органического церебрального синдрома.
Исходы гипертензионно-гидроцефального синдрома:
1. Нормализация роста окружности головы к 6 месяцам.
2. Компенсированный гидроцефальный синдром в 8 — 12 месяцев.
3. Развитие гидроцефалии.
Синдром вегето-висцеральных дисфункций начинает проявляться после 1 — 1,5 месяца жизни на фоне повышения нервно-рефлекторной возбудимости и гипертензионно-гидроцефального синдрома. В клинической картине отмечаются упорные срыгивания, стойкая гипотрофия, нарушение ритма дыхания и апное, изменение окраски кожных покровов, акроцианоз, пароксизмы тахи- и брадипное, расстройства терморегуляции, дисфункция желудочно-кишечного тракта, височное облысение.
Эпилептический синдром может проявляться в любом возрасте (как продолжение судорог после рождения или на фоне соматической инфекции). У новорожденных и грудных детей он имеет так называемое возрастное лицо, т. е. судорожные пароксизмы имитируют те двигательные возможности, которыми ребенок к моменту их появления обладает.
У новорожденных и грудных детей (особенно у недоношенных) судорожный синдром характеризуется многообразием клинических форм припадков. Наблюдаются генерализованные судорожные припадки (тонико-клонические, клонические, тонические), абортивные, фокальные, гемиконвульсивные, полиморфные припадки, простые и сложные абсансы. По частоте преобладают полиморфные формы припадков. У недоношенных детей с перинатальной энцефалопатией пропульсивные и импульсивные пароксизмы в изолированном виде не встречаются, а наблюдаются только в составе полиморфных припадков. Наибольшую трудность в диагностике представляют абортивные и бессудорожные формы пароксизмов.
Наблюдается имитация безусловных двигательных рефлексов в виде пароксизмально возникающих проявлений шейно-тонического симметричного рефлекса с наклоном головы и тоническим напряжением рук и ног; шейно-тонического асимметричного рефлекса с поворотом головы в сторону и разгибанием одноименной руки и ноги; первой фазы рефлекса Моро с раскрытием ручек. Бывают пароксизмы в виде спазма взора и нистагмом, имитацией «симптома заходящего солнца». Нередко наблюдаются приступы покраснения и побледнения кожных покровов с усиленным потоотделением, иногда срыгиваниями. После 3 — 4 месяцев жизни, по мере появления способности удерживать голову, появляются «кивки», «кливки», а с 6 — 7 месяцев — «поклоны» (сгибание туловища вперед-назад).
Такие особенности судорожного синдрома у недоношенных детей, как нестабильность клинических проявлений с преобладанием полиморфных судорог, наличие абортивных форм припадков, а также сложных абсансов с имитацией безусловных рефлексов новорожденных (первой фазы рефлекса Моро, асимметричного шейно-тонического рефлекса) являются, вероятно, следствием незрелости структур головного мозга. Однако увеличение частоты припадков, нарастание полиморфизма их проявлений, резистентность к противосудорожной терапии должны настораживать в отношении формирования грубых органических форм поражения мозга.
Полиморфизм приступов, их резистентность к терапии является прогностически неблагоприятным признаком.
Синдром двигательных нарушений выявляется с первых недель жизни, может протекать с мышечной гипотонией или гипертонией. При появлении синдрома двигательных нарушений с мышечной гипотонией отмечается снижение спонтанной двигательной активности, угнетение сухожильных рефлексов и врожденных безусловных рефлексов новорожденных. Синдром двигательных нарушений с мышечной гипотонией встречается изолированно, а также в сочетании с гипертензионно-гидроцефальным синдромом, синдром повышенной нервно-рефлекторной возбудимости с понижением порога судорожной готовности. Неблагоприятно сочетание синдрома двигательных нарушений и судорожного синдрома.
Нарастание мышечной гипертонии у доношенных детей, появление сторонности очаговых симптомов должны настораживать в плане развития детского церебрального паралича.
Синдром задержки психомоторного развития начинает проявляться с 1 — 2 месяцев. В структуре синдрома отмечается нарушение редукции безусловных врожденных рефлексов. Большую диагностическую роль приобретает шейно-тонические симметричный и асимметричный рефлексы, задержка формирования выпрямительных лабиринтных цепных тонических рефлексов. При наличии в структуре данного синдрома задержки психического развития у детей к месячному возрасту наблюдается недостаточно устойчивая фиксация взгляда, кратковременное прослеживание с быстрым истощением. Нет реакции на голос матери, слухового сосредоточения. К 2 — 3-месячному возрасту наблюдается недостаточное оживление при общении, крик маловыразителен, гуление отсутствует, дети отыскивают источник звука глазами без поворота головы, появляется редкая, трудно вызываемая улыбка. К полугоду — недостаточно активно интересуются игрушками и окружающими предметами, недостаточно реагируют на присутствие матери, гуление малоактивное и непродолжительное, манипуляции с предметами задержаны, нет активного внимания. Если задержка развития является «темповой», она при правильном выхаживании начинает исчезать. Данная группа детей в 4 — 5 месяцев как бы «скачком» становится активнее, причем психическое развитие опережает моторное. Появляются эмоциональная реакция на окружающих, интерес к игрушкам.
Возрастные двигательные функции начинают активно компенсироваться после 6 — 7 месяцев и, как правило, восстанавливаются к 1 — 1,5 годам. Прогностически неблагоприятна длительная задержка психического развития.
Диагностика
Исследование глазного дна в остром периоде легкой гипоксической энцефалопатии отклонений не выявляет, реже наблюдают умеренное полнокровие вен. При среднетяжелой степени отмечают расширение вен, отек, отдельные геморрагии. При тяжелой степени повреждения на фоне выраженного отека расширения сосудов отмечается стушеванность границ диска зрительного нерва, кровоизлияния. В дальнейшем у таких детей может обнаружиться атрофия сосков зрительных нервов.
В спинномозговой жидкости изменения выявляются при наличии внутричерепного кровоизлияния. В этих случаях в ликворе имеются свежие и выщелочные эритроциты. После 7 — 10-го дня жизни подтверждением перенесенного кровоизлияния является наличие в ликворе макрофагов.
Нейросонография — двухмерное ультразвуковое исследование анатомических структур мозга через большой родничок — позволяет установить перивентрикулярное кровоизлияние, очаги лейкомаляции, расширение желудочковой системы — вентрикуломегалию [5, 10]. Нейросонография позволяет провести дифференциальную диагностику с пороками головного мозга. Признаки гипоплазии мозга: увеличение субарахноидальных пространств, расширение межполушарной щели, вентрикуломегалия, повышение плотности в области паренхимы мозга без четкой дифференциации извилин, порэнцефалия. Галопрозэнцефалия — увеличение одного желудочка, тени, повышение эхоплотности от стволовых структур мозга, снижение плотности от паренхимы мозга [7]. При клинико-нейросонографических сопоставлениях выявляется корреляция числа лейкомаляций и неврологических исходов. Множественные лейкомаляции в обоих полушариях, обнаруживаемые у больных по данным нейросонографии в остром периоде заболевания, сочетаются с синдромом двигательных нарушений и грубой задержкой психомоторного развития в восстановительном периоде. Компьютерная томография головного мозга помогает объективизировать гипоксические изменения мозговой ткани в структурах мозжечка и ствола мозга, которые недостаточно четко выявляются при нейросонографии.
Электроэнцефалографическое (ЭЭГ) исследование выявляет очаги медленноволновой активности, очаги редукции корковой ритмики, очаги эпилептической активности. Большое значение ЭЭГ-исследование имеет для выделения группы риска по судорожному синдрому и диагностики клинически «немых» приступов. Косвенным подтверждением судорожного синдрома, а также признаком понижения порога судорожной готовности у больных является наличие пароксизмальных изменений ЭЭГ. Повторные припадки могут приводить к усилению выраженности пароксизмальной активности на ЭЭГ.
Из биохимических исследований в остром периоде показателем глубины гипоксических нарушений является оценка ацидоза от смешанного до выраженного декомпенсированного метаболического. При тяжелой гипоксии нарастает осмотическое давление плазмы крови, увеличивается уровень лактатдегидрогеназы. Лактатдегидрогеназа и другие ферменты гликолиза коррелируют с тяжестью состояния детей и отражают выраженность гипоксии в остром периоде перинатальной энцефалопатии.
Рентгенография легких используется для диагностики врожденных ателектазов, пневмопатии и воспалительных изменений легких.
Лечение острого периода
В остром периоде необходима своевременная коррекция респираторного дыхательного дисстресс-синдрома и адекватная вентиляция легких. У недоношенных проводится эндотрахеальное введение колфосцерила пальмитата 5 мл/кг. Использование аналогов сурфактанта приводит к значительному регрессу неврологических синдромов гипоксической энцефалопатии.
1. Коррекция гомеостаза и гиповолемии: свежезамороженная плазма 5 — 10 мл/кг, 10% альбумин 5 — 10 мл/кг, реополиглюкин 7 — 10 мл/кг, гемодез 10 мл/кг.
2. Снижение проницаемости сосудов: 12,5% раствор этамзилата внутримышечно или внутривенно, 1% викасол 0,1 мл/кг.
3. Метаболическая и антиоксидантная терапия: пирацетам 50 мг/кг, 10% глюкоза 10 мл/кг, актовегин внутривенно, 5% витамин Е 0,1 мл в день. В качестве антиоксиданта используется соевое масло 2 — 3 мл 4 — 6 дней на кожу живота [11].
4. Сосудистая терапия: винпоцетин 1мг/кг внутривенно.
5. Дегидратационная терапия: гидрокортизон 3 — 10 мг/кг, преднизолон 1 — 2 мг/кг, 25% магния сульфат 0,2 мл/кг.
6. Улучшение тканевого метаболизма сердечной мышцы: кокарбоксилаза 8 мг/кг, АТФ 10 мг/кг.
7. Антиконвульсантная терапия: диазепам 1мг/кг внутримышечно или внутривенно, ГОМК 50 мг/кг, барбитураты, когда бензодиазепины не эффективны, 5 мг/кг [14].
Лечение восстановительного периода
Лечение восстановительного периода проводится по синдромологическому принципу.
1. При синдроме повышенной нервно-рефлекторной возбудимости с проявлениями вегетовисцеральных дисфункций показаны седативные препараты: диазепам 0,001 г 2 раза в день, тазепам 0,001 г 2 раза в день, микстура с цитралью — раствор цитраля 2,0, магния сульфат 3,0, 10% раствор глюкозы 200,0 — по чайной ложке 3 раза в день; с 2-месячного возраста назначаются успокоительный коктейль из трав (корень валерианы, пустырник, шалфей) по 1 чайной ложке 3 раза в день.
2. При гипертензионно-гидроцефальном синдроме целесообразно назначать фуросемид 0, 002 г/кг в сутки с панангином, глицерол по 1 чайной ложке 3 раза в день. При выраженных проявлениях гипертензионно-гидроцефального синдрома используют ацетазоламид по 0,02 г/кг в сутки однократно по схеме: 3 дня — прием, 1 день перерыв, курс от 3 нед до 1 — 1,5 мес с панангином.
3. При синдроме двигательных нарушений: витамин В6 5 мг, витамин В1 2 мг, АТФ 0,5 мл 10 — 12 инъекций, пиритинол 10 — 20 капель на 1 кг массы тела 2 раза в день в первой половине дня 1 — 3 мес. Массаж. Лечебная гимнастика, проводится обучение матери навыкам реабилитации.
4. При синдроме задержки психомоторного развития: пирацетам 30 — 50 мг/кг в 3 приема, пиритинол. С 6 месяцев церебролизин 0,5 мл № 20 (противопоказан при судорожном синдроме), витамины В6, В1. Гамма-аминобутировая кислота по 0,06 г 2 — 3 раза в день.
5. При судорожном синдроме: вальпроат натрия 20 — 50 мг/кг, клоназепам до 1 — 2 мг в сутки, фенобарбитал 1 — 2 мг/кг. При резистентных судорогах ламотригин 1 — 2 мг/кг.
6. Хирургическое лечение применяется при сочетанных перивентрикулярных кровоизлияниях и развитии постгеморрагической гидроцефалии, проводится вентрикулярное шунтирование.
Терапевтические мероприятия в дальнейшем индивидуализируются в зависимости от исхода процесса. К годовалому возрасту у большинства зрелых детей с появлением вертикализации и речевых функций можно выявить исходы перинатальной гипоксической энцефалопатии. Выздоровление наступает у 15 — 20% детей. Частыми последствиями перенесенной энцефалопатии являются минимальная мозговая дисфункция, гидроцефальный синдром. Наиболее тяжелыми исходами являются детский церебральный паралич и эпилепсия.
Безусловно, успехи перинатальной медицины, адекватное ведение родов и острого периода гипоксической энцефалопатии позволят снизить психоневрологические исходы заболевания.
Литература:
1.Балан П.В., Маклакова А.С., Крушинская Я.В., Соколова Н.Л., Кудаков Н.И. Сравнительный анализ устойчивости к острой гипобарической гипоксии новорожденных и взрослых экспериментальных животных. Акуш. и гин. 1998;3:20-3.
2. Громыко Ю.Л. Оценка эффективности нового антиоксидантного препарата -актовегина для лечения плацентарной недостаточности и отставания в размерах плода. Материалы 1 съезда Российской ассоциации специалистов перинатальной медицины, 32.
3. Ивановская Т.Е., Покровская Л.Я. Основная патология перинатального периода по современным патологическим данным. Педиатрия 1987;4:11-7.
4. Кулаков В.И. Пренатальная медицина и репродуктивное здоровье женщины. Акуш. и гин. 1997;5:19-22.
5. Кузнецова Л.М, Дворяковский И.В., Мордова Н.А. Корреляция клинических и ультразвуковых признаков при ликвородинамических нарушениях у детей раннего возраста. Материалы научно-практической конференции. Калуга, 1980;34.
6. Миленин О.Б., Ефимов М.С. Применение синтетического сурфактанта экзосорфа в лечении и профилактике респираторного дисстресс-синдрома у новорожденных детей. Акуш. и гин. 1998;3:5-9.
7. Орлова Н.С., Мачинская Е.А., Фишкина Е.В. Нейросонография в диагностике некоторых пороков развития головного мозга. Материалы научно-практической конференции. Калуга. 1982;35.
8. Педиатрия (пер. англ.) / Под ред. Н.Н.Володина. М.,1996;125-70.
9. Федорова М.В. Плацентарная недостаточность. Акуш. и гин. 1997;5:40-3.
10. Фишкина Е.В., Симушин Г.П., Рубцова И.И. и др. Возможности нейросонографии в диагностике поражений центральной нервной системы
у новорожденных детей. Материалы научно-практической конференции. Калуга. 1980;43.
11. Шарипов Р.Х. Применение препаратов мембраннотропного действия в комплексном лечении недоношенных детей с перинатальной энцефалопатией. Тезисы докладов научно-практической конференции. Самара. 1993;1:63.
12. Эдельштейн Э.А., Бондаренко Е.С., Быкова Л.И. Перинатальные гипоксические синдромы. Учебное пособие. М., 1988;38.
13. De Volder AG, Joffinet AM, Bol A, et al. Brain glucose metabolism in postanoxic syndrome. Arch Neurol 1990;47(2):197-204.
14. Carlier G, Guidi О, Dubru JM. Le traitement des convulsions d’enfant. Rev/med/ Liege. 1989;257-62.
15. J. VoIpe Neurology of the Newborn, coundres company. 1987;715.
www.rmj.ru
