Пентаксим аннотация: Пентаксим инструкция по применению: показания, противопоказания, побочное действие – описание Pentaxim Лиофилизат для приготовления суспензии для в/м введения в комплекте с суспензией для в/м введения (31200)
Оценка безопасности ревакцинации детей старше 1,5 лет против дифтерии, коклюша, столбняка, полиомиелита и гемофильной инфекции типа В вакциной Пентаксим | Харит
1. Webdelboe, F.M. Transmission of Bordetella pertussis to young infants / F.M. Webdelboe, E. Njamkepo, A. Bourillon // Pediatr. Infect. Dis. J. – 2007. -V. 26. – P. 293–299.
2. Surridge, J. Pertussis requiring intensive care / J. Surridge, E.R. Segedin, C.C. Grant // Arh Dis Child. – 2007. – V. 92. – P. 970–975.
3. Wirsing von Konig, C.H. Pertussis immunization in Global Pertussis Initiative European Region: recommended strategies and implementation considerations / C.H. Wirsing von Konig [et al.] // Pediatr. Infect. Dis. J. – 2005. – V. 24. – P. 87–92.
4.
5. Kulenkampff, M. Neurological Complications of Pertussis Inoculation / M. Kulenkampff, J.S. Schwartzman, J. Wilson //Arch. Dis. Child. 1974. – V. 49. – P. – 46–49.
6. Torch, W.C. Diphthena-Pertussis-Tetanus (DPT) Immunization: A Potential Cause of the Sudden Infant Death Syndrome (SIDS) / W.C. Torch // Neurology. – 1982. – V. 32. – P. – 169–170.
7. Miller, D. Pertussis Immunization and Serious Acute Neurological Illnesses in Children / D. Miller [et al.] // Br. Med. J. – 1993. – V.307. – P. 1171–1176.
1171–1176.
8. Николаенко, В.Н. Сдвиги в системе иммунокомпетентных клеток у людей, иммунизированных различными вакцинными препаратами: автореф. дисс… канд.мед.наук / В.Н. Николаенко. – М., 1990. – 22 с.
10. Таточенко, В.К. Реактогенность и безопасность адсорбированных вакцин против коклюша, дифтерии и столбняка: результаты наблюдательного многоцентрового исследования / В.К. Таточенко, Л.С. Намазова, О.А. Аликова // Вопросы современной педиатрии, 2006. – Т. 5. – № 4. – С.32–38.
 Edwards, K.M. Chapter 21 Pertussis vaccine / K.M. Edwards [et al.] // Vaccine 4th ed. Philadelphia. – 2004. – Р. 471–528.
Edwards, K.M. Chapter 21 Pertussis vaccine / K.M. Edwards [et al.] // Vaccine 4th ed. Philadelphia. – 2004. – Р. 471–528.12. Carlsson, R.M. Safety and immunogenicity of a combined diphtheria-tetanus-acellular pertussis-inactivated polio vaccine-Haemophilus influenzae type b vaccine administered at 2-4-6-13 or 3-5-12 months of age / R.M. Carlsson, B.A. Claesson, U. Selsam // Pediatr. Infect. Dis. J. – 1998. –V. 17. – P. 1026–1033.
14. Включение вакцины против Haemophilus influenzae тип b в программы иммунизации. Общее руководство, включая информацию для работников здравоохранения и родителей. ВОЗ, Женева, 2001, 37с. www. who.int/vaccines -documents 15. Харит, С.М. Вакцинация детей с проблемами в состоянии здоровья. В помощь практическим врачам / С.М. Харит [и др.]. – СПб.: Изд-во ООО «Феникс», 2007. – 120с.
Общее руководство, включая информацию для работников здравоохранения и родителей. ВОЗ, Женева, 2001, 37с. www. who.int/vaccines -documents 15. Харит, С.М. Вакцинация детей с проблемами в состоянии здоровья. В помощь практическим врачам / С.М. Харит [и др.]. – СПб.: Изд-во ООО «Феникс», 2007. – 120с.
15. Баранов, А.А. Комбинированные вакцины в национальных календарях профилактических прививок для детей в Беларуси, Казахстане, России и Украине / А.А. Баранов [и др.] // Педиатрическая фармакология. – 2007. – Т. 4, № 1. – С. 4–17.
Применение пятикомпонентной вакцины АаКДС-ИПВ/Hib в рамках национального календаря профилактических прививок | Михеева
1. Obando-Pacheco P Rivero-Calle I, Gomez-Rial J, et al. New perspectives for hexavalent vaccines. Vaccine. 2018;36(36):5485-5494.
2. Maman K, Zollner Y, Greco D, et al. The value of childhood combination vaccines: from beliefs to evidence. Hum Vaccin Immunother. 2015;11(9):2132-2141. doi: 10.1080/21645515.2015.104410.
3. Marshall GS, Happe LE, Lunacsek OE, et al. Use of combination vaccines is associated with improved coverage rates. Pediatr Infect Dis J. 2007;26(6):496-500. doi: 10.1097/INF.0b013e31805d7f17.
5. White C, Halperin SA, Scheifele DW. Pediatric combined formulation DTaP-IPV/Hib vaccine. Expert Rev Vaccines. 2009;8(7):831-840. doi: 10.1586/erv.09.59.
2009;8(7):831-840. doi: 10.1586/erv.09.59.
7. Приказ Министерства здравоохранения РФ от 21 марта 2014 г. № 125н «Об утверждении национального календаря профилактических прививок и календаря профилактических прививок по эпидемическим показаниям» (в редакции Приказа Минздрава России от 24.04.2019 № 243н). Доступно по: http://docs.cntd.ru/document/499086215. Ссылка активна на 15.02.2019.
 — 2016. — Т.15. — №1. — С. 61-66.
— 2016. — Т.15. — №1. — С. 61-66.9. Государственный доклад «О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2018 году» [электронный ресурс]. — М.: Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека; 2019. Доступно по: https://rospotrebnadzor.ru/documents/details.php?ELEMENT_ID=12053. Ссылка активна на 03.06.2019.
10. (осударственный доклад «О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2013 году» [электронный ресурс]. — М.: Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека; 2014. Доступно по: https://rospotrebnadzor.ru/documents/details.php?ELEMENT_ID=1984. Ссылка активна на 15.02.2019.
11. Государственный доклад «О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2014 году» [электронный ресурс].
12. Государственный доклад «О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2017 году» [электронный ресурс]. — М.: Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека; 2018. Доступно по: https://rospotrebnadzor.ru/documents/details.php?ELEMENT_ID=10145. Ссылка активна на 15.02.2019.
13. Brickley EB, Wright PF. Maximising the impact of inactivated polio vaccines. Lancet Infect Dis. 2017;17(7):680-681. doi: 10.1016/S1473-3099(17)30236-0.
14. Карпова Е.В., Саркисян К.А., Мовсесянц А. А., Меркулов В.А. Вакцинопрофилактика полиомиелита на современном этапе // Биопрепараты. Профилактика, диагностика, лечение. — 2018. — Т.18. — №4. — С. 236-242. doi: 10.30895/2221-996X-2018-18-4-236-242.
А., Меркулов В.А. Вакцинопрофилактика полиомиелита на современном этапе // Биопрепараты. Профилактика, диагностика, лечение. — 2018. — Т.18. — №4. — С. 236-242. doi: 10.30895/2221-996X-2018-18-4-236-242.
15. Степенко А.В., Миндлина А.Я. Управление рисками развития эпидемического процесса коклюша: упущенные возможности и новые перспективы // Медицинский альманах. — 2017. — №4. — С. 83-86.
16. Государственный доклад «О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2016 году» [электронный ресурс]. — М.: Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека; 2017. Доступно по: https://rospotrebnadzor.ru/documents/details.php?ELEMENTJD=8345. Ссылка активна на 15.02.2019.
17. Инструкция по применению лекарственного препарата по медицинскому применению Пентаксим (утв. Министерством здравоохранения Российской Федерации) [электронный ресурс]. Доступно по: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=a477b540-df8d-4955-a321-67317ff72322&t=. Ссылка активна на 16.02.2019.
Министерством здравоохранения Российской Федерации) [электронный ресурс]. Доступно по: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=a477b540-df8d-4955-a321-67317ff72322&t=. Ссылка активна на 16.02.2019.
18. Плоткин С, Йоханнес Л, Мадхи Ш, Эстебан О. Вакцина АБКДС-ИПВ/ZPRP-T: обзор 16-летнего опыта клинического применения // Вопросы современной педиатрии. — 2012. — Т.11. — №1. — С. 18-36.
19. Федеральная служба государственной статистики. Ожидаемая продолжительность жизни при рождении. [электронный ресурс]. Доступно по: http://www.gks.ru/wps/wcm/connect/rosstat_main/rosstat/ru/statistics/population/demography/#. Ссылка активна на 23.08.2019/
20. Федеральная служба государственной статистики. Рождаемость, смертность и естественный прирост. [электронный ресурс]. [Доступно по http://www.gks.ru/wps/wcm/connect/rosstat_main/rosstat/ru/statistics/population/demography/#. Ссылка активна на 23.08.2019/
[электронный ресурс]. [Доступно по http://www.gks.ru/wps/wcm/connect/rosstat_main/rosstat/ru/statistics/population/demography/#. Ссылка активна на 23.08.2019/
21. Куликов А.Ю., Акимова Ю.И. Фармакоэкономический анализ применения пятикомпонентной комбинированной вакцины с ацеллюлярным коклюшным компонентом в рамках регионального календаря профилактических прививок на примере г. Краснодара для всех детей от 0 до 18 мес и отдельно для детей групп риска // Педиатрическая фармакология. — 2014. — Т.11. — №6. — С. 30-41.
22. Куликов А.Ю., Акимова Ю.И. Фармакоэкономический анализ применения комбинированной вакцины Пентаксим с ацеллюлярным коклюшным компонентом в рамках национального календаря профилактических прививок Российской Федерации // Эпидемиология и инфекционные болезни. Актуальные вопросы. — 2014. — №4. — С. 56-64.
23. Единая информационная система в сфере закупок. [электронный ресурс]. Доступно по: http://www.zakupki. gov.ru. Ссылка активна на 16.02.2019.
Единая информационная система в сфере закупок. [электронный ресурс]. Доступно по: http://www.zakupki. gov.ru. Ссылка активна на 16.02.2019.
24. Куликов А.Ю., Акимова Ю.И. Методология фармакоэкономического анализа вакцинопрофилактики // Фармакоэкономика. Современная фармакоэкономика и фармакоэпидемиология. — 2013. — Т.6. — №1. — С. 4-10.
25. Государственный реестр лекарственных средств [электронный ресурс]. Доступно по: https://grls.rosminzdrav.ru/grls.aspx. Ссылка активна на 16.02.2019.
26. Приложение № 6 к Тарифному соглашению на 2019 год от 27 декабря 2018 г. «Тарифы на оплату медицинской помощи, оказываемой в амбулаторных условиях в рамках Территориальной программы ОМС, применяемые, в том числе для осуществления горизонтальных расчетов (за исключением профиля «стоматология»)» [электронный ресурс]. Доступно по: https://www.mgfoms.ru/system/files/prilozhenie_no_6_k_tarifnomu_soglasheniyu_na_2019_god.pdf]. Ссылка активна на 23.08.2019.
Доступно по: https://www.mgfoms.ru/system/files/prilozhenie_no_6_k_tarifnomu_soglasheniyu_na_2019_god.pdf]. Ссылка активна на 23.08.2019.
27. Таточенко В.К., Намазова Л.С., Харит С.М., и др. Реактогенность и безопасность адсорбированных вакцин против коклюша, дифтерии и столбняка: результаты наблюдательного исследования // Вопросы современной педиатрии. — 2006. — Т.5. — №4. — С. 32-38.
28. Федоров А.М., Ляшко В.В. Вся правда о прививках. — М.: Эксмо: Метафора; 2012. — 428 с.
29. Edmond K, Clark A, Korczak VS, et al. Global and regional risk of disabling sequelae from bacterial meningitis: a systematic review and meta-analysis. Lancet Infect Dis. 2010;10(5):317-328. doi: 10.1016/S1473-3099(10)70048-7.
30. Харит С.М., Черняева Т.В., Начарова Е.П., и др. Оценка безопасности ревакцинации детей старше 1,5 лет против дифтерии, коклюша, столбняка, полиомиелита и гемофиль-ной инфекции типа b вакциной Пентаксим // Журнал инфек-тологии. — 2009. — Т.1. — №2-3. — С. 73-78.
Харит С.М., Черняева Т.В., Начарова Е.П., и др. Оценка безопасности ревакцинации детей старше 1,5 лет против дифтерии, коклюша, столбняка, полиомиелита и гемофиль-ной инфекции типа b вакциной Пентаксим // Журнал инфек-тологии. — 2009. — Т.1. — №2-3. — С. 73-78.
31. Тарифы на оплату медицинской помощи, оказываемой в стационарных условиях по законченным случаям лечения заболевания с применением высокотехнологичной медицинской помощи в рамках Территориальной программы ОМС. Приложение № 8.1 к Тарифному соглашению на 2019 год от «29» декабря 2018 г. [электронный ресурс]. Доступно по: https://www.mgfoms.ru/system/files/prilozheniya_no_8.1_k_tarifnomu_soglasheniyu_na_2019_god.pdf. Ссылка активна на 16.02.2019.
8 отзывов, инструкция по применению
Вакцину вводят внутримышечно в дозе 0.5 мл, рекомендуемое место введения — средняя треть передне-латеральной поверхности бедра. Не вводить внутрикожно или внутривенно. Перед введением необходимо убедиться, что игла не проникла в кровеносный сосуд. Для варианта упаковки с двумя отдельными иглами, перед приготовлением вакцины иглу следует плотно закрепить, вращая ее на четверть оборота относительно шприца. Для приготовления вакцины, предварительно удалив пластиковую цветную крышечку с флакона, полностью ввести суспензию для внутримышечного введения (вакцина для профилактики дифтерии, столбняка; коклюша и полиомиелита) через иглу из шприца во флакон с лиофилизатом (вакцина для профилактики инфекции, вызываемой Haemophilus influenzae тип b).
Не вводить внутрикожно или внутривенно. Перед введением необходимо убедиться, что игла не проникла в кровеносный сосуд. Для варианта упаковки с двумя отдельными иглами, перед приготовлением вакцины иглу следует плотно закрепить, вращая ее на четверть оборота относительно шприца. Для приготовления вакцины, предварительно удалив пластиковую цветную крышечку с флакона, полностью ввести суспензию для внутримышечного введения (вакцина для профилактики дифтерии, столбняка; коклюша и полиомиелита) через иглу из шприца во флакон с лиофилизатом (вакцина для профилактики инфекции, вызываемой Haemophilus influenzae тип b).
Взболтать флакон, не вынимая шприца из него, и дождаться полного растворения лиофилизата (не более 3 минут). Полученная суспензия должна быть мутной и иметь беловатый оттенок. Вакцина не должна использоваться в случае изменения окраски или наличия посторонних частиц. Приготовленную таким образом вакцину следует полностью набрать в тот же шприц. Готовую вакцину следует ввести немедленно.
Курс вакцинации Пентаксим состоит из 3 инъекций по одной дозе вакцины (0.5 мл) с интервалом 1 -2 месяца, начиная с 3-х месячного возраста. Ревакцинацию осуществляют.
Курс вакцинации Пентаксим состоит из 3 инъекций по одной дозе вакцины (0.5 мл) с интервалом 1-2 месяца, начиная с 3-х месячного возраста. Ревакцинацию осуществляют введением 1 дозы Пентаксим в возрасте 18 месяцев жизни.
В соответствии с Национальным календарем профилактических прививок Российской Федерации, курс вакцинации для профилактики дифтерии, столбняка, коклюша и полиомиелита состоит из 3-х введений препарата с интервалом в 1,5 месяца, в возрасте 3, 4.5 и 6 месяцев соответственно; ревакцинация проводится однократно в возрасте 18 месяцев.
При нарушении графика вакцинации последующие интервалы между введением очередной дозы вакцины не изменяются, в том числе, интервал перед 4-й (ревакцинирующей) дозой -12 мес
Если первая доза Пентаксима была введена в возрасте 6-12 мес, то вторая доза вводится через 1. 5 мес после первой, а в качестве 3-й дозы, вводимой через 1.5 мес после второй, должна использоваться вакцина для профилактики дифтерии, столбняка; коклюша и полиомиелита, исходно представленная в шприце (т е. без разведения лиофилизата во флаконе (Hlb)) В качестве ревакцинирующей (4-й дозы) используется обычная доза Пентаксима (с разведением лиофилизата (Hlb)).
5 мес после первой, а в качестве 3-й дозы, вводимой через 1.5 мес после второй, должна использоваться вакцина для профилактики дифтерии, столбняка; коклюша и полиомиелита, исходно представленная в шприце (т е. без разведения лиофилизата во флаконе (Hlb)) В качестве ревакцинирующей (4-й дозы) используется обычная доза Пентаксима (с разведением лиофилизата (Hlb)).
Если первая доза Пентаксима вводится в возрасте после 1 года жизни, то для 2-й, 3-й и 4-й (ревакцинирующей) дозы должна использоваться вакцина для профилактики дифтерии, столбняка, коклюша и полиомиелита, исходно представленная в шприце, без разведения лиофилизата во флаконе (Hlb).
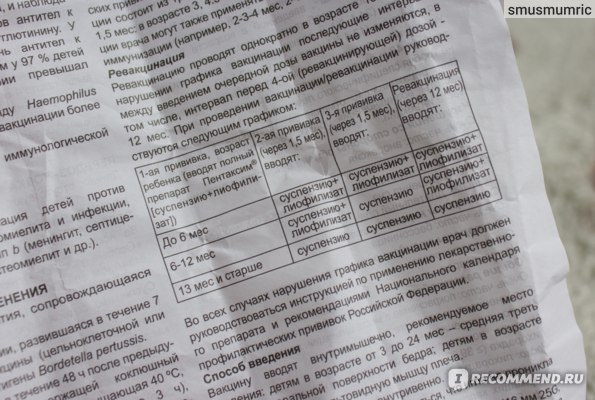
| Первая прививка, возраст ребенка (вводится полный препарат Пентаксим) | Вторая прививка (через 1.5 мес), вводится: | Третья прививка (через 1.5 мес), вводится: | Ревакцинация (через 12 мес), вводится |
| до 6 мес | полный препарат Пентаксим | полный препарат Пентаксим | полный препарат Пентаксим |
| 6-12 мес | полный препарат Пентаксим | Пентаксим без разведения лиофилизата Hlb во флаконе | полный препарат Пентаксим |
| после 12 мес | Пентаксим без разведения лиофилизата Hlb во флаконе | Пентаксим без разведения лиофилизата ШЬ во флаконе | Пентаксим без разведения лиофилизата Hlb во флаконе |
Во всех случаях нарушения графика вакцинации, врач должен руководствоваться Национальным календарем профилактических прививок Российской Федерации.
Пентаксим
6. Способ применения и дозы
Вакцину вводят внутримышечно в дозе 0.5 мл, рекомендуемое место введения — средняя треть передне-латеральной поверхности бедра. Не вводить внутрикожно или внутривенно. Перед введением необходимо убедиться, что игла не проникла в кровеносный сосуд. Для варианта упаковки с двумя отдельными иглами, перед приготовлением вакцины иглу следует плотно закрепить, вращая её на четверть оборота относительно шприца. Для приготовления вакцины, предварительно удалив пластиковую цветную крышечку с флакона, полностью ввести суспензию для внутримышечного введения вакцина для профилактики дифтерии, столбняка; коклюша и полиомиелита через иглу из шприца во флакон с лиофилизатом вакцина для профилактики инфекции, вызываемой Haemophilus influenzae тип b. Взболтать флакон, не вынимая шприца из него, и дождаться полного растворения лиофилизата не более 3 минут. Полученная суспензия должна быть мутной и иметь беловатый оттенок. Вакцина не должна использоваться в случае изменения окраски или наличия посторонних частиц. Приготовленную таким образом вакцину следует полностью набрать в тот же шприц. Готовую вакцину следует ввести немедленно.
Вакцина не должна использоваться в случае изменения окраски или наличия посторонних частиц. Приготовленную таким образом вакцину следует полностью набрать в тот же шприц. Готовую вакцину следует ввести немедленно.
Курс вакцинации ПЕНТАКСИМ состоит из 3 инъекций по одной дозе вакцины 0.5 мл с интервалом 1-2 месяца, начиная с 3-х месячного возраста. Ревакцинацию осуществляют введением 1 дозы ПЕНТАКСИМ в возрасте 18 мес. жизни. В соответствии с Национальным календарём профилактических прививок Российской Федерации, курс вакцинации для профилактики дифтерии, столбняка, коклюша и полиомиелита состоит из 3-х введений препарата с интервалом в 1.5 месяца, в возрасте 3, 4.5 и 6 месяцев соответственно; ревакцинация проводится однократно в возрасте 18 месяцев. При нарушении графика вакцинации последующие интервалы между введением очередной дозы вакцины не изменяются, в том числе, интервал перед 4-й ревакцинирующей дозой — 12 мес. Если первая доза Пентаксима была введена в возрасте 6-12 мес. , то вторая доза вводится через 1.5 мес. после первой, а в качестве 3-й дозы, вводимой через 1.5 мес. после второй, должна использоваться вакцина для профилактики дифтерии, столбняка; коклюша и полиомиелита, исходно представленная в шприце то есть без разведения лиофилизата во флаконе HIb). В качестве ревакцинирующей 4-й дозы используется обычная доза Пентаксима с разведением лиофилизата HIb). Если первая доза Пентаксима вводится в возрасте после 1 года жизни, то для 2-й, 3-й и 4-й ревакцинирующей дозы должна использоваться вакцина для профилактики дифтерии, столбняка; коклюша и полиомиелита, исходно представленная в шприце, без разведения лиофилизата во флаконе HIb.
, то вторая доза вводится через 1.5 мес. после первой, а в качестве 3-й дозы, вводимой через 1.5 мес. после второй, должна использоваться вакцина для профилактики дифтерии, столбняка; коклюша и полиомиелита, исходно представленная в шприце то есть без разведения лиофилизата во флаконе HIb). В качестве ревакцинирующей 4-й дозы используется обычная доза Пентаксима с разведением лиофилизата HIb). Если первая доза Пентаксима вводится в возрасте после 1 года жизни, то для 2-й, 3-й и 4-й ревакцинирующей дозы должна использоваться вакцина для профилактики дифтерии, столбняка; коклюша и полиомиелита, исходно представленная в шприце, без разведения лиофилизата во флаконе HIb.
Во всех случаях нарушения графика вакцинации, врач должен руководствоваться Национальным календарём профилактических прививок Российской Федерации.
Менактра — вакцина от менингита
«Я видел случаи,
когда человек хорошо себя чувствовал за завтраком,
а к обеду был уже мертв!»
Dr Clayton Golledge, микробиолог, инфекционист, США.
Менингококковая инфекция – это острое инфекционное заболевание, возбудителем которого является бактерия Neisseria meningitidis. Тяжесть менингококковой инфекции колеблется от назофарингита до молниеносного сепсиса, приводящего к смерти в течение нескольких часов.
В России заболеваемость составляет в среднем 5 на 100 тыс. населения в год, что является довольно высоким показателем. Наибольшая распространенность менингококковой инфекции в мире приходится на Центральную Африку, Китай, Южную Америку (так называемый «менингитный пояс»), где регулярно возникают крупные эпидемии этого заболевания. Вспышки инфекции возникают в основном в условиях антисанитарии и скученности населения.
Для менингококковой инфекции характерна сезонность — выше всего заболеваемость зимой и ранней весной, т.к. иммунная система в этот период ослаблена попаданием в организм большого количества вирусов, которые тоже активизируются в это время года – ОРВИ, грипп и др. Кроме того, немаловажным пусковым фактором развития менингококковой инфекции являются переохлаждения.
Единственным носителем бактерии Neisseria meningitidis является человек.
Инфекция распространяется воздушно-капельным путем и при прямом контакте с больным или носителем. Инкубационный период в среднем составляет 3-4 дня, но может варьировать от 2 до 10 дней. При молниеносной форме заболевания симптомы развиваются в течение нескольких часов с момента попадания менингококковой инфекции в организм.
Наиболее частой «мишенью» для менигококковой инфекции являются дети в возрасте младше 5 лет. Иммунная система детей в этом возрасте неокончательно сформирована; кроме того, детям свойственно дотрагиваться до рта немытыми руками и различными предметами, они пока плохо соблюдают правила общей гигиены – такие как прикрывание рта при кашле и чихании, регулярное мытье рук. Помимо этого, распространению инфекции способствуют детские дошкольные учреждения, где дети тесно общаются друг с другом во время игр и приема пищи.
Самая легкая форма заболевания – это менингококковый назофарингит, который симптоматически протекает как неосложненное ОРВИ, в связи с чем часто не бывает диагностирован.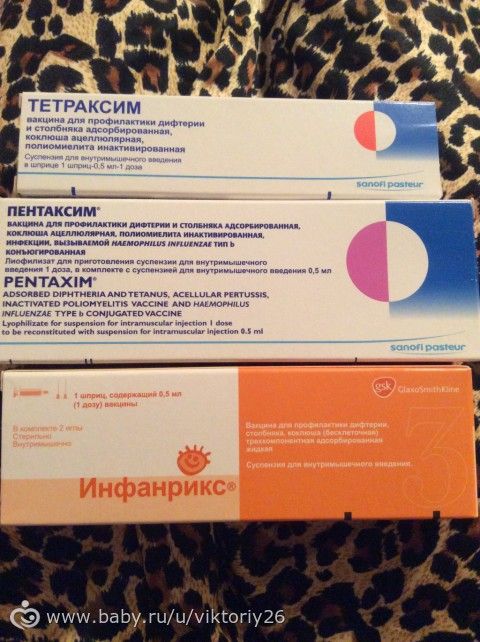 На этом этапе заболевание может закончиться, после чего инфекция переходит в бессимптомное носительство, что встречается у 8-25% пациентов. Однако часто бактерии попадают в кровь и вызывают менингококкцемию (или менингококковый сепсис). При этом бактерии стремительно размножаются в крови и вызывают нарушение свертывающей системы крови, что приводит к кровоизлияниям в кожу и внутренние органы, и нередко заканчивается летальным исходом. Менингококковый сепсис может осложниться менингитом. Менингитом — это воспаление мозговой оболочки, покрывающей головной и спинной мозг. Менингит бывает не только менингококковый – причиной воспаления могут быть другие бактерии (пневмококк, стафилококк, гемофильная палочка типа В), а также встречаются вирусные и грибковые формы менингита. Менингококковая инфекция обладает повышенной склонностью поражать именно мозговые оболочки.
На этом этапе заболевание может закончиться, после чего инфекция переходит в бессимптомное носительство, что встречается у 8-25% пациентов. Однако часто бактерии попадают в кровь и вызывают менингококкцемию (или менингококковый сепсис). При этом бактерии стремительно размножаются в крови и вызывают нарушение свертывающей системы крови, что приводит к кровоизлияниям в кожу и внутренние органы, и нередко заканчивается летальным исходом. Менингококковый сепсис может осложниться менингитом. Менингитом — это воспаление мозговой оболочки, покрывающей головной и спинной мозг. Менингит бывает не только менингококковый – причиной воспаления могут быть другие бактерии (пневмококк, стафилококк, гемофильная палочка типа В), а также встречаются вирусные и грибковые формы менингита. Менингококковая инфекция обладает повышенной склонностью поражать именно мозговые оболочки.
Проявления менингококковой инфекции коварны и обманчивы. Первые симптомы часто неспецифичны, поставить правильный диагноз при начальных признаках заболевания бывает крайне сложно. Однако, при появлении развернутой картины заболевания, больного часто уже невозможно спасти. Существует три формы менингококковой инфекции, каждая из которых может возникать самостоятельно, или иметь последовательное развитие — от назофарингита к бактериемии (сепсису) и менингиту.
Однако, при появлении развернутой картины заболевания, больного часто уже невозможно спасти. Существует три формы менингококковой инфекции, каждая из которых может возникать самостоятельно, или иметь последовательное развитие — от назофарингита к бактериемии (сепсису) и менингиту.
***
Примерно 1 из 10 заразившихся менингитом умирает, а до четверти остаются с пожизненными осложнениями, включая ампутированные конечности и глухоту.
***
Симптомы, характерные для менигококкового назофарингита (схожи с симптомами ОРВИ):
-
Повышение температуры тела до фебрильных цифр (в среднем до 38-38,5ºС)
-
Явления ринита
-
Боль в горле
-
Головная боль
-
Бледность кожи
-
Общая слабость.
Крайне важно среди вышеуказанных симптомов не пропустить резкое ухудшение состояния, которое обычно развивается в кратчайшие сроки.
Симптомы, характерные для менингококкового менингита (50%):
-
Лихорадка, которая слабо реагирует на жаропонижающие средства и головная боль (гриппоподобные симптомы)
-
Ригидность шейных (затылочных) мышц
-
Тошнота, рвота
-
Фотофобия
-
Нарушение сознания, спутанность и дезориентация
-
Судороги.
Симптомы, характерные для бактериемии (сепсиса), включая менингококкцемию (37,5%):
-
Лихорадка
-
Петехиальная и пурпурная сыпь (чаще начинается на нижних конечностях)
-
Гипотензия
-
Шок
-
Полиорганная недостаточность
-
Смерть может наступить в первые 24 часа от появления первых симптомов.
Около 10% заболевших менингококковой инфекцией погибают, а у 20% возникают инвалидизирующие осложнения.
 Основой эффективного лечения является ранняя диагностика заболевания, также немаловажную роль играет профилактика, в частности, вакцинация против менингококковой инфекции.
Основой эффективного лечения является ранняя диагностика заболевания, также немаловажную роль играет профилактика, в частности, вакцинация против менингококковой инфекции.
Согласно рекомендациям ВОЗ, один из рекомендуемых подходов в профилактике менингококковой инфекции заключается в первичной массовой вакцинации всех детей и подростков в возрасте от 9 месяцев до 18 лет, с последующим включением вакцины в программу рутинной иммунизации детей. В странах с меньшей заболеваемостью (<2 случаев/100 тыс. человек в год), вакцинация против менингококковой инфекции рекомендуется только в определенных группах риска:
-
дети и подростки в закрытых учреждениях, т.е. школах-интернатах, военных лагерях;
-
работники бактериологических лабораторий, подвергающиеся высокому риску воздействия менингококков;
-
лица, путешествующие в высокоэндемичные регионы мира, должны быть привиты против распространенных в данных регионах серогрупп.

В Детском Медицинском Центре «Санаре» Вы можете защитить ребенка от опасного заболевания препаратом Менактра.
Производитель: Sanofi Pasteur, Франция.
Стоимость вакцины Менактра
| Услуга | Цена | Примечание |
|---|---|---|
| Менактра, Франция | 5900 | с 9-ти месяцев |
Описание препарата
Менактра представляет собой менингококковую полисахаридную вакцину (серогрупп А, С, Y и W-135), конъюгированную с дифтерийным анатоксином. Вакцина зарегистрирована в 53 странах мира. Вакцина Менактра обеспечивает стойкий иммунный ответ у детей, подростков и взрослых к указанным типам инфекции. Безопасность доказана длительными клиническими исследованиями и 9-летним опытом применения.
Показания к применению
-
Профилактика инвазивной менингококковой инфекции, вызываемой N. meningitidis серогрупп A, C, Y и W-135 у лиц в возрасте от 9 месяцев до 55 лет.
-
Контроль вспышек менингококковой инфекции.
-
Иммунизация «групп риска».
Способ применения и дозы
Вакцинация проводится в дозе 0,5 мл. Вакцина вводится внутримышечно, предпочтительно в дельтовидную мышцу плеча. Категорически запрещено внутривенное введение.
Совместимость с другими вакцинами
Вакцину Менактра применяли одновременно с полисахаридной вакциной для профилактики брюшного тифа и с адсорбированной вакциной, содержащей столбнячный и дифтерийный анатоксины, предназначенной для использования у взрослых (Td), у лиц в возрасте 18-55 лет и 11-17 лет, соответственно. БЦЖ вакцина не должна применяться одновременно с вакциной Менактра. Вводить вакцины необходимо всегда в разные участки тела, используя отдельные шприцы для каждой из них.
Введение нескольких вакцин в один день не является избыточной нагрузкой на иммунитет. Все вакцины национального календаря прививок России взаимозаменяемы.
Схема вакцинации
-
Дети от 9 до 23 месяцев прививаются в два этапа с интервалом не менее 3 месяцев.
-
Всем детям старше 2 лет, подросткам и взрослым достаточно однократного введения препарата.
Побочные действия
Вакцина переносится хорошо. Побочные эффекты сведены к минимуму. Возможны болезненность, отек, уплотнение и гиперемия в месте введения вакцины. Также возможно повышение температуры тела до фебрильных цифр. Побочные эффекты от введения вакцины Менактра носят кратковременный характер и не требуют никакой специфической терапии, кроме симптоматической.
Опыт личного применения
В клинике «Санаре» проведены вакцинации пациентам (детям) в возрасте от 9-ти месяцев препаратом Менактра. Вакцина переносилась хорошо. Жалоб в поствакцинальном периоде не было. (Всех пациентов клиники на следующий день обзванивала и опрашивала медицинская сестра).
Первыми препаратом «Менактра», после его поступления в клинику, были привиты врачи-педиатры, сотрудники клиники, а также их дети (в возрасте от 2-х до 11 лет). Также отмечалась хорошая переносимость препарата.
Как проходит вакцинация?
Вакцинация проводится в прививочном кабинете, с соблюдением всех требований санитарного режима. Все препараты сертифицированы. Сертификат на препарат предоставляется по первому требованию.
Без напоминаний, в обязательном порядке перед прививкой медицинский работник показывает препарат, срок годности вакцины.
Используется только стерильный и одноразовый инструментарий. Обязательно прививка проводится в одноразовых медицинских перчатках.
В день вакцинации ребенка осматривает врач-педиатр, измеряется температура. При отсутствии противопоказаний проводится прививка. Данные о проведенной прививке заносятся в карту, прививочный сертификат, а также даются подробные рекомендации по уходу за ребенком в поствакцинальном периоде.
Перед прививкой доктор ответит на все волнующие Вас вопросы. Обязательно возьмите на прием данные о предыдущих вакцинациях!
Пожалуйста, обратите внимание, что вакцинация ребенка, постановка реакции Манту, Диаскинтеста могут быть проведены только в присутствии родителей или законных представителей ребенка (опекунов), или при наличии у сопровождающего лица НОТАРИАЛЬНО заверенную доверенность на проведение манипуляции (с указанием препарата, планируемого к введению). В ином случае — в вакцинации будет отказано. Мы соблюдаем законы РФ.
Только у нас!
Мы осуществляем поствакцинальное сопровождение: если Вы связываете недомогание с проведенной у нас прививкой, Вы всегда можете нам позвонить или обратиться в клинику на прием к врачу-вакцинологу БЕСПЛАТНО!
Для записи на вакцинацию звоните
Какие вакцины входят в состав пентаксима. Вакцина Пентаксим: описание инструкция отзывы
Вакцину вводят внутримышечно в дозе 0.5 мл, рекомендуемое место введения — средняя треть передне-латеральной поверхности бедра. Не вводить внутрикожно или внутривенно. Перед введением необходимо убедиться, что игла не проникла в кровеносный сосуд. Для варианта упаковки с двумя отдельными иглами, перед приготовлением вакцины иглу следует плотно закрепить, вращая ее на четверть оборота относительно шприца. Для приготовления вакцины, предварительно удалив пластиковую цветную крышечку с флакона, полностью ввести суспензию для внутримышечного введения (вакцина для профилактики дифтерии, столбняка; коклюша и полиомиелита) через иглу из шприца во флакон с лиофилизатом (вакцина для профилактики инфекции, вызываемой Haemophilus influenzae тип b).
Вакцина защищает от виндсерфинга или болезни, облегчает прогрессирование и предотвращает неврологические осложнения, которые могут возникать в ходе ветряной оспы. Согласно последним сообщениям, из-за постепенного уменьшения иммунитета после одной дозы вакцины против ветра рекомендуется повторить вакцинацию.
Тиквенный менингит вызван укусом кожи клещом, его личинками и нимфами. Клещи присутствуют в кустах, листьях деревьев и растениях более 1, 5 м, растущих в лесах, но также и в садах. Клещи падают на человека и отсасывают кровь. Понятно, что 1-2% контракта вызывает укус клеща и болезнь Лайма. Есть области, где количество зараженных клещей довольно велико. Области значительного воздействия клещевого энцефалита включают: северо-восточную Польшу, юго-западную Ополе и районы, окружающие Быдгощ и Краков.
Взболтать флакон, не вынимая шприца из него, и дождаться полного растворения лиофилизата (не более 3 минут). Полученная суспензия должна быть мутной и иметь беловатый оттенок. Вакцина не должна использоваться в случае изменения окраски или наличия посторонних частиц. Приготовленную таким образом вакцину следует полностью набрать в тот же шприц. Готовую вакцину следует ввести немедленно.
Рекомендуется, чтобы люди, вакцинированные в районах с тяжелыми заболеваниями, развивались. В этих районах есть лесничие и другие люди. Полная базовая вакцинация состоит из 3 доз вакцины. Такая вакцинация защищает в течение 3 лет от 3 доз вакцины. Затем, через трехлетний интервал, проводится единая вакцинация. Вакцины, имеющиеся в настоящее время, не защищают от болезни Лайма.
Гепатит А — в течение нескольких лет все дети вакцинируются против гепатита В, но гепатит А может быть вакцинирован. Вирусный гепатит А распространяется по одичало-оральному пути. Вирус выводится из организма человеком, который болеет за 1-2 недели до появления симптомов и недели после появления симптомов. Чаще всего инфекция протекает бессимптомно. Дополнительные трансаминазы наблюдаются в дополнительных исследованиях. Симптомы инфекции включают тепловую лихорадку, желудочно-кишечные симптомы, мышечную боль, недомогание, увеличение печени и селезенки и перегрузку кожи.
Курс вакцинации Пентаксим состоит из 3 инъекций по одной дозе вакцины (0.5 мл) с интервалом 1 -2 месяца, начиная с 3-х месячного возраста. Ревакцинацию осуществляют.
Курс вакцинации Пентаксим состоит из 3 инъекций по одной дозе вакцины (0.5 мл) с интервалом 1-2 месяца, начиная с 3-х месячного возраста. Ревакцинацию осуществляют введением 1 дозы Пентаксим в возрасте 18 месяцев жизни.
Правила введения Пентаксима ребенку, перенесшему острое заболевание
Болезнь в большинстве случаев является самонадеянной, хотя есть случаи ошеломляющего курса, ведущего к разрушению печени. Профилактика гепатита типа А основана на уважении гигиены пищевых продуктов. Важно мыть руки и использовать проверенную воду. Вакцинация против А может быть назначена более 1 года. Вакцинация состоит из 2 доз, даваемых в течение 6-12 месяцев или 6-18 месяцев. Целесообразно вакцинировать людей, путешествующих и детей в детских садах. Защита от заболевания появляется через 15 дней после начала вакцинации.
В соответствии с Национальным календарем профилактических прививок Российской Федерации, курс вакцинации для профилактики дифтерии, столбняка, коклюша и полиомиелита состоит из 3-х введений препарата с интервалом в 1,5 месяца, в возрасте 3, 4.5 и 6 месяцев соответственно; ревакцинация проводится однократно в возрасте 18 месяцев.
Могут ли клиники и больницы использовать вакцины из старых запасов, содержащих это соединение? Имеют ли они объемную упаковку? Кто несет ответственность в нашей стране за осложнения после вакцинации? Является ли вакцинированный врач, производитель вакцины, уполномоченным органом по лицензированию сбыта или страной вакцинации?
Эрнест Кучар Кафедра педиатрии и инфекционных болезней Медицинский университет Вроцлава. Подавляющее большинство существующих вакцин не содержит тиомерсал. Как правило, тиомерсал содержит многодозовые упаковки. Комбинированные вакцины, например 5 — и 6-валентные, не содержат тиомерсал. Больницы и поликлиники могут использовать лекарства с действительным сроком годности, если только они не были выведены с рынка, включая старые запасы вакцин. Состав вакцин является общедоступным и всегда можно найти в брошюре или на веб-сайте Управления по регистрации лекарственных средств, медицинских приборов и биоцидных продуктов.
При нарушении графика вакцинации последующие интервалы между введением очередной дозы вакцины не изменяются, в том числе, интервал перед 4-й (ревакцинирующей) дозой -12 мес
Если первая доза Пентаксима была введена в возрасте 6-12 мес, то вторая доза вводится через 1.5 мес после первой, а в качестве 3-й дозы, вводимой через 1.5 мес после второй, должна использоваться вакцина для профилактики дифтерии, столбняка; коклюша и полиомиелита, исходно представленная в шприце (т е. без разведения лиофилизата во флаконе (Hlb)) В качестве ревакцинирующей (4-й дозы) используется обычная доза Пентаксима (с разведением лиофилизата (Hlb)).
Поскольку возможны изменения, проверьте текущий буклет. Вакцины, содержащие тиомерсал в Польше, представлены в таблице. Как правило, когда дело доходит до источника ртути в организме, более важно есть рыбу, которая часто заражается опасной метилртути.
Что касается ответственности за прививки, то это потому, что это медицинское лечение, поэтому ответственность за надлежащую квалификацию для вакцинации — это врач. Чтобы принять юридические меры, проконсультируйтесь с вашим адвокатом. Она сказала: Вы хотите дать вашему ребенку устаревшую вакцину? Они, конечно, хуже, почему они связали их? Молодая мама смутила и приняла решение о многокомпонентном продукте.
Если первая доза Пентаксима вводится в возрасте после 1 года жизни, то для 2-й, 3-й и 4-й (ревакцинирующей) дозы должна использоваться вакцина для профилактики дифтерии, столбняка, коклюша и полиомиелита, исходно представленная в шприце, без разведения лиофилизата во флаконе (Hlb).
| Первая прививка, возраст ребенка (вводится полный препарат Пентаксим) | Вторая прививка (через 1.5 мес), вводится: | Третья прививка (через 1.5 мес), вводится: | Ревакцинация (через 12 мес), вводится |
| до 6 мес | полный препарат Пентаксим | полный препарат Пентаксим | полный препарат Пентаксим |
| 6-12 мес | полный препарат Пентаксим | полный препарат Пентаксим | |
| после 12 мес | Пентаксим без разведения лиофилизата Hlb во флаконе | Пентаксим без разведения лиофилизата ШЬ во флаконе | Пентаксим без разведения лиофилизата Hlb во флаконе |
Во всех случаях нарушения графика вакцинации, врач должен руководствоваться Национальным календарем профилактических прививок Российской Федерации.
Однако, в заявлении медсестры не было ничего существенного, тогда в этом направлении? В дополнение к бесспорным достоинствам, они также имеют свои недостатки. Они были созданы, чтобы уменьшить количество ударов, что избавляет ребенка от боли. Хотя реакция ребенка на вакцинацию во многом зависит от личности ребенка и отношения родителя.
Менее антиген лучше переносится, наиболее распространенными постгерпетическими реакциями являются покраснение и отек. Он защищает от коклюша, но не защищает от бактериальной инфекции и является источником распространения зародыша. Существует меньше вспомогательных веществ, но они не отличаются количественно с точки зрения антимикробных антигенов от одиночных вакцин.
Один укол — щит от пяти инфекцийВакцинация — крайне сложная тема для всех родителей. Как только они получают приглашение на прививку, начинают мучиться сомнениями — делать или не делать? А если соглашаться, то какую вакцину, импортную или отечественную, лучше выбрать? В центре нашего внимания — прививка пентаксим. От чего она защитит ребенка и какие побочные эффекты может вызвать?
Это щадящие расходы, особенно когда родитель дополнительно решает рекомендуемые прививки. Как это ни парадоксально, бывают ситуации, когда отсутствует многокомпонентная вакцина. Это связано с диспропорцией спроса и предложения. То, что Польша получает в так называемом.
Что делать, если вакцины отсутствуют?
Второй рулон. Национальный педиатрический консультант советует, чтобы в исключительных ситуациях использовали эквивалент вакцины, например, произведенный другой компанией. Производитель, принимающий решение о вакцинации, может быть проигнорирован производителем. К сожалению, однако, мало что можно сделать, чтобы избежать бессмысленного распространения аптек в нынешней ситуации относительно наличия вакцин, доступных на веб-сайте Главной санитарной инспекции.
Столбняк, коклюш, дифтерия, полиомиелит часто поражают именно маленьких детей. Переносятся эти болезни крайне тяжело, кроме того, они могут быть опасны для жизни малыша, поэтому вакцинация против этих недугов просто обязательна. Сегодня для создания искусственного иммунитета к перечисленным инфекциям можно использовать импортный поливалентный препарат Пентаксим. Такие прививки, сделанные детям, позволят выработать стойкий иммунитет к этим четырем недугам, а также к ХИБ-инфекциям (их вызывает гемофильная палочка типа В).
Несомненным плюсом является тот факт, что они доступны и бесплатны. Затем сэкономленные деньги можно использовать для дополнительных вакцинаций, таких как пневмококковая, менингококковая, ротавирусная или оспа-вакцина. Оба компенсированных и многокомпонентных препарата будут иммунизированы против одних и тех же заболеваний за тот же период времени, в случае.
Американские исследования проводились среди детей со старшими братьями и сестрами. В результате дальнейшие ученые развеяли сомнения молодых людей, ожидающих первого ребенка. Также польские специалисты — ведущий польский неонатолог и известный педиатр — подтверждают: вакцины не соответствуют действительности, и дети вакцинированы.
Вакцина составлена из двух частей. Первая представляет собой шприц, заполненный мутноватой суспензией. В ней находятся уже готовые столбнячные, дифтерийные и коклюшные анатоксины и мертвые вирусы полиомиелита. Вторая — это флакон, куда помещен сухой лиофилизат.
Как и когда вводят Пентаксим?Важно! Если ребенку сделана такая прививка, это не значит, что он получит абсолютную защиту от всех видов менингита, сепсиса и пневмонии, так как эти болезни может вызывать не только гемофильная палочка. Поэтому при появлении у привитого ребенка любых признаков, указывающих на какое-либо из этих заболеваний, срочно звоните в скорую!
Нет надежных исследований влияния вакцин на развитие аутизма у детей, — подчеркивает проф. Эва Хельвич, национальный консультант по неонатологии. Болена Кочишевска-Наджман, специалист в области педиатрии и неонатологии, напомнила, что сомнения в отношении вакцинации появились в начале года.
Затем вирус вакцины попадает в центральную нервную систему, что является прямой причиной аутизма. Как вы думаете, вы должны вакцинировать своих детей? Сам автор, доктор Уэйкфилд, был признан мошенничеством, и суд запретил ему заниматься профессией врача, — говорит док. Не существует достоверных исследований влияния вакцин на развитие аутизма у детей.
Курс включает три инъекции с интервалом в 1,5 месяца. Первый укол предписывается сделать в 3 месяца, затем — в 4,5 и 6 месяцев. Ревакцинация назначается на 18 месяцев. Если график сместился, то все равно надо соблюдать полуторамесячный перерыв между первыми тремя вакцинациями и 12 месяцев между последней прививкой и ревакцинацией.
Что вызывает аутизм? — Аутизм — это глобальное расстройство развития, которое все чаще признается у самых молодых, — объясняет док. Среди факторов превентивного риска гипертензия, протеинурия, судороги, сахарный диабет, беременность, а также расширенный родительский возраст и материнские препараты во время беременности имеют наивысшее значение. — Недавние исследования показывают, что значительно выше риск аутизма у детей, которые родились преждевременно. Третий триместр — это период интенсивного развития мозга.
Ребенок должен справиться за пределами своей природной среды, которая была животом матери, — говорит проф. Вот почему врачи призывают родителей не отказываться от вакцинации своих детей. Современные вакцины безопасны. Они не подавляют иммунную систему, потому что они содержат один белок — перечисляют док. При туберкулезе или болезни Гейне-Медина добавляет проф. Современные ассоциированные вакцины безопасны.
Если первый укол был сделан в период с 6 по 12 месяцы, то для третьей дозы уже не применяют лиофизилат, а ревакцинацию проводят полной дозой (суспензия плюс сухая часть).
Если первая доза препарата была введена ребенку старше года, то для всех остальных инъекций применяют только суспензию без лиофизилата.
К чему должны быть готовы родители?Важно! Обязательно проконтролируйте, чтобы вакцину достали из холодильника в Вашем присутствии. Проверьте срок годности. Прежде чем ввести малышу, ее должны нагреть до комнатной температуры (мама может продержать ее пару минут в ладонях). Это позволит избежать местных реакций. После разведения вакцина должна иметь беловатый оттенок и не содержать включений.
Конечно, вакцинация может привести к нежелательным реакциям после вакцинации. Однако мы наблюдаем их крайне редко, и они не являются серьезными, — говорит док. По ее мнению, гораздо более «плохие» могут привести к кампании, работающей в Интернете. Хотите иметь лучшие статьи в одном месте?
Вакцинация или нет? — такой вопрос задают многие родители. Они не знают, безопасны ли вакцины для их ребенка. Будет ли вакцинация действительно защищать ребенка от болезни или, может быть, наоборот — вызовет ли она это? Ребенок рождается из так называемого. Первичное сопротивление. К сожалению, защитных антител этих матерей хватает только на первые три месяца после рождения. Затем, до девятого месяца жизни, иммунная система ребенка становится слабее и слабее. Он учится только распознавать врага, т.е. вирусы и бактерии и продуцируют соответствующие антитела против них.
После применения Пентаксима возможны такие местные и общие побочные эффекты:
- болезненность, покраснение, уплотнение, отек размером до 5 см в месте инъекции. Эти реакции развиваются на протяжении 48 часов после нее и проходят сами по себе;
- расстройство сна, беспокойство, сонливость, плач;
- рвота;
- проблемы со стулом;
- крапивница;
- снижение АД;
- редко — судороги;
- в исключительных случаях — анафилаксия.
Один из самых распространенных нежелательных эффектов после прививки Пентаксим — температура (до 38,5˚, максимум 39˚) Ее подъем может наблюдаться на протяжении 24-72 часов. Она держится от 3 до 5 дней и не требует обращения к врачу (достаточно использовать жаропонижающее), если не сопровождается судорогами и длительным необычным плачем.
С вакцинами они учатся быстрее и эффективнее. Вакцина — это не что иное, как ослабленные организмы или смертельные патогенные микробы, которые провоцируют иммунную систему на продуцирование антител. Это тренировка, которая подготавливает организм к немедленной идентификации микробов и отправке антител к ним. Эта армия либо защищает ребенка от инфекции, либо, по крайней мере, решает его курс. Для того, чтобы приобретенный иммунитет сохранялся в течение длительного времени, Напоминая дозу вакцины.
Обязательный: туберкулез. Обязательно: корь, эпидемический паротит, краснухаРекомендуемые: ветряная оспа. Обязательно: корь, туберкулез Рекомендуется: свинка, краснуха. Обязательно: краснуха Рекомендуется: краснуха. Большинство детей не испытывают никаких реакций или осложнений после введения вакцины. Иногда возникают переходные, нелокальные реакции.
Как отзывается о прививке Пентаксим доктор Комаровский? Его мнение таково: это одна из новых бесклеточных вакцин, пришедшая на смену устаревшим ацеллюлярным препаратам, например, АКДС. Она является менее реактогенной, потому что в ней нет бактериальной мембраны, провоцирующей постпрививочные осложнения. В то же время это высокоиммуногенная вакцина. Она обеспечит крепкий иммунитет и надежно защитит ребенка сразу от пяти опасных детских болезней.
Вакцинация — когда не указано?
Не применяйте компрессы или придерживайтесь патчей, которые препятствуют доступу к воздуху. После вакцинации против кори некоторые дети имеют симптомы, сходные с обычной простудой или кратковременной сыпью. Ребенок может оставаться 1-2 дня дома. Иногда у детей наблюдается лихорадка после вакцинации. На более высоком уровне вы должны связаться со своим педиатром.
- Это место не должно быть уничтожено салициловым духом!
- Ребенок может мыть и купаться.
- Эти жалобы быстро исчезают.
Читайте также:
Таким образом, известный педиатр полагает, что французский аналог АКДС — более надежный препарат. При его применении риск развития тяжелых побочных реакций гораздо ниже, чем при использовании отечественной вакцины. Если родители самостоятельно приобретут Пентаксим, то должны держать его в холодильнике (лучше, чтобы он полежал до момента прививки в аптеке).
Что говорят о французской вакцине родители?Большинство родителей боятся делать АКДС, потому что она довольно часто вызывает тяжелые реакции. Но, учитывая, от чего спасает такая прививка, они опасаются от нее отказываться и согласны приобрести дорогую вакцину Пентаксим, которая позволит избежать опасных последствий.
Как же малыши переносят прививку Пентаксим? Отзывы в 70 % случаев положительные, у большинства родителей, оставивших отклик, дети пережили введение вакцины более-менее спокойно. Укол делается тоненькой иглой и практически не вызывает боли, хотя малыш все же может плакать.
В первый день после прививки может подняться температура. Как правило, она не превышает 38˚. Но обычно все ограничивается тем, что ребенок становится более капризным, а градусник показывает до 37,2˚. Однако родители советуют все же подготовиться — за 2 дня до процедуры пропить Фенистил или капли Зиртек (по 4 кап.) и купить в аптеке жаропонижающие (свечи Вибуркол, Панадол, Нурофен), чтобы дать их малышу, если температура превысит 38,5˚. Накануне и в день прививки надо постараться избегать контактов с посторонними людьми, не вводить в рацион ничего нового.
В редких случаях, как отмечают родители, развиваются такие осложнения: конечность, куда был сделан укол, сильно отекает, температура держится 3-5 суток, причем может превышать 39˚ и даже вызывать судороги. Но врачи объясняют, что такие проблемы бывают у детей с невралгиями, тех, кто имеет склонность к аллергическим реакциям, либо у малышей, которые на момент прививки оказались не вполне здоровы.
Сравнительная оценка предотвращаемого социально-экономического ущерба при различных подходах к профилактике вакциноуправляемых инфекций в рамках Национального календаря профилактических прививок | Брико
1. Брико Н. И., Фельдблюм И. В. Современная концепция развития вакцинопрофилактики в России. // Эпидемиология и Вакцинопрофилактика. 2019. Том 19, № 5. С.4 — 13.
2. Намазова-Баранова Л. С, Федосеенко М. В., Баранов А. А. Новые горизонты Национального календаря профилактических прививок//Вопросы современной педиатрии. 2019. Т. 18. № 1. С.13 — 30.
3. World Health Organization. Global Immunization Vision and Strategy. Доступно на: www.who.int/vaccines-documents/DocsPDF05/GIVS_Final_EN.pdf.
4. World Health Organization. More than 140,000 die from measles as cases surge worldwide. Доступно на: https://www.who.int/news-room/detail/05-12-2019-more-than-140-000-die-from-measles-as-cases-surge-worldwide (дата обращения 30.01.2020).
5. На пороге эпидемии. Почему в Украину вернулись корь, дифтерия и коклюш [статья]. // Фокус (ежедневный новостной интернет-ресурс) Доступно на:: https://focus.ua/ukraine/413141-na-konchike-igly.
6. Дифтерия в России в 21 веке. //Эпидемиология и Вакцинопрофилактика. 2017. № 5. С. 4 — 14.
7. Maman K1, Zollner Y, Greco D at al. The value of childhood combination vaccines: From beliefs to evidence. // Human Vaccines & Immunotherapeutics. 2015. № 11 (9). Р. 2132-2214
8. Харит С. М., Брико Н. И. Актуальные проблемы вакцинопрофилактики и способы их решений: опыт экспертного совета по здравоохранению комитета Совета Федерации по социальной политике//Медицинские технологии. Оценка и выбор. 2014. № 3. С.32-36
9. Ozawa S, Portnoy A, Getaneh H.,et al., Modeling The economic burden of adult vaccine-preventable diseases in the united states. // Health Affairs, 2016.
10. Проект ведомственного акта Минздрава России «Об утверждении национального календаря профилактических прививок, календаря профилактических прививок по эпидемическим показаниям и порядка проведения профилактических прививок». Доступно на: https://regulation.gov.ru/projects#npa=95954.
11. Приказ Министерства здравоохранения РФ от 21.03.2014 №125н «Об утверждении национального календаря профилактических прививок и календаря профилактических прививок по эпидемическим показаниям»
12. Михеева И. В., Акимова Ю. И., Михеева М. А. Применение пятикомпонентной вакцины АаКДС-ИПВ/Hib в рамках национального календаря профилактических прививок. //Педиатрическая фармакология. 2019. Т. 16, № 3. С. 171-179.
13. Murray CJ, Vos T, Lozano R at al. Disability-adjusted life years (DALYs) for 291 diseases and injuries in 21 regions, 1990-2010: a systematic analysis for the Global Burden of Disease Study 2010. // Lancet. 2012. № 380 (9859).
14. Foreman KJ, Marquez N, Dolgert A at al. Forecasting life expectancy, years of life lost, and all-cause and cause-specific mortality for 250 causes of death: reference and alternative scenarios for2016-40 for 195 countries and territories//Lancet. 2018. № 392. Р. 2052-2090.
15. Прохоров Б. Б., Шмаков Д.И. Оценка стоимости статистической жизни и экономического ущерба от потерь здоровья//Проблемы прогнозирования. 2002. № 3. С. 125-135.
16. Государственный доклад «О состоянии санитарно-эпидемиологического благополучия населения в Российской Федерации в 2018 году». Роспотребнадзор. 2019.
17. Платонов А. Е., Николаев М. К., Королева И. С. и др. Проспективное популяционное изучение заболеваемости гнойными менингитами у детей в возрасте до 5лет в 8 городах России//Эпидемиология и инфекционные болезни. 2009. № 4. С. 133-143.
18. Методические рекомендации. МР3.3.1.0001-10 «Эпидемиология и вакцинопрофилактика инфекции, вызываемой Haemophilus influenzae типа b.», утверждены Главным государственным санитарным врачом РФ 31.03.2010.
19. Клинические рекомендации Министерства здравоохранения Российской Федерации. Внебольничные пневмонии, 2018.
20. Клинические рекомендации по вакцинопрофилактике гемофильной инфекции типа b у детей, Министерство здравоохранения Российской Федерации, Союз педиатров России. 2016.
21. Сведения об инфекционных и паразитарных заболеваниях за январь-декабрь 2018. Роспотребнадзор, Федеральный центр гигиены и эпидемиологии. Доступно на: https://rospotrebnadzor.ru/activities/statistical-materials/statictic_details.php?ELEMENT_ID=11277.
22. Материалы Координационного центра профилактики полиомиелита и энтеровирусной (неполио) инфекций «Основные качественные показатели эпидемиологического надзора за ПОЛИО/ОВП в РФ (январь-август 2019 г.)». // Информационный бюллетень «Эпидемиологический надзор за ПОЛИО/ОВП в субъектах Российской Федерации». 2019. Доступно на: https://www.fcgie.ru/page,7,koord_tsentr.html (дата обращения 30.07.2019).
23. Харит С. М., Покровский В. С, РулёваА. А., Фридман И. В. Программаэрадикации полиомиелита ВОЗ:проблемы и решения. //Педиатрическая фармакология. 2016. Т. 13. № 3. С. 289-298
24. Междисциплинарное совещание экспертов «Нерешенные вопросы эпидемиологии коклюша в РФ и новые возможности его вакцинопрофилактики». // Эпидемиология и Вакцинопрофилактика. 2018. № 17 (4). С. 63-67.
25. Decker M., Bogaerts H., Edwards K. Combination vaccines. In: Vaccines. 5th edition. Plotkin S. A., Orenstein W., OffitP. A. (Eds). USA, Saunders Co., PA. 2008. Р. 1069-1101.
26. Pichichero M. E. New combination vaccines. // Pediatr. Clin. North. Am. 2000. № 47 (2). Р. 407-426.
27. Суетина И. Г., Иллек Я. Ю., Хлебникова Н. В. и др, Проблема своевременности вакцинации детей раннего возраста и пути ее решения//Эпидемиология и вакцинопрофилактика. 2019. Т.19, № 5. С. 85-89
28. Haemophilus influenzae type b (Hib) Vaccination Position Paper. WHO. //Weekly epidemiological record — 2013. -№ 88 (39). — Р. 413-28
29. Харит С. М., Иозефович О. В., Рулева А.А. и др. Оценка безопасности и реактогенности комбинированной вакцины «Пентаксим». //Эпидемиология и инфекционные болезни. Актуальные вопросы. 2017. № 2. С. 62-66.
обзор 16-летнего клинического опыта
Expert Rev. Vaccines 10 (7), (2011)
1002
Vaccine Profile Plotkin, Liese, Madhi & Ortiz
12 Decker M, Bogaerts H, Edwards K.
Комбинированные вакцины. В кн .: Вакцины. 5-е издание
. Плоткин С.А., Оренштейн В., Оффит ПА
(Ред.). Saunders Co., PA, USA 1069–1101
(2008).
• Обзор комбинированных вакцин.
13 Вт JP, Wolfson LJ, O’Brien KL et al.
Бремя болезней, вызываемых Haemophilus
гриппом типа b среди детей младше
5 лет: глобальные оценки. Ланцет 374 (9693),
903–911 (2009).
14 Всемирная организация здравоохранения. Дифтерия
позиционный документ. Wkly Epidemiol. Рек. 81 (3),
24–32 (2006).
15 Всемирная организация здравоохранения. Позиционный документ по столбняку
. Wkly Epidemiol. Рек. 81 (20),
198–208 (2010).
16 Всемирная организация здравоохранения.Инактивированная вакцина против полиовируса
после прекращения применения вакцины против перорального полиовируса
. Wkly Epidemiol. Рек.
81 (15), 137–144 (2006).
17 центров по контролю и профилактике заболеваний.
Рекомендуемая иммунизация детей
График— США, 2001 г. MMWR
50 (1), 1–3 (2001).
18 центров по контролю и профилактике заболеваний.
Обновленная информация о полиовирусах вакцинного происхождения —
во всем мире, январь 2006 г. — август 2007 г.
MMWR 56 (38), 996–1001 (2007).
19 Heymann DL, Sutter RW, Aylward RB. Глобальный призыв
к выпуску новых вакцин против полиомиелита. Nature
434 (7034), 699–700 (2005).
20 Кью О.М., Саттер Р.В., де Гурвилль Е.М.,
Даудл В.Р., Палланш М.А. Вакцина-
Полиовирусы, полученные из, и стратегия endga me
для глобальной ликвидации полиомиелита. Анну.
Ред. Microbiol. 59, 587–635 (2005).
21 Всемирная организация здравоохранения.Внедрение
инактивированной полиовакцины в страны, использующие пероральные
вакцины против полиовируса. Wkly
Epidemiol. Рек. 78 (28), 241–252 (2003).
22 Всемирная организация здравоохранения. Вакцина
производных отполиовирусов — обновленная информация. Wkly
Epidemiol. Рек. 81 (42), 398–404 (2006).
23 Вашишта В.М., Калра А., Джон Т.Дж.,
Такер Н., Агарвал Р.К.
Рекомендации 2-го Национального консультативного совещания
Индийской академии
педиатрии по искоренению полиомиелита
и улучшению рутинная
иммунизация.Indian Pediatr. 45 (5),
367–378 (2008).
24 центра по контролю заболеваний и
профилактики. Профилактика полиомиелита в США
. Обновленные рекомендации
Консультативного комитета по практике иммунизации
. MMW R 49, 1–22
(2000).
25 Bonnet MC, Dutta A. Мировой опыт
с инактивированной вакциной против полиовируса
. Vaccine 26 (39), 4978–4983
(2008).
26 Decker MD, Edwards KM, Steinhoff MC
et al. Сравнение 13 бесклеточных коклюшных вакцин
: побочные реакции. Педиатрия 96 (3
Pt 2), 557–566 (1995).
27 Pichichero ME, Deloria MA, Rennels MB
et al. Безопасность и иммуногенность
Сравнение 12 бесклеточных коклюшных вакцин
и одной цельноклеточной коклюшной вакцины
, введенных четвертой дозой детям в возрасте от 15 до
в возрасте 20 месяцев.Педиатрия 100 (5),
772–788 (1997).
28 Beutels P, Bonanni P, Tormans G,
Canale F, Crovari PC. Экономическая оценка
вакцинации против коклюша
в Италии. Vaccine 17 (19),
2400–2409 (1999).
29 Ekwueme DU, Strebel PM, Hadler SC,
Meltzer MI, Allen JW, Livengood JR.
Экономическая оценка использования вакцины против дифтерии,
столбняка и бесклеточного коклюша или
вакцины против дифтерии, столбняка и цельноклеточной
коклюшной вакцины в США,
1997.Arch. Педиатр. Adolesc. Med. 154 (8),
797–803 (2000).
30 Tormans G, Van Doorslaer E, Van
Damme P, Clara R, Schmitt HJ. Экономическая
оценка профилактики коклюша с помощью
цельноклеточной и бесклеточной вакцины в
Германии. Евро. J. Pediatr. 157 (5), 395–401
(1998).
31 Thisyakorn U, Montellano M, Ortiz E,
Lane A. Обзор схем введения вакцины против гепатита B
младенцам.
Представлено на 5-м Азиатском педиатрическом конгрессе
Инфекционные болезни. Тайбэй, Тайвань, 23–26
сентября 2010 г.
32 Capeding MR, Cadorna-Carlos J,
Book-Montellano M, Ortiz E.
Иммуногенность и безопасность DTaP–
IPV // PRP ~ Комбинированная вакцина T
с вакциной против гепатита B: рандомизированное открытое испытание
. Бык. Всемирный орган здравоохранения.
86 (6), 443–451 (2008).
•• Первичная серияиммуногенностьиsafet y
Испытаниена Филиппинах, после
Pentaxim ™ вна6, 10,
14 «Недельный» график.
33 Dutta AK, Verghese VP, Pemde HK,
Mathew LG, Ortiz E. Иммуногенность и
безопасность пятивалентной дифтерии, столбняка,
бесклеточного коклюша, комбинации инактивированного полиовируса,
ue вакцина (Пентаксим) с вакциной против гепатита
. Indian Pediatr. 46 (11),
975–982 (2009).
•• Первичная серияиммуногенностьиsafet y
Испытаниев Индии, после Penta xim
Администрацияна6, 10, 14 неделя
график.
34 Мадхи С.А., Катленд С., Джонс С., Ортис Э.
Антитела после первичной вакцинации
Устойчивость и иммуногенность / безопасность бустерной вакцины
DTaP – IPV // PRP ~ T у
младенцев из Южной Африки 18-19
мес. Программы и тезисы 26-го конгресса
Международной педиатрической ассоциации
педиатрии. Йоханнесбург, Южная Африка
(2010).
35 Мадхи С.А., Катленд С., Джонс С., Ортис Э.
Иммуногенность и безопасность бесклеточного
коклюш, дифтерия, столбняк, инактивированный
полиовирус, комбинированный Hib-конъюгат
вакцина (Pentaxim ™) и моновалентная
вакцина против гепатита B
на сроке 6, 6 месяцев возраст младенцев в Южной Африке. S. Afr.
Мед. J. 101, 126–131 (2011).
36 Канра Г., Силиер Т., Юрдакок К. и др.
Исследование иммуногенности комбинированной вакцины
против дифтерии, столбняка, бесклеточного коклюша,
инактивированной вакцины против полиомиелита, используемой для
восстановления лиофилизированной вакцины Haemophilus
в вакцине buenzae типа B-
-9V / DTaP / одновременно свакциной против гепатита В через два, три и четыре
месяцев жизни.Vaccine 18 (9–10), 947–954
(1999).
37 Li RC, Li FX, Li YP и др. Иммуногенность
и безопасность пятивалентной бесклеточной
комбинированной вакцины против коклюша, включая
дифтерии, столбняка, инактивированного полиовируса
и конъюгированного Haemophilus в uenzae
2, полисахарид типа b
,
, полисахарид типа b
,
для первичной вакцины 5 месяцев возраста
у младенцев в Китае. Vaccine 29 (10),
1913–1920 (2011).
38 La ngue J, David T., Roussel F, Pines E,
Hoffenbach A. Безопасность и иммуногенность
вакцин DTaP – IPV и Act-Hib
, вводимых в комбинации или по отдельности
младенцам в возрасте 2 лет. 3-х и 4-х месячный возраст.
Программы и тезисы 15-й ежегодной встречи
Европейского общества по
Детским инфекционным заболеваниям. Париж, Франция
(1997).
39 Mallet E, Hoffenbach A, Salomon H,
Blondeau C, Fritzell B.Первичная
иммунизация комбинированной бесклеточной вакциной
DTaP – IPV – Act-HIB, вводимая в возрасте
2–3–4 или 2–4–6 месяцев. Программы
и Рефераты 14-го Европейского общества
по детским инфекционным заболеваниям. Elisnore,
Дания (1996) (Реферат 19).
40 Reinert P, Boucher J, Pines E, Leroux MC,
Hoffenbach A, Salomon H. Первичная или
бустерная иммунизациявакциной DTaP – IPV
Экспертный обзор вакцин, загруженный с сайта informahealthcare.com от 41.234.15.214 от 20.05.14
Только для личного пользования.
ПРАЙМ PubMed | Иммуногенность и безопасность бустерной инъекции DTap-IPV // Hib (пентаксим), вводимой одновременно с тетравалентной вакциной против денге здоровым детям в возрасте 15-18 месяцев в Мексике: рандомизированное исследование
Citation
Melo, Flor Irene Rodriguez, et al. al. «Иммуногенность и безопасность бустерной инъекции DTap-IPV // Hib (пентаксим), вводимой одновременно с тетравалентной вакциной против денге здоровым детям в возрасте 15-18 месяцев в Мексике: рандомизированное исследование.» The Pediatric Infectious Disease Journal, vol. 36, no. 6, 2017, pp. 602-608.
Melo FIR, Morales JJR, De Los Santos AHM, et al. Иммуногенность и безопасность бустерной инъекции DTap -IPV // Hib (пентаксим), вводимый одновременно с тетравалентной вакциной против денге здоровым малышам в возрасте 15-18 месяцев в Мексике: рандомизированное исследование. Pediatr Infect Dis J .2017; 36 (6): 602-608.
Мело, FIR, Моралес, JJR, Де Лос Сантос, AHM, Ривас, Э., Винье, К., & Норьега, Ф. (2017). Иммуногенность и безопасность бустерной инъекции DTap-IPV // Hib (пентаксим), вводимой одновременно с тетравалентной вакциной против денге здоровым детям в возрасте 15-18 месяцев в Мексике: рандомизированное исследование. Журнал детских инфекционных болезней , 36, (6), 602-608. https://doi.org/10.1097/INF.0000000000001542
Melo FIR, et al. Иммуногенность и безопасность бустерной инъекции DTap-IPV // Hib (пентаксим), вводимой одновременно с тетравалентной вакциной против денге здоровым детям в возрасте 15-18 месяцев в Мексике: рандомизированное исследование. Pediatr Infect Dis J. 2017; 36 (6): 602-608. PubMed PMID: 28067718.
TY — JOUR T1 — Иммуногенность и безопасность бустерной инъекции DTap-IPV // Hib (пентаксим), вводимой одновременно с тетравалентной вакциной против денге здоровым малышам в возрасте 15-18 месяцев в Мексике: рандомизированное исследование. Австралия — Мело, Флор Ирен Родригес, AU — Моралес, Хосе Хуан Рентерия, Австралия — Де Лос Сантос, Абьель Омеро Маскареньяс, AU — Ривас, Энрике, AU — Винь, Клэр, AU — Норьега, Фернандо, PY — 2017/1/10 / pubmed PY — 2017/6/21 / medline PY — 2017/1/10 / entrez SP — 602 EP — 608 JF — Журнал детских инфекционных болезней JO — Педиатр Infect Dis J ВЛ — 36 ИС — 6 N2 — ИСТОРИЯ ВОПРОСА: Живая аттенуированная четырехвалентная вакцина против денге (CYD-TDV) лицензирована в ряде эндемичных по денге стран для лиц в возрасте ≥9 лет.Перед включением какой-либо вакцины в графики вакцинации детей необходимо продемонстрировать отсутствие иммунного вмешательства и приемлемую безопасность при одновременном применении с другими рекомендованными вакцинами. МЕТОДЫ. Это рандомизированное многоцентровое исследование III фазы проводилось в Мексике. Здоровые дети ясельного возраста (n = 732) получили бустерную дозу лицензированной пятивалентной комбинированной вакцины [дифтерии, столбняка, бесклеточного коклюша, инактивированной вакцины против полиомиелита и Haemophilus influenzae типа b (DTaP-IPV // Hib)] либо одновременно, либо последовательно, со второй доза CYD-TDV, вводимая по схеме из 3 доз.Титры антител к антигенам дифтерийного анатоксина, столбнячного анатоксина и коклюша измеряли с помощью иммуноферментного анализа. Антитела против полиовируса и серотипов денге определяли с помощью теста нейтрализации уменьшения образования бляшек. Не меньшая эффективность была продемонстрирована для каждого из антигенов DTaP-IPV // Hib, если нижняя граница двухстороннего 95% доверительного интервала разницы в уровнях сероконверсии между двумя группами (CYD-TDV и плацебо) составляла ≥10%. Была оценена безопасность обеих вакцин.РЕЗУЛЬТАТЫ: продемонстрирована неэффективность иммунного ответа для всех антигенов DTaP-IPV // Hib. После 3 доз CYD-TDV не наблюдалось различий в иммунном ответе на CYD-TDV между группами. Во время исследования не было проблем с безопасностью. ЗАКЛЮЧЕНИЕ: Совместное введение бустерной вакцины DTaP-IPV // Hib с CYD-TDV не оказывает наблюдаемого влияния на иммуногенность или профиль безопасности бустерной вакцины DTaP-IPV // Hib. Не наблюдалось различий в профиле CYD-TDV при одновременном или последовательном введении с бустерной вакциной DTaP-IPV // Hib.SN — 1532-0987 UR — https://www.unboundmedicine.com/medline/citation/28067718/immunogenicity_and_safety_of_a_booster_injection_of_dtap_ipv/hib__pentaxim%c2%ae__administered_concomitally_with_tetravalent_dengue_moncomitally_with_tetravalent_dengue_moncomitally_with_tetravalent_dengue_moncomitally_with_tetravalent_dengue_moncomitally_with_tetravalent_dengue_mon_thrial_inaccine_index_vaccine_vaccine_vac L2 — https://doi.org/10.1097/INF.0000000000001542 БД — ПРЕМЬЕР DP — Unbound Medicine ER —
Годовая постпервичная персистенция антител и бустерный иммунный ответ на вакцину DTaP-IPV // PRP ~ T (Pentaxim), вводимую в возрасте 18-19 месяцев южноафриканским детям, примированным в возрасте 6, 10 и 14 недель с той же вакциной
- СА Мадхи
- C Катленд
- С Джонс
- M Groome
- Э Ортис
Абстрактные
Цель.Оценить иммуногенность и безопасность пятивалентной дифтерии, столбняка, бесклеточного коклюша, инактивированного полиовируса, бустерной вакцины на основе конъюгата полисахарида Hib.
Дизайн, постановка и участники. Вакцина DTaP-IPV // PRP ~ T (Pentaxim, семейная вакцина Sanofi Pasteur AcXim) была введена 182 здоровым детям в Южной Африке в возрасте 18-19 месяцев после примирования той же вакциной и моновалентной вакциной против гепатита B в 6 лет. , Возраст 10 и 14 недель.
Показатели результата. Скорость серопротекции (SP) и сероконверсии (SC), средние геометрические титры (GMT) и концентрации (GMC) оценивались до и через 1 месяц после бустерной дозы.Безопасность оценивалась по отчетам родителей.
Результаты. Через месяц после первичной вакцинации не менее 94,3% участников были защищены от столбняка (≥0,01 МЕ / мл), дифтерии (≥0,01 МЕ / мл), полиовируса (≥8 1 / разл) и инфекции Haemophilus influenzae типа b (Hib). (≥0,15 мкг / мл). Перед бустерной дозой уровни SP составляли от 65,7% до 100%. Через месяц после бустерной дозы частота SP составила 97,7% для Hib (титр антител к PRP ≥1,0 мкг / мл), 100,0% для дифтерии (≥0,1 МЕ / мл) и 100% для столбняка (≥0.1 МЕ / мл) и полиовируса типов 1, 2, 3 (≥8 1 / разл.). По крайней мере, 95,7% участников имели четырехкратное повышение титров антител против коклюша после ревакцинации. GMTs увеличились с 11,21 до 465,51 EU / мл и с 12,89 до 520,35 EU / мл для анти-PT и анти-FHA соответственно. Anti-PRP GMT увеличился с 0,35 до 47,01 мкг / мл. Бустерная вакцина DTaPIPV // PRP ~ T переносилась хорошо, с лихорадкой ≥39,0 ° C только у 1,7% участников.
Выводы. Сохранение антител после прайминга было удовлетворительным. Пятивалентная бустерная вакцина DTaP-IPV // PRP ~ T была высокоиммуногенной и хорошо переносимой.
Авторские права принадлежат автору. Работа находится под лицензией Creative Commons Attribution — Noncommercial Works License. Авторы должны заполнить и подписать форму авторского соглашения, в которой изложены права автора и издателя и условия публикации.Форма соглашения должна быть загружена вместе с другими файлами представлений, и любое представление будет считаться неполным без его [готовится к печати].
Материалы, представленные для публикации в SAMJ , принимаются при условии, что они не были опубликованы или отправлены для публикации в другом месте. Пожалуйста, проинформируйте редакцию, если основные выводы вашей статьи были представлены на конференции и опубликованы в виде тезисов, чтобы избежать нарушения авторских прав. SAMJ не несет ответственности за заявления авторов.
Ранее опубликованные изображения
Если изображение / рисунок были ранее опубликованы, разрешение на его воспроизведение или изменение должно быть получено авторами от первоначального издателя, а в легенде рисунка должен быть указан полный указание на исходный источник. Этот кредит должен сопровождаться письмом, указывающим, что разрешение на воспроизведение изображения было предоставлено автору / авторам. Это письмо следует загрузить в качестве дополнительного файла при подаче.
Иммуногенность и безопасность бесклеточного коклюша, дифтерии, столбняка, инактивированного полиовируса, комбинированной Hib-конъюгированной вакцины (Pentaxim ™) и моновалентной вакцины против гепатита B в возрасте 6, 10 и 14 недель для младенцев в Южной Африке
- СА Мадхи
- C Катленд
- С Джонс
- M Groome
- Э Ортис
Абстрактные
Цель.Оценить данные об иммуногенности и безопасности для пятивалентной комбинированной вакцины, содержащей бесклеточный коклюш, инактивированный полиовирус и полисахарид-конъюгированные антигены Haemophilus influenzae (Hib). Методы. Вакцина DTaP-IPV // PRP ~ T (Pentaxim ™) вводилась 212 младенцам в возрасте 6, 10 и 14 недель в Южной Африке. Одновременно вводилась моновалентная вакцина против гепатита В. Иммуногенность оценивалась с использованием показателей серопротекции и сероконверсии; Безопасность оценивалась путем мониторинга запрашиваемого места инъекции и системных нежелательных явлений, а также последующего мониторинга нежелательных нежелательных явлений и серьезных нежелательных явлений.Полученные результаты. Иммуногенность была высокой для каждого вакцинного антигена и аналогична контрольному исследованию, проведенному во Франции с использованием аналогичной схемы введения (возраст 2, 3 и 4 месяца). После третьей дозы 94,6% участников имели анти-PRP ≥0,15 мкг / мл. Среднее геометрическое значение титра антител против PRP (GMT) составляло 2,0 мкг / мл. Показатели серозащиты от дифтерии и столбняка (≥0,01 МЕ / мл), полиовируса типов 1, 2 и 3 (≥8 1 / разл. U) и гепатита B были 100%. GMT против полиомиелита были очень высокими, 1 453, 1 699 и 2 398 (1 / разл. U) для типов 1, 2 и 3 соответственно.Показатели сероконверсии / ответа вакцины на коклюшные антигены (4-кратное увеличение концентрации антител) составили 97,5% для PT и 83,9% для FHA. Выводы. Вакцина DTaP-IPV // PRP ~ T была высокоиммуногенной для младенцев в возрасте 6, 10 и 14 недель в Южной Африке, была совместима с моновалентной вакциной против гепатита B и хорошо переносилась.Авторские права принадлежат автору.Работа находится под лицензией Creative Commons Attribution — Noncommercial Works License. Авторы должны заполнить и подписать форму авторского соглашения, в которой изложены права автора и издателя и условия публикации. Форма соглашения должна быть загружена вместе с другими файлами представлений, и любое представление будет считаться неполным без его [готовится к печати].
Материалы, представленные для публикации в SAMJ , принимаются при условии, что они не были опубликованы или отправлены для публикации в другом месте.Пожалуйста, проинформируйте редакцию, если основные выводы вашей статьи были представлены на конференции и опубликованы в виде тезисов, чтобы избежать нарушения авторских прав. SAMJ не несет ответственности за заявления авторов.
Ранее опубликованные изображения
Если изображение / рисунок были ранее опубликованы, разрешение на его воспроизведение или изменение должно быть получено авторами от первоначального издателя, а в легенде рисунка должен быть указан полный указание на исходный источник.Этот кредит должен сопровождаться письмом, указывающим, что разрешение на воспроизведение изображения было предоставлено автору / авторам. Это письмо следует загрузить в качестве дополнительного файла при подаче.
Иммуногенность и безопасность бесклеточного коклюша, дифтерии, столбняка, инактивированного полиовируса, комбинированной Hib-конъюгированной вакцины (PentaximTM) и моновалентной вакцины против гепатита B в возрасте 6, 10 и 14 месяцев для младенцев в Южной Африке | Мадхи
Оригинальные статьи
Иммуногенность и безопасность бесклеточного коклюша, дифтерии, столбняка, инактивированного полиовируса, комбинированной Hib-конъюгированной вакцины (PentaximTM) и моновалентной вакцины против гепатита B в возрасте 6, 10 и 14 месяцев для младенцев в Южной Африке
Шабир Ахмед Мадхи, Клэр Катленд, Стефани Джонс, Мишель Грум, Эстебан Ортис
Абстрактные
Цель.Оценить данные об иммуногенности и безопасности пятивалентной комбинированной вакцины, содержащей бесклеточный коклюш, инактивированный полиовирус и конъюгированные с полисахаридом антигены Haemophilus influenzae (Hib).
Методы. Вакцина DTaP-IPV // PRP ~ T (Pentaxim ™) вводилась 212 младенцам в возрасте 6, 10 и 14 недель в Южной Африке. Одновременно вводилась моновалентная вакцина против гепатита В.
Иммуногенность оценивалась с использованием показателей серопротекции и сероконверсии; Безопасность оценивалась путем мониторинга запрашиваемого места инъекции и системных нежелательных явлений, а также последующего мониторинга нежелательных нежелательных явлений и серьезных нежелательных явлений.
результатов. Иммуногенность была высокой для каждого вакцинного антигена и аналогична контрольному исследованию, проведенному во Франции с использованием аналогичной схемы введения (возраст 2, 3 и 4 месяца). После третьей дозы 94,6% участников имели анти-PRP ≥0,15 мкг / мл. Среднее геометрическое значение титра антител против PRP (GMT) составляло 2,0 мкг / мл. Показатели серозащиты от дифтерии и столбняка (± 0,01 МЕ / мл), полиовирусов типов 1, 2 и 3 (± 8 1 / разл. U) и гепатита B были 100%. GMT против полиомиелита были очень высокими, 1 453, 1 699 и 2 398 (1 / разл. U) для типов 1, 2 и 3 соответственно.Показатели сероконверсии / ответа вакцины на коклюшные антигены (4-кратное увеличение концентрации антител) составили 97,5% для PT и 83,9% для FHA.
Выводы. Вакцина DTaP-IPV // PRP ~ T была высокоиммуногенной для младенцев в возрасте 6, 10 и 14 недель в Южной Африке, была совместима с моновалентной вакциной против гепатита B и хорошо переносилась.
Принадлежность авторов
Шабир Ахмед Мадхи, Университет Витватерсранда
Клэр Катленд, Университет Витватерсранда
Стефани Джонс, Университет Витватерсранда
Мишель Грум, Университет Витватерсранда
Эстебан Ортис, Санофи Пастер
Полный текст
PDF (160 КБ)Ключевые слова
пятивалентная комбинированная вакцина; бесклеточный коклюш; инактивированная вакцина против полиомиелита; Hib-конъюгированная вакцина; иммуногенность; безопасность; График EPI
Цитируйте эту статью
Южноафриканский медицинский журнал 2011; 101 (2): 126-131.
История статей
Дата публикации: 2010-07-19
Дата публикации: 2011-01-27
Просмотры статьи
Просмотры аннотации: 2542
Просмотры полного текста: 1207
Комментарии к статье
* Ознакомьтесь с нашей политикой размещения комментариев здесьИммуногенность семивалентной пневмококковой конъюгированной вакцины, вводимой южноафриканским младенцам в возрасте 6, 14 и 40 недель
Аннотация
Фон
Высокая стоимость пневмококковой конъюгированной вакцины (ПКВ) и местные эпидемиологические факторы способствовали оценке различных схем дозирования ПКВ.В этом исследовании оценивалась иммуногенность семивалентной PCV (PCV7), вводимой через 6 недель; 14 недель и 9 месяцев.
Методы
250 здоровых младенцев, не контактировавших с ВИЧ, были иммунизированы ЦВС7 одновременно с другими вакцинами для детей. Концентрации серотип-специфических антикапсулярных IgG измеряли через месяц после введения 1 -й и 2 -й -й доз PCV, до и через две недели после 3-х -й дозы . Опсонофагоцитарный анализ киллинга (OPA) измеряли для трех серотипов после 2 -й и 3 -й -й доз PCV7.Иммуногенность нынешнего графика сравнивалась с историей когорт младенцев, которые получали PCV7 в возрасте 6, 10 и 14 недель.
Результаты
Доля младенцев с серотип-специфическими антителами ≥0,35 мкг / мл после 2 -й дозы PCV7 варьировалась от 84% для 6B до ≥89% для других серотипов. Устойчивые ответы антител наблюдались после дозы 3 rd . Доля детей с OPA ≥8 для серотипов 9V, 19F и 23F значительно увеличилась после 3 rd PCV7-дозы до 93.6%; 86,0% и 89,7% соответственно. Количественные концентрации антител после введения 2 -й дозы PCV7 были сравнимы с концентрацией после 3-х -й дозы по графику 6-10-14 недель. Средние геометрические концентрации (GMC) после 3 rd PCV7-дозы были выше для всех серотипов в этом исследовании по сравнению с исторической когортой.
Выводы
Изученный график дозирования PCV7 вызывал хорошие иммунные ответы, включая более высокие GMC после дозы 3 rd- через 9 месяцев по сравнению с дозой при введении в 14-недельном возрасте.Это может обеспечить более длительную стойкость антител и продолжительность защиты от пневмококковой инфекции.
Образец цитирования: Jones SA, Groome M, Koen A, Van Niekerk N, Sewraj P, Kuwanda L, et al. (2013) Иммуногенность семивалентной пневмококковой конъюгированной вакцины, вводимой младенцам из Южной Африки в возрасте 6, 14 и 40 недель. PLoS ONE 8 (8): e72794. https://doi.org/10.1371/journal.pone.0072794
Редактор: Бернард Билл, Центры по контролю и профилактике заболеваний, Соединенные Штаты Америки
Поступила: 23 мая 2013 г .; Принята к печати: 12 июля 2013 г .; Опубликовано: 28 августа 2013 г.
Авторские права: © 2013 Jones et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Исследование финансировалось исследовательским грантом Национального исследовательского фонда. Спонсор не принимал участия в планировании исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: SAM получил гонорары за работу в бюро докладчиков GSK и Pfizer, а также входил в состав консультативных советов по пневмококковой вакцине для GSK, Pfizer, Novartis и MERCK.Все остальные авторы заявляют об отсутствии конкурирующих интересов. Это не влияет на соблюдение авторами всех политик PLOS ONE в отношении обмена данными и материалами.
Введение
Всемирная организация здравоохранения рекомендует ввести 10- или 13-валентную пневмококковую конъюгированную вакцину (ПКВ) в программы иммунизации либо в виде трех доз первичной серии (3 + 0), либо двух доз в младенчестве с последующей третьей дозой в второй год жизни (график 2 + 1) [1]. Выбор между этими двумя графиками должен включать рассмотрение местных эпидемиологических факторов [1].Мета-анализ трех по сравнению с первичной серией двух доз PCV7 в младенчестве показал аналогичную иммуногенность по отношению к большинству серотипов между двумя схемами дозирования [2,3], за исключением серотипов 6B и 23F, для которых средние геометрические концентрации антител (GMC) и доля младенцев с концентрацией серотип-специфических антител ≥0,35 мкг / мл были ниже после 2-х доз по сравнению с 3-х дозами первичной серии [2,3]. Кроме того, иммуногенность после введения двух доз ПКВ младенцам повышается за счет интервалов между дозами в два месяца по сравнению с интервалом в один месяц [4].
Высокая стоимость PCV была основным фактором для принятия схем вакцинации, требующих меньшего количества доз, чем схема 3 + 1, которая использовалась в основном исследовании, на которое была получена лицензия PCV7 (Prevenar®) [5]. В другом месте в рамках исследований, не связанных с лицензированием, в Африке была установлена эффективность вакцины против инвазивных пневмококковых заболеваний и пневмонии с использованием только трех доз первичной серии [6,7]. Однако отсутствие бустерной дозы в исследовании в Южной Африке было связано с ослаблением защиты у ВИЧ-инфицированных детей, ранее не получавших антиретровирусные препараты [8].ВИЧ-инфицированные дети составляют примерно 55% всех инвазивных пневмококковых заболеваний в Южной Африке, несмотря на доступ к антиретровирусному лечению, и имеют более чем в 40 раз повышенный риск развития болезни после двухлетнего возраста [9]. ЦВС7 был введен в программу иммунизации в Южной Африке с апреля 2009 года по уникальному графику в возрасте 6 и 14 недель с последующей третьей дозой примерно в 9-месячном возрасте. Обоснование этого графика включало соображения рентабельности схемы из четырех доз, а также стремление к увеличению устойчивости защиты уязвимых групп, таких как ВИЧ-инфицированные дети.Выбор введения третьей дозы в 9-месячном возрасте был основан на том, что дети уже должны были получить свою первую дозу противокоревой вакцины в этом возрасте, в сочетании с более высоким потреблением первой дозы против кори по сравнению со второй дозой. доза, которую вводят в возрасте 15-18 месяцев. Иммуногенность схемы дозирования PCV, принятой в Южной Африке, не оценивалась.
Целью этого исследования было определение иммуногенности нового режима дозирования PCV, применяемого в возрасте 6 недель, 14 недель и 9 месяцев.Кроме того, мы сравнили иммунные ответы по последнему графику с иммунными ответами исторической когорты, которая получала PCV7 в возрасте 6, 10 и 14 недель, как описано [10,11].
Методы
Популяция и дизайн исследования
250 здоровых младенцев, рожденных от матери, не инфицированной ВИЧ, были включены в проспективное продольное когортное исследование в период с октября 2009 года по февраль 2010 года. Потенциальные участники исследования были определены через регистр рождений в Академической больнице Криса Хани Барагваната (CHBAH, Соуэто, Йоханнесбург) и в клинике иммунизации здоровых детей в соседней клинике первичной медико-санитарной помощи (клиника Дипклуфа).Здоровые младенцы в возрасте 6–8 недель, рожденные доношенными матерями, у которых было подтверждено отсутствие ВИЧ-инфекции в последнем триместре беременности, имели право на участие в исследовании.
Детям была назначена иммунизация PCV7 (Prevnar®, Wyeth Vaccines, NY, USA) в возрасте 6–12 и 12–24 недель, а третья доза назначена на 38–42 недели. PCV7 вводили одновременно с другими вакцинами, запланированными на то время. Другие вакцины, полученные всеми детьми, включали БЦЖ и трехвалентную пероральную вакцину против полиомиелита (TOPV, OPV-Mérieux®; Sanofi-Pasteur, Лион, Франция) при рождении, TOPV через 6 недель, дифтерийный токсоид-столбнячный токсоид-бесклеточный коклюш- трехвалентный инактивированный полиомиелит. вакцина и конъюгированная вакцина Haemophilus influenzae типа b (DTaP-IPV // HibCV; i.е. Пентаксим®; Санофи-Пастер, Лион, Франция) и вакцина против гепатита В (Heberbiovac HB®, Институт Биовак, Пинеландс, Южная Африка) в возрасте 6, 10, 14 недель и ротавирусная вакцина (Rotarix®; GSK Biologicals, Rixensart, Бельгия) в возрасте 6 и 14 недель. Кроме того, вакцина против кори (Rouvax®, Sanofi-Pasteur, Лион, Франция) вводилась в возрасте 9 месяцев. Вся вакцинация проводилась исследовательским персоналом в исследовательской клинике бесплатно для участников.
Иммуногенность к ЦВС7 в этом исследовании сравнивалась с иммунными ответами в ранее включенной когорте (N = 125) младенцев, также рожденных от ВИЧ-неинфицированных матерей, которые получили ЦВС7 на 6, 10 и 14 неделях.Последняя когорта была набрана с апреля 2005 г. по июнь 2006 г. и получила свои 1 , 2 и 3 доз PCV7 в среднем (стандартное отклонение; SD) 7,0 (SD 1,0), 11,1 (SD 1,2) и 15,2 (SD 1,2) недельного возраста, при этом ответы антикапсулярных антител измерялись через 28-30 дней после каждой дозы, как сообщалось [10,11]. Сопутствующие вакцины с ЦВС7 в исторической когорте включали БЦЖ и трехвалентную пероральную вакцину против полиомиелита (TOPV, OPV-Mérieux®; Санофи-Пастер, Лион, Франция) при рождении; TOPV, DTPw-Hib-CV (Combact-HIB, Sanofi-Pasteur, Лион, Франция) и вакцина против гепатита B (Heberbiovac HB®, Институт Биовак, Пайнелэндс, Южная Африка) в возрасте 6, 10 и 14 недель.
Учебные процедуры
Кровь для определения серотипоспецифичных антикапсулярных антител IgG к каждому из серотипов PCV7 была взята перед каждой дозой, а также через один месяц (период окна 3-6 недель) после первой и второй доз и через 7-14 дней после третья доза, чтобы определить анамнестические ответы вместо «первичных» ответов после «бустерной дозы» вакцины.
Образцы из этого исследования, а также историческая когорта были обработаны в отделе исследования респираторных и менингеальных патогенов (RMPRU, Йоханнесбург, Южная Африка), а сыворотка заархивирована при -70 o C до запуска теста.Определение сывороточных антикапсулярных антител IgG проводилось с использованием стандартного ELISA со стадией адсорбции 22-F, как описано [12]. Функциональную активность антител определяли методом опсонофагоцитарного киллинга (OPA) с использованием дифференцированных клеток HL-60 для серотипов 9V, 19F и 23F после 2 -й и 3 -й дозы PCV-7, как описано [12, 13].
Статистический анализ
Данные были проанализированы с использованием Stata Version 11.0 (StataCorp LP, College Station, Texas).Анализ включал антикапсулярные GMC, кратное увеличение GMC и долю детей, у которых развились ответы антител ≥0,35 мкг / мл. Последний порог является предполагаемой мерой защиты от инвазивного пневмококкового заболевания [14]. GMC и 95% доверительные интервалы (95% ДИ) концентраций антител определяли после преобразования данных log 10 . Средние геометрические титры опсонофагоцитов (GMT) также рассчитывали после преобразования данных log . 10 , и обнаруживаемая убивающая активность на OPA была определена как титр ≥8, который был нижним порогом анализа.
Кроме того, было проведено описательное сравнение иммунных ответов после второй и третьей дозы PCV7 в текущем исследовании по сравнению с тем, которое наблюдалось через месяц после второй и третьей дозы PCV7 из исторической когорты.
Рисунок 1. Блок-схема участия в исследовании.
Диаграмма, показывающая количество детей, включенных в исследование, и количество детей, исключенных или потерянных для последующего наблюдения в ходе исследования.
Отзыв согласия = участник больше не хотел быть частью исследуемой когорты и предпочел пройти вакцинацию в местной клинике.Переселение = участник переехал из области исследования и, следовательно, не может посещать учебные поездки. Потерян для последующего наблюдения = исследовательскому центру не удалось связаться с участником исследования. Период вне окна = вакцинация произошла вне установленного протоколом периода в 6-12 недель; 12-24 недели и 38-42 недели для первой, второй и третьей доз соответственно. PCV = 7-валентная пневмококковая конъюгированная вакцина.
https://doi.org/10.1371/journal.pone.0072794.g001
Заявление об этике
Исследование было одобрено Комитетом по этике исследований на людях Университета Витватерсранда (HREC M0
Результаты
250 детей чернокожего африканского происхождения, 57% из которых составляли мальчики, были зачислены и получили PCV7 в среднем 6,3 (диапазон 5,7-7,7; стандартное отклонение [SD] 0,04), 15,8 (диапазон 11,5-23,4; SD 0,1) и 39,9 (диапазон 38,7–46,1; стандартное отклонение 0,05) недель. Средний интервал времени между первой и второй дозой PCV составлял 9,4 недели (диапазон 5,4–16,8 недель; стандартное отклонение 1,4 недели), и только один ребенок получил вакцины с интервалом менее 8 недель.В целом 250 (100%), 235 (94,0%) и 226 (90,4%) получили первую, вторую и третью дозы PCV7 в течение периода, определенного протоколом. Анализ в любой конкретный момент времени был ограничен теми детьми, которые соблюдали ранее определенные протоколом временные точки, в том числе до анализируемой временной точки. В целом, 228 (91,2%) участников были активны в исследовании к моменту последнего проанализированного момента времени (Рисунок 1).
Рис. 2. IgG GMC после 2-х дозовой первичной серии и бустерной дозы PCV-7.
IgG-антитела GMC для каждого из 7 серотипов после вакцинации PCV-7, вводимые в виде первичной серии из 2 доз в возрасте 6 и 14 недель, и бустерной дозы в возрасте 40 недель. GMC измеряли на исходном уровне, после первой дозы (Post PCV1) и второй дозы (Post PCV2), а также до (Pre PCV3) и после (Post PCV3) бустерной дозы.
GMC = средние геометрические концентрации, PCV-7 = 7-валентная пневмококковая конъюгированная вакцина.
https: // doi.org / 10.1371 / journal.pone.0072794.g002
Количественные и качественные ответы антител
GMC, специфичные для серотипа вакцины, после каждой дозы PCV7 показаны в таблице S1 и на рисунке 2. Между первой и второй дозами PCV7 было увеличение GMC в 3,48 (серотип 14) до 11,73 (серотип 23F) раз, что постоянно выше. для всех серотипов по сравнению с кратным увеличением между исходным уровнем и после первой дозы PCV7; Таблица S1. ГМК для всех серотипов снизились к 39 годам.Через 9 недель, когда была введена доза 3 rd PCV7, после чего последовало увеличение GMC в 4,74 (серотип 14) до 29,25 (серотип 23F) раз после 3 rd PCV7-дозы; Таблица S1 и Рисунок 2.
Доля младенцев с серотип-специфическими антителами ≥0,35 мкг / мл после первой дозы PCV7 колебалась от 20,6–21,9% (серотипы 23F и 6B) до 94,0% для других серотипов. Это увеличилось до 84,1% и 89,3% для серотипов 6B и 23F, соответственно, и ≥97,4% для других серотипов после 2 nd доз PCV7; Таблица S1.Хотя количество GMC снизилось, стойкость антител ≥0,35 мкг / мл оставалась такой же, как после 2 -й дозы PCV7 при оценке непосредственно перед третьей дозой PCV7; Таблица S1. После введения дозы 3 rd PCV7> 96,8% детей имели концентрации антител ≥0,35 мкг / мл к каждому серотипу. Доля детей, у которых после введения 3 rd PCV дозы GMC увеличилась в 4 раза, колебалась от 61,8% для серотипа 14 до 92,7% для серотипа 18C; Таблица S1.
Доля детей с OPA ≥8 до 9V, 19F и 23F составляла 78.5%, 69,4% и 71,2%, после 2 nd PCV7-дозы, которая значительно увеличилась до 93,6% (p <0,001), 77,6,% (p <0,001) и 89,7% (p <0,001), соответственно , после третьей дозы PCV7; Таблица 1.
| Титр OPA ≥8 (95% ДИ) | Средний геометрический титр OPA (95% ДИ) | |||
|---|---|---|---|---|
| Постдоза 2 Н; % (95%) ДИ | Постдоза 3 N; % (95% ДИ) | Постдоза 2 GMT (95% ДИ) | Постдоза 3 GMT (95% ДИ) | |
| Серотип 9V | 168/214; 78.5% (72,4-83,8) | 161/172; 93,6% (88,8-96,8) | 22 (19-26) | 79 (66-95) |
| Серотип 19F | 154/221; 69,4% (62,8-75,3) | 135/174; 77,6% (70,6-83,5) | 19 (16-22) | 47 (35-61) |
| Серотип 23F | 161/225; 71,2% (64,8-77,0) | 156/174; 89,7% (84,1-93,7) | 30 (24-37) | 137 (103-182) |
Таблица 1. Анализ опсонофагоцитарной активности после второй и третьей доз 7-валентной пневмококковой конъюгированной вакцины для 3 различных пневмококковые серотипы.
Сравнение с исторической когортой, получавшей PCV7 в возрасте 6, 10 и 14 недель
По сравнению с исторической когортой, получавшей PCV7 в среднем возрасте 7,0, 11,1 и 15,2 недель, GMC были выше для большинства серотипов в текущей когорте при сравнении иммунных ответов после второй дозы PCV7; хотя и перекрытие 95% доверительного интервала для серотипов 9V и 19F; Рисунок 3. GMC в этой когорте исследования в целом были схожими (серотипы 6B, 9V, 14, 18C, 19F), за исключением серотипов 4 (выше) и 23F (ниже)) после 2 nd -PCV7 дозы в текущем — когорта по сравнению с одним месяцем после третьей дозы PCV7 в исторической группе сравнения; Рисунок 3 и Таблица 2.При сравнении иммунных ответов после третьей дозы PCV7 в текущей когорте по сравнению с исторической когортой, GMC в целом были в 4-5 раз больше в текущей когорте по сравнению с большинством серотипов (4, 9V, 14, 18C, 23F) и в 16,3 раза больше для серотипа 6В; Рисунок 3 и Таблица 2.
Рисунок 3. Сравнение IgG GMC после 2 и 3 доз PCV-7, вводимых с разными интервалами.
Сравнение IgG-антител GMC после вакцинации PCV-7, вводимой в возрасте 6, 10 и 14 недель или в возрасте 6 и 14 недель, и бустерной вакцины в возрасте 40 недель.GMC оценивали после второй и после третьей дозы в серии.
GMC = средние геометрические концентрации, PCV-7 = 7-валентная пневмококковая конъюгированная вакцина, IgG = иммуноглобулин G.
https://doi.org/10.1371/journal.pone.0072794.g003
| Группа | Историческая когорта * | Исследовательская когорта ** | 6 Историческая когорта|||||
|---|---|---|---|---|---|---|---|
| Серотип | Пост доза 2 (интервал 4 недели) | Пост доза 2 (интервал 8 недель) | Пост доза 3 | Пост доза 3 | Сложенная разница 3 vs.3 *** | ||
| n = 116 GMC (95% CI) | n = 234 GMC (95% CI) | n = 114 GMC (95% CI) | N = 222 GMC (95% CI) ) | ||||
| 4 | 4,43 (3,44–5,70) | 9,23 (7,96–10,70) | 6,45 (5,32–7,82) | 34,63 (30,63–39,14) | 5,37 | 624B | |
| 1,66 (1,36-2,03) | 1,43 (1,05-1,94) | 22,82 (18,67-27,89) | 16.30 | ||||
| 9V | 3,84 (3,01-4,91) | 5,56 (4,73-6,52) | 5,12 (4,36-6,0) | 20,83 (17,99-24,11) | 4,06 | ||
| 14 | 1,48-2,15) | 3,58 (3,00-4,28) | 3,6 (2,90-4,47) | 20,40 (16,52-25,19) | 5,66 | ||
| 18C | 3,29 (2,61-4,15) | 5,48 (4,78 (2,61-4,15) 6,33) | 6,02 (5,0-7,25) | 27,87 (23,53-33,0) | 4.62 | ||
| 19F | 4,04 (3,24-5,03) | 5,31 (4,60-6,13) | 6,97 (5,88-8,27) | 13,57 (11,21-16,42) | 1,95 | ||
| 7 23F 0,65–1,06) | 2,14 (1,78–2,56) | 4,09 (3,23–5,19) | 21,99; (17,93–26,98) | 5,37 | |||
Таблица 2. Средние геометрические антикапсулярные концентрации IgG после введения второй дозы с интервалом в 4 или 8 недель и третьей дозы пневмококковой конъюгированной вакцины.
При сравнении доли младенцев с концентрацией антител ≥0,35 мкг / мл между текущей и исторической когортами, более высокая доля детей в текущей когорте имела антитела ≥0,35 мкг / мл к серотипу 6B (84,1% против 37,0%). ), и аналогичная тенденция наблюдалась для серотипа 23F (89,3% против 80,2%) после вторых доз PCV7; Рисунок 4. Кроме того, доля детей с антителами ≥0,35 мкг / мл была почти идентична после второй дозы в текущей когорте по сравнению с третьей дозой в исторической когорте; Рисунок 4.
Рис. 4. Доля младенцев с концентрацией IgG ≥ 35 мкг / мл после 2 и 3 доз PCV-7.
Доля младенцев с концентрацией сывороточных антикапсулярных антител IgG ≥ 35 мкг / мл, предполагаемой мерой защиты от инвазивного пневмококкового заболевания, после вакцинации ЦВС-7. Вакцину вводили в возрасте 6, 10 и 14 недель или в возрасте 6, 14 и 40 недель. Концентрации антител оценивали после второй и после третьей дозы в серии.
PCV-7 = 7-валентная пневмококковая конъюгированная вакцина, IgG = иммуноглобулин G.
https://doi.org/10.1371/journal.pone.0072794.g004
Обсуждение
Результаты нашего исследования указывают на устойчивые количественные и качественные ответы антител на схему дозирования PCV7 при введении в возрасте 6, 14 и 40 недель. Иммунные ответы этого режима дозирования вызвали аналогичные концентрации уровней антител после введения 2 и дозы PCV7 по сравнению с после введения 3 -й дозы PCV7 в исторической когорте, вакцинированной в возрасте 6-10-14 недель. .Это говорит о том, что текущий южноафриканский график дозирования PCV7 будет столь же эффективным после второй дозы PCV7 по сравнению с третьей дозой PCV7 при введении через 6-10-14 недель, что, как ранее было показано, защищает от инвазивного пневмококкового заболевания и пневмонии. в той же постановке [15]. Примечательно, что иммунные ответы после дозы 3 rd PCV7 в возрасте 40 недель в нашем исследовании были связаны с более высокими количественными ответами антител по сравнению с дозой 3 rd -PCV7 в возрасте 14 недель в историческом когорта.Хотя не было никакой разницы в доле младенцев с концентрациями антител ≥0,35 мкг / мл после 3 rd доз PCV7, за исключением того, что для серотипа 6B в настоящее время выше по сравнению с исторической когортой, более высокие GMCs в 6 14-40-недельный график дозирования может повлиять на более высокую стойкость антител в более позднем возрасте, что, следовательно, может повлиять на долговечность защиты от пневмококкового заболевания. В частности, такие более высокие ГМК могут обеспечить лучшую защиту от пневмококковых инфекций слизистой оболочки, таких как острый средний отит и пневмония, если защита от инфекций слизистой оболочки требует более высоких уровней антител по сравнению с теми, которые требуются для защиты от инвазивного пневмококкового заболевания [4,16].
При выборе схем дозирования ПКВ, особенно при выборе между схемами 2 + 1 и 3 + 0, ВОЗ рекомендует странам учитывать эпидемиологию, охват и своевременность вакцинации. Одной из проблем стран с низким уровнем дохода является то, что схема из трех доз может поставить под угрозу защиту из-за недостаточного иммунного ответа после 2 и доз. Goldblatt et al. сообщили, что иммунный ответ на серотип 6B и 23 F оставался слабым, даже при назначении через 2 и 4 месяца с сопутствующим DTaP5 / IPV / Hib-TT, только 47% и 62% достигали уровней IgG ≥0.35 мкг / мл соответственно. Считалось, что снижение эффективности серотипа 6B в Великобритании, возможно, связано с этим слабым иммунным ответом, и в документе с изложением позиции ВОЗ говорится, что схема 2 + 1 может не предлагать дополнительную индивидуальную защиту для 6B и 23F. В нашем исследовании иммунные ответы на все семь серотипов, включая 6B и 23F, были сопоставимы после второй дозы PCV7 по сравнению с третьей дозой PCV7 по графику 6-10-14 недель.
В исследовании Goldblatt et al. [4], иммунные ответы на серотипы 6B, 14F и 23F были значительно ниже после введения двух доз PCV7 с интервалом в один месяц по сравнению с тем, когда интервал между ними составлял не менее двух месяцев.Результаты нашего исследования подтверждают обнаружение лучших иммунных ответов, когда ЦВС7 находится с интервалом в два месяца, для доли младенцев, достигающих уровня антител ≥0,35 мкг / мл, а также в отношении уровней GMC после второй дозы ЦВС7. Хотя дизайн исследования допускал широкий диапазон возрастов для иммунизации, средний возраст и небольшое стандартное отклонение времени, когда вводили вакцины, показали, что большинство детей получили вакцины близко к тому времени, когда вакцинация была запланирована в программе иммунизации.Повышенная иммуногенность разнесения ЦВС7 с интервалом не менее двух месяцев была особенно заметна в отношении иммунных ответов на серотип 6В, который признан менее иммуногенным, чем другие серотипы ЦВС7, и без снижения иммуногенности по отношению к другим серотипам. Защита от серотипа 6B особенно важна в таких странах, как Южная Африка, где 67% инвазивных пневмококковых заболеваний (ИПБ) в возрастной группе <5 лет в довакцинальную эру были вызваны серотипами ЦВС7, из которых 30% были вызваны к 6B [17].
Несмотря на то, что наблюдались более высокие уровни GMC IgG, индуцированные при введении дозы 3 rd в возрасте 9 месяцев по сравнению с возрастом 15 недель, ограничение этого наблюдения заключалось в том, что ответы антител были измерены через 2 недели после введения дозы 3 rd в это исследование по сравнению с 4 неделями после 3 rd доз в исторической когорте. Хотя это может исказить результаты, показывающие более высокие концентрации антител в текущей когорте, величина различия, а также кратное увеличение концентраций антител по сравнению с после третьей дозы в исторической когорте предполагают, что эти различия, вероятно, верны.
Другие ограничения нашего исследования включают то, что оно не является рандомизированным исследованием, сравнивающим две схемы дозирования, однако историческая когорта детей была в основном из одного и того же сообщества. Кроме того, тесты на пневмококковые антитела проводились с использованием стандартизированного метода со стандартной контрольной сывороткой и в той же лаборатории, что частично смягчает это ограничение. Однако мы не смогли провести сравнение ответов OPA для текущей когорты исследования по сравнению с исторической когортой [14], так как на анализ OPA могут влиять вариации из-за партий реагентов, клеточных линий и целевых бактериальных клеток. напрягает сверхурочно.Кроме того, это спонсируемое исследователем исследование было ограничено ресурсами и, следовательно, оценивало OPA только для трех из семи серотипов. Однако это включало серотипы с присущими им различиями в иммуногенности, в том числе относительно слабоиммуногенный серотип 23F и более иммуногенные серотипы 9V и 19F. Еще одним ограничением нашего исследования был переход от комбинированных цельноклеточных коклюшных вакцин, используемых в исторической когорте, на бесклеточную коклюшную вакцину, содержащую пентавалентную вакцину (Pentaxim ™) в качестве одновременно вводимых вакцин.Однако сопутствующее введение бесклеточной коклюшной вакцины вместо цельноклеточной коклюшной вакцины было связано с ослаблением иммунных ответов на белок-полисахаридные конъюгированные вакцины, в том числе в исследованиях иммуногенности с участием конъюгированной вакцины Haemophilus influenzae типа b и столбнячного анатоксина пневмококка. конъюгированные вакцины [18,19]. Другие исследования показали, что ЦВС7 обладал высокой иммуногенностью при одновременном применении с комбинациями DTaP – IPV-Hib и DTaP – IPV – HBV / Hib и что не было клинически значимых взаимодействий или влияния на иммуногенность [20–22].Таким образом, устойчивые иммунные ответы в нынешней когорте исследователей, получавших бесклеточные коклюшные вакцины, позволяют предположить отсутствие влияния иммунных ответов на PCV у африканских детей и при использовании в соответствии с действующим южноафриканским графиком.
Основная причина для принятия действующего графика дозирования в Южной Африке связана с обеспечением большей продолжительности защиты от инвазивного пневмококкового заболевания у ВИЧ-инфицированных детей. Хотя наше исследование не было разработано для оценки иммунных ответов на этот режим дозирования у ВИЧ-инфицированных детей, сходство иммунных ответов после каждой из трех доз PCV7 через 6-10-14 недель между ВИЧ-инфицированными, получавшими лечение на ранней стадии с помощью Антиретровирусная терапия, применяемая в настоящее время в Южной Африке, по сравнению с ВИЧ-неинфицированными детьми [23], позволяет предположить, что иммуногенность нынешнего южноафриканского режима дозирования, вероятно, будет аналогичным образом проявляться у ВИЧ-инфицированных детей, начавших раннее лечение антиретровирусными препаратами. ретровирусное лечение.Эффективность схемы дозирования 6–14–40 недель в Южной Африке в настоящее время оценивается в исследованиях «случай – контроль» против инвазивной пневмококковой инфекции и пневмонии [24,25].
Благодарности
Мы благодарим родителей и их детей за участие в этом исследовании. Мы благодарны сотрудникам RMPRU за их самоотверженную работу над этим исследованием, в частности Эндрю Моултри, Киртешу Парбху и Наташе Стандер за выполнение анализа ELISA и обработку образцов; медсестрам-исследователям, Целан Макгоба, Морин Нкоси и Одри Флерс, и всем клиницистам за помощь в регистрации участников и последующем наблюдении.
Презентации на встрече: Результаты этого исследования были частично представлены на 8-м Международном симпозиуме по пневмококкам и пневмококковым заболеваниям в Бразилии, 11-15 марта 2012 г. Номер реферата: A-428-0027-00682.
Вклад авторов
Задумал и спроектировал эксперименты: SAM MG PA. Проведены эксперименты: НВН ПС. Проанализированы данные: САЖ ЛК А.И. Написал рукопись: SAJ. Произведен образец коллекции: САЖ АК.
Ссылки
- 1.Всемирная организация здравоохранения (2012) Пневмококковые вакцины Позиционный документ ВОЗ-2012. Wkly Epidemiol Rec 87: 129-144.
- 2. Скотт П., Рутес А.В., Берметц Л., Роберт Н., Скотт С. и др. (2011) Сравнение схем пневмококковой конъюгированной вакцины на основе 3 и 2 первичных доз: систематический обзор и метаанализ. Vaccine 29: 9711-9721. DOI: https: //doi.org/10.1016/j.vaccine.2011.07.042. PubMed: 21821080. ,
- 3. Rückinger S, Dagan R, Albers L, Schönberger K, von Kries R (2011) Иммуногенность пневмококковых конъюгированных вакцин у младенцев после двух или трех первичных вакцинаций: систематический обзор и метаанализ.Вакцина 29: 9600-9606. DOI: https: //doi.org/10.1016/j.vaccine.2011.09.011. PubMed: 21933696.
- 4. Голдблатт Д., Саузерн Дж., Эштон Л., Эндрюс Н., Вудгейт С. и др. (2010) Иммуногенность сокращенного графика пневмококковой конъюгированной вакцины у здоровых младенцев и корреляты защиты от серотипа 6B в Соединенном Королевстве. Pediatr Infect Dis J 29: 401-405. DOI: https: //doi.org/10.1097/INF.0b013e3181c67f04. PubMed: 20010312. ,
- 5. Блэк С., Шайнфилд Х, Файермен Б., Льюис Э., Рэй П. и др.(2000) Эффективность, безопасность и иммуногенность гептавалентной пневмококковой конъюгированной вакцины у детей. Группа Центра изучения вакцин Kaiser Permanente Северной Калифорнии. Pediatr Infect Dis J 19: 187-195.
- 6. Клугман К.П., Мадхи С.А., Хюбнер Р.Э., Кохбергер Р., Мбелле Н. и др. (2003) Испытание 9-валентной пневмококковой конъюгированной вакцины у детей с ВИЧ-инфекцией и без нее. N Engl J Med 349: 1341-1348. DOI: https: //doi.org/10.1056/NEJMoa035060. PubMed: 14523142.
- 7.Cutts FT, Zaman SM, Enwere G, Jaffar S, Levine OS et al. (2005) Эффективность девятивалентной пневмококковой конъюгированной вакцины против пневмонии и инвазивного пневмококкового заболевания в Гамбии: рандомизированное, двойное слепое, плацебо-контролируемое испытание. Ланцет 365: 1139-1146. DOI: https: //doi.org/10.1016/S0140-6736 (05) 71876-6. PubMed: 15794968.
- 8. Мадхи С.А., Адриан П., Куванда Л., Джассат В., Джонс С. и др. (2007) Долгосрочная иммуногенность и эффективность 9-валентной конъюгированной пневмококковой вакцины у детей, инфицированных и неинфицированных вирусом иммунодефицита человека, в отсутствие бустерной дозы вакцины.Vaccine 25: 2451-2457. DOI: https: //doi.org/10.1016/j.vaccine.2006.09.019. PubMed: 17023095.
- 9. Нуньес М.С., фон Готберг А., де Гувейя Л., Коэн С., Мур Д.П. и др. (2011) Влияние антиретровирусной терапии на бремя инвазивной пневмококковой инфекции у южноафриканских детей: анализ временных рядов. СПИД 25: 453-462. DOI: https: //doi.org/10.1097/QAD.0b013e328341b7f1. PubMed: 21178754.
- 10. Мадхи С.А., Клугман К.П., Куванда Л., Катланд С., Кайхти Х. и др.(2009) Количественные и качественные анамнестические иммунные ответы на пневмококковую конъюгированную вакцину у ВИЧ-инфицированных и ВИЧ-неинфицированных детей через 5 лет после вакцинации. J Infect Dis 199: 1168-1176. DOI: https: //doi.org/10.1086/597388. PubMed: 19265481.
- 11. Ромеро-Штайнер С., Либутти Д., Паис Л. Б., Дайкс Дж., Андерсон П. и др. (1997) Стандартизация опсонофагоцитарного анализа для измерения функциональной активности антител против Streptococcus pneumoniae с использованием дифференцированных клеток HL-60.Clin Diagn Lab Immunol 4: 415-422. PubMed: 9220157.
- 12. Йодар Л., Батлер Дж., Карлоне Дж., Даган Р., Голдблатт Д. и др. (2003) Серологические критерии оценки и лицензирования новых рецептур пневмококковой конъюгированной вакцины для использования у младенцев. Vaccine 21: 3265-3272. DOI: https: //doi.org/10.1016/S0264-410X (03) 00230-5. PubMed: 12804857.
- 13. Мадхи С.А., Адриан П., Коттон М.Ф., Макинтайр Дж. А., Жан-Филипп П. и др. (2010) Влияние статуса ВИЧ-инфекции и антиретровирусной терапии на количественный и качественный ответ антител на пневмококковую конъюгированную вакцину у младенцев.J Infect Dis, 202: 355-361. DOI: https: //doi.org/10.1086/653704. PubMed: 20583920.
- 14. Мадхи С.А., Идзу А., Виолари А., Коттон М.Ф., Панчиа Р и др. (2013) Иммуногенность после первой и второй доз 7-валентной пневмококковой конъюгированной вакцины у ВИЧ-инфицированных и неинфицированных младенцев. Vaccine 31: 777-783. DOI: https: //doi.org/10.1016/j.vaccine.2012.11.076. PubMed: 23228814.
- 15. Клугман К.П., Мадхи С.А., Хюбнер Р.Э., Кохбергер Р., Мбелле Н. и др. (2003) Испытание 9-валентной пневмококковой конъюгированной вакцины у детей с ВИЧ-инфекцией и без нее.N. Engl. J. Med. 349: 1341-1348. DOI: https: //doi.org/10.1056/NEJMoa035060. PubMed: 14523142.
- 16. Даган Р., Гивон-Лави Н., Порат Н., Гринберг Д. (2012) Влияние альтернативного режима питания младенцев с пониженными дозами и графика наверстывания на второй год с 7-валентной пневмококковой конъюгированной вакциной на носительство пневмококка: рандомизированный контролируемый испытание. Vaccine 30: 1532-1540.
- 17.
Silberbauer EJ, Ismail N, Von Gottberg A, Hoosen AA (2011) Распределение серотипов и антимикробных профилей инвазивных пневмококков, выделенных в период до внедрения вакцины в Претории, Южная Африка, 2005-2009 гг.Диагностика Microbiol Infect Dis 71: 309-311. DOI: https://doi.org/10.1016/j.diagmicrobio.2011.07.006. PubMed: 21
7. - 18. Dagan R, Poolman JT, Zepp F (2008) Комбинированные вакцины, содержащие DTaP-Hib: влияние IPV и одновременное введение конъюгатов CRM197. Expert Rev Vaccines 7: 97-115. DOI: https: //doi.org/10.1586/14760584.7.1.97. PubMed: 18251697.
- 19. Даган Р., Голдблатт Д., Малекар Дж. Р., Яич М., Эскола Дж. (2004) Снижение ответа антител на пневмококковую вакцину с 11-валентными валентными вакцинами, одновременно вводимую с вакциной, содержащей бесклеточные компоненты коклюша.Infect Immun 72: 5383-5391. DOI: https: //doi.org/10.1128/IAI.72.9.5383-5391.2004. PubMed: 15322036.
- 20. Schmitt HJ, Faber J, Lorenz I, Schmöle-Thoma B, Ahlers N (2003) Безопасность, реактогенность и иммуногенность 7-валентной пневмококковой конъюгированной вакцины (7VPnC), одновременно вводимой с комбинированной вакциной DTaP-IPV-Hib. Vaccine 21: 3653-3662. DOI: https: //doi.org/10.1016/S0264-410X (03) 00389-X. PubMed: 12922095.
- 21. Knuf M, Habermehl P, Cimino C, Petersen G, Schmitt HJ (2006) Иммуногенность, реактогенность и безопасность 7-валентной пневмококковой конъюгированной вакцины (PCV7), одновременно вводимой с комбинированной вакциной DTaP – HBV – IPV / Hib здоровым младенцам .Vaccine 24: 4727-4736. DOI: https: //doi.org/10.1016/j.vaccine.2006.03.032. PubMed: 16616973.
- 22. Knuf M, Szenborn L, Moro M, Petit C, Bermal N et al. (2009) Иммуногенность широко используемых детских вакцин при одновременном назначении с 10-валентной пневмококковой нетипируемой конъюгированной вакциной Heamophilus influenzae с белком D (PHiD-CV). Pediatr Infect Dis J 28: S97-S108. DOI: https: //doi.org/10.1097/INF.0b013e318199f61b. PubMed: 19325452.
- 23. Мадхи С.А., Коэн С., фон Готтберг А. (2012) Внедрение пневмококковой конъюгированной вакцины в программу иммунизации населения в Южной Африке: перевод исследований в политику.Вакцина 7 Дополнение 3: C21-C27. PubMed: 22939016.
- 24. Мадхи С.А., Грум М., Зар Х., Капонго С., Маллиган С. и др. (2012) Эффективность пневмококковой конъюгированной вакцины против предполагаемой бактериальной пневмонии (PBP) у южноафриканских детей, не инфицированных ВИЧ: Case-Contril Study. Abstract 304: В: Тезисы: 8-й Международный симпозиум по пневмококкам и пневмококковым заболеваниям. Водопад Игаку, Бразилия, 11-15 марта 2012 г.
- 25. Махди С.А. (2012) Из Африки: извлеченные уроки и проблемы при оценке эффективности пневмококковой конъюгированной вакцины.Реферат 16: В: Тезисы: 8-й Международный симпозиум по пневмококкам и пневмококковым заболеваниям. Водопад Игаку, Бразилия, 11-15 марта 2012 г.
Рандомизированное двойное слепое плацебо-контролируемое исследование — тема исследовательской статьи в области биологических наук. Скачайте научную статью в формате PDF и читайте ее бесплатно в открытом научном центре CyberLeninka.
Тип: стендовая презентация
Окончательный номер реферата: 63.002 Сессия: Вакцины и разработка вакцины Дата: суббота, 5 апреля 2014 г. Время: 12: 45-14: 15 Зал: бальный зал
Тип: стендовая презентация
Окончательный номер реферата: 63.003 Сессия: Вакцины и разработка вакцин Дата: суббота, 5 апреля 2014 г. Время: 12: 45-14: 15 Зал: Банкетный зал
CrossMark
Экономическая оценка внедрения вакцины Hexaxim® в рамках Расширенной программы иммунизации Южной Африки (EPI-SA)
М. Могале1, Р.Дж. Burnett1, D. Olivier2, J. Mphahlele1- *
1 Университет Лимпопо (кампус Медунса), Медунса, Претория, Южная Африка
2 Quark Healthcare Consulting (Pty) Ltd, Претория, Южная Африка
Справочная информация: В рамках Расширенной программы иммунизации Южной Африки (EPI-SA) в настоящее время проводится вакцинация против 10 детских болезней, которые можно предотвратить с помощью вакцин.Для первичной вакцинации против дифтерии, столбняка, коклюша, полиомиелита, Haemophilus influenza типа b и гепатита B требуется шесть инъекций: три дозы DTaP-IPV // Hib [Pentaxim®] и три моновалентные вакцины против гепатита B детям в возрасте до 12 месяцев. с седьмой инъекцией (бустер Pentaxim®) в 18 месяцев. Мадхи и др. (PIDJ 30: e68 2011) не продемонстрировали значительных различий в безопасности и эффективности между Пентаксим® плюс моновалентный гепатит В и новой полностью жидкой гекса-валентной вакциной Гексаксим® (DTaP-IPV-Hib-HepB).С точки зрения поставщика медицинских услуг, комбинированные вакцины могут снизить затраты, упростить логистику и инфраструктуру доставки, а также улучшить охват за счет меньшего количества инъекций. Это исследование было направлено на анализ финансовых последствий перехода с нынешней комбинации инъекций Пентаксим® плюс моновалентный гепатит В на однократную инъекцию гексаксима® с точки зрения государственного сектора.
Методы и материалы: Данные были собраны для определения прямых затрат, т. Е. Цен на вакцины (за исключением Hexaxim®, цена пока не известна), транспортных расходов, хранения холодовой цепи, количества потерь вакцин, утилизации опасных отходов и введения вакцин.Все затраты были рассчитаны на дозу и выражены в южноафриканских рандах (R) (1,00 долл. США = 10,19 рандов по обменному курсу 2013 г.). Косвенные затраты, такие как индивидуальные и общественные выгоды, были исключены.
Результаты: Стоимость доставки одной дозы Пентаксим® и гепатита B составляет 166,30 рандов. Уменьшение объемов приводит к снижению затрат при использовании Hexaxim® для: холодного хранения; удаление опасных отходов; и введение вакцины, что приводит к расчетной экономии от 10,52 до 29,40 рандов на дозу, в зависимости от использования полезного пространства для хранения в холодильнике.
Заключение: Внедрение Hexaxim® в EPI-SA настоятельно рекомендуется, поскольку оно снижает затраты поставщика медицинских услуг за счет упрощения инфраструктуры логистики и доставки. С точки зрения сообщества, такие вакцины сокращают количество посещений клиники, количество ошибок вакцинаторов, количество инъекций и побочных эффектов, что приводит к большей приемлемости, удобству и более строгому соблюдению. Поскольку использование Hexaxim® демонстрирует прямую и косвенную экономию затрат, потенциальное внедрение в государственный сектор следует оценивать не только с точки зрения цены на Pentaxim® и Hep B.
http://dx.doi.org/10.1016/j.ijid.2014.03.1307
CrossMark
Эффективность и иммуногенность инактивированной вакцины против гриппа у беременных женщин: рандомизированное двойное слепое плацебо-контролируемое исследование
С. Мадхи1- *, К. Катленд2, А.Хьюго2, С.Джонс2, Л. Куванда2, Б. Дигеро3, Ф.К. Treurnicht1, K. Klugman4, M. Venter1, E.A.F. Simoes5, K.Neuzil6, J.Ortiz6, A. Weinberg3, M.S.C. Nunes2
1 Национальный институт инфекционных заболеваний (NICD), Йоханнесбург, Южная Африка
2 Витватерсрандский университет, Йоханнесбург, Южная Африка
3 Университет Колорадо, Медицинский кампус Аншутц, Аврора, США
4 Университет Эмори, Атланта, Джорджия, США
5 Университет Колорадо Денвер, Денвер, США
6 PATH, Сиэтл, США
Справочная информация: Беременные женщины имеют повышенную предрасположенность к тяжелой форме гриппа и рекомендованы ВОЗ в качестве приоритетной группы для вакцинации против гриппа.Цели нашего исследования заключались в оценке иммуногенности трехвалентного IIV (IIV3) у беременных, вакцинированных во 2/3 триместре беременности, и в вычислении эффективности вакцины (VE) против гриппа, подтвержденного методом ПЦР (PCI).
Методы и материалы: Двойное слепое рандомизированное плацебо-контролируемое испытание было проведено в Соуэто, Южная Африка, в 2011 и 2012 годах. 2116 подтвержденных ВИЧ-неинфицированных беременных женщин были рандомизированы для внутримышечного введения плацебо IIV3 или физиологического раствора.Иммунные ответы на каждый вакцинный штамм с использованием анализов ингибирования гемагглютинации (HAI) измеряли до вакцинации и через один месяц после вакцинации. Титры HAI> 1:40 были классифицированы как серопротективные, а сероконверсия была определена как по крайней мере 4-кратное увеличение титров от пре- до поствакцинации. За участниками наблюдали в течение шести месяцев после родов на предмет наличия острого респираторного заболевания или госпитализации по поводу острого сердечно-легочного заболевания. После подтверждения ГПЗ врачом-исследователем были взяты мазки из ротоглотки и носоглотки для тестирования вируса гриппа с помощью ПЦР в реальном времени.
Результаты: через месяц после вакцинации, сравнивая IIV3 и получателей плацебо, доля женщин, у которых произошла сероконверсия, составила 72,5% против 8,1% к A / h2N1pdm09, 64,8% против 2,7% к h4N2, 92,3% против 2,0% к грипп-B (все сравнения p <0,001). После вакцинации доля женщин с серопротекторными титрами HAI составила 93,7% против 48,0% для A / h2N1pdm09, 78,9% против 27,0% для h4N2 и 97,2% против 29,1% для гриппа-B (p <0,001 для всех сравнений). ). Эффективность вакцины IIV3 составила 46.1% (95% ДИ: от 6,4% до 69,0%) при защите от ЧКВ из-за гомотипических вакцинных штаммов и 50,4% (95% ДИ: от 14,5 до 71,2) при включении 3 невакцинальных случаев гриппа B-Yamagata, которые произошли исключительно среди получатели плацебо. Доминирующим идентифицированным штаммом вируса гриппа был h4N2, который составлял 22 (57,9%) случая в группе плацебо и 10 (52,6%) случаев у вакцинированных. 174 и 181 реципиент IIV и получатель плацебо, соответственно, имели по крайней мере один визит к врачу по ГПЗ. IIV3 не был связан с уменьшением первого эпизода ГПЗ (VE: 4.6%; 95% ДИ: от -15,4% до 21,1%).
Заключение. Вакцинация беременных женщин IIV3 вызвала хорошие гуморальные иммунные ответы, вероятно, связанные с защитой от инфекции вирусом гриппа.
http://dx.doi.org/10.1016/j.ijid.2014.03.1308 Тип: Презентация плаката
Окончательный номер реферата: 63.004 Сессия: Вакцины и разработка вакцины Дата: суббота, 5 апреля 2014 г. Время: 12: 45-14: 15 Зал: бальный зал
Запущенный ДНК репликон на основе вируса синдбис, кодирующий белок ED-lll вируса желтой лихорадки
Н.Вилджоэн1- *, М. Хейсе2, Ф.Дж. Бурт1
1 Университет Свободного государства, Блумфонтейн, Южная Африка
2 Университет Северной Каролины, Чапел-Хилл, США
Предпосылки: Вирус желтой лихорадки (YFV) представляет собой вирус с одноцепочечной РНК с положительным смыслом, который передается комарами и является эндемичным в тропических регионах Африки и Южной Америки. По оценкам Всемирной организации здравоохранения, ежегодная распространенность желтой лихорадки составляет 200 000 случаев, из которых более 90% приходится на Африку.Хотя доступны высокоэффективные живые аттенуированные вакцины, их использование у лиц с ослабленным иммунитетом противопоказано, и, хотя и редко, сообщалось о связанных с вакцинами побочных эффектах висцеротропного действия. Следовательно, могла бы быть применена разработка более безопасной альтернативы, которая могла бы дополнить использование живых вакцин. Целью этого исследования было приготовить запускаемый ДНК репликон на основе Sindbis, кодирующий белок ED-111 YFV, и охарактеризовать экспрессию белка ED-111 в трансфецированных клетках перед оценкой в качестве вакцины-кандидата на животной модели.
Методы и материалы: Ген, кодирующий белок ED-lll штамма Asibi YFV дикого типа, был оптимизирован по кодонам и синтезирован GenScript. Ген был клонирован в систему экспрессии на основе ДНК, несущую геном Sindbis, и обозначен как pSinED-lll. Репликон pSinED-III очищали и использовали для трансфекции клеток BHK21. Подобным образом сконструированная ДНК запускала репликон Sindbis, экспрессирующий репортерный ген, зеленый флуоресцирующий белок, использовали в качестве контроля трансфекции.Трансфицированные клетки BHK анализировали через 24 часа после трансфекции на экспрессию белка ED-111, используя непрямой иммунофлуоресцентный анализ (IFA). Моноклональные антитела мыши против his6 использовали для обнаружения С-концевой гистидиновой метки. Кроме того, для обнаружения белка ED-111 в трансфицированных клетках использовали сыворотку, полученную от мышей, иммунизированных бактериально экспрессируемым ED-111 и показавшей ответ антител IgG на ED-111.
Результаты. Присутствие гена, кодирующего белок ED-111, в конструкции подтверждали с помощью ПЦР и секвенирования с использованием праймеров, фланкирующих сайт клонирования.Обнаружение С-концевой гистидиновой метки и белка ED-111 в непрямом IFA подтвердило экспрессию белка ED-111 YFV в клетках млекопитающих.
Заключение. IFA подтвердил экспрессию белка ED-111 из pSinED-111. Поэтому иммуногенность репликона на основе запущенного ДНК вируса Синдбис будет оцениваться с использованием мышей.
http://dx.doi.org/10.1016/j.ijid.2014.03.1309
CrossMark
Тип: стендовая презентация
Окончательный номер реферата: 63.005 Сессия: Вакцины и разработка вакцины Дата: суббота, 5 апреля 2014 г. Время: 12: 45-14: 15 Зал: Банкетный зал
Рандомизированное двойное слепое контролируемое исследование по оценке безопасности и иммуногенности убитой пероральной вакцины против холеры (Шанчол®) у здоровых людей в Эфиопии
С.Н. Desai1- *, Z.Akalu2, S.Teshome1, L. Yamuah3, D.R. Kim1, J.S. Ян1, М.Тефери2, Дж. Хусейн2, Т.Ф. Вежба1, А. Асеффа2
1 Международный институт вакцин, Сеул, Корея, Республика
2 Исследовательский институт Армауэра Хансена, Аддис-Абеба, Эфиопия
Предыстория: ВОЗ провела предварительную квалификацию убитой оральной вакцины против холеры (OCV) в 2011 году, что явилось ключевой мерой по облегчению ее использования в рамках комплексного пакета, включающего меры водоснабжения и санитарии, в пострадавших от эпидемии холеры районах, таких как Гвинея и Гаити.Недавнее исследование фазы 3, в котором приняли участие около 70 000 взрослых и детей в Индии, продемонстрировало совокупную защитную эффективность 65% за 5 лет. Это первое испытание по оценке безопасности и иммуногенности схемы приема двух доз OCV в африканской популяции. Вакцина была протестирована на большом количестве людей в Индии, Вьетнаме и Бангладеш, где она продемонстрировала безопасность, иммуногенность и клиническую защитную эффективность. Хотя мы не ожидаем, что вакцина будет действовать иначе в эфиопском населении, мы стремимся подтвердить наше понимание использования OCV у здоровых людей в возрасте от 1 года и старше в Африке.
Методы и материалы. Это было индивидуально рандомизированное контролируемое двойное слепое плацебо-контролируемое исследование с участием 216 субъектов, поровну разделенных между здоровыми детьми и взрослыми. Участники получили две дозы вакцины или плацебо. Кровь была взята для измерения ответа вибриоцидных антител перед первой дозой (день 0), перед второй дозой (день 14) и на 28 день.
Результаты: Предварительные неослепленные данные о безопасности позволяют предположить, что вакцина безопасна и имеет только 8 нежелательных явлений (НЯ) как для группы вакцины, так и для группы плацебо.Все НЯ были легкими, разрешились самостоятельно и не сгруппировались после приема любой дозы. Полный анализ должен быть завершен в марте 2014 г., когда будут доступны результаты сравнения вакцины и реципиентов плацебо на предмет безопасности и вибриоцидного ответа. Это является важным шагом на пути к массовому демонстрационному проекту вакцинации, направленному на усиление национального надзора за холерой. Эти результаты, наряду с параллельными усилиями в других регионах высокого риска, могут проложить путь к интеграции OCV как в эндемичных условиях, так и в условиях вспышек в Эфиопии, Африке и за ее пределами.
Заключение. Побочные реакции наблюдались с одинаковой частотой у реципиентов вакцины и плацебо в обеих возрастных группах. Нежелательные явления (НЯ) были зарегистрированы в течение 28 дней после введения любой дозы у 0% и 1,8% вакцинированных и у 5,6% и 1,8% реципиентов плацебо у взрослых и детей соответственно. Все НЯ были легкими и разрешались самостоятельно. Наблюдался устойчивый иммунный ответ против холерного вибриона O1 с уровнем сероконверсии 81% и 77% у взрослых и детей. Эти результаты, наряду с параллельными усилиями в других регионах высокого риска, могут проложить путь к интеграции OCV как в эндемичных условиях, так и в условиях вспышек в Эфиопии, Африке и за ее пределами.Поскольку ВОЗ и партнеры работают над созданием международных запасов, данные о безопасности и иммуногенности за пределами Азии будут поддерживаться —
.

 Основой эффективного лечения является ранняя диагностика заболевания, также немаловажную роль играет профилактика, в частности, вакцинация против менингококковой инфекции.
Основой эффективного лечения является ранняя диагностика заболевания, также немаловажную роль играет профилактика, в частности, вакцинация против менингококковой инфекции.