Кал грудничка при дисбактериозе: Лечение дисбактериоза кишечника у детей
Дисбактериоз у детей
Дисбактериоз у детей – явление очень частое. К счастью, диагнозом дисбактериоз кишечника не является, то есть не входит в международную классификацию болезней. Тем не менее, дисбактериоз существует, и в особенности часто у детей.
Что же такое дисбактериоз?
Ребенок, как мы с Вами знаем уже из предыдущих статей, рождается в этом мире абсолютно стерильным. Важным моментом в формировании на коже новорожденного малыша и его слизистых оболочках поверхностной микрофлоры является прохождение ребенка по родовым путям матери и первый контакт с ее кожей, когда младенца акушеры должны выложить на мать. В первые часы жизни новорожденного начинается самое активное заселение поверхностей его тела множеством бактерий, которые в дальнейшем должны сформировать защитный слой везде, где возможен контакт наших с вами оболочек (кожи, слизистого эпителия) с возбудителями опасных инфекций.
Если в эти первые часы жизни в организм ребенка попадут помимо условно хороших бактерий еще и не очень хорошие, или патогенные бактерии, то у ребенка с самого момента его появления на свет будет нарушено состояние поверхностной защиты, иными словами, пленка может оказаться с дырками.
Точно также «дырки в защитной пленке» образуются в результате применения различных химиотерапевтических препаратов, прежде всего, антибиотиков.
Отсюда вывод: если мама ребенка во время беременности или во время лактации (кормления грудью), или же сам ребенок сразу после рождения получали
А как следствие дисбактериоза возникают проблемы с аллергией, вплоть до непереносимости белка материнского молока. В настоящее время уже появились анализы на антитела IgE и IgG грудного ребенка к белку не только коровьего, но даже грудного материнского молока.
Как мы можем вылечить дисбактериоз?
Справедливости ради надо сказать, что вылечить дисбактериоз нельзя, поскольку это не болезнь, как уже написано выше. Но если в микробиологическом анализе кала на дисбактериоз высеиваются патогенные бактерии, то это – не дисбактериоз, а кишечная инфекция, которая лечится, увы, антибиотиками.
Во всех остальных случаях нарушения нормальной микрофлоры кишечника, запомните, дисбактериоз Не лечится антибиотиками!
В настоящее время принято очень много схем лечения дисбактериоза, которые включают различные бактериофаги – специальные вирусы, которые паразитируют на плохих микробах, во все схемы лечения дисбактериоза обязательно входят сорбенты – препараты, связывающие и выводящие из организма токсины патогенных бактерий, а также пищевые аллергены.
Но основным методом лечения дисбактериоза кишечника по-прежнему остается длительный прием пробиотиков, то есть колоний хороших, полезных бактерий, которые очень нужны для правильного пищеварения и профилактики аллергии у детей, кто бы и что Вам не говорил.
Лечение дисбактериоза – это длительный и сложный процесс, но стоит того, чтобы предотвратить у ребенка развитие хронического запора или остановить развитие атопического дерматита.
Самостоятельно нельзя начинать прием никаких препаратов для лечения дисбактериоза, так как любые препараты имеют и плюсы, и минусы, то есть возможные побочные эффекты, и только грамотный врач педиатр, аллерголог илигастроэнтеролог должны подобрать и контролировать необходимый курс лечения.
Дисбактериоз у детей: лечим правильно!
На следующей стадии дисбактериоза, когда в микрофлоре уже появляются патогенные бактерии, проявлений значительно больше. Они могут быть похожи на симптомы различных заболеваний.
У грудных детей наблюдаются срыгивания, рвота, вздутие живота, через 1,5-2 часа после еды малыш беспокоится, притягивает ножки к животу, у него нарушается сон, он плохо прибавляет в весе.
У детей постарше могут наблюдаться признаки гастрита (воспаления желудка). После приема пищи появляется чувство распирания или боли в животе; снижается, а иногда и совсем пропадает аппетит; часто случается изжога, может появиться отрыжка, тошнота и даже рвота; периодически болит верхняя часть живота; постоянны усиленное газообразование и
Дисбактериоз может проявляться симптомами энтерита (воспаления тонкого кишечника), а именно частыми поносами, вздутием живота, метеоризмом, болями в животе.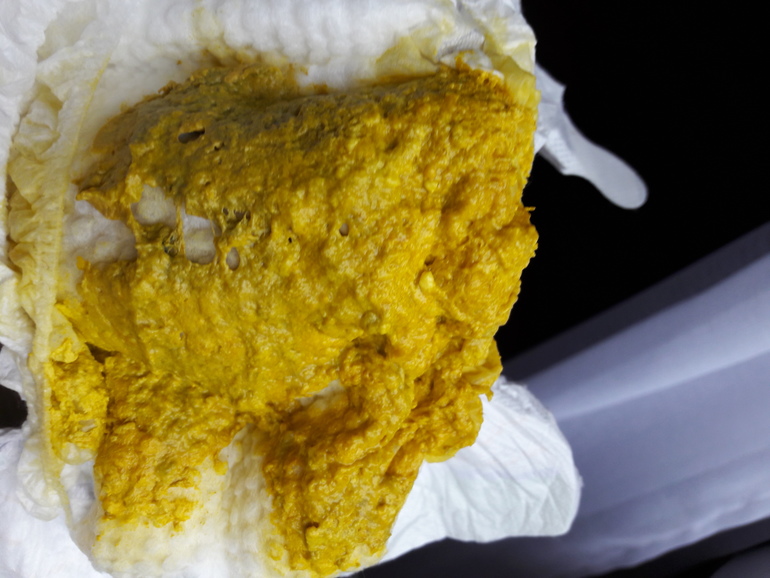 Ребенок становится раздражительным, но в то же время слабым, вялым, он быстро устает, жалуется на головную боль. Стул при этом жидкий, может быть пенистым, с кислым запахом, со слизью и зеленью.
Ребенок становится раздражительным, но в то же время слабым, вялым, он быстро устает, жалуется на головную боль. Стул при этом жидкий, может быть пенистым, с кислым запахом, со слизью и зеленью.
В некоторых случаях дисбактериоз имеет все
Дети теряют интерес к пище, даже самые любимые в прошлом продукты им уже не по вкусу. Поскольку нарушаются всасывательные функции кишечника, наблюдается симптом проскальзывания пищи (только поел и уже просится на горшок), появляются сбои в обменных процессах. Дети вялы, им явно не хватает витаминов и минеральных веществ.
Порой дисбактериоз своими симптомами напоминает колит (воспаление толстого кишечника). У ребенка неустойчивый стул: то поносы, то запоры.
фото, симптомы, кал грудничка при дисбактериозе, высыпания на коже, сыпь
Появляется дисбактериоз у грудничков довольно часто, при этом многие врачи вовсе не считают его диагнозом. Симптомы дисбактериоза у грудничка лишь сигнализируют об уменьшении полезной микрофлоры, что легко исправить, если вовремя заметить признаки расстройства кишечника.
Симптомы дисбактериоза у грудничков
Дисбактериоз у грудничка (фото 1) характеризуется определенным набором признаков, по которым врачи безошибочно определяют бактериальный дисбаланс. Дисбиоз — более правильное название расстройства желудка, но большинство предпочитает пользоваться привычным термином. Симптомы дисбактериоза у грудничка проявляются в следующем:
- у ребенка чувствуется тяжесть в животе, от боли детки плачут и становятся беспокойными;
- дети страдают метеоризмом, накопление газов провоцирует боль;
- типичный признак нарушения микрофлоры — расстройство стула;
- нетипичный кал с примесью непереваренной пищи;
- частые срыгивания большими объемами;
- кожные высыпания, атопический дерматит, появление опрелости;
- ломкость ногтей, выпадение волосиков на голове и их повышенная ломкость;
- грязно белый налет на поверхности языка, отличный от молочного после кормления;
- появление неприятного запаха изо рта;
- снижение аппетита, капризы перед кормлением.

Кал грудничка при дисбактериозе
Кал у грудничка при дисбактериозе (фото 2) имеет характерные признаки. В первую очередь, как и кал у взрослого, изменяется консистенция каловых масс. Если в норме кал ребенка имеет плотную структуру, то дисбактериоз у грудничков провоцирует изменение характера испражнений – они имеют жидкий вид, причем в самом кале заметны непереваренные крупинки пищи. Это может быть створожившееся молоко или частички прикорма, которые четко визуализируются на подгузнике.
Изменяется и цвет кала при дисбактериозе у грудничка – в зависимости от тяжести расстройства и принятой пищи цвет кала может быть грязно-зеленым или желтоватым. Цвет кала у взрослых примерно такой же, но темнее из-за присутствия пищи другого характера. При этом стул при дисбактериозе у грудничков имеет жидкую консистенцию и включает в себя светлые слизистые тяжи, а сам кал может пузырится. Это хорошо заметно, если ребенок недавно сходил на горшок или в памперс.
Внешне кал может быть похож на цвет кала при панкреатите, когда заболевание приобретает острый характер. Также стоит отметить, что стул новорожденного приобретает характерный резкий запах с кислинкой. Это подтверждает проблемы с перевариваемостью — запор или диарею, при которых желудочное содержимое выводится ненормально. Кал новорожденного при подозрении на дисбактериоз собирается и отправляется в лабораторию на исследование.
Высыпания на коже при дисбактериозе
Дисбактериоз у детей и взрослых имеет тесную связь с кожными высыпаниями. Высыпания у грудничка при обострении дисбактериоза будут давать четкую реакцию на коже. Поэтому сыпь у взрослых и детей можно лечить симптоматически, уделяя основное внимание проблемам кишечника.
Высыпания на коже при дисбактериозе (фото 3) появляются при интоксикации организма токсинами, которые образуются в процессе брожения и гниения содержимого кишечника. Токсические вещества из кишечника, богато снабженного кровеносными сосудами, попадают в кровь и разносятся по организму.
Дисбактериоз у ребенка и взрослого провоцирует защитную реакцию организма, активизируется работа сальных и потовых желез, которые пытаются вывести токсины из крови. При этом на коже появляется сыпь, при дисбактериозе у детей и взрослых она имеет типичные признаки раздражения и аллергической реакции.
Проявляется дисбактериоз на лице типично – кожный покров становится более тусклым, а сальные железы активно выделяют жировую смазку. Появляется мелкая сыпь у грудничка при дисбактериозе, у взрослых при закупорке желез жировым содержимым появляются гнойнички. Больше всего заметен дисбактериоз у новорожденного на лице, в складках кожи, на руках.
Если у новорожденных и детей не ухаживать за кожей правильно, то детский дерматит усугубляется, аллергический процесс захватывает все большие площади. Высыпания у ребенка при усилении аллергического компонента сопровождаются зудом и жжением, отечностью.
Дисбактериоз полости рта
Дисбактериоз полости рта (фото 4) проявляется при различных формах дисбактериоза. Дисбактериоз у грудных детей и взрослого характеризуется увеличением патогенной микрофлоры в ротовой полости по сравнению со здоровой. Дисбактериоз на языке и полости рта проходит несколько ступеней:
Дисбактериоз у грудных детей и взрослого характеризуется увеличением патогенной микрофлоры в ротовой полости по сравнению со здоровой. Дисбактериоз на языке и полости рта проходит несколько ступеней:
- Дисбиотический сдвиг — слабо увеличенное количество патогенной микрофлоры, внешне общий состав форы не страдает, поэтому визуальные проявления на этой стадии практически не заметны. Выглядит дисбактериоз в начале патологического процесса как белесые заезды в уголках рта;
- При субкомпенсированной форме дисбактериоз ротовой полости провоцирует белесый налет, а при сдаче анализа отмечают сдвиг по 2-3 показателям представителей флоры. Налет можно заметить на зубах, а во рту отмечается сухость, начинают кровоточить десна;
- При монокультуральной форме лактобактерии вытесняются. Язык при дисбактериозе кишечника изменяет свой цвет и приобретает грязно желтый оттенок, появляется неприятный кислый запах изо рта. Возникает воспаление миндалин, страдают зубы и десна;
- При четвертой, декомпенсированной стадии, в ротовой полости поселяются дрожжеподобные грибки, они поражают не только язык, но и обволакивают налетом стенки рта, небо.

Дисбактериоз кишечника не должен беспокоить — это состояние легко исправить, если добавить пациенту полезной микрофлоры, которая быстро подавит патогенные микроорганизмы и восстановит нормальный баланс в органах пищеварения.
Галерея фотографий дисбактериоза
Дисбактериоз у детей
Одним из часто встречающихся у детей заболеваний является дисбактериоз кишечника. При этом состоянии нарушается нормальный баланс микрофлоры, которая необходима для жизнедеятельности организма. Снижается количество «полезных» бактерий и увеличивается содержание патогенных микроорганизмов.
Причины
Основной причиной развития дисбактериоза у новорожденных и детей старшего возраста является нерациональная медикаментозная терапия. Особенно это относится к антибактериальному лечению. Однако дисбаланс микрофлоры может появляться и при наличии других заболеваний, а также под влиянием факторов, снижающих иммунитет:
Особенно это относится к антибактериальному лечению. Однако дисбаланс микрофлоры может появляться и при наличии других заболеваний, а также под влиянием факторов, снижающих иммунитет:
- ожоги;
- тяжелые операции;
- повышенное влияние ионизирующего излучения;
- ухудшение экологической ситуации;
- перевод на искусственное питание, позднее начало грудного вскармливания, заболевания матери.
Симптомы дисбактериоза
Симптомы дисбактериоза зависят возраста ребенка.
У детей старшего возраста может наблюдаться:
- жидкий стул или запор;
- кусочки непереваренной пищи и прожилки крови в кале.
У грудничка патология проявляется следующими симптомами:
- рвота, срыгивания;
- вздутие и боли в животе; урчание в животе;
- обильный жидкий или кашицеобразный стул;
- медленный набор веса.
Такие дети плохо растут и мало прибавляют в весе, могут болеть рахитом или анемией.
Диагностика
Для определения нарушения микрофлоры используются следующие исследования:
- анализ кала, в том числе биохимическое исследование;
- бактериологическое изучение состава кишечного содержимого и желчи;
- эзофагогастроскопия с последующим бактериологическим изучением соскоба со слизистой оболочки двенадцатиперстной кишки;
- колоноскопия с бактериологическим исследованием соскоба слизистой оболочки толстой и прямой кишки.
Лечение дисбактериоза у детей
Лечение дисбактериоза начинается с устранения причины, которая способствовала его развитию. Для нормализации состава микрофлоры применяются пребиотики и пробиотики. В целом лечение похоже на лечение Дисбактериоз у взрослых.
Диета
Диета при дисбактериозе у детей зависит от особенностей клинической картины у каждого пациента: показателей кислотности желудочного сока, степени нарушения пищеварения, локализации патологического процесса.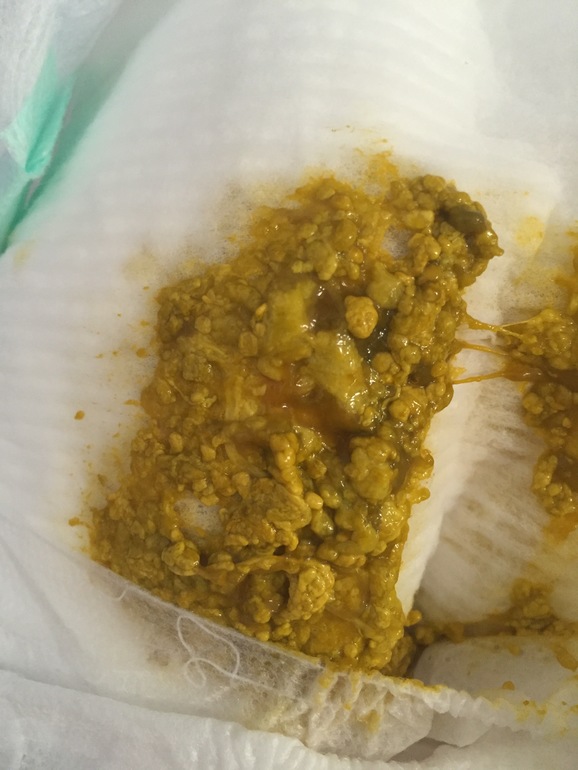 Питание ребенка при дисбактериозе должно быть сбалансированным и легкоусвояемым.
Питание ребенка при дисбактериозе должно быть сбалансированным и легкоусвояемым.
Опасность
Опасность заключается в нарушении водно-электролитного баланса, истощения малыша вследствие длительного поноса.
Группа риска
В группу риска входят малыши, которые перенесли:
- родовые травмы;
- глистные инвазии;
- искусственное вскармливание;
- Колит, энтерит;
- инфекционные заболевания (дизентерия, тиф).
Профилактика
Профилактика заключается в соблюдении режима питания малыша и проведении рациональной антибиотикотерапии.
Данная статья размещена исключительно в познавательных целях и не является научным материалом или профессиональным медицинским советом.
Все о дисбактериозе | Медицинский центр «Новая медицина»
ВСЁ О ДИСБАКТЕРИОЗЕ
Дисбактериоз очень распространенное заболевание. По данным Минздрава дисбактериоз выявляют у 90% взрослого населения и свыше 25% детей в возрасте до года. Многие заболевания, в том числе и хронические, связаны с нарушением микробиоценоза кишечника и часто являются следствием дисбактериоза, а не его причиной.
Многие заболевания, в том числе и хронические, связаны с нарушением микробиоценоза кишечника и часто являются следствием дисбактериоза, а не его причиной.
Дисбактериоз считается основной социальной болезнью 21-го века. Актуальность проблемы требует постоянного поиска новых средств лечения дисбактериоза и его коррекции.
ДИСБАКТЕРИОЗ У ДЕТЕЙ
Дисбактериоз у детей, как и у взрослых, возникает вследствие нарушения баланса микрофлоры кишечника. Определить его наличие без анализа в лаборатории крайне сложно, поскольку это не является самостоятельным заболеванием, а возникает вследствие воспалительного процесса в организме или же в случае нарушения баланса витаминов. В медицинской терминологии также применяется определение «дисбиоз», которое является синонимом «дисбактериоза».
Чаще всего возникает дисбактериоз у детей грудного возраста. К основному фактору его появления относится искусственное вскармливание малыша и недостаток витаминов, получаемых с дополнительной пищей. Также дисбактериоз у детей может возникнуть при аллергических реакциях организма, приема антибиотиков, зоны повышенной радиации, острых и хронических заболеваний пищеварительной системы или нарушения нормального функционирования кишечника из-за недостатка бактерий, расщепляющих кислоты и питательные вещества. Источник, как правило, устанавливает врач.
Также дисбактериоз у детей может возникнуть при аллергических реакциях организма, приема антибиотиков, зоны повышенной радиации, острых и хронических заболеваний пищеварительной системы или нарушения нормального функционирования кишечника из-за недостатка бактерий, расщепляющих кислоты и питательные вещества. Источник, как правило, устанавливает врач.
Кишечно-желудочный тракт взрослого человека содержит примерно 1,5 кг бактерий, около 400—500 разных видов, а у детей до двух лет, вскармливаемых грудным молоком, преобладают в основной массе бифидобактерии, которые препятствуют развитию кишечно-желудочных заболеваний. У малышей, которых вскармливают искусственным путем, из-за невозможности кормить грудью, не формируется преобладание какой-то определенной группы бактерий — бифидо бактерий, такое питание не сможет предотвратить дисбактериоз у ребенка и защитить организм от других заболеваний. Поэтому врачи рекомендуют кормить теми кисломолочными смесями, которые способствуют их размножению. Информацию о свойствах смесей можно прочитать на упаковке и выбрать оптимальную для ребенка.
Информацию о свойствах смесей можно прочитать на упаковке и выбрать оптимальную для ребенка.
Преобладание бифидобактерий в детском организме важно тем, что они помогают регулировать обмен желчных кислот, а также принимают участие в формировании органических веществ и кислот, необходимых для работы кишечника. Способствуют усваиванию витаминов К, группы В, D, солей, никотиновой и фолиевой кислоты, получаемых с питанием. Имеют антиаллергическое, антирахитическое и антианемическое действие на организм, а кроме того формируют иммунитет.
Как мы уже говорили, симптомов, по которым можно однозначно сделать вывод, что это дисбактериоз — нет, поэтому нужно искать в первую очередь причину — то заболевание, которое может сопровождаться дисбактериозом.
Раньше дисбактериоз определяли с помощью анализа состава кала, но так как осуществить правильный сбор кала в стерильную посуду не возможно, результат такого анализа не до конца объективен. На сегодняшний день в современной медицине применяются более сложные и точные методы, такие как исследование с помощью биохимии; для гастроскопии — анализ соскоба слизистой 12-перстнойлибо тощей кишки, для колоноскопии — анализ соскоба прямой и толстой кишки. Но такие сложные исследования проводятся только по назначению лечащего врача.
Но такие сложные исследования проводятся только по назначению лечащего врача.
Каким же образом происходит лечение?
Первостепенно необходимо лечить причину его возникновения — основное заболевание, которое устанавливает один из врачей, назначенных педиатром. Курс лечения будет состоять из лечения очага заболевания и специализированного питания смесями, способствующими либо образованию правильной (здоровой) микрофлоры кишечника либо смесями, которые уже содержат микроорганизмы.
Предотвращается возможный дисбактериоз у ребенка в первую очередь длительным грудным кормлением и своевременным введением дополнительного прикорма к молоку. Лучше всего все этапы вскармливания ребенка согласовывать с наблюдающим педиатром, собственная интуиция важна, но совет профессионала не менее важен, тем более в этом возрасте закладывается основа иммунитета на всю жизнь. Дополнять рацион питания рекомендуется специальными кисло-молочными смесями, которые содержат в себе бифидо и лактобактерии полезные деткам.
В том случае, если врач установил дисбактериоз у ребенка, к основному питанию добавляются кисло-молочные продукты, в зависимости от направления лечения. Наринэ-Форте, Биовестин, Биовестин-лакто содержат бифидо и лактобактерии в пропорциях и состояние, которые способны стимулировать развитие микроорганизмов нормальной флоры.
Но не забывайте — не только питанием лечится дисбактериоз у детей, а также предупреждением первоисточника его возникновения, который определяет врач. Лучше всего сразу применять смеси, которые способствуют образованию бифидобактерий, как прикорм к основному питанию, для того, чтобы поддерживать необходимую микрофлору кишечника и предотвратить дисбактериоз у ребенка, а именно лечение смесями уже осуществлять под руководством врача в сочетании с лечением очага воспаления.
ДИСБАКТЕРИОЗ — ВРАГ ЗДОРОВЬЯ
Каждый день наш организм нуждается в еде. Без пищи человек не может существовать. Прием пищи становится ритуалом, который человек должен соблюдать изо дня в день. Однако не всегда наш организм в силе переварить ее. Особенно, если мы позволяем себе лишнего.
Однако не всегда наш организм в силе переварить ее. Особенно, если мы позволяем себе лишнего.
Например, переедаем за ужином или перед сном, едим не совсем полезную и здоровую пищу. Полноценное пищеварение возможно только в случае наличия в желудке каждого человека самых разнообразных микробов. Причем эти микробы могут быть как положительными, так и, как это ни странно, отрицательными. Именно они помогают нашему желудку все это переварить.
Если говорить о дисбактериозе, то это состояние, во время которого все микробы нашего организма изменяют свой состав. Это изменение в свою очередь ведет к нарушению работы желудка и кишечника.
Вполне правильным будет вопрос — почему же все это происходит? Изменение состава Вашего кишечника происходит в результате каких-либо изменений в Вашем организме. Что это значит? Ваш организм чем-то заражен или в него попала какая-то инфекция. Все это приводит к появлению дисбактериоза.
Рассмотрим подробнее причины появления дисбактериоза. Этот сбой работы кишечника может произойти в результате неправильного применения различных антибиотиков. Если Вы страдаете заболеваниями пищеварительного тракта, у Вас также может появиться дисбактериоз. Слабый иммунитет, послеоперационное состояние или неправильное питание — еще три причины появления дисбактериоза.
Если Вы страдаете заболеваниями пищеварительного тракта, у Вас также может появиться дисбактериоз. Слабый иммунитет, послеоперационное состояние или неправильное питание — еще три причины появления дисбактериоза.
Во время дисбактериоза кишечник перестает обладать полезными микробами. Он наполнен только вредными бактериями, которые приводят к болям в области кишечника. В этот момент организм человека практически не получает никаких витаминов, жиров и других важных для организма веществ. Все это приводит к сильному снижению веса больного. При дисбактериозе у больного болит и вздувается живот. У него обязательно меняется стул.
Чтобы выявить наличие этого заболевания, Вам необходимо обратиться к врачу-гастроэнтерологу. Он назначит Вам гастроскопию, то есть проверят Ваш кишечник при помощи специального аппарата. Вам также проверят кишку и возьмут анализы кала. Все эти процедуры помогут врачу назначить Вам правильный курс лечения.
При любом курсе лечения этого заболевания Вы должны будете соблюдать диету. Эта диета обязательно будет включать в свой состав различные продукты, которые богаты полезными бактериями. Чаще всего таковыми являются различные кисломолочные продукты. Также Вам пропишут антибиотики или бактериофаги. Это препараты, которые помогут Вам очистить кишечник от вредных бактерий. Также Ваше лечение не обойдется без лекарственных препаратов, которые помогут Вашему кишечнику нормализоваться. Это такие препараты как: Нарине-Форте, Бификол, Биовестин, Нарине Ф-баланс и др.
Эта диета обязательно будет включать в свой состав различные продукты, которые богаты полезными бактериями. Чаще всего таковыми являются различные кисломолочные продукты. Также Вам пропишут антибиотики или бактериофаги. Это препараты, которые помогут Вам очистить кишечник от вредных бактерий. Также Ваше лечение не обойдется без лекарственных препаратов, которые помогут Вашему кишечнику нормализоваться. Это такие препараты как: Нарине-Форте, Бификол, Биовестин, Нарине Ф-баланс и др.
Чаще всего для полного выздоровления хватает двух месяцев. Однако есть одно но. Как правило, после лечения ни один врач не даст Вам стопроцентной гарантии, что Вы не заболеете дисбактериозом вновь. Микрофлора кишечника имеет один большой минус. Она очень быстро реагирует на любые изменения Вашего организма. Чтобы избежать всех этих неприятностей, Вам необходимо вовремя избавляться от любых неполадок Вашего органи. Например можно проводить профилактику — время от времени пропивать препараты, которые нормализуют микрофлору кишечника. Для этих целей отлично подойдет Нарине-Форте или Нарине Ф-баланс. При регулярном применение эти препараты не дадут развиться дисбактериозу, а так же нормализуют микрофлору пищеварительного тракта, что улучшит аппетит, стул и защитит Ваш кишечник от патогенных микробов. Также Вам не стоит принимать никакие антибиотики без консультации у врача.
Для этих целей отлично подойдет Нарине-Форте или Нарине Ф-баланс. При регулярном применение эти препараты не дадут развиться дисбактериозу, а так же нормализуют микрофлору пищеварительного тракта, что улучшит аппетит, стул и защитит Ваш кишечник от патогенных микробов. Также Вам не стоит принимать никакие антибиотики без консультации у врача.
Если говорить честно, то все в Ваших руках. Здоровье каждого человека в огромнейшей степени зависит исключительно от него самого. Если Вы будете себя беречь, Вы навсегда останетесь здоровыми и счастливыми.
БАД — ЭТО ТО, ЧТО НАМ НЕ ХВАТАЕТ В ПИЩЕ?
Относятся ли БАДы к разряду медикаментозных препаратов? Вызывают ли пищевые добавки привыкание? Могут ли добавки заменить обычное питание? Как правильно их применять? Что входит в их состав? Есть ли у БАДов противопоказания, и в каких случаях необходимо посоветоваться с врачом, прежде чем их принимать? На вопросы отвечает директор направления по улучшению качества пищевых продуктов канадского Института Здоровья Nutrilite.
Кто из нас не мечтает укрепить здоровье и продлить отпущенный природой срок жизни? Для этих целей вроде бы и выпускаются различные биологически активные добавки (БАДы). О них ходит множество мифов. Кто-то считает их панацеей от всего, кто-то убежден, что они не дают никакого эффекта, а их производители — шарлатаны…
Так что же такое БАДы и как правильно их принимать? С этим вопросом «Правда.ру» обратилась к Одре Дэвис — директору направления по улучшению качества пищевых продуктов канадского Института Здоровья Nutrilite.
— Относятся ли БАДы к разряду медикаментозных препаратов?
— Биологически активные добавки к пище — не лекарства. Но использовать их в комплексе с лекарственными средствами вполне разумно и оправданно. Они помогают оздоровить организм, сократить длительность болезни, снизить риск развития осложнений и обострений, позволяют увеличить продолжительность жизни. Лекарства хороши, когда человек уже заболел. А БАДы применяются как средства профилактики, предупреждения болезней. Ведь, за исключением травм и инфекций, болезнь никогда не возникает внезапно. Зачастую развитие заболевания являет собой длительный процесс, на протяжении которого организм пытается бороться с патологическими изменениями… Если в это время прибегнуть к БАДам, возможно, удастся восстановить нормальную работу органов еще до того, как нарушения станут очевидны.
Ведь, за исключением травм и инфекций, болезнь никогда не возникает внезапно. Зачастую развитие заболевания являет собой длительный процесс, на протяжении которого организм пытается бороться с патологическими изменениями… Если в это время прибегнуть к БАДам, возможно, удастся восстановить нормальную работу органов еще до того, как нарушения станут очевидны.
— Вызывают ли пищевые добавки привыкание?
— Физиологического привыкания не вызывают. Но есть люди, «зацикленные» на приеме различных витаминов, добавок и лекарств. На самом деле в состав добавок входят вещества, которые должны присутствовать в нашем ежедневном рационе. Но мало кто из нас умеет питаться рационально. Вот и бежим покупать БАДы!
— Могут ли добавки заменить обычное питание? Как правильно их применять?
— БАДы являются именно добавками к пище, а не ее заменителями. С их помощью организм адаптируется к воздействию различных внешних и внутренних факторов. Биодобавки и витаминно-минеральные комплексы рекомендуется принимать регулярно в осенно-зимне-весенний период, когда организм ослаблен непогодой и гиповитоминозами. Кроме того, они могут оказать незаменимую помощь в восстановлении после стрессов и физических нагрузок.
Кроме того, они могут оказать незаменимую помощь в восстановлении после стрессов и физических нагрузок.
— А что входит в их состав?
— БАДы включают в себя компоненты животного, растительного и минерального происхождения. В их состав могут входить как природные ингредиенты, так и соединения, полученные биотехнологическими или химическими методами. Могу с уверенностью сказать, что генетически модифицированные продукты при производстве биологически активных добавок не используются. В России утвержден и действует список из 190 разрешенных компонентов. Есть и перечень запрещенных: это, во-первых, сильнодействующие психотропные и ядовитые вещества, а также вещества, не являющиеся аналогами элементов нашего пищевого рациона, неприродные синтетические продукты, гормоны и ряд других…
— Есть ли у БАДов противопоказания, и в каких случаях необходимо посоветоваться с врачом, прежде чем их принимать?
— Предупреждения о возможных противопоказаниях потребитель может прочитать на этикетке к препарату. В России БАДы обязательно проходят государственную регистрацию. Но за консультацией к врачу не мешает обратиться, если вы беременны, кормите грудью, а также, если препарат предназначается для ребенка. Стоит помнить и о том, что у разных людей организм может по-разному реагировать на те или иные продукты и препараты, даже, на первый взгляд, безвредные. Поэтому совет грамотного специалиста никогда не помешает.
В России БАДы обязательно проходят государственную регистрацию. Но за консультацией к врачу не мешает обратиться, если вы беременны, кормите грудью, а также, если препарат предназначается для ребенка. Стоит помнить и о том, что у разных людей организм может по-разному реагировать на те или иные продукты и препараты, даже, на первый взгляд, безвредные. Поэтому совет грамотного специалиста никогда не помешает.
РОДИТЕЛЯМ ОБ АНТИБИОТИКАХ
Вторую половину ХХ века можно смело назвать антибактериальной эрой, и это не будет преувеличением: число жизней, спасенных с помощью антибиотиков, давно перешагнуло за миллиард! Об их чудотворной силе ходят легенды, но и хулы в их адрес приходится слышать не меньше. Виной тому поверхностное знание, провоцирующее неоправданные ожидания, а стало быть — и многочисленные обвинения антибиотиков в бедах, за которые они на самом деле ответственности вовсе не несут.
А хуже всего то, что антибиотики применяют гораздо чаще, чем это необходимо, нанося тем самым серьезнейший вред не только больным, но и обществу в целом.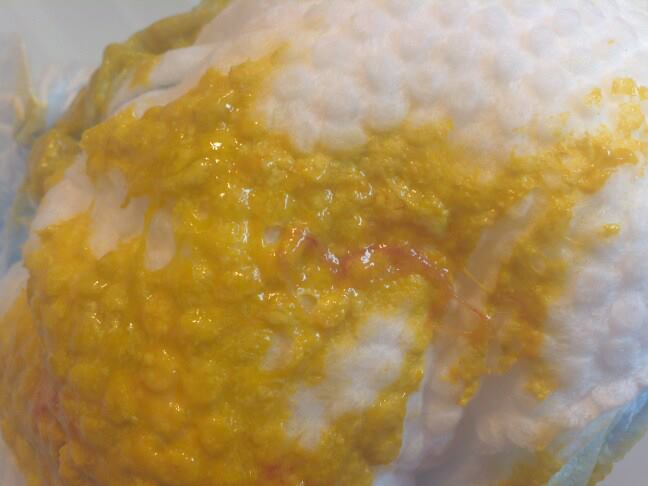 Я далек от мысли научить родителей самостоятельно использовать антибиотики — это дело врача. Но я убежден, что понимать логику назначения врача современные родители не только могут, но и обязаны.
Я далек от мысли научить родителей самостоятельно использовать антибиотики — это дело врача. Но я убежден, что понимать логику назначения врача современные родители не только могут, но и обязаны.
О ПОЛЬЗЕ ГРЯЗНОЙ ПОСУДЫ
Слово «антибиотик» образовано из двух элементов греческого происхождения: anti- — «против» и bios — «жизнь». Антибиотиками называют образуемые микроорганизмами, высшими растениями или тканями животных организмов вещества, избирательно подавляющие развитие микроорганизмов (или клеток злокачественных опухолей).
Любопытна история открытия первого антибиотика — пенициллина — шотландским бактериологом Александером Флемингом в 1829 г.: будучи по природе человеком неряшливым, он очень не любил… мыть чашки с бактериологическими культурами. Каждые 2—3 недели на его рабочем столе вырастала целая груда грязных чашек, и он скрепя сердце приступал к очистке «авгиевых конюшен». Одна из таких акций дала неожиданный результат, масштаб последствий которого сам ученый оценить в тот момент не мог. В одной из чашек обнаружилась плесень, подавляющая рост высеянной культуры болезнетворной бактерии группы staphylococcus. Кроме того, «бульон», на котором разрослась плесень, приобрел отчетливо выраженные бактерицидные свойства по отношению ко многим распространенным патогенным бактериям. Плесень, которой была заражена культура, относилась к виду penicillium.
В одной из чашек обнаружилась плесень, подавляющая рост высеянной культуры болезнетворной бактерии группы staphylococcus. Кроме того, «бульон», на котором разрослась плесень, приобрел отчетливо выраженные бактерицидные свойства по отношению ко многим распространенным патогенным бактериям. Плесень, которой была заражена культура, относилась к виду penicillium.
В очищенном виде пенициллин был получен лишь в 1940 г., т. е. спустя 11 лет после его открытия, в Великобритании. Сказать, что это произвело революцию в медицине, — значит не сказать ничего. Но у любой медали, увы, две стороны…
ОБОРОТНАЯ СТОРОНА МЕДАЛИ
Открыв столь мощное оружие в борьбе с болезнетворными микроорганизмами, человечество впало в эйфорию: к чему долго и кропотливо подбирать лекарственную терапию, если можно «шарахнуть» по зловредным микробам антибиотиком? Но и микробы «не лыком шиты» — они весьма эффективно защищаются от грозного оружия, вырабатывая устойчивость к нему. Если антибиотик, скажем, блокирует синтез необходимых микробу белков — микроб в ответ на это просто… меняет белок, обеспечивающий его жизнедеятельность. Некоторые микроорганизмы ухитряются научиться выработке ферментов, разрушающих сам антибиотик. Короче говоря, способов множество, и «хитроумные» микробы ни одним из них не пренебрегают. Но самое печальное заключается в том, что устойчивость микробов может передаваться от одного вида другому путем межвидового скрещивания! Чем чаще применяется антибиотик, тем быстрее и успешнее микробы приспосабливаются к нему. Возникает, как вы понимаете, порочный круг — чтобы разорвать его, ученые вынуждены вступить в навязанную микробами «гонку вооружений», создавая все новые и новые виды антибиотиков.
Некоторые микроорганизмы ухитряются научиться выработке ферментов, разрушающих сам антибиотик. Короче говоря, способов множество, и «хитроумные» микробы ни одним из них не пренебрегают. Но самое печальное заключается в том, что устойчивость микробов может передаваться от одного вида другому путем межвидового скрещивания! Чем чаще применяется антибиотик, тем быстрее и успешнее микробы приспосабливаются к нему. Возникает, как вы понимаете, порочный круг — чтобы разорвать его, ученые вынуждены вступить в навязанную микробами «гонку вооружений», создавая все новые и новые виды антибиотиков.
НОВОЕ ПОКОЛЕНИЕ ВЫБИРАЕТ…
К настоящему времени создано более 200 противомикробных препаратов, из них более 150 используются для лечения детей. Их мудреные названия нередко ставят в тупик людей, не имеющих отношения к медицине. Как же разобраться в обилии замысловатых терминов? На помощь, как всегда, приходит классификация. Все антибиотики делятся на группы — в зависимости от способа воздействия на микроорганизмы.
Пенициллины и цефалоспорины разрушают оболочку бактериальной клетки.
Аминогликозиды, макролиды, левомицетин, рифампицин и линкомицин убивают бактерии, подавляя синтез разных ферментов — каждый своего.
Фторхинолоны уничтожают микроорганизмы более «изощренно»: подавляемый ими фермент отвечает за размножение микробов.
В непрекращающемся состязании с микробами ученым приходится придумывать все новые и новые методы борьбы — каждый из них дает начало новому поколению соответствующей группы антибиотиков.
Теперь о названиях. Увы, здесь царит изрядная неразбериха. Дело в том, что помимо основных международных (так называемых генерических) названий многие антибиотики имеют и фирменные, запатентованные тем или иным конкретным производителем (в России их более 600). Так, например, один и тот же препарат может называться амоксициллином, Оспамоксом и Флемоксин Солютабом. Как же разобраться? По закону наряду с патентованным фирменным названием на упаковке лекарства обязательно указывается и его генерическое название — мелким шрифтом, нередко по-латыни (в данном случае — amoxycillinum).
При назначении антибиотика часто говорят о препаратепервого выбора и резервных препаратах. Препарат первого выбора — это тот препарат, назначение которого определяется диагнозом — если у больного нет устойчивости или аллергии к этому лекарственному средству. В последнем случае обычно назначаются резервные препараты.
ЧЕГО ЖДАТЬ И ЧЕГО НЕ ЖДАТЬ ОТ АНТИБИОТИКОВ?
Антибиотики способны излечить заболевание, вызванное бактериями, грибками и простейшими, но не вирусами. Именно поэтому бесполезно ожидать эффекта от антибиотика, назначенного при ОРВИ, точнее, эффект в таких случаях бывает негативным: температура держится несмотря на прием антибиотика — вот вам и «питательная среда» для распространения молвы о якобы потерянной эффективности антибиотиков или же о повальной устойчивости микробов.
Назначение антибиотика при вирусной инфекции не предотвращает бактериальных осложнений. Напротив, подавляя рост чувствительных к препарату микробов, например обитающих в дыхательных путях, антибиотик облегчает заселение дыхательных путей устойчивыми к нему патогенными бактериями, легко вызывающими осложнение.
Антибиотики не подавляют воспалительного процесса, обусловливающего подъем температуры, так что «сбить температуру» через полчаса, как парацетамол, антибиотик не может. При приеме антибиотика падение температуры наступает лишь через несколько часов или даже через 1—3 дня. Именно поэтому нельзя давать одновременно антибиотик и жаропонижающее: падение температуры от парацетамола может замаскировать отсутствие эффекта от антибиотика, а при отсутствии эффекта антибиотик, естественно, необходимо как можно скорее сменить.
Однако сохранение температуры нельзя считать признаком, однозначно свидетельствующим о неэффективности принимаемого антибиотика: порой выраженная воспалительная реакция, образование гноя требуют дополнительного к антибактериальному лечения (назначения противовоспалительных средств, вскрытия гнойника).
ВЫБОР ЗА ВРАЧОМ
Для лечения заболеваний, вызываемых чувствительными к антибиотикам микробами, обычно используются препараты первого выбора. Так, ангину, отит, пневмонию лечат амоксициллином или оспеном, микоплазменную инфекцию или хламидиоз эритромицином или другим антибиотиком из группы макролидов.
Возбудители кишечных инфекций зачастую быстро вырабатывают устойчивость к антибиотикам, поэтому при лечении кишечных инфекций антибиотики применяются лишь в тяжелых случаях — обычно цефалоспорины 2—3-го поколений или хинолоны.
Инфекции мочевых путей вызываются представителями кишечной флоры, их лечат амоксициллином или, при устойчивости возбудителей, резервными препаратами.
Как долго принимают антибиотик? При большинстве острых болезней его дают в течение 2—3 дней после падения температуры, однако есть много исключений. Так, отит обычно лечат амоксициллином не более 7—10 дней, а ангину — не менее 10 дней, иначе может быть рецидив.
ТАБЛЕТКИ, СИРОПЫ, МАЗИ, КАПЛИ…
Для детей особенно удобны препараты в детских формах. Так, препарат амоксициллина Флемоксин Солютаб выпускается в растворимых таблетках, их легко дать с молоком или чаем. Многие препараты, такие как джосамицин (Вильпрафен), азитромицин (Сумамед), цефуроксим (Зиннат), амоксициллин (Оспамокс) и др., выпускаются в сиропе или в гранулах для его приготовления.
Есть несколько форм антибиотиков для наружного применения — левомицетиновая, гентамициновая, эритромициновая мази, тобрамициновые глазные капли и др.
ОПАСНЫЕ ДРУЗЬЯ
Опасности, связанные с приемом антибиотиков, часто преувеличивают, но помнить о них необходимо всегда.
Поскольку антибиотики подавляют нормальную флору организма, они могут вызывать дисбактериоз, т. е. размножение бактерий или грибов, не свойственных тому или иному органу, прежде всего кишечнику. Однако лишь в редких случаях такой дисбактериоз опасен: при недлительном (1—3 недели) лечении антибиотиками проявления дисбактериоза фиксируются крайне редко, к тому же пенициллин, макролиды, цефалоспорины 1-го поколения не подавляют роста флоры кишечника. Так что противогрибковые (нистатин) и бактериальные (Бифидумбактерин, Лактобактерин) препараты применяются для предупреждения дисбактериоза лишь в случаях длительного лечения несколькими лекарственными препаратами широкого антибактериального спектра.
Термином «дисбактериоз», однако, в последнее время стали злоупотреблять — ставят его в качестве диагноза, списывая на него чуть ли не любые нарушения функционирования желудочно-кишечного тракта. Есть ли вред от такого злоупотребления? Да, поскольку это мешает постановке правильного диагноза. Так, например, у многих детей с пищевой непереносимостью диагностируют дисбактериоз, а потом «лечат» Бифидумбактерином, обычно без успеха. Да и стоят анализы кала на дисбактериоз немало.
Есть ли вред от такого злоупотребления? Да, поскольку это мешает постановке правильного диагноза. Так, например, у многих детей с пищевой непереносимостью диагностируют дисбактериоз, а потом «лечат» Бифидумбактерином, обычно без успеха. Да и стоят анализы кала на дисбактериоз немало.
Еще одна опасность, подстерегающая при приеме антибиотиков, — аллергия. У некоторых людей (в том числе и у грудных детей) имеется аллергия к пенициллинам и другим препаратам-антибиотикам: сыпи, шоковые реакции (последние, к счастью, встречаются очень редко). Если у вашего ребенка уже наблюдалась реакция на тот или иной антибиотик, об этом надо обязательно сообщить врачу, и он легко подберет замену. Особенно часты аллергические реакции в тех случаях, когда антибиотик дают больному, страдающему заболеванием небактериальной природы: дело в том, что многие бактериальные инфекции как бы снижают «аллергическую готовность» больного, что уменьшает риск реакции на антибиотик.
Аминогликозиды могут вызывать поражение почек и глухоту, их без большой надобности их не применяют. Тетрациклины окрашивают эмаль растущих зубов, их дают детям только после 8 лет. Препараты фторхинолонов детям не назначают из-за опасности нарушения роста, их дают лишь по жизненным показаниям.
Тетрациклины окрашивают эмаль растущих зубов, их дают детям только после 8 лет. Препараты фторхинолонов детям не назначают из-за опасности нарушения роста, их дают лишь по жизненным показаниям.
Принимая во внимание все вышеперечисленные «факторы риска», врач обязательно оценивает вероятность осложнений и применяет препарат только тогда, когда отказ от лечения сопряжен с большой степенью риска.
В заключение остается лишь сказать несколько слов об экономических аспектах назначения антибиотиков. Новые антибиотики стоят очень дорого. Спору нет, бывают ситуации, когда их применение необходимо, однако я часто сталкиваюсь со случаями, когда эти препараты назначаются без надобности, при заболеваниях, которые можно легко вылечить дешевыми лекарствами «старого образца». Я согласен с тем, что не следует скупиться, если речь идет о лечении ребенка. Но траты должны быть разумными! (Можно, например, купить антибиотик в форме сиропа: сиропы довольно дороги, но дети их принимают охотно, да и дозировать сироп или капли очень удобно. ) Однако это не означает, что при выборе препарата вовсе не следует принимать во внимание финансовую сторону дела. Не надо стесняться спросить у врача, во что обойдется вам выписанный рецепт, и если он вас не устраивает (слишком дорог или слишком дешев — это тоже нередко настораживает родителей), поищите вместе с врачом удовлетворяющую вас замену. Хочу еще раз повторить: десятки препаратов, имеющиеся сегодня в аптеках, почти всегда позволяют найти эффективное лекарство, соответствующее вашим возможностям.
) Однако это не означает, что при выборе препарата вовсе не следует принимать во внимание финансовую сторону дела. Не надо стесняться спросить у врача, во что обойдется вам выписанный рецепт, и если он вас не устраивает (слишком дорог или слишком дешев — это тоже нередко настораживает родителей), поищите вместе с врачом удовлетворяющую вас замену. Хочу еще раз повторить: десятки препаратов, имеющиеся сегодня в аптеках, почти всегда позволяют найти эффективное лекарство, соответствующее вашим возможностям.
ДИСБАКТЕРИОЗ — АКТУАЛЬНОСТЬ ПРОБЛЕМЫ
Проблема сохранения здоровья, поиск путей снижения неблагоприятного воздействия на организм внешней среды являются в настоящее время крайне актуальными для нашей страны. По данным Российской академии наук, более 90% населения Российской Федерации в настоящее время имеют отклонения от физиологической нормы по тем или иным показателям, характеризующим здоровье человека.
Техногенные и экологические катастрофы, инфекционные болезни, экспансия некачественных лекарственных средств и продуктов питания, самоотравление алкоголем и наркотиками, психоэмоциональное напряжение и множество других вредоносных факторов истощают защитные силы организма, снижают его адаптационный потенциал.
Одной из важнейших систем поддержания и сохранения гомеостаза организма является его нормальная микрофлора, населяющая желудочно-кишечный тракт, мочеполовую систему, кожные покровы. Она оказывает многоплановое влияние на защитные, адаптационные и обменно-трофические механизмы организма, а ее нарушения под влиянием факторов эндогенной или экзогенной природы могут привести к утрате или искажению этих функций, которые влекут за собой проявления дисбактериоза — изменения качественного и количественного состава микрофлоры организма. Спектр клинических синдромов и патологических состояний, патогенез которых связан с дисбактериозом, в настоящее время очень широк и имеет тенденцию к увеличению.
Это возводит проблему разработки средств, повышающих адаптационный потенциал организма человека, в ранг первостепенных задач не только медицинского, но и экономического и политического характера.
В настоящее время одним из наиболее доступных и эффективных способов экологической реабилитации являются пробиотики — продукты, биологически активные добавки и фармацевтические препараты на основе полезных микроорганизмов, прежде всего, бифидобактерий и лактобацилл, оказывающих многофакторное регулирующее и стимулирующее воздействиие на организм человека, укрепляющих иммунную систему, защищающих от болезнетворных микробов. И не случайно, согласно данным российских маркетологов, занятых анализом объемов потребления фармпрепаратов и БАД, начиная с 2000 года только два сегмента этого рынка имеют тенденцию к росту — антиканцерогенные и пробиотические препараты. Им принадлежит ведущая роль в нормализации микробиоценоза кишечника, поддержании неспецифической резистентности организма, улучшении процессов всасывания и гидролиза жиров, белкового и минерального обмена, синтезе биологически активных веществ.
И не случайно, согласно данным российских маркетологов, занятых анализом объемов потребления фармпрепаратов и БАД, начиная с 2000 года только два сегмента этого рынка имеют тенденцию к росту — антиканцерогенные и пробиотические препараты. Им принадлежит ведущая роль в нормализации микробиоценоза кишечника, поддержании неспецифической резистентности организма, улучшении процессов всасывания и гидролиза жиров, белкового и минерального обмена, синтезе биологически активных веществ.
Представители нормофлоры синтезируют витамины группы В, никотиновую кислоту, биотин, витамин К. Большая роль принадлежит им в защите организма от токсических элементов экзогенного происхождения и эндогенных субстратов и метаболитов. Они принимают активное участие в метаболизации разнообразных веществ растительного, животного и микробного происхождения, рециркуляции желчных кислот, активно влияют на метаболизм билирубина и холестерина. Установлена их антиканцерогенная и антимутагенная активность. Известна способность инактивировать гистамин, играющий важную роль в проявлении аллергии.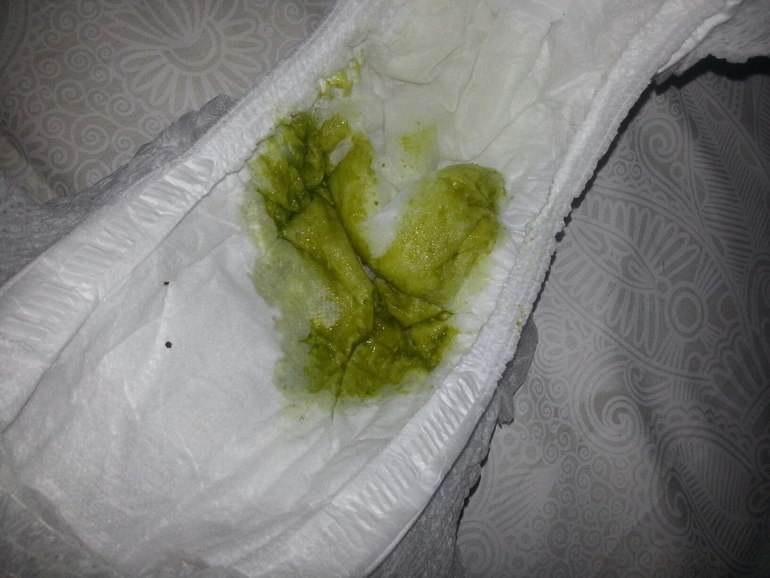
Все эти положительные эффекты позволяют рассматривать представителей нормальной микрофлоры как эффективный биокорректор и основу для создания различных форм пробиотиков.
По материалам сайта www.disbakterioza.net
Дисбактериоз с определением чувствительности к антибиотикам и бактериофагам
Количественный метод бактериологического исследования микрофлоры кишечника на специальных обогащенных питательных средах с целью выявления дисбиотических состояний у взрослых. Исследование на определение чувствительности к антибиотикам ставится диско-диффузионным методом с учетом рекомендаций по антибиотикорезистентности. Исследование на определение чувствительности к бактериофагам может быть выполнено в случае, если к обнаруженному возбудителю существует бактериофаг.
В каких случаях обычно назначают посев на дисбактериоз?
Посев на дисбактериоз проводится с целью выявления нарушений баланса микрофлоры кишечника, основывается на определении количественного состава основных бактерий, населяющих кишечник. Полученные результаты сопоставляют с нормальными показателями. С целью оценки динамики показателей, посев кала на дисбактериоз проводят не ранее, чем через 2 недели после окончания терапии антибиотиками или бактериофагами.
Полученные результаты сопоставляют с нормальными показателями. С целью оценки динамики показателей, посев кала на дисбактериоз проводят не ранее, чем через 2 недели после окончания терапии антибиотиками или бактериофагами.
Дисбактериоз (нарушение баланса нормальной флоры кишечника) у взрослых и у детей может быть связано с нарушением работы печени, желчевыводящих путей, желудка, поджелудочной железы.
Признаки дисбактериоза могут сопровождать следующие состояния:
- паразитарные инвазии, в том числе лямблиоз;
- хронические инфекции, например, носительство стафилококка;
- аллергии;
- гиповитаминоз;
- сахарный диабет;
- после приема антибиотиков.
Дисбактериоз кишечника может проявляться запором, диареей, метеоризмом, болями и другими расстройствами.
Что именно определяется в процессе анализа?
Исследование позволят выявить и определить количество как нормальной микрофлоры, так и условно- патогенных микроорганизмов. Часть возбудителей кишечных инфекций тоже может быть обнаружена в этом тесте.
Часть возбудителей кишечных инфекций тоже может быть обнаружена в этом тесте.
Что означают результаты теста?
Анализ позволит выявить изменения биоценоза кишечника и определить степень их выраженности. При выявлении патогенных бактерий или условно-патогенных микроорганизмов в значимом количестве проводится тестирование их на чувствительность к действию антибиотиков и бактериофагов.
Обычный срок выполнения теста:
до 7-8 дней
Нужна ли специальная подготовка к анализу?
Специальная подготовка не требуется. Исследование нельзя проводить на фоне приема антибактериальных препаратов. После окончания лечения должно пройти не менее 2-ух недель.
Сдать анализ кала на дисбактериоз кишечника
Метод определения Бактериологический, бактериоскопический
Исследуемый материал Кал
Доступен выезд на дом
Синонимы: Дисбиоз кишечника; Анализ кала на дисбактериоз.
Intestinal dysbiosis; Intestinal disbios; Intestinal dysbacteriosis.
Краткое описание исследования «Дисбактериоз кишечника»
В медицинских офисах Москвы и Московской области приём биоматериала для выполнения теста № 456 производится 7 дней в неделю с ограничениями по времени взятия. Интересующую информацию уточняйте у администраторов медицинских офисов.
Дисбактериоз (в англоязычной литературе используют термин Intestinal bacterial overgrowth, реже – disbios) острое или хроническое нарушение нормальной микрофлоры кишечника.
В содержимом тощей кишки здоровых людей может находиться до 105 бактерий в 1 мл кишечного содержимого. Основными являются молочнокислые палочки, стафилококки и стрептококки, другие грамположительные аэробные бактерии и грибы. В дистальном отделе подвздошной кишки количество микробов увеличивается до 108, в первую очередь за счёт энтерококков, кишечной палочки, бактероидов и анаэробных бактерий. В толстой кишке преобладают анаэробы (бактероиды, клостридии, лактобациллы). Этот симбиоз бактерий у здорового человека (и у млекопитающих!) выполняет многие полезные функции: противодействует чужеродным патогенным микробам и вирусам, помогает пищеварению, синтезирует витамины группы В.
Этот симбиоз бактерий у здорового человека (и у млекопитающих!) выполняет многие полезные функции: противодействует чужеродным патогенным микробам и вирусам, помогает пищеварению, синтезирует витамины группы В.
Соотношение количества различных микроорганизмов достаточно постоянно. Но вследствии ослабления иммунитета, нерациональной терапии антибиотиками, лучевой и химиотерапии, врождённых дефектов ферментов баланс нарушается. Могут исчезнуть некоторые представители нормальной микрофлоры (бифидобактерии, молочнокислые и кишечные палочки) и появиться грибки рода кандида, стафилококки, протей, синегнойная палочка. Возникает клинический синдром, для которого характерны понос, стеаторея, снижение веса и анемия. При резком ослаблении защитных сил, иммунитета может развиться генерализованная форма эндогенной инфекции вплоть до сепсиса.
С какой целью проводят исследование на дисбактериоз кишечника
Исследование микрофлоры кишечника применяют для определения характера нарушения биоценоза кишечника.
Выявляемые микроорганизмы и возбудители в исследовании «Дисбактериоз кишечника»
Выделяемые микроорганизмы и возбудители:
- полезные бактерии кишечника – лактобактерии, бифидобактерии, кишечные палочки с типичными свойствами, а также со сниженными ферментативными и гемолитическими признаками;
- условно-патогенные бактерии – энтеробактерии, неферментирующие бактерии, стафилококки, энтерококки, анаэробные бактерии (клостридии, без идентификации до вида), грибы;
- патогенные – сальмонеллы, шигеллы.
Литература
Основная литература
- Парфенов А. И. Микробная флора кишечника и дисбактериоз РМЖ, 1998, т. 6, №18.
- Henry C. Small Intestinal Bacterial Overgrowth and Irritable Bowel Syndrome JAMA. 2004, v.292, pp. 2213 — 2214.
Дисбактериоз каловых масс у младенцев с муковисцидозом связан с ранним нарушением линейного роста
Муковисцидоз (МВ) вызывается мутациями в регуляторе трансмембранной проводимости МВ (CFTR), что приводит к изменению транспорта жидкости и ионов через мембраны эпителиальных клеток во множестве органы 8 . Осложнения со стороны желудочно-кишечного тракта, включая мальабсорбцию питательных веществ, стеаторею, обструкцию желудочно-кишечного тракта и недостаточную массу и длину тела, являются одними из самых ранних проявлений МВ и могут быть опасными для жизни 9,10,11 .Эти симптомы возникают в результате внешнесекреторной недостаточности поджелудочной железы, осложнения, которым страдают примерно 85% младенцев с МВ, которое лишь частично компенсируется заместительной терапией ферментами поджелудочной железы. Однако, хотя ранняя недостаточная прибавка веса часто объясняется нарушением всасывания питательных веществ или повышенными метаболическими потребностями, длина тела в зависимости от возраста варьируется у детей с аналогичными уровнями дисфункции CFTR и панкреатической недостаточности, даже у детей с нормальным весом 1 , что позволяет предположить, что неизвестные факторы способствуют развитию сбой линейного роста.
Осложнения со стороны желудочно-кишечного тракта, включая мальабсорбцию питательных веществ, стеаторею, обструкцию желудочно-кишечного тракта и недостаточную массу и длину тела, являются одними из самых ранних проявлений МВ и могут быть опасными для жизни 9,10,11 .Эти симптомы возникают в результате внешнесекреторной недостаточности поджелудочной железы, осложнения, которым страдают примерно 85% младенцев с МВ, которое лишь частично компенсируется заместительной терапией ферментами поджелудочной железы. Однако, хотя ранняя недостаточная прибавка веса часто объясняется нарушением всасывания питательных веществ или повышенными метаболическими потребностями, длина тела в зависимости от возраста варьируется у детей с аналогичными уровнями дисфункции CFTR и панкреатической недостаточности, даже у детей с нормальным весом 1 , что позволяет предположить, что неизвестные факторы способствуют развитию сбой линейного роста.
Наблюдения из клинических исследований 1 и моделей на животных 12 предполагают, что один из механизмов низкого роста, связанный с МВ, связан с зависимым от CFTR дефицитом гормона роста, который не связан с питанием. В проспективном многоцентровом исследовании младенцев с МВ (Исследование детского наблюдения и питания, BONUS) исследуемая популяция достигла нормального среднего веса для возраста в 12 месяцев с помощью пищевых добавок, основанных на кривых роста Всемирной организации здравоохранения (ВОЗ) для здоровых младенцев ( среднее значение z — разница оценок -0.04, 95% доверительный интервал (ДИ) от –0,17 до 0,09). Напротив, младенцы с МВ не достигли нормальной средней длины тела в 12 месяцев по стандартам ВОЗ (среднее значение z — разница баллов, -0,56, 95% ДИ от -0,70 до -0,42), что указывает на низкий рост, несмотря на агрессивное вмешательство в питание 1 . Более того, вес и длина z -баллы были отрицательно коррелированы с потребленными калориями, что свидетельствует против недостаточного потребления калорий как причины задержки роста. Младенцы с низкой длиной тела имели значительно более низкие сывороточные уровни инсулиноподобного фактора роста I (IGF-1), чем дети с нормальной длиной тела 1 , аналогично наблюдениям на моделях CF на животных 12 .
В проспективном многоцентровом исследовании младенцев с МВ (Исследование детского наблюдения и питания, BONUS) исследуемая популяция достигла нормального среднего веса для возраста в 12 месяцев с помощью пищевых добавок, основанных на кривых роста Всемирной организации здравоохранения (ВОЗ) для здоровых младенцев ( среднее значение z — разница оценок -0.04, 95% доверительный интервал (ДИ) от –0,17 до 0,09). Напротив, младенцы с МВ не достигли нормальной средней длины тела в 12 месяцев по стандартам ВОЗ (среднее значение z — разница баллов, -0,56, 95% ДИ от -0,70 до -0,42), что указывает на низкий рост, несмотря на агрессивное вмешательство в питание 1 . Более того, вес и длина z -баллы были отрицательно коррелированы с потребленными калориями, что свидетельствует против недостаточного потребления калорий как причины задержки роста. Младенцы с низкой длиной тела имели значительно более низкие сывороточные уровни инсулиноподобного фактора роста I (IGF-1), чем дети с нормальной длиной тела 1 , аналогично наблюдениям на моделях CF на животных 12 .
Длина тела является ключевым фактором роста легких; Ранний низкий рост у пациентов с МВ связан с последующей задержкой роста, плохими респираторными исходами и снижением выживаемости 2,3 . Следовательно, улучшение или восстановление нормального линейного роста у младенцев с МВ является важной целью, которая может улучшить долгосрочные результаты. Хотя лекарства, улучшающие функцию CFTR (модуляторы), были введены недавно, их начинают применять после младенчества и они не нормализуют рост для всех детей с МВ в США 12 , что подчеркивает важность дополнительных стратегий для борьбы с ранней задержкой роста, связанной с CF.
Несколько исследований 4,5,13,14 сообщили о фекальном дисбактериозе у маленьких детей с МВ, который коррелирует с фекальными показателями воспаления и жира. В дополнение к измененному содержанию питательных веществ из-за мальабсорбции, желудочно-кишечный тракт CF характеризуется нарушением времени прохождения, аномальными слизью и pH, а также воспалением 9,10,11 , все из которых могут влиять на состав и функцию микробиома GI. Здоровая микробиота желудочно-кишечного тракта выполняет функции, важные для роста, в том числе сбор питательных веществ и производство субстратов, регулирующих метаболизм хозяина.Микробные метаболиты ЖКТ также контролируют рост костей и тела, модулируя гормоны роста, включая IGF-1 (ref. 6 ). Таким образом, микробиота желудочно-кишечного тракта может влиять на исходы питания при МВ и, в свою очередь, на общее долгосрочное здоровье. Чтобы исследовать эту возможность, мы сравнили фекальную микробиоту младенцев нормальной и малой длины с МВ, чтобы определить связь между фекальным дисбиозом при МВ и линейным ростом.
Здоровая микробиота желудочно-кишечного тракта выполняет функции, важные для роста, в том числе сбор питательных веществ и производство субстратов, регулирующих метаболизм хозяина.Микробные метаболиты ЖКТ также контролируют рост костей и тела, модулируя гормоны роста, включая IGF-1 (ref. 6 ). Таким образом, микробиота желудочно-кишечного тракта может влиять на исходы питания при МВ и, в свою очередь, на общее долгосрочное здоровье. Чтобы исследовать эту возможность, мы сравнили фекальную микробиоту младенцев нормальной и малой длины с МВ, чтобы определить связь между фекальным дисбиозом при МВ и линейным ростом.
Для выполнения этого анализа проспективно собранные образцы фекалий 207 младенцев с CF 1 из исследования BONUS были проанализированы с помощью метагеномного секвенирования (таблица 1 и дополнительные таблицы 1,2).Это было исследование со стандартизированным сбором образцов между 3 и 12 месяцами для всех включенных младенцев. Чтобы обеспечить контекст для понимания взаимосвязи между возрастом, фекальными таксономическими различиями и ростом у младенцев с МВ, мы сначала сравнили фекальную микробиоту младенцев из исследования BONUS с микробиотой фекалий здоровых младенцев соответствующего возраста (контроль) (таблица 1 и дополнительная таблица 3 ). Мы выполнили метагеномное секвенирование для всех образцов и использовали метагеномный филогенетический анализ 15 для определения их таксономического состава.Тесты ассоциации между бета-разнообразием микробов (видов) и собранными клиническими данными были проведены с использованием перестановочного многомерного дисперсионного анализа (PERMANOVA) с измерением расстояния Брея и нулевой гипотезой о 0% вариабельности. Различия между участниками объясняют большой процент (46%) микробных таксономических вариаций в исследуемой популяции ( P <0,001), за которым следует возраст (1,7%, P <0,001). Присутствие CF объясняет 1,5%, 1,8% и 5,2% таксономической изменчивости на 4, 6 и 12 месяцах соответственно (дополнительная таблица 4).Величина эффекта заболевания по сравнению с наблюдаемой здесь вариабельностью между субъектами аналогична той, которая была выявлена в других исследованиях педиатрического фекального микробиома, например, воспалительного заболевания кишечника и диабета 16,17 .
Мы выполнили метагеномное секвенирование для всех образцов и использовали метагеномный филогенетический анализ 15 для определения их таксономического состава.Тесты ассоциации между бета-разнообразием микробов (видов) и собранными клиническими данными были проведены с использованием перестановочного многомерного дисперсионного анализа (PERMANOVA) с измерением расстояния Брея и нулевой гипотезой о 0% вариабельности. Различия между участниками объясняют большой процент (46%) микробных таксономических вариаций в исследуемой популяции ( P <0,001), за которым следует возраст (1,7%, P <0,001). Присутствие CF объясняет 1,5%, 1,8% и 5,2% таксономической изменчивости на 4, 6 и 12 месяцах соответственно (дополнительная таблица 4).Величина эффекта заболевания по сравнению с наблюдаемой здесь вариабельностью между субъектами аналогична той, которая была выявлена в других исследованиях педиатрического фекального микробиома, например, воспалительного заболевания кишечника и диабета 16,17 .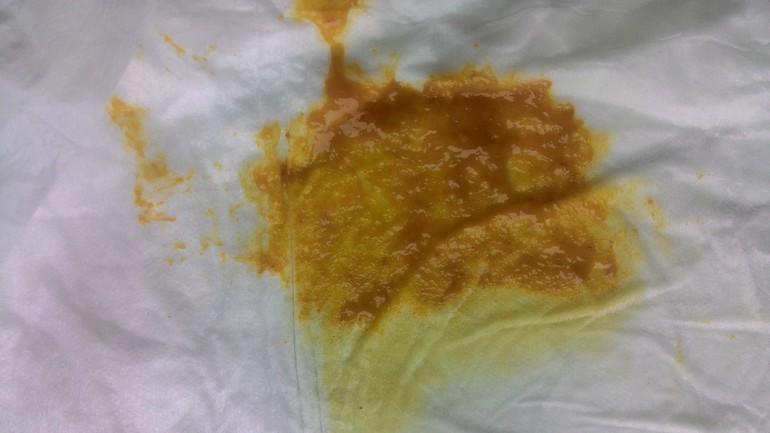 Более сильный эффект CF был замечен при сравнении микробиоты на уровне филумов всех исследуемых образцов, особенно в отношении общего распределения Proteobacteria, преимущественно Escherichia coli (рис. 1a). В самые ранние моменты времени в составе фекальной микробиоты большинства участников преобладала высокая относительная численность лишь нескольких видов, в основном Bifidobacterium longum , Bifidobacterium breve и E.coli (расширенные данные, рис. 1), результат аналогичен результатам недавнего исследования здоровых младенцев 16 . Альфа-разнообразие, которое было относительно низким в течение 4 месяцев у большинства участников, увеличилось в течение первого года жизни у всех младенцев, как и ожидалось 18,19 ; тем не менее, у младенцев с МВ рост был значительно медленнее, чем у детей контрольной группы (рис. 1b).
Более сильный эффект CF был замечен при сравнении микробиоты на уровне филумов всех исследуемых образцов, особенно в отношении общего распределения Proteobacteria, преимущественно Escherichia coli (рис. 1a). В самые ранние моменты времени в составе фекальной микробиоты большинства участников преобладала высокая относительная численность лишь нескольких видов, в основном Bifidobacterium longum , Bifidobacterium breve и E.coli (расширенные данные, рис. 1), результат аналогичен результатам недавнего исследования здоровых младенцев 16 . Альфа-разнообразие, которое было относительно низким в течение 4 месяцев у большинства участников, увеличилось в течение первого года жизни у всех младенцев, как и ожидалось 18,19 ; тем не менее, у младенцев с МВ рост был значительно медленнее, чем у детей контрольной группы (рис. 1b).
 1: Микробный состав фекалий изменен у младенцев с МВ по сравнению с контрольной группой.
1: Микробный состав фекалий изменен у младенцев с МВ по сравнению с контрольной группой. a , Микробиота всех образцов на уровне филума у младенцев контрольной группы (слева) и младенцев с МВ (справа). Образцы упорядочены в каждой когорте в соответствии с относительной численностью Proteobacteria (а затем Actinobacteria для образцов, в которых относительная численность Proteobacteria была незначительной). Черные точки указывают относительное количество E. coli в каждом образце.b , прямоугольная диаграмма индекса Шеннона с отдельными точками данных, указывающая на более медленное увеличение разнообразия фекальной микробиоты у младенцев с МВ по сравнению с контрольной группой и значительные различия на 12-м месяце. были n, = 156, 169 и 152 для младенцев с МВ и n = 25, 25 и 23 для контрольной группы. c , Коробчатые диаграммы относительной численности Proteobacteria, Bacteroidetes, Firmicutes и Actinobacteria на 4, 6 и 12 месяцах для младенцев с CF и контрольной группы. Петли прямоугольной диаграммы обозначают первый и третий квартили, а усы указывают в 1,5 раза больше межквартильного диапазона (IQR) выше и ниже. Отступы в каждом поле указывают приблизительно 95% доверительный интервал относительно медианы. Ширина прямоугольника пропорциональна квадратному корню из n . * P <0,05, ** P <0,01, *** P <0,001, односторонний критерий суммы рангов Вилкоксона.
Петли прямоугольной диаграммы обозначают первый и третий квартили, а усы указывают в 1,5 раза больше межквартильного диапазона (IQR) выше и ниже. Отступы в каждом поле указывают приблизительно 95% доверительный интервал относительно медианы. Ширина прямоугольника пропорциональна квадратному корню из n . * P <0,05, ** P <0,01, *** P <0,001, односторонний критерий суммы рангов Вилкоксона.
К 4 месяцу фекальная микробиота младенцев с МВ показала заметные таксономические отличия от таксономической микрофлоры контрольной группы.Эти различия соответствовали ранее опубликованным исследованиям детей раннего возраста с CF 4,5,13,14 , наиболее заметно по относительной численности Proteobacteria и Bacteroidetes. Эти различия сохранялись или увеличивались с течением времени (рис. 1c и расширенные данные рис. 2–4). Средняя относительная численность Proteobacteria в течение первого года снизилась в контроле на 11,2% ( P <0,001, t -тест), но не изменилась значительно у младенцев с МВ (рис. 1c). Хотя средняя численность видов Proteobacteria, исключая E.coli снизилась на 6,7% у младенцев с МВ ( P <0,001, t -тест), численность E. coli увеличилась на 6,8% ( P <0,01, t -тест) ( Расширенные данные (рис. 3). В отличие от Proteobacteria, относительная численность Bacteroidetes была значительно ниже у младенцев с МВ, чем в контрольной группе во все временные точки ( P <0,001, t -тест) (рис. 1c, расширенные данные, рис. 1,4). . Хотя несколько опубликованных исследований воздействия супрессоров кислоты желудочного сока (блокаторы H 2 и ингибиторы протонной помпы) на микробиом фекалий младенцев позволяют предположить, что относительное количество Proteobacteria, включая E.coli , увеличивается с этими обработками 20,21 , численность Proteobacteria оставалась высокой (а Bacteroidetes ниже) в образцах, взятых у младенцев с CF (образцы CF) на 12-м месяце, когда мы исключили образцы от младенцев, которым прописаны супрессоры желудочной кислоты ( P <0,001, односторонний критерий суммы рангов Вилкоксона).
1c). Хотя средняя численность видов Proteobacteria, исключая E.coli снизилась на 6,7% у младенцев с МВ ( P <0,001, t -тест), численность E. coli увеличилась на 6,8% ( P <0,01, t -тест) ( Расширенные данные (рис. 3). В отличие от Proteobacteria, относительная численность Bacteroidetes была значительно ниже у младенцев с МВ, чем в контрольной группе во все временные точки ( P <0,001, t -тест) (рис. 1c, расширенные данные, рис. 1,4). . Хотя несколько опубликованных исследований воздействия супрессоров кислоты желудочного сока (блокаторы H 2 и ингибиторы протонной помпы) на микробиом фекалий младенцев позволяют предположить, что относительное количество Proteobacteria, включая E.coli , увеличивается с этими обработками 20,21 , численность Proteobacteria оставалась высокой (а Bacteroidetes ниже) в образцах, взятых у младенцев с CF (образцы CF) на 12-м месяце, когда мы исключили образцы от младенцев, которым прописаны супрессоры желудочной кислоты ( P <0,001, односторонний критерий суммы рангов Вилкоксона). Относительное количество Firmicutes увеличилось, а количество Actinobacteria уменьшилось в контрольной группе в течение первого года, как описано в других исследованиях здоровых младенцев 22 ; обе тенденции были относительно ослаблены в образцах от младенцев с МВ (рис.1c и расширенные данные рис. 4).
Относительное количество Firmicutes увеличилось, а количество Actinobacteria уменьшилось в контрольной группе в течение первого года, как описано в других исследованиях здоровых младенцев 22 ; обе тенденции были относительно ослаблены в образцах от младенцев с МВ (рис.1c и расширенные данные рис. 4).
Эти сравнения предполагают отсроченное созревание фекальной микробиоты CF по сравнению с контролем, что мы количественно оценили с помощью анализа возраста микробиоты 22 . Сравнение возраста микробиоты выходит за рамки сравнений в отдельные моменты времени, что может лишь косвенно указывать на дифференциальное развитие. Вместо этого они напрямую спрашивают, выглядит ли развитие микробиоты схожим по траектории, но демонстрирует ли отставание в одной когорте относительно другой когорты, учитывая временную динамику во время подбора модели.Опять же, прежде чем исследовать взаимосвязь между развитием микробиоты и ростом у младенцев с МВ, мы сначала выполнили этот анализ, сравнив данные по младенцам с МВ и без него. Случайные лесные модели были обучены на подмножестве контрольных образцов для прогнозирования возраста хозяев на основе соответствующих таксономических профилей фекального микробиома. Затем на оставшихся контрольных выборках оценивалась прогностическая сила каждой модели, демонстрирующая высокую корреляцию между истинным и прогнозируемым возрастом (0,843 ≤ r ≤ 0.937 для полных реплик модели, рис. 2а) для различных случайно выбранных обучающих подмножеств и различных наборов функций. Напротив, при применении этих моделей, обученных контролю, к образцам CF, предсказанный и истинный возраст хозяев коррелировали относительно плохо (0,479 ≤ r ≤ 0,583 для полных реплик модели, рис. 2a). Различия в развитии CF и контрольной фекальной микробиоты были дополнительно количественно оценены путем сравнения их рассчитанного относительного возраста микробиоты. В частности, мы определили «относительный возраст микробиоты» образца как разницу между истинным возрастом образца и возрастом, предсказанным моделями возраста микробиоты.
Случайные лесные модели были обучены на подмножестве контрольных образцов для прогнозирования возраста хозяев на основе соответствующих таксономических профилей фекального микробиома. Затем на оставшихся контрольных выборках оценивалась прогностическая сила каждой модели, демонстрирующая высокую корреляцию между истинным и прогнозируемым возрастом (0,843 ≤ r ≤ 0.937 для полных реплик модели, рис. 2а) для различных случайно выбранных обучающих подмножеств и различных наборов функций. Напротив, при применении этих моделей, обученных контролю, к образцам CF, предсказанный и истинный возраст хозяев коррелировали относительно плохо (0,479 ≤ r ≤ 0,583 для полных реплик модели, рис. 2a). Различия в развитии CF и контрольной фекальной микробиоты были дополнительно количественно оценены путем сравнения их рассчитанного относительного возраста микробиоты. В частности, мы определили «относительный возраст микробиоты» образца как разницу между истинным возрастом образца и возрастом, предсказанным моделями возраста микробиоты. Затем мы использовали модели, обученные на контрольных образцах, для прогнозирования относительного возраста микробиоты образцов CF, тем самым сравнив их с наблюдаемым паттерном развития микробиоты в контроле, чтобы определить, оказалась ли микробиота образцов CF моложе их истинного возраста, что позволяет предположить задержка развития. Чтобы усилить это сравнение, мы аналогичным образом проверили, выглядит ли контрольная микробиота старше своего истинного возраста, на основе моделей развития микробиоты, наблюдаемых у младенцев с CF, путем прогнозирования возраста микробиоты контрольных образцов с использованием возрастных моделей микробиоты, обученных на образцах CF.Относительный возраст микробиоты при МВ имел тенденцию быть отрицательным (значительный отрицательный сдвиг на 6-м и 12-м месяцах во всех повторных моделях; q <0,01, знаковый ранговый критерий Вилкоксона, рис. 2b), но контрольный относительный возраст микробиоты имел тенденцию быть положительным (значимо положительный сдвиг на 12-м месяце в 8 из 10 повторных моделей; q <0,01, знаковый ранговый критерий Вилкоксона, рис.
Затем мы использовали модели, обученные на контрольных образцах, для прогнозирования относительного возраста микробиоты образцов CF, тем самым сравнив их с наблюдаемым паттерном развития микробиоты в контроле, чтобы определить, оказалась ли микробиота образцов CF моложе их истинного возраста, что позволяет предположить задержка развития. Чтобы усилить это сравнение, мы аналогичным образом проверили, выглядит ли контрольная микробиота старше своего истинного возраста, на основе моделей развития микробиоты, наблюдаемых у младенцев с CF, путем прогнозирования возраста микробиоты контрольных образцов с использованием возрастных моделей микробиоты, обученных на образцах CF.Относительный возраст микробиоты при МВ имел тенденцию быть отрицательным (значительный отрицательный сдвиг на 6-м и 12-м месяцах во всех повторных моделях; q <0,01, знаковый ранговый критерий Вилкоксона, рис. 2b), но контрольный относительный возраст микробиоты имел тенденцию быть положительным (значимо положительный сдвиг на 12-м месяце в 8 из 10 повторных моделей; q <0,01, знаковый ранговый критерий Вилкоксона, рис. 2b). Интересно, что большинство информативных таксонов для наших моделей принадлежало к типу Firmicutes (дополнительная таблица 5), что аналогично результату Subramanian et al. 22 , и результаты анализа возраста микробиоты были аналогичными при использовании разреженных моделей, а также при контроле кислотных супрессоров (расширенные данные, рис. 5). Эти результаты показывают, что созревание фекальной микробиоты у младенцев с МВ задерживается по сравнению с таковым у нормальных младенцев.
2b). Интересно, что большинство информативных таксонов для наших моделей принадлежало к типу Firmicutes (дополнительная таблица 5), что аналогично результату Subramanian et al. 22 , и результаты анализа возраста микробиоты были аналогичными при использовании разреженных моделей, а также при контроле кислотных супрессоров (расширенные данные, рис. 5). Эти результаты показывают, что созревание фекальной микробиоты у младенцев с МВ задерживается по сравнению с таковым у нормальных младенцев.
a , Характеристики возрастных моделей микробиоты. В каждом блоке суммированы корреляции Пирсона (ось y ) между истинным и прогнозируемым возрастом микробиоты в реплицируемых моделях, обученных на подмножествах контрольных образцов.Контрольные корреляции рассчитывались на основе подмножеств удерживаемых тестовых выборок, а корреляции CF рассчитывались с использованием этих моделей, обученных контролю, на всех CF выборках. Модели различаются набором функций, используемых для прогнозирования, как показано на оси x : все таксономические признаки MetaPhlAn, признаки уровня филума, признаки уровня рода, признаки уровня вида или признаки уровня штамма ( n = 10 повторяющихся моделей для каждого набора функций). Петли прямоугольной диаграммы указывают на первый и третий квартили, а усы — на 1.В 5 раз выше и ниже IQR. b , Развитие фекальной микробиоты у младенцев с МВ значительно задерживается по сравнению с контролем. Следуя Subramanian et al. 22 , распределения относительного возраста микробиоты показаны (ось x ) для каждой группы субъектов (младенцы с МВ или контрольная группа) как нормализованная ошибка в прогнозируемом возрасте микробиоты образца при использовании вычислительной модели, построенной для другой группы. Например, отрицательный относительный возраст микробиоты указывает на задержку развития микробиоты по сравнению с группой, использованной для построения модели.
Модели различаются набором функций, используемых для прогнозирования, как показано на оси x : все таксономические признаки MetaPhlAn, признаки уровня филума, признаки уровня рода, признаки уровня вида или признаки уровня штамма ( n = 10 повторяющихся моделей для каждого набора функций). Петли прямоугольной диаграммы указывают на первый и третий квартили, а усы — на 1.В 5 раз выше и ниже IQR. b , Развитие фекальной микробиоты у младенцев с МВ значительно задерживается по сравнению с контролем. Следуя Subramanian et al. 22 , распределения относительного возраста микробиоты показаны (ось x ) для каждой группы субъектов (младенцы с МВ или контрольная группа) как нормализованная ошибка в прогнозируемом возрасте микробиоты образца при использовании вычислительной модели, построенной для другой группы. Например, отрицательный относительный возраст микробиоты указывает на задержку развития микробиоты по сравнению с группой, использованной для построения модели. Ось y показывает плотность образцов, сопоставленных с данным относительным возрастом микробиоты в указанные моменты времени. Цветные соотношения суммируют долю реплицированных полнофункциональных моделей, которые дали распределение относительного возраста микробиоты, которое было значительно отрицательно (зеленый для образцов CF по сравнению с контрольными моделями) или положительно (синий для контрольных образцов относительно моделей CF) отличалось от нуля. q <0,01, односторонний знаковый критерий Вилкоксона.
Ось y показывает плотность образцов, сопоставленных с данным относительным возрастом микробиоты в указанные моменты времени. Цветные соотношения суммируют долю реплицированных полнофункциональных моделей, которые дали распределение относительного возраста микробиоты, которое было значительно отрицательно (зеленый для образцов CF по сравнению с контрольными моделями) или положительно (синий для контрольных образцов относительно моделей CF) отличалось от нуля. q <0,01, односторонний знаковый критерий Вилкоксона.
Ранее мы продемонстрировали, что более старшая когорта детей с МВ страдает фекальными дисбиозами, характеризующимися высокой относительной численностью протеобактерий, в том числе E.coli , который был связан с фекальными показателями как мальабсорбированного жира, так и воспаления (кальпротектин) 4 . В текущем исследовании динамика этих ассоциаций в течение первого года жизни и их взаимосвязь с диетой были проанализированы с использованием многомерного линейного моделирования со смешанными эффектами при контроле диеты. Было показано, что диета оказывает большое влияние на развитие микробиома кишечника младенца. Среди исследованных факторов прекращение грудного вскармливания, как известно, является основным фактором созревания до взрослого состава у здоровых детей 18 ; Таким образом, модельная категоризация диеты включала наличие или отсутствие грудного молока (дополнительные таблицы 2–4,6).Относительная численность Enterobacteriaceae была связана ( q <0,004) с фекальным жиром, который был значительно выше у младенцев с МВ, чем в контроле (расширенные данные, рис. 6). Однако, хотя кальпротектин был также выше у младенцев с МВ, чем в контрольной группе (расширенные данные, рис. 6), мы не выявили значимой связи между таксономией фекальной микробиоты и кальпротектином. Эти результаты подтверждают модель, в которой мальабсорбированные питательные вещества, такие как жир, но не воспаление кишечника, вызывают фекальный дисбактериоз у младенцев с МВ.
В этом контексте мы затем сравнили фекальную микробиоту младенцев с низкой длиной тела и без нее. Многие таксоны с различным содержанием в образцах кала при МВ обладают метаболической активностью, которая может влиять на линейный рост. Поэтому мы проверили взаимосвязь между степенью таксономического дисбиоза и длиной тела у младенцев с МВ, используя многомерное линейное моделирование со смешанными эффектами. Для этого анализа мы контролировали диету, низкий вес и использование антибиотиков. Хотя младенцы в нашей когорте CF имели нормальный вес в среднем 1 , мы исключили младенцев с низким весом ( n = 25) из этого анализа, чтобы дополнительно минимизировать любой вклад недостаточности питания в низкий рост 1,23,24 .Кроме того, было показано, что использование антибиотиков влияет на состав фекального микробиома 25 ; лечение этими препаратами было связано с уменьшением протеобактерий ( q <0,01) и увеличением Firmicutes ( q <0,04) в нашей когорте CF. Младенцы с МВ классифицировались как имеющие низкую или нормальную длину или массу тела (дополнительная таблица 1), как описано ранее 1 . Для всех образцов во всех временных точках у младенцев с малой длиной тела с МВ было низкое относительное содержание Bacteroidetes в кале и высокое относительное содержание Proteobacteria по сравнению с младенцами нормальной длины с МВ ( q <0.02, дополнительная таблица 6), и эти различия были значимы при попарных сравнениях на 12-м месяце ( P <0,001 и P <0,04, односторонние тесты суммы рангов Вилкоксона для Bacteroidetes и Proteobacteria, соответственно, рис. 3a) , картина, аналогичная той, что наблюдалась при сравнении младенцев с МВ с контрольной группой (рис. 1c, 3b). Сравнение фекальной микробиоты на уровне филумов этих трех групп младенцев показало, что дисбактериоз наиболее выражен у младенцев с МВ и малой длиной тела (рис.3a, b и расширенные данные на рис. 4), независимо от диеты или антибиотиков (дополнительная таблица 6), и включали взаимные изменения в численности не только Proteobacteria и Bacteroidetes, но также Actinobacteria и Firmicutes. Более того, когда был проведен анализ возраста микробиоты для сравнения младенцев с нормальным и низким ростом с МВ, мы снова обнаружили различия в развитии микробиоты (расширенные данные, рис. 7). В частности, предсказания модели предполагали значительные задержки в развитии микробиоты у детей с малой длиной тела с МВ по сравнению с младенцами с нормальной длиной тела с МВ на 12-м месяце (значительные отрицательные сдвиги в относительном возрасте микробиоты с низкой длиной тела для всех повторных моделей; q <0.01, знаковый ранговый тест Вилкоксона). Следовательно, низкая длина была связана с задержкой развития фекальной микробиоты у младенцев с МВ.
Рис. 3. Младенцы с малой длиной тела с МВ имеют более выраженный дисбактериоз, чем дети с нормальной длиной тела с МВ.a , Коробчатые диаграммы относительного содержания в фекалиях Proteobacteria, Bacteroidetes, Firmicutes и Actinobacteria в 3, 6 и 12 месяцев для младенцев нормальной длины с CF по сравнению с младенцами с низкой длиной тела с CF. Количество проб ( n ) на 3, 6 и 12 месяцах составляет 120, 124 и 113 для детей с нормальной длиной тела и 38, 45 и 39 для детей с низкой длиной тела.Петли указывают на первый и третий квартили, а усы указывают на 1,5-кратный IQR выше и ниже. Отступы в каждом поле указывают приблизительно 95% доверительный интервал относительно медианы. Ширина прямоугольника пропорциональна квадратному корню из n . * P <0,05, ** P <0,01, *** P <0,001, односторонний критерий суммы рангов Вилкоксона. b , Динамика фекальной микробиоты детей контрольной группы (слева), а также младенцев нормальной длины (в центре) и малой длины тела (справа) с МВ в течение первого года жизни.Столбцы представляют собой относительную численность бактериальных типов. Образцы упорядочены в каждой панели в соответствии с относительной численностью протеобактерий (и затем актинобактерий, когда относительное количество протеобактерий незначительно). Не гарантируется, что вертикально выровненные образцы принадлежат одному и тому же объекту. Черные точки указывают относительное количество E. coli в каждом образце.
Ранее мы обнаружили, что фекальная микробиота детей с МВ изменила прогнозируемую способность к синтезу и разложению двух короткоцепочечных жирных кислот (SCFA), бутирата и пропионата 5 .Было показано, что SCFAs модулируют рост костей и тела 6,7 , что указывает на то, что фекальный дисбиоз может способствовать достижению неадекватной длины путем изменения продукции SCFA. Значимые измерения SCFA были невозможны в этом исследовании, потому что SCFAs летучие и требуют специальных условий хранения образцов 26 , а уровни SCFA в фекалиях не точно отражают уровни в просвете из-за быстрого поглощения хозяином 27,28,29 . Поэтому, чтобы проверить взаимосвязь между дисбактериозом и прогнозируемой продукцией SCFA, мы сравнили присутствие и численность таксонов, которые, как известно или прогнозируются, продуцируют бутират и пропионат (дополнительная таблица 7) среди различных групп участников исследования.На 12-м месяце 20 из 28 видов, продуцирующих SCFA, обычно встречающихся в нашем наборе данных (присутствующих в> 10% проб), были менее распространены в образцах от младенцев с МВ, чем в контрольной. Более того, 12 из 13 видов, продуцирующих SCFA, которые показали статистически значимую разницу в распространенности между младенцами с МВ и контрольной группой ( q <0,05, критерий хи-квадрат), были значительно менее распространены у младенцев с МВ, чем в контроле (расширенные данные Рис.8). Эти результаты предполагают, что продукция SCFA кишечной микробиотой младенцев с МВ может быть снижена по сравнению с таковой у младенцев без МВ.Они согласуются с недавними результатами как метаболомных, так и протеомных исследований, которые предполагают более низкие уровни бутирата и пропионата в кишечнике у детей с МВ, чем у здоровых людей из контрольной группы 30,31 .
Наши результаты согласуются с концепцией о том, что фекальный дисбиоз младенцев с МВ обусловлен изменением содержания питательных веществ в просвете ЖКТ. В поддержку этой модели предыдущие исследования пациентов с хирургически индуцированной мальабсорбцией жира и животных, получавших пищу с высоким содержанием жиров, продемонстрировали обогащение фекалий Proteobacteria и истощение Bacteroidetes, как показано здесь 32,33 .Кроме того, недавно мы показали, что E. coli , выделенная из образцов фекалий детей старшего возраста с МВ, демонстрирует преимущества роста в глицерине 34 , который составляет основу многих пищевых фосфолипидов, содержащихся в желудочно-кишечном тракте МВ из-за недостаточности поджелудочной железы и мальабсорбция. Эти эффекты наблюдались, несмотря на лечение пероральными добавками панкреатических ферментов (включая липазу) 1 . Таким образом, наши результаты показывают, что мальабсорбция является устойчивым фактором риска фекального дисбактериоза и, как очевидное следствие, нарушения роста в раннем детстве с МВ.Ранее было обнаружено, что низкая длина тела у младенцев с CF 1 коррелирует с более низкими уровнями в сыворотке факторов роста факторов семейства IGF, которые, как было показано, модулируются микробиотой желудочно-кишечного тракта посредством продукции SCFA на модели мыши-гнотобиота 6,7 . Следовательно, фекальный дисбиоз у младенцев с МВ может влиять на достижение длины тела, изменяя эндокринную функцию. К сожалению, в этом исследовании слишком мало участников взяли парные образцы кала и сыворотки для проверки этой модели. Будущие функциональные метагеномные или метаболомные исследования животных или людей могут выявить функции микробиоты ЖКТ, которые модулируют передачу сигналов гормонов и рост.
Также возможно, что дисфункция CFTR напрямую влияет на рост через немикробные механизмы. Однако исследования раннего питания и роста при МВ продемонстрировали широкий спектр результатов у детей с одной и той же мутацией CFTR 1 независимо от терапии модулятором CFTR 12 , что указывает на важную роль влияний, не связанных с CFTR, таких как микробиота желудочно-кишечного тракта, которая поддаются манипуляции. Следовательно, методы лечения, направленные на устранение раннего фекального дисбиоза, проявляемого здесь у младенцев с МВ, восполняющие SCFAs или регулирующие их выработку (например, с помощью пребиотиков, как подтверждено недавним исследованием 35 ), могут улучшить ранний рост, функцию желудочно-кишечного тракта и долгосрочное Исходы МВ многих типов.Дисбиоз желудочно-кишечного тракта также может усугублять мальабсорбцию жира и воспаление, нарушая выработку желчной кислоты, что может способствовать задержке роста 36 . Это исследование выявило взаимосвязь между фекальной микробиотой и малой длиной тела у младенцев с МВ, которая предлагает механистические гипотезы, которые могут быть проверены на моделях на животных и будущих интервенционных исследованиях, и которые могут дать информацию для более эффективных стратегий улучшения роста и последующих долгосрочных результатов у младенцев с CF.
Новое исследование показывает значительные изменения pH фекалий у младенцев за последние 100 лет — Evolve BioSystems
Evolve BioSystems обнаруживает резкий сдвиг, указывающий на потерю полезных бактерий в микробиоме кишечника ребенка из поколения в поколение.ДЭВИС, Калифорния, 7 марта 2018 г. — Evolve BioSystems сегодня объявила о новом исследовании, которое связывает повышенный уровень pH фекалий младенцев с глубоким изменением микробиома кишечника младенцев, включая исчезновение полезных бактерий, которые могут быть ключом к краткосрочному и долгосрочному здоровью. За последние 100 лет средний уровень pH стула ребенка, который может указывать на тип бактерий в кишечнике ребенка, претерпел тревожное повышение с 5,0 до 6.5. Исследование, опубликованное в журнале mSphere Американского общества микробиологов, связывает это повышение pH с потерей поколениями Bifidobacterium , критических кишечных бактерий в младенчестве, и сопутствующим увеличением числа вредных бактерий.
Полное исследование «Повышенный уровень pH в фекалиях указывает на глубокое изменение микробиома кишечника грудного ребенка из-за уменьшения количества бифидобактерий за последний век» можно найти здесь.
Резкое повышение pH фекалий младенцев с 1926 по 2017 год, связанное с нарушением микробов кишечника младенцев
Обзор 14 клинических исследований, опубликованных в период с 1926 по 2017 год, охватывающих сотни здоровых младенцев, вскармливаемых грудью, показал изменение pH фекалий с 5 .От 0 до 6,5 за этот период времени. Авторы связывают эту тенденцию с наблюдаемым снижением содержания Biofdobacterium в кишечнике младенцев, наряду с увеличением потенциально вредных бактерий, таких как E. coli и Clostridia, , что приводит к «дисбиозу», потенциально пагубному дисбалансу микробная экосистема кишечника.
Согласно соавтору исследования , д-ру Дженнифер Смиловиц, , заместителю директора программы исследований на людях Института пищевых продуктов для здоровья в Калифорнийском университете в Дэвисе, , «Эти тревожные изменения в микробиоме кишечника младенца и, следовательно, в кишечной среде. , может быть связано с современной медицинской практикой, такой как антибиотики, кесарево сечение и кормление смесью.Все эти методы могут спасти жизнь, но имеют непредвиденные последствия для микробиома кишечника младенца. В результате процветают некоторые патогенные бактерии, которые связаны с повышенным риском проблем со здоровьем, таких как колики, экзема, аллергия, диабет и ожирение. Необходимость для клиницистов в быстром и надежном методе определения уровня Bifidobacterium в кишечнике ребенка и эффективном способе замены правильных Bifidobacterium для коррекции дисбактериоза при его обнаружении является следующим важным шагом для здоровья ребенка.”
Восстановление кишечника младенца до его естественного состояния
В декабре 2017 года Evolve BioSystems опубликовала результаты знаменательного клинического испытания mSphere , показывающие, что Evivo®, активированная форма B. infantis, быстро вырабатывала , существенное и стойкое улучшение микробиома кишечника младенцев, находящихся на грудном вскармливании. Evivo — единственный детский пробиотик, который, как клинически доказано, восстанавливает уровень Bifidobacterium в кишечнике ребенка, снижает количество потенциально вредных кишечных бактерий на 80 процентов и возвращает pH в фекалиях до уровней, наблюдаемых ранее.
«Это устойчивое повышение pH фекалий у младенцев на протяжении последних нескольких поколений в значительной степени осталось незамеченным медицинским сообществом, но, похоже, свидетельствует о серьезном нарушении работы кишечника младенца», — сказал Дэвид Кайл, доктор философии. ., Главный научный сотрудник и исполнительный председатель Evolve BioSystems, Inc. «Это может внести значительный вклад в частоту аллергических и аутоиммунных заболеваний. Мы добиваемся успехов в изучении того, как определять дисбактериоз кишечника у младенцев и восстанавливать его естественное состояние с помощью введения очень специфических пробиотиков.”
Для получения дополнительной информации о Evivo посетите сайт www.evivo.com
Связь между грибковым и бактериальным дисбиозом у младенцев и атопическим хрипом у детей в непромышленных условиях
Общие сведения
Астма — наиболее распространенное хроническое заболевание детского возраста. Недавно мы определили критическое окно в начале жизни мышей и канадских младенцев, в течение которого микробные изменения кишечника (дисбиоз) влияют на развитие астмы. Учитывая географические различия в микробиоте кишечника человека во всем мире, мы изучили влияние микробного дисбиоза кишечника на атопическое дыхание у населения, живущего в разных условиях развивающегося мира.
Цель
Мы стремились определить, связаны ли микробные изменения в раннем младенчестве с развитием атопического хрипа в непромышленных условиях.
Методы
Мы провели исследование случай-контроль, вложенное в когорту новорожденных из сельских районов Эквадора, в котором мы идентифицировали 27 детей с атопическим хрипом и 70 здоровых контрольных субъектов в возрасте 5 лет. Мы проанализировали бактериальную и эукариотическую микробиоту кишечника в образцах стула, собранных в возрасте 3 месяцев, с использованием секвенирования 16S и 18S.Бактериальные метагеномы были предсказаны на основе данных 16S рРНК с использованием филогенетического исследования сообществ путем реконструкции ненаблюдаемых состояний и классифицированы по функциям с помощью Киотской энциклопедии генов и онтологии геномов. Концентрации фекальных короткоцепочечных жирных кислот определяли с помощью газовой хроматографии.
Результаты
Как ранее наблюдалось у канадских младенцев, микробный дисбиоз в возрасте 3 месяцев был связан с более поздним развитием атопического хрипа. Однако дисбактериоз у эквадорских младенцев затрагивал разные бактериальные таксоны, был более выраженным, а также затрагивал несколько грибковых таксонов.Прогнозируемый метагеномный анализ подчеркнул значительные связанные с дисбиозом различия в генах, участвующих в метаболизме углеводов и таурина. Уровни ацетата и капроата короткоцепочечных жирных кислот в кале были снижены и увеличены, соответственно, в 3-месячных образцах стула детей, у которых развился атопический хрип.
Выводы
Наши результаты подтверждают важность грибковой и бактериальной микробиоты в течение первых 100 дней жизни в развитии атопического хрипа и обеспечивают дополнительную поддержку для рассмотрения модуляции микробиома кишечника в качестве стратегии первичной профилактики астмы.
Ключевые слова
Астма
атопия
свистящее дыхание
микробиом кишечника
микобиом
короткоцепочечные жирные кислоты
непромышленные условия
Используемые аббревиатуры CHA
Канадский больной
AW9000
MaAsLinМногомерная ассоциация с линейными моделями
MEDМинимальная энтропийная декомпозиция
OTUОперативная таксономическая единица
PICRUStФилогенетическое исследование сообществ путем реконструкции ненаблюдаемых состояний
SCFAстатей с короткоцепочечной жирной кислотой
Аннотация© 2017 Авторы.Опубликовано Elsevier Inc. от имени Американской академии аллергии, астмы и иммунологии.
Рекомендуемые статьи
Ссылки на статьи
Детский фекалий изменился с прошлого века, что может объяснить рост аллергии
Он может выглядеть и пахнуть одинаково, но недавнее исследование показало, что детский фекалий (и, следовательно, бактерии в кишечнике младенцев) медленно менялись за последние сто лет, что, по мнению ученых, является причиной того, что детей стало больше. теперь с такими состояниями, как астма, диабет, ожирение, аллергия и колики.
Длительные исследования
Обзор исследований, проведенных в период с 1926 по 2017 год, в ходе которых изучали фекалии 312 здоровых младенцев, был опубликован в журнале Американского общества микробиологов mSphere. Сообщается, что баланс pH (который определяет его кислотность или щелочность) в детских фекалиях увеличился. Исследователи сообщили об увеличении уровня pH с 5,0 до 6,5, что было связано с уменьшением количества Bifidobacterium (основных бактерий для младенцев) в кишечнике младенцев, а также с увеличением потенциально вредных бактерий, таких как E.coli и Clostridia. Таким образом, потенциально пагубный дисбаланс микробной экосистемы кишечника называется «дисбактериозом».Почему изменение?
По словам соавтора исследования, доктора Дженнифер Смиловиц, заместителя директора Программы исследований на людях Института продуктов питания для здоровья Калифорнийского университета в Дэвисе, современная наука может быть виновата в изменениях, поскольку все больше детей сейчас лишаются жизненно важных функций. бактерии из-за лекарств или в первую очередь не от матери.
«Эти тревожные изменения в микробиоме кишечника младенца и, следовательно, в кишечной среде, могут быть связаны с современными медицинскими методами, такими как антибиотики, кесарево сечение и кормление смесями. Все эти методы могут спасти жизнь, но имеют непредвиденные последствия для микробиома кишечника младенца », — говорит она.
Подробнее о детском помете:
Что это значит
Хотя вы можете не задумываться о фекалиях вашего ребенка или о том, какие бактерии присутствуют в его кишечнике, ученые полагают, что именно дисбактериоз может быть причиной роста ряда различных проблем со здоровьем.
«В результате [современной медицинской практики] некоторые патогенные бактерии, связанные с повышенным риском проблем со здоровьем, таких как колики, экзема, аллергия, диабет и ожирение, процветают», — сказал Д. Смиловиц.
«Необходимость для клиницистов в быстром и надежном методе определения уровней бифидобактерий в кишечнике ребенка и эффективном способе замены нужных бифидобактерий для коррекции дисбактериоза при его обнаружении является критически важными следующими шагами для здоровья ребенка», — добавила она.
Восстановление баланса
Если вы сейчас задаетесь вопросом, можно ли что-нибудь сделать, чтобы вернуть кишечник (и фекалии) вашего ребенка в нормальное состояние, хорошая новость — да, есть надежда в виде пробиотика.
Evivo (активированная форма B. infantis) — единственный детский пробиотик, который, как было клинически доказано, быстро и значительно восстанавливает уровни Bifidobacterium в кишечнике грудного ребенка за счет взаимодействия с питательными веществами грудного молока. Это также уменьшает количество потенциально вредных бактерий на 80 процентов и возвращает уровень pH в помете, который наблюдался много лет назад.
Не то же самое с формулой
Таким образом, хотя вы, возможно, не сможете избежать кесарева сечения или назначения своему ребенку антибиотиков, по крайней мере, вы сможете снизить вероятность развития у него проблем со здоровьем, таких как диабет 1 типа, аллергии и ожирение, помогая восстановить их микробиом. естественное состояние с конкретным пробиотиком — но только при грудном вскармливании.
Дети, вскармливаемые смесью, в целом могут получить пользу от Evivo, однако, к сожалению, исследования доказывают, что кишечные бактерии восстанавливаются только в сочетании с питательными веществами, содержащимися исключительно в грудном молоке. Надеемся, что в ближайшее время появятся новые исследования и решения для детей, находящихся на искусственном вскармливании.
Evivo пока недоступен для покупки в Австралии; тем не менее, мы будем держать вас в курсе последних новостей об этом, а также о любых новых разработках по восстановлению полезных бактерий у всех младенцев.
Первый тест быстрого ответа на уровень бифидобактерий в микробиоме кишечника ребенка
Быстрый и неинвазивный тестEvivo измеряет наличие маркеров, которые указывают на низкий или высокий уровень хороших Bifidobacterium , таких как ацетат и лактат. Образец стула, содержащий высокие уровни этих маркеров, будет достаточно прочным, чтобы изменить цвет жидкой фазы теста с розового на желтый, указывая на высокий уровень Bifidobacterium. Жидкость останется розовой, если в образце будет низкий уровень ацетата и лактата, что указывает на отсутствие Bifidobacterium и на то, что ключевые питательные вещества грудного молока, олигосахариды грудного молока (HMO), теряются.Evivo начала тщательные клинические испытания прототипа, чтобы продемонстрировать результаты, полученные на образцах детского стула.
Специалист по диагностике на месте обращает внимание на кишечник младенца
Разработкой прототипа руководит доктор Бетани Хенрик, доктор философии, директор по иммунологии и диагностике Evivo. Обладая более чем десятилетним опытом разработки и создания быстрой диагностики на месте оказания медицинской помощи, Хенрик ранее был неотъемлемой частью команды, которая в 2005 году разработала и оптимизировала самый быстрый в мире тест на ВИЧ в местах оказания медицинской помощи.
«Это первый и единственный скрининговый тест в месте оказания медицинской помощи, разработанный для выявления младенцев, у которых недостаточно уровней Bifidobacterium для создания стабильного микробиома кишечника младенца», — сказал доктор Хенрик. «Благодаря недавним исследованиям, показывающим, что большинство детей, родившихся после 1980 года, не приобретают Bifidobacterium при рождении, наша способность обнаруживать значительные уровни Bifidobacterium дает педиатрам и родителям немедленное указание на наличие у их ребенка этих полезных кишечных бактерий, которые их вызывают. для здоровья на всю жизнь.»
Выявление исчезающего, но критически важного элемента здоровья кишечника
Ранее опубликованные данные доктора Хенрика, которые лежат в основе теста Evivo, показывают обратную корреляцию между повышением pH фекалий младенцев, снижением содержания ацетата и лактата и более низкими уровнями полезного Bifidobacterium , что доказывает, что микробиом кишечника младенца быстро менялся на протяжении последних трех поколений. В прошлом младенцы получали Bifidobacterium от своей матери во время родов, но из-за более широкого использования современных медицинских методов, таких как антибиотики , Кесарево сечение и искусственное вскармливание, девять из 10 детей, рожденных в США.С. сегодня уже не приобретает. Потеря поколений этих полезных бактерий в кишечнике младенца позволяет процветать потенциально вредным бактериям, таким как E. Coli и Clostridia , которые связаны с более высоким риском краткосрочных и долгосрочных проблем со здоровьем, таких как колики, экзема. , аллергия, диабет и ожирение.
«В настоящее время нет возможности легко определить, колонизирован ли ребенок здоровыми бактериями», — сказал Марк Андервуд, доктор медицины, руководитель отделения неонатологии в Медицинском центре Калифорнийского университета в Дэвисе.«Возможность быстро измерять уровни Bifidobacterium в образце стула позволит педиатрам выявлять младенцев с низким уровнем этих полезных бактерий и принимать соответствующие меры».
Evolve BioSystems — единственный детский пробиотик, который клинически доказал, что восстанавливает Bifidobacterium в кишечнике ребенка и снижает количество потенциально вредных бактерий на 80 процентов. В эпохальном клиническом исследовании Evivo обеспечила быструю, существенную и стойкую стабилизацию микробиома кишечника младенца, чтобы заложить основу для здоровья на всю жизнь.
О компании Evolve BioSystems
Evolve BioSystems, Inc. — частная микробиомная компания, занимающаяся разработкой продуктов следующего поколения для создания, восстановления и поддержания здорового микробиома кишечника. Evolve недавно завершила раунд финансирования серии C на сумму 40 миллионов долларов, совместно возглавляемый Фондом Билла и Мелинды Гейтс и Horizons Ventures, венчурным подразделением Фонда Ли Ка Шинга.
Evolve — это ответвление Института продуктов питания для здоровья (FFHI) Калифорнийского университета в Дэвисе, основанное на более чем десятилетних исследованиях, направленных на понимание уникального партнерства микробиома кишечника младенца и компонентов грудного молока.Благодаря разработке и коммерческому запуску продуктов для лечения дисбактериоза кишечника новорожденных, в том числе Evivo ® для младенцев, открытая платформа Evolve теперь применяется для решения проблемы дисбактериоза кишечника на протяжении всего жизненного цикла человека. В дополнение к историческому испытанию, подтверждающему правильность концепции, Evolve проводит дальнейшие клинические исследования для создания своего набора решений на основе микробиома.
ИСТОЧНИК Evolve BioSystems, Inc.
Ссылки по теме
https: // www.evolvebiosystems.com/
Что за сено? • MSPCA-Angell
, Брендан Нунан, DVM, DABVP (птичья практика)
angell.org/avianandexotic
[email protected]
617 989-1561
Диарея — это частая жалоба от заинтересованных владельцев домашних кроликов; однако у кроликов редко бывает настоящая диарея или, другими словами, жидкие фекалии. Кролики чаще проявляют вялость и убыль мягкого липкого стула, который прилипает к их урогенитальному бугорку и хвосту.Эти кролики требуют частой чистки и часто имеют резкий запах. Больные кролики обычно производят нормальный стул в дополнение к мягкому стулу, который в конечном итоге слеживается с нижней стороны. Эти клинические признаки обычно вызваны образованием рыхлых цекотропов вторичных по отношению к дисбактериозу слепой кишки. Напомним, что у кроликов обычно выделяется два типа стула, а цекотропы — это небольшое количество мягких гранул, которые испражняются первыми, которые слипаются, как гроздь винограда. Второй тип стула — это каловые шарики, которые владельцы привыкли видеть — твердые сухие шарики, которые попадают в туалетный лоток или рассыпаются по клетке.
Слепая кишка представляет собой высокоразвитый мешочек с слепым концом, отходящий от соединения тонкой и толстой кишок. Сообщества бактерий и дрожжей процветают в слепой кишке и расщепляют неперевариваемую клетчатку, содержащуюся в травах и сене, обеспечивая необходимые питательные вещества и жирные кислоты. Эти продукты ферментации затем покрываются слизистой оболочкой, прежде чем они выводятся в виде цекотропов. Большинство кроликов рано утром съедают цекотропы прямо из ануса, и поэтому их владельцы не подозревают о производстве цекотропов.Цекотропы не пережевываются, оставляя неповрежденной слизистую оболочку, чтобы защитить плотную упаковку питательных веществ от низкого pH желудка до тех пор, пока она не будет повторно абсорбирована в тонкой кишке 1 . Цекотропы содержат незаменимые короткоцепочечные жирные кислоты, микробные белки, витамины группы B и до 30% азота, потребляемого кроликом. 1 .
Дисбиоз слепой кишки относится к нарушению тонкого баланса организмов в пищеварительном тракте кролика. Слепая кишка действует как большая емкость для ферментации, состоящая из многих типов анаэробных организмов, таких как видов Bacteroides, , грамотрицательные овальные и веретенообразные стержни, амебы и простейшие. 2 В слепой кишке также содержится разновидность дрожжей Sarcomyces (Cyniclomyces guttulatus) в небольших количествах при нормальных обстоятельствах. Один из наиболее распространенных способов, которыми владельцы неосознанно способствуют развитию дисбактериоза слепой кишки, — это кормление кроликов продуктами питания с высоким содержанием простых сахаров и крахмалов. Эти диеты обычно также имеют пониженное содержание клетчатки, что приводит к пониженной моторике головного мозга. Когда нормальная популяция флоры подвергается воздействию углеводов в течение длительного периода времени, происходит чрезмерное брожение и популяции организмов перемещаются.Дрожжи размножаются, и обычно небольшие количества видов Escherichia coli и Clostridium начинают размножаться, что приводит к мягкому стулу или, в тяжелых случаях, к настоящей диарее. Избыток глюкозы позволяет Clostridium создавать йота-токсин, что может привести к энтеротоксемии и смерти. 2
Когда домашние кролики не образуют нормальных цекотропов, они теряют важную часть своего питания и подвергаются высокому риску опасного для жизни изменения их флоры слепой кишки.Чтобы кролики вернулись в норму, необходимо тщательное изучение рациона. Некоторые из наиболее распространенных причин — слишком много сладких угощений, таких как фрукты, крекеры, хлеб, хлопья, коммерческие угощения и гранулы с добавлением дополнительных ингредиентов. Даже морковь может содержать слишком много крахмала для некоторых кроликов. Все эти продукты следует немедленно исключить из рациона, а акцент следует сместить на увеличение количества клетчатки. Наиболее эффективно это достигается за счет увеличения в рационе травяного сена (например.г. сено тимофеевки, садовая трава, сено овсяное). Люцерна — это сено из бобовых культур, которое, как правило, содержит больше углеводов и белков, поэтому его следует избегать. Листовую зелень (например, ромэн, эндивий, одуванчик и т. Д.) Можно предлагать из расчета 2 чашки на 5 фунтов кролика в день. Сено и зелень сами по себе могут обеспечить все основные компоненты здорового рациона кролика. Пеллеты можно в конечном итоге снова ввести (1/8 стакана на 5 фунтов кролика), как только мягкие цекотропы исчезнут. В зависимости от серьезности изменения флоры слепой кишки может пройти от нескольких дней до недель, прежде чем цекотропы достигнут нормальной консистенции.Если пораженный кролик не ест сено на регулярной основе, то при внесении сена следует заменить любые коммерческие смеси гранул / семян / сухофруктов, предоставляя гранулы тимофеевки с высоким содержанием клетчатки.
Для получения дополнительной информации о дисбиозе слепой кишки у кроликов или об услугах Angell’s Avian and Exotic, пожалуйста, позвоните по телефону 617 989-1561 или напишите по электронной почте [email protected].
ССЫЛКИ
- Велла Д, Доннелли ТМ. Основы анатомии, физиологии и животноводства. В Quesenberry K, Carpenter J (ред.): Хорьки, кролики и грызуны: клиническая медицина и хирургия, 3-е изд.Сент-Луис: Elsevier, 2012, стр. 161-163.
- Оглсби Б.Л., Дженкинс-младший. Заболевания желудочно-кишечного тракта. В Quesenberry K, Carpenter J (ред.): Хорьки, кролики и грызуны: клиническая медицина и хирургия, 3-е изд. Сент-Луис: Эльзевир, 2012, стр. 193–195.
Новая парадигма детского питания
6 -я Международная конференция и выставка пробиотиков, функционального и детского питания
02-03 октября 2017 г. Лондон, Великобритания
Дэвид Дж. Кайл
Evolve Biosystems, США
Основной доклад : J Prob Health
Аннотация :Постановка проблемы: грудное молоко было единственным источником питания для младенцев на протяжении миллионов лет и богато специфические олигосахариды (HMOs).В естественном микробиоме кишечника младенцев преобладает один вид бифидобактерий, исключительно конкурентоспособны при потреблении ОПЗ. Из-за непредвиденных последствий кормления смесью, использования антибиотиков и Кесарево сечение, этот естественный микробиом был радикально изменен, так что сегодня более 90% новорожденных в США бывают дисбактериозом. Целью этой работы является разработка решения для спасения естественного микробиома от дисбактериоза с помощью раннее ремоделирование, которое возвращает микросреду толстой кишки в ее естественное состояние.Методология: рандомизированное параллельное контролируемое проспективное клиническое исследование (n = 68) было проведено в пяти исследованиях в Дэвисе, Калифорния, США. США со здоровыми доношенными детьми, находящимися на грудном вскармливании, зарегистрированными на четвертый день жизни. Половина когорты получала добавки ежедневно в течение 21 дня. с активированными Bifidobacteria infantis, и половина из них обеспечивала стандартный уход. Результаты: у всех младенцев, получавших добавки, независимо от способа родов, в микробиоме преобладали более 80% B. infantis. тогда как младенцы без добавок были лишены B.Infantis и 21 из 34 младенцев вообще не имели бифидобактерий. Различия в Также были отмечены зрелость стула, pH, микробные и химические различия. Заключение и значение: естественный микробиом hi-bif был утрачен за последние 50-80 лет в развитых странах. В возникающий в результате дисбактериоз может иметь значительное влияние на запрограммированное развитие иммунной системы и формирование метаболических уставок. Мы показали, что этот дисбиоз можно исправить и восстановить микросреду с помощью добавление активированного B.Infantis.
Биография :Дэвид Дж. Кайл — генеральный директор Evolve Biosystems Inc., дочернего предприятия Института продуктов питания для здоровья Калифорнийского университета в Дэвисе. За свою карьеру он основал несколько компаний, в том числе Martek Biosciences Corp, где более 15 лет руководил исследованиями и разработками и коммерческим развитием. Его продукты DHA и ARA теперь присутствуют практически во всех детских смесях по всему миру. В 2011 году он был приобретен DSM за 1,2 млрд долларов. Он получил докторскую степень по биохимии в Университете Альберты, Канада.За свою выдающуюся карьеру он опубликовал более 80 научных статей и отредактировал две книги. В 2009 году он был занесен в Зал славы космических технологий США за вклад в науку и промышленность.
.

