Диффузная гипотония: Мышечная гипотония у детей диагностика, лечение в МЦ «СантаЛен» г. Буча и Г. Ирпень
Мышечная гипотония у детей диагностика, лечение в МЦ «СантаЛен» г. Буча и Г. Ирпень
Мышечная гипотония у детей диагностика, лечение
Мышечная гипотония- это снижение тонуса скелетных мышц, обусловленное физиологическими или патологическими причинами. В норме мышечный тонус регулируется тесным взаимодействием коры головного мозга, подкорковых узлов, мозжечка, спинного мозга, а также рецепторов самих мышц. Данные структуры работают в тесном балансе, что приводит к регуляции мышечного тонуса. Нарушение работы хотя бы одной из данных структур приводит к изменениям тонуса мышц.
У новорожденных детей, а также у детей до 3 мес. основной контроль в регуляции мышц осуществляется подкорковыми узлами (ганглиями), что приводит к физиологическому гипертонуса мышц. В данной возрастной группе это является нормой. Во время сна ребенка мышечный тонус несколько снижается.
Повышенный тонус мышц у детей раннего возраста сопровождается непроизвольными движениями в конечностях, что является нормальным явлением.
Важным симптомом у новорожденных является резкое снижение мышечного тонуса в течение первого месяца, свидетельствует о патологии. В данном случае необходимо срочно проконсультироваться с детским неврологом. Причинами мышечной гипотонии есть ряд заболеваний нервной системы и мышц. Болезнями головного мозга, которые вызывают гипотонию является лейкодистрофией, врожденные наследственные лейкоэнцефалопатии, сосудистые заболевания головного мозга. Некоторые эндокринные заболевания могут вызвать гипотонусе мышц-это чаще врожденный гипотиреоз, фенилкетолургия.
Болезнями спинного мозга, вызывают гипотонию мышц является спинальные амиотрофии или травмы спинного мозга. Также причиной пониженного тонуса в мышцах являются наследственные заболевания, которые объединяются в группу мышечных дистрофий (Дюшена, Беккера, Дрейфуса и др.). Точно установить причину снижения тонуса мышц может только специалист после осмотра ребенка, а также после проведения лабораторных и инструментальных исследований.
Также причиной пониженного тонуса в мышцах являются наследственные заболевания, которые объединяются в группу мышечных дистрофий (Дюшена, Беккера, Дрейфуса и др.). Точно установить причину снижения тонуса мышц может только специалист после осмотра ребенка, а также после проведения лабораторных и инструментальных исследований.
В Украине проводится два основных скрининговых теста у новорожденных для выявления фенилкетонурии и врожденного гипотиреоза. Кстати данные заболевания почти всегда сопровождаются пониженным тонусом мягкой мышц начиная с первых дней.
Ребенок с пониженным мышечным тонусом выглядит дряблой, непроизвольные движения ее достаточно бедные. Если взять на руки здорового новорожденного ребенка на руки, то она пытается согнуться, а ребенок с гипотонией вытягивает ручки и ножки под действием силы тяжести. В таких детей снижен сосательный рефлекс, они имеют слабый крик и плач, не активны. Данные симптомы должны быть основанием для консультации детского невролога или педиатра для определения причины мышечной гипотонии.
Гипотония
Гипотония у детей – снижение мышечного тонуса, которое развивается, в первую очередь, у самых маленьких. Это состояние характеризуется тем, что в ответ на нервную стимуляцию ослабленные волокна мышц сокращаются слишком медленно, и не могут обеспечить нужную степень мышечной реакции, то есть не могут действовать так же активно, как и нормальная мышечная ткань.
Гипотония у детей еще называется синдромом мышечной слабости, и, без должного внимания специалистов и лечения, может приводить к дистрофии (отмиранию) мышечной ткани. Гипотония мышц у детей – это симптом, который сопровождает самые разные болезни самого разного происхождения. Ослабленный тонус мышц бывает вызван очень серьезными причинами: в некоторых случаях это состояние указывает на появление нарушений в работе центральной нервной системы, в других – на наличие генетических проблем или мышечных пороков развития.
Важно понимать, что мышечным тонусом называется напряжение или степень сопротивления движению, которое развивается в мышцах, и гипотония не является аналогом мышечной слабости, которая проявляется в виде снижения силы мышц, но она может сопровождаться этим симптомом.
Общая мышечная гипотония – постоянный симптом у детей с синдромом Дауна, и эта слабость может мешать грудному вскармливанию (ребенок сосет вяло и слишком долго), у малышей чаще возникают запоры из-за сниженной активности мускулатуры кишечника.
Здравствуйте. Надеюсь на Вашу помощь. — Морозовская ДГКБ ДЗМ
Здравствуйте.
Надеюсь на Вашу помощь. Не хотел отвлекать Вас своим вопросом, но видимо буду вынужден, так как после осмотра ребенка неврологом возникли некоторые сомнения в назначенных ею лекарствах. Город у нас совсем небольшой, поэтому специалистов очень немного. Я понимаю, что, возможно, не получу ответов, так как комментировать назначения врачей Вам наверное не совсем этично…но уж очень большие сомнения у нас, извините, если что не так…
Не хотел отвлекать Вас своим вопросом, но видимо буду вынужден, так как после осмотра ребенка неврологом возникли некоторые сомнения в назначенных ею лекарствах. Город у нас совсем небольшой, поэтому специалистов очень немного. Я понимаю, что, возможно, не получу ответов, так как комментировать назначения врачей Вам наверное не совсем этично…но уж очень большие сомнения у нас, извините, если что не так…
Рекомендации:
— массаж, СМТ мышц спины; ЛФК;
— лекарства: нейромидим, 0,005 – в течении месяца;
— неуробекс – 3 недели по ¼ таблетки;
У второго невролога (через 3,5 недели) малыш вел себя более послушно, в заключении: мышечный тонус дистонично (вроде так).

Рекомендации:
-массаж мышц спины+руки, чередуя ноги, парафин на поясницу, ЛФК, плавание.
На наш вопрос о применении вышеуказанных лекарств сказала, что на момент осмотра она бы такие лекарства не назначила, но вообще ребенка нужно наблюдать в динамике (хотя сами лекарства как таковые она одобрила).
P.S. Сам ребенок всегда адекватен, его рефлексы тоже адекватны. Мать ребенка сама села лишь к году, пошла к 1,5; я в детстве не ползал, тоже сел ближе к году. Сейчас ребенку скоро 9 месяцев, он старается все активнее сесть, если помочь ему сесть, то определенное время сидит сам, без поддержки. В кормильном кресле сидит хорошо.
После посещений 2-х неврологов возникают вопросы:
1) нужно ли принимать эти лекарства?;
2) можно ли давать ребенку витамин группы B12 (говорят чтобы зубы легче лезли – сейчас у нас 3 зуба, 4-й на подходе)?
Извините, если эмоционально изложил, просто хотелось бы какой-то определенности.
 Мы Вам заранее признательны за информацию.
Мы Вам заранее признательны за информацию.Уважаемый Игорь! Благодарим за обращение. К сожалению, ответить на ваш вопрос без осмотра ребенка невозможно. Вы можете приехать на консультацию к нашим специалистам по предварительной записи. Запись производится по телефону консультативного центра 8-495-959-8803.
Проведение анализа на спинальную амиотрофию
Наша детская клиника на Ленинском проспекте предлагает пройти тестирование. Анализ на спинальную амиотрофию проводят методом ПЦР. Он отличается высокими показателями специфичности и информативности.
Спинальная мышечная амиотрофия связана с гибелью моторных нейронов.
Первая форма, или болезнь Вердниг — Гофмана, — самая неблагоприятная. Симптомы появляются в период с рождения до шести месяцев: диффузная гипотония в плечах, тазу, дрожание пальцев рук, подбородка, языка, снижение или отсутствие рефлексов сухожилий. Амиотрофия не влияет на развитие психики и речи.
Вторая форма протекает легче. Симптомы появляются в 6-12 месяцев. У детей снижена скорость приобретения навыков движения. Они вовремя начинают держать голову, переворачиваться, но не могут ходить.
Третий тип, болезнь Кугельберга — Веландера, развивается с 12 месяцев до 15 лет. Симптомы заметны после начала ходьбы. Для постановки диагноза необходима оценка характерных признаков, данных электромиографии и генетического анализа на спинальную амиотрофию.
Ген SMN кодирует белок, участвующий в обмене нервных клеток. Он имеет две копии: SMN1 и SMN2. Принципиальное значение имеет анализ первой, поскольку ее полиморфизмы приводят к амиотрофиям трех типов. Мутации называются делециями 7 и 8 экзонов. Их обнаружение в анализе гомозитного гена точно подтверждает диагноз. Если исследование показывает гетерозиготный полиморфизм у супругов, то их предупреждают о высоком риске рождения ребенка с заболеванием.
Принципиальное значение имеет анализ первой, поскольку ее полиморфизмы приводят к амиотрофиям трех типов. Мутации называются делециями 7 и 8 экзонов. Их обнаружение в анализе гомозитного гена точно подтверждает диагноз. Если исследование показывает гетерозиготный полиморфизм у супругов, то их предупреждают о высоком риске рождения ребенка с заболеванием.
Перинатальные поражения ЦНС у детей первого года
В проблеме охраны здоровья подрастающего поколения одной из важнейших задач является обеспечение нормального развития нервной системы ребенка. Медицинскими аспектами этой задачи являются профилактика и лечение заболеваний нервной системы.
Одной из проблем детской неврологии является диагностика и лечение перинатальных поражений нервной системы. В последнее время растет число новорожденных детей с низкой массой тела, отмечается тенденция к росту числа недоношенных детей, наблюдается рост частоты внутриутробных инфекций. В этиологии перинатальной заболеваемости решающую роль играют социальные условия жизни родителей, патология беременности, родов и послеродовые заболевания ребенка.
Патогенными факторами могут быть заболевания матери в период беременности: поздние токсикозы, инфекции, интоксикации, нарушения обмена веществ, иммунопатологические состояния и многообразная акушерская патология: узкий таз, затяжные или стремительные роды, преждевременное отхождение вод, преждевременная отслойка плаценты, фетоплацентарная недостаточность, обвитие пуповиной вокруг шеи, неправильные предлежания плода и др. Имеют значения также акушерские манипуляции (выходные щипцы, вакуум-экстракция плода, кесарево сечение), которые могут повреждать нервную систему плода. У многих новорожденных после извлечения путем кесарева сечения при обследовании выявлены переломы костей черепа, травматическое смещение шейных позвонков, кровоизлияния на глазном дне.
Гипоксически-ишемическая энцефалопатия — приобретенный синдром, характеризуемый клиническими и лабораторными признаками острого повреждения мозга из-за асфиксии (то есть, гипоксии, ацидоза). Среди младенцев, выживших после тяжелой ГИЭ, самые частые причины инвалидности — олигофрения, эпилепсия, детский церебральный паралич. Симптомы: Развитие клиники и течение болезни очень зависит от степени тяжести ГИЭ.
Симптомы: Развитие клиники и течение болезни очень зависит от степени тяжести ГИЭ.
Легкая ГИЭ: Мышечный тонус может быть слегка повышен, и могут быть оживлены сухожильные рефлексы в течение первых нескольких дней. Могут наблюдаться преходящие поведенческие нарушения, такие как слабое сосание, раздражительность, беспокойство или сонливость. Спустя 3-4 дня неврологический статус приходит к норме.
ГИЭ средней степени тяжести. Новорожденный находится в состоянии летаргии: вял, сонлив, с симптомами мышечной гипотонии и значительным снижением сухожильных рефлексов. Рефлексы новорожденного, такие как хватательный, сосательный и рефлекс Моро могут быть резко сниженными или отсутствовать. Новорожденный может испытывать периоды кратковременных апноэ. Судороги могут появиться в первые сутки жизни. Полное неврологическое восстановление возможно в течение 1-2 недель, что ассоциируется с хорошим отдаленным прогнозом. После начального периода благополучия может последовать внезапное ухудшение, что обычно свидетельствует о реперфузионных нарушениях. В течение этого периода может увеличиться интенсивность судорог.
В течение этого периода может увеличиться интенсивность судорог.
Тяжелая ГИЭ: Типичны ступор или кома. Новорожденный может не реагировать на физические раздражители. Дыхание может быть нерегулярным, и такой ребенок обычно нуждается в аппаратной поддержке дыхания. Во всех случаях отмечается диффузная гипотония мышц и глубокое снижение сухожильных рефлексов. Рефлексы новорожденного (сосательный, глотательный, хватательный, Моро) отсутствуют. Во время исследования функции черепно-мозговых нервов можно выявить глазодвигательные нарушения, такие как нистагм, экзофтальм и отсутствие симптома «кукольных глаз» (то есть, отсутствие содружественных движений глазных яблок). Зрачки могут быть широкими, не реагировать или слабо реагировать на свет.
Ранние и частые судороги вначале могут быть резистентными к стандартной терапии. Судороги обычно носят генерализованный характер, и их частота может увеличиваться в последующие 2-3 дня, кореллируя с фазой реперфузионного повреждения. По мере прогрессирования повреждения, судороги спадают и ЭЭГ может стать изоэлектрической или на ней появляется подавление паттерна. В это же время может нарастать угнетение сознания, и появляться напряжение родничка, свидетельствующее о нарастании отека мозга.
В это же время может нарастать угнетение сознания, и появляться напряжение родничка, свидетельствующее о нарастании отека мозга.
Типичным для периода реперфузионных повреждений является нестабильность сердечного ритма и АД, и наступление смерти от кардиореспираторных нарушений. У детей, которые выживают после ГИЭ
сознание восстанавливается к 4-5 дню жизни. Гипотония и трудности с кормлением сохраняются, что требует проведения зондового питания на протяжении недель и месяцев. Помимо повреждения нервной системы,
признаком тяжелой асфиксии является полиорганная недостаточность.
Рис.1 Ребенок с ДЦП, спастической диплегией.
Рис.2 Хореатетоз в руках у девочки, гиперкинетическая форма ДЦП
К внутричерепной родовой травме относят кровоизлияния в вещество мозга, его оболочки, субдуральные кровоизлияния, субарахноидальные кровоизлияния, а также другие расстройства кровообращения, вызывающие структурные изменения нервной системы, перинатальные инсульты; также к родовой травме относятся кефалогематомы, травмы костей черепа и прилегающих тканей.
Клиническая картина внутричерепной родовой травмы в остром периоде характеризуется в основном общемозговыми симптомами, степень выраженности которых различна.
При легкой внутричерепной родовой травме преобладают симптомы повышения нейрорефлекторной возбудимости (беспокойство, тремор конечностей, расстройство сна), обусловленные нарушением ликворо- и гемодинамики. В большинстве случаев эти симптомы быстро исчезают.
При внутричерепной родовой травме средней степени тяжести наблюдаются значительное возбуждение новорожденного (громкий крик, тремор конечностей, переходящий в судороги), симптомы повышения внутричерепного давления, выбухание родничков и расхождение черепных швов.
Тяжелая внутричерепная родовая травма проявляется прекоматозным или коматозным состоянием с общей резкой вялостью ребенка, угнетением всех функций ЦНС, в т.ч. врожденных рефлексов (сосания, глотания, болевого рефлекса). На фоне коматозного состояния могут наблюдаться частые судороги, преимущественно тонического характера.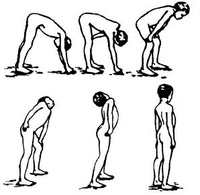
Травматические повреждения спинного мозга в родах возникают вследствие его перерастяжения при сильной тракции за туловище при фиксированной головке — компрессионно-ишемические повреждения и кровоизлияния в спинной мозг.
Клиническая картина зависит от локализации и вида повреждения. При наличии травмы шейного отдела позвоночника, как правило, имеется болевой симптом (перемены положения ребенка, взятие его на руки и особенно исследование симптома Робинсона вызывают резкий плач). Помимо этого, могут быть фиксированная кривошея, удлиненная или укороченная шея, напряжение шейно-затылочных мышц, кровоподтеки и уплотнение мягких тканей шеи, отсутствие пота и сухая кожа над местом поражения.
При тяжелом повреждении верхнешейных сегментов (С1– C4) отмечается картина спинального шока: адинамия, вялость, мышечная гипотония, гипотермия, артериальная гипотония, сухожильные и болевые рефлексы резко снижены или отсутствуют. С момента рождения наблюдается синдром дыхательных расстройств. Нередко голова повернута в какую-либо сторону (часто на этой же стороне обнаруживается спастическая кривошея). Могут выявляться очаговые симптомы поражения черепных нервов. Парез диафрагмы развивается в случае травмы плечевого сплетения, спинного мозга на уровне C3-C4. Ведущим симптомом является синдром дыхательных расстройств: одышка, усиливающаяся при перемене положения, аритмичное дыхание, приступы цианоза. При осмотре новорожденного отмечаются асимметрия грудной клетки, отставание в акте дыхания пораженной половины. У больных с парезом диафрагмы может развиться пневмония, особенностью которой является крайне тяжелое и затяжное течение. При легких формах пареза диафрагмы возможно самопроизвольное восстановление. Среди повреждений в родах периферической нервной системы наиболее часто встречаются травмы плечевого сплетения: проксимальный паралич Дюшенна-Эрба, дистальный паралич Дежерин-Клюмпке, значительно реже – лицевого, диафрагмального, в единичных случаях –лучевого, седалищного нервов.
Нередко голова повернута в какую-либо сторону (часто на этой же стороне обнаруживается спастическая кривошея). Могут выявляться очаговые симптомы поражения черепных нервов. Парез диафрагмы развивается в случае травмы плечевого сплетения, спинного мозга на уровне C3-C4. Ведущим симптомом является синдром дыхательных расстройств: одышка, усиливающаяся при перемене положения, аритмичное дыхание, приступы цианоза. При осмотре новорожденного отмечаются асимметрия грудной клетки, отставание в акте дыхания пораженной половины. У больных с парезом диафрагмы может развиться пневмония, особенностью которой является крайне тяжелое и затяжное течение. При легких формах пареза диафрагмы возможно самопроизвольное восстановление. Среди повреждений в родах периферической нервной системы наиболее часто встречаются травмы плечевого сплетения: проксимальный паралич Дюшенна-Эрба, дистальный паралич Дежерин-Клюмпке, значительно реже – лицевого, диафрагмального, в единичных случаях –лучевого, седалищного нервов.
Рис.3 Родовая травма шейного утолщения спинного мозга. Вялый двусторонний парез рук, преимущественно дистальной локализации (вариант Дежерин-Клюмпке).
Рис.4 Последствия натальной травмы шейного утолщения спинного мозга. Вялый парез правой руки. Укорочение паретичной руки.
Рис.5 Родовая травма шейного утолщения спинного мозга.Вялый тотальный паралич правой руки.
Осложнения перинатальных повреждений. При негрубом поражении нервной системы наступает благоприятный исход, при выраженном — формируются стойкие двигательные нарушения (параличи, атаксия, гиперкинезы), детский церебральный паралич, эпилепсия.
Задержка психомоторного развития характеризуется задержкой формирования высших корковых функций: речи, памяти, внимания, мышления или преобладают нарушения статико-моторных функций, например, синдром дефицита внимания с гиперактивностью: ребенок не способен сосредоточиться, плохо успевает в школе, импульсивен, раздражителен, нередко развивается невроз; отставание в психическом развитии.
В результате натальной (обусловленной родовой травмой шейного отдела позвоночника) нестабильности шейных позвонков и хронической сосудистой недостаточности на вполне благополучном фоне под влиянием умственного, эмоционального или физического перенапряжения может развиться сосудистая катастрофа (инсульт) либо в спинном мозге или стволе головного мозга. Одним из самых частых вариантов поздних осложнений перинатальных повреждений нервной системы являются головные боли, раннее развитие шейного остеохондроза у детей школьного возраста. Цервикальная близорукость, миопия является следствием натальной травмы шейного отдела позвоночника, травмы позвоночных артерий.
Целая группа заболеваний, укладывающихся в понятие поздних отсроченных осложнений нервной системы, является фактически заболеваниями на грани неврологии и ортопедии- нейроортопедическими: сколиотическая деформация позвоночника, кривошея, плоскостопие, вывихи бедер.
Одним из поздних осложнений перинатальных повреждений нервной системы является проблема ночного энуреза у детей, эпилепсия, аффективно-респираторные пароксизмы.
Ранняя диагностика, своевременное адекватное лечение, которое проводится на первом году жизни, способствуют хорошему восстановлению пострадавшей нервной системы, и препятствует развитию грубых отклонений, как в нервно-психическом, так и в двигательном развитии.
Врач детский невролог
медицинского центра «Целитель» — Орлова Ю.М.
БОЛЕЗНЬ КАНАВАН
БОЛЕЗНЬ КАНАВАН
(БОЛЕЗНЬ КАНАВАН-ВАН БОГАРТА БЕРТРАНДА, СПОНГИОЗНАЯ ДЕГЕНЕРАЦИЯ ГОЛОВНОГО МОЗГА, НЕДОСТАТОЧНОСТЬ АСПАРТОАЦИЛАЗЫ).
CANAVAN-VAN BOGAERT-BERTRAND DISEASE; SPONGY DEGENERATION OF CENTRAL NERVOUS SYSTEM; ASPARTOACYLASE DEFICIENCY; ASPA DEFICIENCY ASP DEFICIENCY; AMINOACYLASE 2 DEFICIENCY; ACY2 DEFICIENCY
MIM#271900
Генетика: Мутациями гена аспартоацилазы 2 (ASPA;MIM *608034). Ген картирован на коротком плече 17 хромосомы (локус 17pter-p13).
Тип наследования: аутосомно-рецессивный
Эпидемиология:Высокая частота наблюдается среди евреев-ашкенази 1:5 000 живых новорожденных.
Патогенез: Фермент аспартоацилаза 2 расщепляет N-ацетил-L-аспарагиновую кислоту на L-аспартат и ацетат, в биологических жидкостях и тканях Молекулярные механизмы патогенеза болезни неясны, так, как мало известно о функции N-ацетиласпартата. Предполагается, что N-ацетиласпартат обладает высокой осмолярностью, поэтому повышение его уровня приводит к накоплению воды в клетках головного мозга, что способствует возникновению хронического отека. При электронной микроскопии выявляются вакуоли в «набухшей» цитоплазме и отростках протоплазматических астроцитов в коре, а также вакуолизация белого вещества и аномальные митохондрии в астроцитах.
Клинические проявления: Инфантильная форма заболевания наиболее хорошо изучена клинически. На первом месяце у детей часто отмечаются: нарушение фиксации взора, повышенная возбудимость, вялое сосание, слабый зрительный контакт «глаза в глаза», судороги, диффузная мышечная гипотония. Основные клинические признаки заболевания становятся очевидными к 3 месяцам жизни, важнейшими из которых являются выраженная мышечная гипотония, неспособность удерживать голову в вертикальном положении, в дальнейшем трансформация диффузной мышечной гипотонии в спастичность. Макроцефалия является характерным симптомом заболевания, но в раннем возрасте окружность головы может оставаться в пределах нормы. Мышечная гипотония, сопровождающаяся снижением двигательной активности, в последующем сменяется спастическим гипертонусом. Наблюдается повышение сухожильных рефлексов, появление патологических кистевых и стопных рефлексов, и по мере прогрессирования болезни развивается децеребрационная или декортикационная ригидность. У 50% больных присоединяются генерализованные тонико-клонические судороги. Атрофия зрительных нервов обычно развивается на втором году жизни.
Макроцефалия является характерным симптомом заболевания, но в раннем возрасте окружность головы может оставаться в пределах нормы. Мышечная гипотония, сопровождающаяся снижением двигательной активности, в последующем сменяется спастическим гипертонусом. Наблюдается повышение сухожильных рефлексов, появление патологических кистевых и стопных рефлексов, и по мере прогрессирования болезни развивается децеребрационная или декортикационная ригидность. У 50% больных присоединяются генерализованные тонико-клонические судороги. Атрофия зрительных нервов обычно развивается на втором году жизни.
Диагностика: При МРТ головного мозга выявляется диффузная дегенерациея белого вещества, с вовлечением в патологический процесс полушарий мозга, в меньшей степени поражаются мозжечок и ствол мозга.
концентрации N-ацетиласпартата в моче и измерение активности аспартоацилазы в культуре кожных фибробластов являются надежными биохимическими тестами, применяемыми для установления диагноза. Концентрация N- ацетиласпартата в моче больных составляет более 1000 нмоль/моль креатинина. Возможно проведение ДНК-диагностики. Диагностика проводится в лаборатории наследственных болезней обмена веществ МГНЦ РАМН (http://www.labnbo.narod.ru).
Концентрация N- ацетиласпартата в моче больных составляет более 1000 нмоль/моль креатинина. Возможно проведение ДНК-диагностики. Диагностика проводится в лаборатории наследственных болезней обмена веществ МГНЦ РАМН (http://www.labnbo.narod.ru).
Лечение: Эффективных методов лечения заболевания не разработано. Разрабатываются методы генотерапии данного заболевания.
Прогноз
Прогноз не благоприятный. Большинство пациентов умирают в первую декаду жизни. При более поздних сроках манифестации заболевания продолжительность жизни несколько больше.
GМ1-ГАНГЛИОЗИДОЗ
GМ1-ГАНГЛИОЗИДОЗ
(СЕМЕЙНАЯ ИНФАНТИЛЬНАЯ АМАВРОТИЧЕСКАЯ ИДИОТИЯ С ПОРАЖЕНИЕМ ВНУТРЕННИХ ОРГАНОВ, БОЛЕЗНЬ ЛАНДИНГА, ГЕНЕРАЛИЗОВАННЫЙ ГАНГЛИОЗИДОЗ НОРМАНА-ЛАНДИНГА)
GANGLIOSIDOSIS GENERALIZED GM1; TYPE I GANGLIOSIDOSIS; GENERALIZED GM1, INFANTILE FORM GANGLIOSIDOSIS; GENERALIZED GM1, TYPE 1 BETA-GALACTOSIDASE-1 DEFICIENCY; GLB1 DEFICIENCY; GM1-GANGLIOSIDOSIS, TYPE I, WITH CARDIAC INVOLVEMENT, INCLUDED; GANGLIOSIDOSIS, GENERALIZED GM1, TYPE I, WITH CARDIAC INVOLVEMENT, INCLUDED
MIM#230500
Генетика: Мутации гена лизосомной -галактозидазы (GLB1; MIM *611458). Ген картирован на коротком плече 15 хромосомы (локус 3p21-p14.2.)
Ген картирован на коротком плече 15 хромосомы (локус 3p21-p14.2.)
Тип наследования: аутосомно-рецессивный.
Эпидемиология:Частота заболевания составляет в среднем 1:40000. В Японии наблюдается высокая частота взрослой формы болезни
Патогенез: Недостаточность феpмента пpиводит к наpушению дегpадации в лизосомах ганглиозида GМ1, являющегося важным компонентом мембpан нейpонов, и наpушению дегpадации кеpатансульфата — большого компонента гликозаминогликанов экстраклеточного матрикса хpящевой ткани.
Клинические проявления: На основании клинических проявлений, биохимических и молекулярно-генетических данных заболевание подразделяют на три клинических формы. Различают остpую инфантильную (тип 1), позднюю инфантильную/ювенильную (тип 2) и взpослую/хроническую фоpмы (тип 3). Инфантильная форма. В большинстве случаев, после короткого, относительно нормального периода развития, обычно в 3 — 6 месяцев, возникают первые симптомы заболевания. Манифестными симптомами в неонатальный период являются нарушение вскармливания (отказ от еды, слабость сосания, отрицательная весовая кривая, срыгивания), генерализованный или локальный отек конечностей, гипертpихоз, диффузная мышечная гипотония. В дальнейшем происходит регресс психомоторного развития, диффузная мышечная гипотония трансформируется в мышечную ригидность, также выявляются сухожильная гиперрефлексия, патологические рефлексы, бульбарно-псевдобульбарный синдром, корковая глухота и слепота. Во втором полугодии жизни, как правило, наблюдается гепатоспленомегалия, иногда — асцит. В 50% случаев — макулодистрофия по типу «вишневой косточки». Поздняя инфантильная /ювенильная фоpма. Возраст начала заболевания — на первом году жизни или в возрасте от 2 до 6 лет. Течение заболевания медленно прогрессирующее, чаще дебютирует задержкой психомоторного развития. На втором году жизни появляются миоклонические и генерализованные тонико-клонические судороги, нарастает мышечный тонус вплоть до децеребрационной/декортикационной ригидности, возникает атрофия зрительных нервов.
Манифестными симптомами в неонатальный период являются нарушение вскармливания (отказ от еды, слабость сосания, отрицательная весовая кривая, срыгивания), генерализованный или локальный отек конечностей, гипертpихоз, диффузная мышечная гипотония. В дальнейшем происходит регресс психомоторного развития, диффузная мышечная гипотония трансформируется в мышечную ригидность, также выявляются сухожильная гиперрефлексия, патологические рефлексы, бульбарно-псевдобульбарный синдром, корковая глухота и слепота. Во втором полугодии жизни, как правило, наблюдается гепатоспленомегалия, иногда — асцит. В 50% случаев — макулодистрофия по типу «вишневой косточки». Поздняя инфантильная /ювенильная фоpма. Возраст начала заболевания — на первом году жизни или в возрасте от 2 до 6 лет. Течение заболевания медленно прогрессирующее, чаще дебютирует задержкой психомоторного развития. На втором году жизни появляются миоклонические и генерализованные тонико-клонические судороги, нарастает мышечный тонус вплоть до децеребрационной/декортикационной ригидности, возникает атрофия зрительных нервов. Течение заболевания для всех форм неуклонно прогрессирующее.
Течение заболевания для всех форм неуклонно прогрессирующее.
Диагностика: При МРТ головного мозга — диффузная гипомиелинизация и повышение интенсивности сигнала в области базальных ганглиев. Дополнительных тестом служит повышение в моче галактоолигосахаридов и незначительное повышение кератансульфата. При исследовании биоптата костного мозга, печени выявляются «пенистые клетки» — гистиоциты с большим количеством вакуолей. При биохимических исследованиях в лейкоцитах крови, ККФ, аутоптатах органов определяется значительное снижение активности фермента -галактозидазы менее 10% от нормы. Диагностика проводится в лаборатории наследственных болезней обмена веществ МГНЦ РАМН (http://www.labnbo.narod.ru).
Лечение: Методов эффективной теpапии не разработано. Проводится симптоматическая терапия. Для лечения форм с высокой остаточной активностью фермента разрабатываются методы лечения с применением фармакологических шаперонов.
Прогноз
Прогноз неблагоприятный.
Диффузная пахименингеальная гиперинтенсивность и субдуральный выпот / гематома, обнаруженная с помощью жидкостно-ослабленной инверсионной восстановительной МР-визуализации у пациентов со спонтанной внутричерепной гипотензией поражения. МРТ-изображение FLAIR использовалось для обнаружения утолщения пахименингеальной оболочки и тонкого двустороннего субдурального выпота / гематом у пациентов со спонтанной внутричерепной гипотензией (SIH).
МАТЕРИАЛЫ И МЕТОДЫ: Восемь пациентов прошли лечение по клиническому диагнозу SIH. Хронологические исследования МРТ, включая последовательность FLAIR, были ретроспективно рассмотрены.
РЕЗУЛЬТАТЫ: Первоначальная МРТ показала диффузное пахименингеальное утолщение как изоинтенсивное в 6 случаях, гипоизоинтенсивное в 1 случае и изогиперинтенсивное в 1 случае на Т1-взвешенных МР-изображениях и гиперинтенсивное во всех случаях как на Т2-взвешенных, так и на МРТ FLAIR. изображений. Гиперинтенсивность твердой мозговой оболочки (пахименингеальная) на МР-томографии FLAIR имела самый высокий контраст с ЦСЖ и наблюдалась как линейная у всех пациентов, обычно располагалась в супратенториальной выпуклости, а также параллельно фалксу, твердой мозговой оболочке выпуклости задней ямки и тенторию. и улучшилось после лечения.Эти характеристики диффузной пахименингеальной гиперинтенсивности на МР-томографии FLAIR были аналогичны диффузному пахименингеальному усилению (DPME) на Т1-взвешенной визуализации с гадолинием. Первоначальная визуализация FLAIR четко показала субдуральный выпот / гематомы у 6 из 8 пациентов. Толщина субдурального выпота / гематом иногда временно увеличивалась после успешного лечения и исчезновения клинических симптомов.
и улучшилось после лечения.Эти характеристики диффузной пахименингеальной гиперинтенсивности на МР-томографии FLAIR были аналогичны диффузному пахименингеальному усилению (DPME) на Т1-взвешенной визуализации с гадолинием. Первоначальная визуализация FLAIR четко показала субдуральный выпот / гематомы у 6 из 8 пациентов. Толщина субдурального выпота / гематом иногда временно увеличивалась после успешного лечения и исчезновения клинических симптомов.
ЗАКЛЮЧЕНИЕ: Диффузная пахименингеальная гиперинтенсивность на МР-томографии FLAIR аналогична DPME для диагностики SIH, но не требует введения контрастного вещества.FLAIR — это последовательность, полезная для обнаружения субдурального выпота / гематом у пациентов с SIH.
Синдром спонтанной внутричерепной гипотензии (SIH) характеризуется низким давлением спинномозговой жидкости и позиционной головной болью, вызванной утечкой спинномозговой жидкости. 1,2 МРТ произвела революцию в идентификации, диагностике, управлении и понимании SIH. Характерные МР-признаки SIH включают диффузное пахименингеальное (твердой мозговой оболочки) усиление (DPME), двусторонний субдуральный выпот / гематомы, смещение мозга вниз, увеличение гипофиза, выступание спинномозгового эпидурального венозного сплетения, нагрубание венозных синусов головного мозга ( «Признак расширения вен» и т. Д.), 3 тромбоз венозного синуса, 4 и изолированный тромбоз кортикальной вены. 5 DPME после введения гадолиния может быть наиболее частым и показательным признаком 1,2 и лежит в основе предполагаемого «синдрома ортостатической головной боли и диффузного пахименингеального усиления гадолиния». 6
Характерные МР-признаки SIH включают диффузное пахименингеальное (твердой мозговой оболочки) усиление (DPME), двусторонний субдуральный выпот / гематомы, смещение мозга вниз, увеличение гипофиза, выступание спинномозгового эпидурального венозного сплетения, нагрубание венозных синусов головного мозга ( «Признак расширения вен» и т. Д.), 3 тромбоз венозного синуса, 4 и изолированный тромбоз кортикальной вены. 5 DPME после введения гадолиния может быть наиболее частым и показательным признаком 1,2 и лежит в основе предполагаемого «синдрома ортостатической головной боли и диффузного пахименингеального усиления гадолиния». 6
Причина DPME остается неясной. Гистологическое исследование образцов биопсии менингеальной оболочки неизменно демонстрирует тонкий слой фибробластов, а также небольшие, тонкостенные, расширенные кровеносные сосуды без признаков воспаления на субдуральной поверхности, так называемом слое пограничных клеток твердой мозговой оболочки. 7 Эти данные убедительно свидетельствуют о том, что расширение дуральных вен в соответствии с правилом Монро-Келли является наиболее вероятным объяснением DPME, связанного с SIH, в котором говорится, что уменьшение объема CSF, вызванное утечкой CSF, требует компенсации объема, что приводит к гиперемии менингеальных вен и последующему усилению пахименингеального отдела. . 8 Тем не менее, предыдущие исследования не включали подробные нейрорадиологические оценки пахименингов у пациентов с SIH без искусственных контрастных материалов для оценки временных и функциональных изменений твердой мозговой оболочки. 9
7 Эти данные убедительно свидетельствуют о том, что расширение дуральных вен в соответствии с правилом Монро-Келли является наиболее вероятным объяснением DPME, связанного с SIH, в котором говорится, что уменьшение объема CSF, вызванное утечкой CSF, требует компенсации объема, что приводит к гиперемии менингеальных вен и последующему усилению пахименингеального отдела. . 8 Тем не менее, предыдущие исследования не включали подробные нейрорадиологические оценки пахименингов у пациентов с SIH без искусственных контрастных материалов для оценки временных и функциональных изменений твердой мозговой оболочки. 9
Двусторонний субдуральный выпот / гематомы также являются классическими внутричерепными признаками в диагностике SIH, что снова может быть объяснено правилом Монро-Келли. 1,6,8 Частота субдурального выпота / гематом, связанных с SIH, составляет от 10% до 50% при использовании обычных нейрорадиологических методов. 10,11 Субдуральный выпот / гематомы, связанные с SIH, как правило, тонкие (обычно 2–7 мм), не вызывают заметного массового эффекта, обычно возникают над выпуклостями мозга и проявляются в виде переменной интенсивности МР-сигнала в зависимости от концентрация белка в жидкости или наличие крови. 1
1
Последовательность импульсов восстановления инверсии с ослабленным флюидом (FLAIR) нейтрализует интенсивность сигнала от CSF и вызывает тяжелое взвешивание T2 из-за очень длинного TE, что приводит к превосходному разрешению анатомических деталей, таких как борозды на поверхности мозга, и высокое контраст поражения в областях, близких к спинномозговой жидкости. 12 Этот метод обычно используется для обнаружения поражений менингеальных сосудов, таких как субарахноидальное кровоизлияние и менингит. 13–15 Таким образом, МРТ FLAIR может быть оптимальной последовательностью для оценки утолщенной твердой мозговой оболочки, связанной с SIH, и для обнаружения очень тонкого субдурального выпота / гематом, расположенных близко к субарахноидальному пространству CSF.
В нашем исследовании использовалась МРТ FLAIR для изучения утолщенной твердой мозговой оболочки и субдурального выпота / гематом у пациентов с SIH.
Методы
Мы ретроспективно проанализировали МРТ-изображения и истории болезни 9 пациентов, проходивших лечение по поводу клинического диагноза SIH в нашем учреждении с 2000 по 2006 год. Мы получили информированное согласие всех пациентов. Один пациент был исключен из-за недоступности МРТ-исследования FLAIR. Восемь последовательных пациентов (6 женщин и 2 мужчин; возраст 36–59 лет) прошли МРТ, включая последовательность FLAIR.У всех пациентов наблюдалась позиционная головная боль, которая усилилась вскоре после принятия вертикального положения и уменьшилась или исчезла после того, как лечь. Сопутствующие симптомы и признаки включали тошноту ( n = 3), рвоту ( n = 3), шум в ушах ( n = 3) и паралич шестого черепного нерва ( n = 1). Критерии для установления диагноза SIH были аналогичны тем, о которых сообщалось ранее для SIH, и включали следующее: диффузная головная боль, усиливающаяся в течение 15 минут после сидения или стоя, свидетельство низкого давления спинномозговой жидкости на МРТ и спонтанное разрешение головной боли или в течение нескольких дней. после эпидуральной мазки кровью. 1,3,16 6 пациентов с SIH получали поддерживающее лечение (строгий постельный режим) в течение 2 недель после поступления, и у 2 пациентов улучшилось состояние.
Мы получили информированное согласие всех пациентов. Один пациент был исключен из-за недоступности МРТ-исследования FLAIR. Восемь последовательных пациентов (6 женщин и 2 мужчин; возраст 36–59 лет) прошли МРТ, включая последовательность FLAIR.У всех пациентов наблюдалась позиционная головная боль, которая усилилась вскоре после принятия вертикального положения и уменьшилась или исчезла после того, как лечь. Сопутствующие симптомы и признаки включали тошноту ( n = 3), рвоту ( n = 3), шум в ушах ( n = 3) и паралич шестого черепного нерва ( n = 1). Критерии для установления диагноза SIH были аналогичны тем, о которых сообщалось ранее для SIH, и включали следующее: диффузная головная боль, усиливающаяся в течение 15 минут после сидения или стоя, свидетельство низкого давления спинномозговой жидкости на МРТ и спонтанное разрешение головной боли или в течение нескольких дней. после эпидуральной мазки кровью. 1,3,16 6 пациентов с SIH получали поддерживающее лечение (строгий постельный режим) в течение 2 недель после поступления, и у 2 пациентов улучшилось состояние. Остальным 4 пациентам была сделана эпидуральная пломбировка кровью на основании результатов 3D-КТ-миелографии, радионуклидной цистернографии и МРТ позвоночника. Два последних пациента с SIH получили эпидуральную пластырь кровью без строгого постельного режима. Этим 2 пациентам после эпидуральной пломбировки кровью были выполнены хирургия отверстий и дренирование субдуральной гематомы.Все пациенты имели отличный результат. О случаях этих пациентов частично сообщалось ранее. 17
Остальным 4 пациентам была сделана эпидуральная пломбировка кровью на основании результатов 3D-КТ-миелографии, радионуклидной цистернографии и МРТ позвоночника. Два последних пациента с SIH получили эпидуральную пластырь кровью без строгого постельного режима. Этим 2 пациентам после эпидуральной пломбировки кровью были выполнены хирургия отверстий и дренирование субдуральной гематомы.Все пациенты имели отличный результат. О случаях этих пациентов частично сообщалось ранее. 17
МРТ-изображения выполнялись с использованием систем 1,5 Тл и 0,3 Тл. Аксиальные, корональные или сагиттальные Т1-взвешенные изображения с гадолинием и без него были получены во всех исследованиях (TR, 440–500 мс; TE, 12,9–20 мс). Осевые Т2-взвешенные изображения обычно получали во всех исследованиях (TR, 3600–4500 мс; TE, 95–120 мс). Всем пациентам выполняли аксиальную или коронарную (или обе) визуализацию FLAIR (TR, 7000–9000 мс; TE, 97–158 мс, время инверсии, 1400–2500 мс).В исследовании использовалось 408 срезов изображений FLAIR (соотношение аксиального и коронарного сечений 1,2: 1). Средняя толщина среза составила 5,5 мм (диапазон 4–8 мм).
Средняя толщина среза составила 5,5 мм (диапазон 4–8 мм).
В нашем исследовании каждого пациента оценивали 3 раза — в качестве первоначального, второго и последующих исследований — для уточнения динамики результатов МРТ. Первоначальное и последующее исследования проводились при первом и последнем посещении больницы соответственно. Первоначальные исследования проводились от 4 дней до 2 месяцев после появления головной боли.Все пациенты имели внутричерепную гипотензию и сильную позиционную головную боль при первоначальном исследовании. Вторые исследования были проведены сразу после успешного лечения (эпидуральная пластыря кровью или строгий постельный режим). Только в случае 2 МРТ не проводилось сразу после успешного лечения. Таким образом, было доступно 23 исследования МРТ. Вторые исследования были выполнены от 10 дней до 2 месяцев (в среднем 25,9 дня) после первоначальных исследований. Последующие исследования проводились через 3-5 месяцев после первоначальных исследований (в среднем 3. 5 месяцев), когда все пациенты вернулись к нормальной повседневной жизни без каких-либо признаков головной боли.
5 месяцев), когда все пациенты вернулись к нормальной повседневной жизни без каких-либо признаков головной боли.
Три независимых наблюдателя просмотрели МРТ-изображения для оценки интенсивности сигнала утолщенной твердой мозговой оболочки и субдурального выпота / гематом. «Признак корковой вены» был использован в качестве основы для выявления субдурального выпота / гематом. 18 Интенсивность сигнала на Т1-взвешенных МР-изображениях была классифицирована как гипоинтенсивная, если она равна или ниже интенсивности сигнала серого вещества, изоинтенсивная, если выше, чем у серого вещества, и ниже, чем у белого вещества, и гиперинтенсивная, если равна или выше, чем у белого вещества.Интенсивность сигнала на T2-взвешенных и МР-изображениях FLAIR была классифицирована как гиперинтенсивная, если она выше, чем у паренхимы головного мозга, и как изоинтенсивная, если она почти равна интенсивности паренхимы головного мозга. Окончательная классификация была определена на основе консенсуса трех наблюдателей. Присутствие DPME на T1-взвешенных изображениях после инъекции контрастного агента оценивали путем сравнения с теми же T1-взвешенными МР-изображениями перед инъекцией агента.
Присутствие DPME на T1-взвешенных изображениях после инъекции контрастного агента оценивали путем сравнения с теми же T1-взвешенными МР-изображениями перед инъекцией агента.
Интенсивность сигналов утолщенной твердой мозговой оболочки и двустороннего субдурального выпота / гематом сравнивалась на исходных T1-взвешенных, T2-взвешенных и FLAIR МР-изображениях всех 8 пациентов.Распределение аномалии твердой мозговой оболочки рассматривалось как супратенториальная выпуклость, ямка, тенториум и выпуклость задней ямки, а распределение субдурального выпота / гематомы — как лобная выпуклость, лобно-теменная выпуклость и над супратенториальной выпуклостью. На серийных МРТ-изображениях оценивались следующие факторы: наличие DPME на T1-взвешенных изображениях с гадолинием (да или нет), наличие диффузной пахименингеальной гиперинтенсивности на изображениях FLAIR (как объяснено в разделе результатов; да или нет) и толщина субдурального выпота / гематомы (очень тонкая, ≤3 мм; тонкая,> 3–6 мм; толстая,> 6– ≤10 мм; очень толстая,> 10 мм). Были оценены хронологические изменения этих характеристик твердой мозговой оболочки и субдурального выпота / гематом.
Были оценены хронологические изменения этих характеристик твердой мозговой оболочки и субдурального выпота / гематом.
Результаты
Исходные МРТ-изображения всех пациентов показали диффузное пахименингеальное утолщение, проявляющееся как изоинтенсивное у 6 пациентов, гипоизоинтенсивное у 1 пациента и изогиперинтенсивное у 1 пациента на Т1-взвешенных МР-изображениях и гиперинтенсивное во всех случаях на обоих Т2 взвешенные изображения и изображения FLAIR MR. CSF выглядел как гипоинтенсивный, гиперинтенсивный и гипоинтенсивный у всех пациентов на T1-взвешенных, T2-взвешенных и FLAIR-изображениях соответственно.Следовательно, пахименингеальная гиперинтенсивность имела самый высокий контраст по сравнению с CSF на изображениях FLAIR и не имела контраста на T2-взвешенных изображениях (рис. 1). Эта линейная пахименингеальная гиперинтенсивность была диффузной, но имела однородную толщину и не была неравномерной, поэтому на изображениях FLAIR она была определена как диффузная пахименингеальная гиперинтенсивность. Двусторонний субдуральный выпот / гематомы наблюдались в первоначальном исследовании у 6 из 8 пациентов: гипоинтенсивный у 1 пациента, гипоизоинтенсивный у 3 пациентов, изоинтенсивный у 1 пациента и изогиперинтенсивный у 1 пациента на Т1-взвешенных МР-изображениях и гиперинтенсивный у 1 пациента. всех пациентов на Т2-взвешенном и МРТ-изображениях FLAIR.Субдуральный выпот / гематома имел самый высокий контраст по сравнению с CSF на изображениях FLAIR и отсутствовал на T2-взвешенных изображениях. Твердая мозговая оболочка и чрезвычайно тонкий субдуральный выпот / гематомы было трудно различить на МРТ-изображениях FLAIR, поскольку эти структуры выглядели с одинаковой гиперинтенсивностью. Считалось, что твердая мозговая оболочка проявляется как линейная гиперинтенсивность во внутренней области черепа, а субдуральный выпот / гематома — как гиперинтенсивность в форме выпуклости в субдуральной области. Т1-взвешенные и Т1-взвешенные изображения гадолиния также были исследованы для выявления субдурального выпота и гематомы.
Двусторонний субдуральный выпот / гематомы наблюдались в первоначальном исследовании у 6 из 8 пациентов: гипоинтенсивный у 1 пациента, гипоизоинтенсивный у 3 пациентов, изоинтенсивный у 1 пациента и изогиперинтенсивный у 1 пациента на Т1-взвешенных МР-изображениях и гиперинтенсивный у 1 пациента. всех пациентов на Т2-взвешенном и МРТ-изображениях FLAIR.Субдуральный выпот / гематома имел самый высокий контраст по сравнению с CSF на изображениях FLAIR и отсутствовал на T2-взвешенных изображениях. Твердая мозговая оболочка и чрезвычайно тонкий субдуральный выпот / гематомы было трудно различить на МРТ-изображениях FLAIR, поскольку эти структуры выглядели с одинаковой гиперинтенсивностью. Считалось, что твердая мозговая оболочка проявляется как линейная гиперинтенсивность во внутренней области черепа, а субдуральный выпот / гематома — как гиперинтенсивность в форме выпуклости в субдуральной области. Т1-взвешенные и Т1-взвешенные изображения гадолиния также были исследованы для выявления субдурального выпота и гематомы.
Пациент 5. Первоначальные аксиальные, полуразрезанные и увеличенные МРТ-изображения 39-летнего мужчины со спонтанной внутричерепной гипотензией, у которого в течение месяца наблюдалась ортостатическая головная боль, тошнота, рвота и диплопия. . Поддерживающая терапия разрешила симптомы. , T1-взвешенное изображение, показывающее диффузно утолщенную твердую мозговую оболочку как изоинтенсивную. Субдуральные поражения неясны. B , T2-взвешенное изображение, показывающее, что двусторонний субдуральный выпот / гематомы нельзя отличить от спинномозговой жидкости. C , T1-взвешенное изображение с гадолинием, ясно демонстрирующее диффузное пахименингеальное усиление. D , изображение FLAIR, показывающее диффузную пахименингеальную гиперинтенсивность (, стрелка, ) и очень тонкий двусторонний субдуральный выпот / гематомы во фронтальной области (, стрелка ).
Распределение DPME, диффузной пахименингеальной гиперинтенсивности на изображениях FLAIR и субдурального выпота / гематом оценивалось с использованием первоначального и второго исследований МРТ, поскольку между ними возникло утолщение диффузной пахименингеальной гиперинтенсивности на изображениях FLAIR и новые субдуральные выпоты / гематомы. начальные и вторые исследования у нескольких пациентов.Диффузная пахименингеальная гиперинтенсивность на изображениях FLAIR была локализована в твердой мозговой оболочке супратенториальной выпуклости у всех пациентов. Диффузная пахименингеальная гиперинтенсивность на изображениях FLAIR также наблюдалась параллельно фалксу у 7 пациентов, тенториуму у 5 пациентов и твердой мозговой оболочке выпуклости задней черепной ямки у 5 пациентов (таблица 1, рисунок 2). DPME наблюдалась на супратенториальной выпуклости, ямке, твердой мозговой оболочке выпуклости задней ямки и тенториуме у всех пациентов. Двусторонний субдуральный выпот / гематомы наблюдались над супратенториальной выпуклостью у 4 пациентов, фронтальной выпуклостью у 2 пациентов и лобно-теменной выпуклостью у 1 пациента (Таблица 1; Рисунки 1-3).
начальные и вторые исследования у нескольких пациентов.Диффузная пахименингеальная гиперинтенсивность на изображениях FLAIR была локализована в твердой мозговой оболочке супратенториальной выпуклости у всех пациентов. Диффузная пахименингеальная гиперинтенсивность на изображениях FLAIR также наблюдалась параллельно фалксу у 7 пациентов, тенториуму у 5 пациентов и твердой мозговой оболочке выпуклости задней черепной ямки у 5 пациентов (таблица 1, рисунок 2). DPME наблюдалась на супратенториальной выпуклости, ямке, твердой мозговой оболочке выпуклости задней ямки и тенториуме у всех пациентов. Двусторонний субдуральный выпот / гематомы наблюдались над супратенториальной выпуклостью у 4 пациентов, фронтальной выпуклостью у 2 пациентов и лобно-теменной выпуклостью у 1 пациента (Таблица 1; Рисунки 1-3).
Пациент 4. Хронологические FLAIR и T1-взвешенные МРТ изображения 37-летней женщины со спонтанной внутричерепной гипотензией. У нее была ортостатическая головная боль в течение 1 месяца. Цервикальная эпидуральная кровяная пломба разрешила симптомы. A , исходное изображение FLAIR, показывающее диффузную пахименингеальную гиперинтенсивность в области ямки, тенториума и твердой мозговой оболочки задней черепной ямки ( наконечник стрелки, ) и двусторонний толстый субдуральный выпот / гематомы (, стрелка ). B , второе изображение FLAIR, полученное через 1 месяц после эффективного пятна крови, показывающее исчезновение диффузной пахименингеальной гиперинтенсивности, но утолщение субдурального выпота / гематом ( стрелки, ). C , Последующее изображение FLAIR, показывающее остаточный субдуральный выпот / гематомы ( стрелки, ). D , исходное T1-взвешенное изображение с гадолинием, показывающее DPME на ямке, тенториуме и твердой мозговой оболочке задней черепной ямки ( стрелки, ) и двусторонний толстый субдуральный выпот / гематомы ( стрелки ). E , второе T1-взвешенное изображение, полученное через 1 месяц после полностью эффективного пятна крови, показывающее небольшой остаток DPME и утолщение субдурального выпота / гематом ( стрелки, ).
Цервикальная эпидуральная кровяная пломба разрешила симптомы. A , исходное изображение FLAIR, показывающее диффузную пахименингеальную гиперинтенсивность в области ямки, тенториума и твердой мозговой оболочки задней черепной ямки ( наконечник стрелки, ) и двусторонний толстый субдуральный выпот / гематомы (, стрелка ). B , второе изображение FLAIR, полученное через 1 месяц после эффективного пятна крови, показывающее исчезновение диффузной пахименингеальной гиперинтенсивности, но утолщение субдурального выпота / гематом ( стрелки, ). C , Последующее изображение FLAIR, показывающее остаточный субдуральный выпот / гематомы ( стрелки, ). D , исходное T1-взвешенное изображение с гадолинием, показывающее DPME на ямке, тенториуме и твердой мозговой оболочке задней черепной ямки ( стрелки, ) и двусторонний толстый субдуральный выпот / гематомы ( стрелки ). E , второе T1-взвешенное изображение, полученное через 1 месяц после полностью эффективного пятна крови, показывающее небольшой остаток DPME и утолщение субдурального выпота / гематом ( стрелки, ). F , Последующее Т1-взвешенное изображение, показывающее остаточный субдуральный выпот / гематомы ( стрелка ).
F , Последующее Т1-взвешенное изображение, показывающее остаточный субдуральный выпот / гематомы ( стрелка ).
Пациент 8. Хронологические FLAIR и T1-взвешенные МРТ изображения 47-летней женщины со спонтанной внутричерепной гипотензией. У нее была ортостатическая головная боль в течение 1 недели. Поясничная эпидуральная заплата кровью разрешила симптомы. A , исходное изображение FLAIR, показывающее диффузную пахименингеальную гиперинтенсивность ( стрелка, ). B , второе изображение FLAIR, полученное через 1 неделю после полностью эффективного пятна крови, показывающее утолщенную диффузную пахименингеальную гиперинтенсивность ( стрелка, ) и частичный субдуральный выпот / гематомы ( стрелка ). C , Последующее изображение FLAIR, показывающее исчезновение диффузной пахименингеальной гиперинтенсивности и субдурального выпота / гематом. D , исходное T1-взвешенное изображение с гадолинием, показывающее DPME ( стрелки ). E , Второе T1-взвешенное изображение, полученное через 1 неделю после эффективного пятна крови, показывающее исчезновение DPME ( стрелки, ) и частичный субдуральный выпот / гематомы ( стрелки, ). F , Последующее Т1-взвешенное изображение, показывающее исчезновение DPME и субдуральный выпот / гематомы.
E , Второе T1-взвешенное изображение, полученное через 1 неделю после эффективного пятна крови, показывающее исчезновение DPME ( стрелки, ) и частичный субдуральный выпот / гематомы ( стрелки, ). F , Последующее Т1-взвешенное изображение, показывающее исчезновение DPME и субдуральный выпот / гематомы.
Распределение диффузной пахименингеальной гиперинтенсивности на изображениях FLAIR и / или двусторонний субдуральный выпот / гематомы у пациентов со спонтанной внутричерепной гипотензией
Первоначальные исследования МРТ у всех пациентов показали DPME и диффузную гиперинтензию FLAIR. , но эти признаки улучшились или исчезли во втором или последующем исследовании (таблица 2). В частности, диффузная пахименингеальная гиперинтенсивность на изображениях FLAIR исчезла на последующих МРТ у всех пациентов.Субдуральный выпот / гематомы были обнаружены у 6 из 8 пациентов в первоначальном исследовании, у 6 из 7 — во втором и у 2 из 8 — в последующем. Субдуральный выпот / гематомы наблюдались у 7 из 8 пациентов во всех исследованиях. Субдуральный выпот / толщина гематомы увеличились или de novo образовались субдуральный выпот / гематомы во втором исследовании, несмотря на успешное лечение пациентов 1, 3, 4 и 8 (рис. 2, 3). У остальных пациентов за этот период изменений не наблюдалось. Субдуральный выпот / гематомы улучшились или исчезли во втором или последующем исследовании у всех пациентов.
Субдуральный выпот / гематомы наблюдались у 7 из 8 пациентов во всех исследованиях. Субдуральный выпот / толщина гематомы увеличились или de novo образовались субдуральный выпот / гематомы во втором исследовании, несмотря на успешное лечение пациентов 1, 3, 4 и 8 (рис. 2, 3). У остальных пациентов за этот период изменений не наблюдалось. Субдуральный выпот / гематомы улучшились или исчезли во втором или последующем исследовании у всех пациентов.
Сводка изменений внешнего вида МРТ у пациентов со спонтанной внутричерепной гипотензией
Обсуждение
В нашем исследовании была сделана попытка оценить утолщение пахименингеальной оболочки и выявить тонкий двусторонний субдуральный выпот / гематомы у пациентов с МРГ с помощью FLAIR визуализация без контрастного вещества. Основные наблюдения были следующими:
Диффузное утолщение твердой мозговой оболочки проявлялось как линейная гиперинтенсивность на изображениях FLAIR, с высоким контрастом с CSF, у всех пациентов с SIH.
 Это открытие было определено как диффузная пахименингеальная гиперинтенсивность на изображениях FLAIR.
Это открытие было определено как диффузная пахименингеальная гиперинтенсивность на изображениях FLAIR.Диффузная пахименингеальная гиперинтенсивность на изображениях FLAIR обычно локализовалась в супратенториальной выпуклости, а также возникала параллельно фалксу, твердой мозговой оболочке задней черепной ямки и тенторию и исчезла к заключительному исследованию МРТ после успешного лечения. Эти функции аналогичны функциям DPME, обнаруживаемым с помощью T1-взвешенной МРТ с гадолинием.
Субдуральный выпот / гематомы часто наблюдались, хотя иногда были очень тонкими, на изображениях FLAIR.
Субдуральный выпот / гематомы иногда демонстрировали временное увеличение толщины, но как DPME, так и диффузная пахименингеальная гиперинтенсивность на изображениях FLAIR улучшились или исчезли рано после успешного лечения у этих пациентов.
Диффузная пахименингеальная гиперинтенсивность на изображениях FLAIR была обнаружена при первоначальном исследовании у всех наших пациентов (таблицы 1 и 2). Диффузная пахименингеальная гиперинтенсивность на изображениях FLAIR обычно локализовалась в супратенториальной выпуклости, но также возникала параллельно фалксу, твердой мозговой оболочке выпуклости задней ямки и тенторию (Таблица 1; Рис. 2).Появление и исчезновение диффузной пахименингеальной гиперинтенсивности на изображениях FLAIR почти соответствовало таковым у DPME (таблица 2; рисунки 2 и 3). На начальной стадии и диффузное пахименингеальное утолщение, и субдуральный выпот / гематомы выглядели как гиперинтенсивные на изображениях FLAIR и не могли быть различимы, но диффузная пахименингеальная гиперинтенсивность на изображениях FLAIR исчезла быстрее, чем субдуральный выпот / гематомы после лечения. Эта характеристика также похожа на DPME. Обзор изображений FLAIR MR пациентов с SIH, о которых ранее сообщалось, показал, что диффузная пахименингеальная гиперинтенсивность на изображениях FLAIR присутствовала, но фактически не описывалась как таковая. 11,19
Диффузная пахименингеальная гиперинтенсивность на изображениях FLAIR обычно локализовалась в супратенториальной выпуклости, но также возникала параллельно фалксу, твердой мозговой оболочке выпуклости задней ямки и тенторию (Таблица 1; Рис. 2).Появление и исчезновение диффузной пахименингеальной гиперинтенсивности на изображениях FLAIR почти соответствовало таковым у DPME (таблица 2; рисунки 2 и 3). На начальной стадии и диффузное пахименингеальное утолщение, и субдуральный выпот / гематомы выглядели как гиперинтенсивные на изображениях FLAIR и не могли быть различимы, но диффузная пахименингеальная гиперинтенсивность на изображениях FLAIR исчезла быстрее, чем субдуральный выпот / гематомы после лечения. Эта характеристика также похожа на DPME. Обзор изображений FLAIR MR пациентов с SIH, о которых ранее сообщалось, показал, что диффузная пахименингеальная гиперинтенсивность на изображениях FLAIR присутствовала, но фактически не описывалась как таковая. 11,19
DPME, диффузная пахименингеальная гиперинтенсивность на изображениях FLAIR и субдуральный выпот / гематомы могут иметь тесную патологическую взаимосвязь в пахименингах пациентов с SIH. Пахименинги состоят из внешней или надкостничной твердой мозговой оболочки и внутренней или менингеальной твердой мозговой оболочки. Глубоко в твердой мозговой оболочке, лежащей над паутинной оболочкой, фибробласты становятся более удлиненными и образуют слой «пограничных клеток твердой мозговой оболочки», который состоит из рыхлых фибробластов и внеклеточных пространств различного размера, но без внеклеточного коллагена и содержит мелкие кровеносные сосуды.Этот слой пограничных клеток твердой мозговой оболочки является структурно относительно слабой зоной на границе твердой и паутинной оболочки. Как правило, в этом слое обычно образуются субдуральные скопления жидкости. 18,20 Уменьшение объема спинномозговой жидкости, связанное с SIH, приводит к компенсаторной вазодилатации в слое пограничных клеток твердой мозговой оболочки, 7 приводит к утолщению пахименингов. Компенсирующий минимальный сбор жидкости с высоким содержанием белка может затем произойти в этом слое и перерасти в субдуральный выпот и субдуральную гематому.
Пахименинги состоят из внешней или надкостничной твердой мозговой оболочки и внутренней или менингеальной твердой мозговой оболочки. Глубоко в твердой мозговой оболочке, лежащей над паутинной оболочкой, фибробласты становятся более удлиненными и образуют слой «пограничных клеток твердой мозговой оболочки», который состоит из рыхлых фибробластов и внеклеточных пространств различного размера, но без внеклеточного коллагена и содержит мелкие кровеносные сосуды.Этот слой пограничных клеток твердой мозговой оболочки является структурно относительно слабой зоной на границе твердой и паутинной оболочки. Как правило, в этом слое обычно образуются субдуральные скопления жидкости. 18,20 Уменьшение объема спинномозговой жидкости, связанное с SIH, приводит к компенсаторной вазодилатации в слое пограничных клеток твердой мозговой оболочки, 7 приводит к утолщению пахименингов. Компенсирующий минимальный сбор жидкости с высоким содержанием белка может затем произойти в этом слое и перерасти в субдуральный выпот и субдуральную гематому. Следовательно, диффузное пахименингеальное утолщение и гиперинтенсивность на изображениях FLAIR могут быть признаками первого пахименингеального события в последовательности, ведущей к субдуральному выпоту и, впоследствии, к субдуральным гематомам. Субдуральный выпот / гематомы возникли и сходились с образованием линейного пахименингеального утолщения, проявляющегося как диффузная пахименингеальная гиперинтенсивность на изображениях FLAIR в случаях наших пациентов 3 и 8, соответственно (рис. 3).
Следовательно, диффузное пахименингеальное утолщение и гиперинтенсивность на изображениях FLAIR могут быть признаками первого пахименингеального события в последовательности, ведущей к субдуральному выпоту и, впоследствии, к субдуральным гематомам. Субдуральный выпот / гематомы возникли и сходились с образованием линейного пахименингеального утолщения, проявляющегося как диффузная пахименингеальная гиперинтенсивность на изображениях FLAIR в случаях наших пациентов 3 и 8, соответственно (рис. 3).
Наше наблюдение хронологических изменений субдурального выпота / гематом на МР-томографии FLAIR показало, что толщина субдурального выпота / гематом в супратенториальной выпуклости увеличилась у 4 пациентов между первоначальным и вторым исследованиями, несмотря на успешное лечение.Однако такое парадоксальное увеличение субдурального выпота / толщины гематомы может не указывать на неэффективность лечения, потому что это увеличение было временным и улучшилось у всех пациентов при последующем исследовании. О таком временном увеличении внутричерепного субдурального выпота / гематом после лечения ранее сообщалось в случае, очень похожем на наш пациент 4 (рис. 2). 21 Толщина субдурального выпота / гематом увеличилась в течение 1-2 месяцев после эпидуральной пластыря кровью, но DPME (или диффузная пахименингеальная гиперинтенсивность на изображениях FLAIR) улучшилась.Последующая МРТ показала, что субдуральный выпот / гематомы улучшились без вмешательства. Причина этого преходящего утолщения субдурального выпота / гематом после лечения остается неясной. Феномен баланса, действующий во время слабого саморасширяющегося потенциала субдурального выпота / гематом и восстановления объема спинномозговой жидкости, является потенциальным кандидатом. Требуется дополнительная серия больших МРТ-изображений, чтобы прояснить взаимосвязь между DPME, диффузной пахименингеальной гиперинтенсивностью на изображениях FLAIR и субдуральным выпотом / гематомами у пациентов с SIH.
О таком временном увеличении внутричерепного субдурального выпота / гематом после лечения ранее сообщалось в случае, очень похожем на наш пациент 4 (рис. 2). 21 Толщина субдурального выпота / гематом увеличилась в течение 1-2 месяцев после эпидуральной пластыря кровью, но DPME (или диффузная пахименингеальная гиперинтенсивность на изображениях FLAIR) улучшилась.Последующая МРТ показала, что субдуральный выпот / гематомы улучшились без вмешательства. Причина этого преходящего утолщения субдурального выпота / гематом после лечения остается неясной. Феномен баланса, действующий во время слабого саморасширяющегося потенциала субдурального выпота / гематом и восстановления объема спинномозговой жидкости, является потенциальным кандидатом. Требуется дополнительная серия больших МРТ-изображений, чтобы прояснить взаимосвязь между DPME, диффузной пахименингеальной гиперинтенсивностью на изображениях FLAIR и субдуральным выпотом / гематомами у пациентов с SIH.
Двусторонние субдуральные выпоты / гематомы являются одним из основных нейровизуализационных признаков SIH, но традиционные нейрорадиологические методы, такие как КТ и Т1-взвешенная или Т2-взвешенная МРТ, обычно позволяют достичь низких показателей обнаружения. Субдуральный выпот / гематомы, связанные с SIH, часто бывают тонкими, поэтому скорость обнаружения может зависеть от чувствительности метода. МРТ обычно лучше КТ для визуализации скоплений субдуральной жидкости, как для оценки размера, так и для обнаружения небольших скоплений. 22 Однако субдуральный выпот иногда бывает трудно обнаружить, потому что как поражение, так и спинномозговая жидкость имеют одинаковую интенсивность сигнала как на обычных T1-взвешенных, так и на T2-взвешенных изображениях. 18 Субдуральный сбор жидкости, связанный с SIH, может происходить в виде выпота на ранней стадии и может быть очень тонким. Следовательно, субдуральный выпот / гематомы, связанные с SIH, особенно на ранней стадии, может быть трудно обнаружить с помощью обычных T1-взвешенных и T2-взвешенных последовательностей.
Субдуральный выпот / гематомы, связанные с SIH, часто бывают тонкими, поэтому скорость обнаружения может зависеть от чувствительности метода. МРТ обычно лучше КТ для визуализации скоплений субдуральной жидкости, как для оценки размера, так и для обнаружения небольших скоплений. 22 Однако субдуральный выпот иногда бывает трудно обнаружить, потому что как поражение, так и спинномозговая жидкость имеют одинаковую интенсивность сигнала как на обычных T1-взвешенных, так и на T2-взвешенных изображениях. 18 Субдуральный сбор жидкости, связанный с SIH, может происходить в виде выпота на ранней стадии и может быть очень тонким. Следовательно, субдуральный выпот / гематомы, связанные с SIH, особенно на ранней стадии, может быть трудно обнаружить с помощью обычных T1-взвешенных и T2-взвешенных последовательностей.
FLAIR MR-визуализация может обнаруживать увеличение концентрации белка в спинномозговой жидкости с высокой чувствительностью в зависимости от эффективного ТЕ, отображать анатомические детали, такие как борозды на поверхности мозга, и обеспечивать высокий контраст поражения в областях, близких к спинномозговой жидкости. 12 Порог определяемой концентрации белка может составлять 125 мг / дл в условиях, использованных в этом исследовании. 23 Кроме того, МРТ FLAIR обычно лучше подходит для обнаружения повреждений поверхности мозга. Высокий тканевый контраст между серым и белым веществом на Т2-взвешенной МРТ-визуализации также может скрывать небольшие гиперинтенсивные очаги на поверхности мозга.Подавляя интенсивность сигнала от спинномозговой жидкости и контраст тканей между серым и белым веществом, последовательность FLAIR значительно улучшает визуализацию небольших поражений на периферии полушарий головного мозга, таких как субдуральные гематомы. 24 В нашем исследовании МРТ FLAIR обеспечила более высокий контраст между субдуральным выпотом / гематомами и ЦСЖ, чем Т1-взвешенная или Т2-взвешенная МРТ. Визуализация FLAIR MR выявила двусторонний субдуральный выпот / гематомы у 6 из 8 пациентов с SIH, что значительно выше, чем при использовании обычных последовательностей МРТ.
12 Порог определяемой концентрации белка может составлять 125 мг / дл в условиях, использованных в этом исследовании. 23 Кроме того, МРТ FLAIR обычно лучше подходит для обнаружения повреждений поверхности мозга. Высокий тканевый контраст между серым и белым веществом на Т2-взвешенной МРТ-визуализации также может скрывать небольшие гиперинтенсивные очаги на поверхности мозга.Подавляя интенсивность сигнала от спинномозговой жидкости и контраст тканей между серым и белым веществом, последовательность FLAIR значительно улучшает визуализацию небольших поражений на периферии полушарий головного мозга, таких как субдуральные гематомы. 24 В нашем исследовании МРТ FLAIR обеспечила более высокий контраст между субдуральным выпотом / гематомами и ЦСЖ, чем Т1-взвешенная или Т2-взвешенная МРТ. Визуализация FLAIR MR выявила двусторонний субдуральный выпот / гематомы у 6 из 8 пациентов с SIH, что значительно выше, чем при использовании обычных последовательностей МРТ.
Наше исследование предполагает, что диффузная пахименингеальная гиперинтенсивность при визуализации FLAIR может предоставить клинические показания, аналогичные обнаружению DPME у пациентов с SIH. Однако диффузная пахименингеальная гиперинтенсивность на изображениях FLAIR не была в точности эквивалентна DPME во время исследования. Вторые исследования МРТ, которые были выполнены сразу после успешного лечения, показали, что диффузная пахименингеальная гиперинтенсивность на изображениях FLAIR исчезла быстрее, чем у DPME (таблица 2).Это различие может быть связано с относительной чувствительностью двух методов или, возможно, с относительной скоростью реакции на нормализацию внутричерепного давления после лечения. К сожалению, это исследование включало только несколько пациентов, поэтому мы не смогли исследовать чувствительность диффузной гиперинтенсивности на изображениях FLAIR. Наше общее впечатление таково, что диффузная пахименингеальная гиперинтенсивность на изображениях FLAIR немного менее чувствительна, чем у DPME. Однако для визуализации FLAIR MR не требуется инъекция контрастного вещества гадолиния, поэтому она предпочтительна для пациентов с такими противопоказаниями, как аллергия, астма, беременность и т. Д.
Однако для визуализации FLAIR MR не требуется инъекция контрастного вещества гадолиния, поэтому она предпочтительна для пациентов с такими противопоказаниями, как аллергия, астма, беременность и т. Д.
Слабыми сторонами нашего исследования были различия в клиническом течении и сборе данных из-за ретроспективного характера исследования. В частности, в период исследования были изменены концепция и протокол лечения. Мы подчеркнули строгий постельный режим перед эпидуральной мазкой кровью для начального лечения SIH в начале исследования. Однако позже приоритет был отдан эпидуральной пластыре кровью. 25 Это исследование включало ретроспективный сбор МРТ изображений. Однако второе исследование МРТ у пациента 2 не соответствовало определению «рано после успешного лечения».Кроме того, пациенту 3 было отказано в разрешении на инъекцию контрастного вещества во время второго МР-исследования. Фактически, результаты второго МР-исследования были разными. Однако наши результаты указывают на взаимосвязь между диффузной пахименингеальной гиперинтенсивностью при визуализации FLAIR и субдуральным выпотом / гематомами, а также относительной чувствительностью диффузной пахименингеальной гиперинтенсивности при визуализации FLAIR по сравнению с DPME, основанной на исследованиях МРТ, включая второе исследование МРТ. Требуется более крупное проспективное исследование, чтобы установить патологическое значение и истинную чувствительность диффузной пахименингеальной гиперинтенсивности на изображениях FLAIR.
Требуется более крупное проспективное исследование, чтобы установить патологическое значение и истинную чувствительность диффузной пахименингеальной гиперинтенсивности на изображениях FLAIR.
FLAIR МРТ у пациентов с SIH выявила линейное утолщение твердой мозговой оболочки как гиперинтенсивность (диффузная пахименингеальная гиперинтенсивность на изображениях FLAIR) у всех 8 пациентов в нашей серии, с хронологическими характеристиками, аналогичными DPME, обнаруженным с помощью T1-взвешенной МРТ с гадолинием. . МРТ FLAIR также выявила двусторонний субдуральный выпот / гематомы у 6 из 8 пациентов с SIH. МРТ FLAIR может предоставить простой неинвазивный метод диагностики SIH.
Footnotes
Это исследование частично поддержано грантами Министерства образования, науки, спорта и культуры.
Каталожные номера
- ↵
Schievink WI. Спонтанная утечка спинномозговой жидкости и внутричерепная гипотензия. JAMA 2006; 17: 2286–96
- ↵
Мокри Б.
 , Крюгер Б.Р., Миллер Г.М. и др. Менингеальное усиление гадолиния при головных болях низкого давления. Ann Neurol 1991; 30: 294–95
, Крюгер Б.Р., Миллер Г.М. и др. Менингеальное усиление гадолиния при головных болях низкого давления. Ann Neurol 1991; 30: 294–95 - ↵
Фарб Р.И., Форгани Р., Ли С.К. и др. Признак венозного расширения: диагностический признак внутричерепной гипотензии при МРТ головного мозга. AJNR Am J Neuroradiol 2007; 28: 1489–93
- ↵
Kataoka H, Tanizawa E, Ueno S. Спонтанная внутричерепная гипотензия связана с риском тромбоза венозного синуса и субдуральной гематомы. Cerebrovasc Dis 2007; 23: 315–17
- ↵
Wang YF, Fuh2 JL, Lirng JF и др. Спонтанная внутричерепная гипотензия с изолированным тромбозом кортикальных вен и субарахноидальным кровоизлиянием. Cephalalgia 2007; 27: 1413–17
- ↵
Mokri B, Piepgras DG, Miller GM. Синдром ортостатических головных болей и диффузного пахименингеального усиления гадолиния.
 Mayo Clin Proc 1997; 72: 400–13
Mayo Clin Proc 1997; 72: 400–13 - ↵
Mokri B, Parisi JE, Scheithauer BW, et al. Биопсия менингеальной оболочки при внутричерепной гипотензии: усиление менингеальной оболочки на МРТ. Неврология 1995; 45: 1801–07
- ↵
Мокри Б. Гипотеза Монро – Келли: применение при истощении объема спинномозговой жидкости. Neurology 2001; 56: 1746–48
- ↵
Bang OY, Kim DI, Yoon SR, et al. Идиопатические гипертрофические пахименингеальные поражения: корреляция между клиническими паттернами и характеристиками нейровизуализации. Eur Neurol 1998; 39: 49–56
- ↵
de Noronha RJ, Sharrack B, Hadjivassiliou M, et al. Субдуральная гематома: потенциально серьезное последствие спонтанной внутричерепной гипотензии. J Neurol Neurosurg Psychiatry 2003; 74: 752–55
- ↵
Schievink WI, Maya MM, Moser FG, et al.
 Спектр скоплений субдуральной жидкости при спонтанной внутричерепной гипотензии. J Neurosurg 2005; 103: 608–13
Спектр скоплений субдуральной жидкости при спонтанной внутричерепной гипотензии. J Neurosurg 2005; 103: 608–13 - ↵
Де Коэн Б., Хайнал СП, Гейтхаус П. и др. МРТ головного мозга с использованием импульсных последовательностей восстановления с инверсией с ослаблением жидкости (FLAIR). AJNR Am J Neuroradiol 1992; 13: 1555–64
- ↵
Noguchi K, Ogawa T., Inugami A, et al. Острое субарахноидальное кровоизлияние: МРТ с последовательностью импульсов восстановления инверсии, ослабленной жидкостью. Радиология 1995; 196: 773–77
Камран С., Бенер А.Б., Альпер Д. и др. Роль восстановления инверсии с ослаблением жидкости в диагностике менингита: сравнение с магнитно-резонансной томографией с контрастным усилением. J Comput Assist Tomogr 2004; 28: 68–72
- ↵
Ногучи К., Огава Т., Сето Х и др. Подострое и хроническое субарахноидальное кровоизлияние: диагностика с помощью МР-томографии с восстановлением инверсии и восстановлением жидкости.
 Радиология 1997; 203: 257–62
Радиология 1997; 203: 257–62 - ↵
Подкомитет по классификации головной боли Международного общества головной боли. Международная классификация заболеваний головной боли: 2-е издание. Cephalalgia 2004; 24 Suppl 1: 9–160
- ↵
Tosaka M, Sato N, Fujimaki H, et al. Волнообразный вид диффузного пахименингеального усиления, связанного с внутричерепной гипотензией. Neuroradiology 2005; 47: 362–67
- ↵
McCluney KW, Yeakley JW, Fenstermacher MJ, et al. Субдуральная гигрома в сравнении с атрофией на МРТ головного мозга: «признак кортикальной вены». AJNR Am J Neuroradiol 1992; 13: 1335–39
- ↵
Rothrock JF. Головная боль низкого давления и псевдосубдуральные гематомы. Headache 2003; 43: 1009
- ↵
Haines DE, Harkey HL, Al-Mefty O. «Субдуральное» пространство: новый взгляд на устаревшую концепцию.
 Neurosurgery 1993; 32: 111–20
Neurosurgery 1993; 32: 111–20 - ↵
Raymackers JM, Duprez T., Jeanjean A, et al. Несоответствие динамики черепных и спинномозговых субдуральных собраний в случае SIH, леченного EBP. Eur Radiol 2001; 11: 2310–13
- ↵
Snow RB, Zimmerman RD, Gandy SE и др. Сравнение магнитно-резонансной томографии и компьютерной томографии при оценке травм головы. Neurosurgery 1986; 18: 45–52
- ↵
Melhem ER, Jara H, Eustace S. МРТ-визуализация с восстановлением инверсии в жидкости: определение пороговых значений концентрации белка для гиперинтенсивности спинномозговой жидкости. AJR Am J Roentgenol 1997; 169: 859–62
- ↵
Ashikaga R, Araki Y, Ishida O. МРТ черепно-мозговой травмы на FLAIR. Neuroradiology 1997; 39: 239–42
- ↵
Berroir S, Loisel B, Ducros A, et al. Ранняя эпидуральная пломбировка кровью при спонтанной внутричерепной гипотензии.
 Neurology 2004; 63: 1950–51
Neurology 2004; 63: 1950–51
- Получено 12 октября 2007 г.
- Принято после пересмотра 17 января 2008 г.
- Авторское право © Американское общество нейрорадиологии
Диффузный гиперостоз свода черепа у пациентов Спонтанная внутричерепная гипотензия
Доступно онлайн 18 ноября 2020 г.
Предпосылки
Диагностика спонтанной внутричерепной гипотензии (SIH) может быть отложена из-за неспецифических симптомов и различных результатов визуализации.Другие сообщали о случаях гиперостоза у детей с чрезмерной нагрузкой, процесса, который может быть физиологически аналогичным взрослым с SIH, и наблюдались в нашей практике. Целью этого ретроспективного исследования было оценить частоту и характер гиперостоза свода черепа у пациентов с SIH.
Методы
Мы ретроспективно проанализировали результаты компьютерной томографии и магнитно-резонансной томографии у последовательных пациентов, которые прошли миелографию для оценки SIH для оценки наличия генерализованного утолщения свода черепа или развития вторичного слоя кости. Исключались пациенты с типичным доброкачественным гиперостозом лобной кости. Демографические данные пациента и клинические факторы были оценены на предмет связи с гиперостозом.
Исключались пациенты с типичным доброкачественным гиперостозом лобной кости. Демографические данные пациента и клинические факторы были оценены на предмет связи с гиперостозом.
Результаты
Среди 285 пациентов с SIH 40 (14,0%) продемонстрировали диффузный гиперостоз свода черепа при визуализации. Большинство этих пациентов (32/40; 80,0%) демонстрировали отчетливый многослойный вид черепа по окружности, тогда как 8 из 40 (20,0%) имели общее утолщение свода черепа без наслоения.
Выводы
Диффузный гиперостоз свода черепа, особенно концентрически слоистая форма, которую мы называем «череп из слоеного пирога», является относительно частым признаком визуализации у пациентов с SIH.В соответствующем клиническом контексте это открытие позволит повысить вероятность SIH на основе компьютерной томографии, которая в противном случае имеет ограниченную полезность при первоначальной диагностике этого состояния.
Ключевые слова
Утечка спинномозговой жидкости
CT
Головная боль
Гиперостоз
Внутричерепная гипотензия
Аббревиатуры и аббревиатуры
МРТМагнитно-резонансная томография
SIHстатьи о спонтанной внутричерепной потере
© 2020 Elsevier Inc. Все права защищены.
Все права защищены.
Рекомендуемые статьи
Ссылки на статьи
Гипотония — Советник по терапии рака
I. Проблема / Состояние.
Гипотония определяется как аномально низкое артериальное давление (АД) или значительное снижение АД. Гипотония приведет к недостаточной перфузии органов и со временем к дисфункции органов. Часто гипотония проявляется признаками и симптомами из-за низкого притока крови к артериям и венам. В целом, нормальное АД здорового взрослого человека колеблется от систолического 90-120 до диастолического 60-80 мм рт. Ст.
В отличие от гипертонии, гипотония определяется признаками и симптомами низкого кровотока, а не конкретным числом. Например, у человека, который живет с постоянно повышенным АД (т. Е. Sys 180), может развиться головокружение, и он будет не переносить резкое падение давления до «нормального». Таким образом, этот человек будет считаться гипотоником. И наоборот, есть некоторые здоровые взрослые люди, которые могут жить при систолическом АД ниже 90. Поэтому важно определить исходное АД человека и оценить симптомы, прежде чем делать вывод о гипотонии.
Поэтому важно определить исходное АД человека и оценить симптомы, прежде чем делать вывод о гипотонии.
II. Диагностический подход
A. Каков дифференциальный диагноз этой проблемы?
Полезно построить дифференциальный диагноз гипотонии, подумав о проблеме с физиологической точки зрения. АД зависит от двух факторов: сердечного выброса и системного сосудистого сопротивления. Затем сердечный выброс определяется ударным объемом и частотой сердечных сокращений. Ударный объем зависит от предварительной нагрузки, постнагрузки и сократимости.
Лекарства
При рассмотрении причин гипотонии полезно сначала просмотреть список лекарств, если очевидная причина не очевидна.Рассмотрите возможность удержания или уменьшения дозировки лекарств, которые могут вызвать гипотонию.
1. Диуретики: снижают АД за счет уменьшения запасов натрия в организме
а.
 Тиазид (т.е. гидрохлоротиазид, метолазон)
Тиазид (т.е. гидрохлоротиазид, метолазон)г. Петлевой диуретик (фуросемид, буметанид)
г. К щадящий диуретик (например, спиринолактон)
2. Симпатолитические средства
а. Агенты центрального действия (например, клонидин): это агонист альфа-2, который действует централизованно для снижения симпатического тонуса и повышения парасимпатического тонуса, что приводит к снижению АД и снижению частоты сердечных сокращений.
г. Средства периферического действия
и. Бета-адреноблокаторы (например, метопролол, карведилол, лабеталол, атенолол): лабеталол (альфа / бета-блокатор) считается наиболее мощным бета-блокатором.
ii. Альфа-адреноблокаторы (например, доксазозин, тамсулозин, теразозин): блокируют альфа-рецепторы в гладких мышцах периферических артерий по всему телу. Часто эти препараты используются для лечения доброкачественной гиперплазии предстательной железы (ДГПЖ).
3. Вазодилататоры прямого действия
а.
 Гидралазин
Гидралазинг.Миноксидил
г. Нитропруссид
4. Ингибиторы АПФ (например, лизиноприл): блокируют превращение ангиотензина I в II. Ангиотензия II приводит к повышению АД.
5. БРА (то есть лозартан): блокаторы рецепторов ангиотензина блокируют ангиотензин II.
6. Блокатор кальциевых каналов
а. Дигидропиридин (например, амлодипин, нифедипин): снижает системное сосудистое сопротивление.
г. Недигидропиридин (например, дилтиазем, верапамил): устраняет коронарный спазм и лечит стенокардию; гораздо меньше влияет на АД.
7. Нитраты (например, нитропаста, изосорбид мононитрат, динитрат): нитропаста является эффективным средством, используемым при ургентных / неотложных случаях гипертонической болезни, поскольку она быстро снижает АД. Таким образом, он также может вызвать гипотензию. В таких случаях можно быстро прекратить действие препарата, удалив пластырь и вытирая нитропасту.
Доброкачественная гиперплазия предстательной железы (например, тамсулозин, теразозин)
Антипаркинсонический9
Комбинация: нитраты и силденафил (Виагра)
Трициклические антидепрессанты
Наркотики
Системное сосудистое сопротивление
Анафилаксия
Сепсис / SIRS
Надпочечниковая недостаточность
Спинной шок
Синдром токсического шока
Гипертиреоз
Сердечный выброс
1.
 Сократимость
Сократимостьа. Застойная сердечная недостаточность (CHF)
г. Правожелудочковая недостаточность
2. Предварительная нагрузка
а. Кровоизлияние b. Истощение жидкости c. Острая митральная регургитация
г. Острая аортальная регургитация
3. Остаточная нагрузка a. Стеноз аорты тяжелой степени
,00
1. Брадикардия
2. Тахикардия
Экстракардиальный (обструктивный)
1.Историческая справка важна в диагностике этой проблемы.
1. Изменилось ли психическое состояние пациента? Если да, см. Главу «Шок».
2. Вызывает ли гипотензия какое-либо из принимаемых лекарств? Были добавлены какие-либо новые лекарства?
3. Есть ли новые продукты или лекарства, которые могут вызвать анафилаксию?
4.
 Внимательно изучите сердечный анамнез: боль в груди, одышка, отек ног.
Внимательно изучите сердечный анамнез: боль в груди, одышка, отек ног.5. Какие-либо недавние процедуры или операции, которые могут привести к значительной потере крови или тампонаде? т.е. катетеризация сердца, аортокоронарное шунтирование (АКШ)
6. Принимает ли пациент стероиды постоянно? Внезапное прекращение приема стероидов может вызвать недостаточность функции надпочечников и гипотонию. С другой стороны, у пациента, который хронически принимает стероиды и имеет значительную инфекцию, может развиться надпочечниковая недостаточность.
7. Использовали ли в последнее время тампоны? Это может привести к синдрому атоксического шока, который проявляется в виде диффузной сыпи с высокой температурой, недомогания, спутанности сознания, гипотонии и полиорганной недостаточности.
2. Маневры физического осмотра, которые могут быть полезны при диагностике причины этой проблемы.
1.
 Тампонада — оценка парадоксального пульса помогает исключить тампонаду. Накачать манжету до известного систолического артериального давления. Медленно спускайте воздух из манжеты до тех пор, пока не услышите впервые звуки Короткова. В этот момент зажмите манжету, отметьте артериальное давление и следите за расширением и сдуванием грудной клетки. Первые звуки Короткова слышны только при сдувании грудной клетки (выдохе).Теперь медленно разжимайте манжету, пока не услышите звуки Короткова при расширении грудной клетки (вдох) и выдувании (выдох). Это ваше второе давление. Если разница давлений превышает 12 мм рт. Ст., Имеется аномальный парадоксальный пульс, что указывает на возможную тампонаду.
Тампонада — оценка парадоксального пульса помогает исключить тампонаду. Накачать манжету до известного систолического артериального давления. Медленно спускайте воздух из манжеты до тех пор, пока не услышите впервые звуки Короткова. В этот момент зажмите манжету, отметьте артериальное давление и следите за расширением и сдуванием грудной клетки. Первые звуки Короткова слышны только при сдувании грудной клетки (выдохе).Теперь медленно разжимайте манжету, пока не услышите звуки Короткова при расширении грудной клетки (вдох) и выдувании (выдох). Это ваше второе давление. Если разница давлений превышает 12 мм рт. Ст., Имеется аномальный парадоксальный пульс, что указывает на возможную тампонаду.2. Стеноз аорты — классически описывается резким ромбовидным шумом на правом верхнем краю грудины; однако тяжесть АС не характеризуется интенсивностью шума, и в некоторых случаях тяжелого АС шум трудно обнаружить; лучший способ охарактеризовать степень тяжести — это оценить уровень шума, усиливающегося в конце систолы.

3. Острая митральная регургитация — обычно голосистолическая и лучше всего слышна на верхушке; нет корреляции между интенсивностью и тяжестью МР.
4. Септический шок — ранний сепсис обычно проявляется согреванием конечностей и ограничением пульса. Поздний сепсис покажет прохладные, бледные, синюшные конечности с пятнами.
5. Кардиогенный шок — проявляется в виде холодных конечностей, слабого пульса и вздутия яремных вен.
3.Лабораторные, рентгенографические и другие анализы, которые могут быть полезны для диагностики причины этой проблемы.
>
1. Оценка отношения BUN / Cr может быть полезной для определения истощения объема. Однако ЗСН также может привести к преренальной картине.
2. Рентген грудной клетки (CXR) полезен для исключения хронической сердечной недостаточности, пневмонии.
3. Натуральный пептид мозга является довольно хорошим маркером, если он в норме, исключающим ЗСН.
 Однако имейте в виду, что он может быть ошибочно повышен в случаях почечной недостаточности, тромбоэмболии легочной артерии, митральной регургитации или любых состояний, вызывающих растяжение предсердий.
Однако имейте в виду, что он может быть ошибочно повышен в случаях почечной недостаточности, тромбоэмболии легочной артерии, митральной регургитации или любых состояний, вызывающих растяжение предсердий.4. Прикроватное эхо может быть выполнено для оценки фракции выброса сердца, клапанной функции, тампонады.
5. Посевы крови, мочи, мокроты, кала и / или любых других потенциальных очагов инфекции при подозрении на сепсис.
C. Критерии диагностики каждого диагноза, описанного выше.
1. Лекарства — диагностированные анамнезом и исключающие другие причины.
2. Анафилаксия — анамнез и обследование с отеком губ, языка и затрудненным дыханием.
3. Сепсис / ССВО — подозрение на инфекцию с повышенным количеством лейкоцитов, тахикардией и тахипноэ.
4. Надпочечниковая недостаточность — хронический прием стероидов в анамнезе с внезапной остановкой и дальнейшим обострением вследствие инфекции; 5 утра уровень кортизола ниже или равный 3 соответствует критериям.

5. Спинальный шок — тяжелая вегетативная дисфункция, гипотензия, относительная брадикардия, периферическая вазодилатация и гипотермия.
6.Синдром токсического шока — внезапное появление высокой температуры, тяжелая гипотензия, полиорганная недостаточность. Другие признаки включают диффузную сыпь и шелушение ладоней и подошв, которое возникает через 1-2 недели. Классический анамнез — женщина, которая пользуется тампоном в течение более длительного периода времени. К другим клиническим условиям относятся хирургические раневые инфекции, послеродовые инфекции, глубокие абсцессы, остеомиелит, эмпиема, перитонзиллярный абсцесс и синусит.
7. CHF — история болезни, результаты физикального обследования, рентгенография, уровень BNP или эхо.
8. Правожелудочковая недостаточность — результаты физикального обследования: JVD, гепато-яремный рефлюкс, отек ног, но чистые легкие.
9. Кровоизлияние — обычно у пациентов после катетеризации с забрюшинным кровоизлиянием и значительным дискомфортом в животе или паху.

10. Истощение жидкости — история BUN / Cr — нормальный, вероятно, исключает истощение жидкости.
11. Острая митральная регургитация — внезапная тяжелая одышка с внезапным отеком легких в анамнезе, недавно перенесенный ИМ или инфекционный эндокардит, пролапс митрального клапана в анамнезе; эхо.
12. Острая аортальная регургитация — внезапная сильная одышка в анамнезе с внезапным отеком легких, боль в груди также может быть жалобой, если из-за расслоения аорты; эхо.
13. Тяжелый стеноз аорты — история болезни и обследование.
14. Брадикардия — электрокардиография (ЭКГ) показывает полную или высокую степень блокады сердца; это единственные брадикардии, вызывающие гипотонию.
15. Тахикардия — ЭКГ, чтобы определить, является ли это желудочковой тахикардией или предсердной тахиаритмией.
III. Управление в процессе диагностики
A.
 Управление гипотонией.
Управление гипотонией.1. Изменилось ли психическое состояние пациента?
2. Получить историю болезни от пациента. Скорее всего, анамнез поможет вам диагностировать причину гипотонии.
3. Если у пациента развивается симптоматическая гипотензия, подумайте о прекращении приема всех антигипертензивных препаратов, удалив пластыри, такие как клонидин, пластырь из нитроглицерина.
4. Если гипотензия вызвана ЗСН, оцените, является ли пациент компенсированной (теплые конечности) или некомпенсированной (холодные конечности). Если пациент получает компенсацию, требуются только диуретики. Однако, если пациент не получает компенсации и имеет гипотензию, ему потребуются диуретики и инотропы. Проконсультируйтесь с кардиологом.
5. Если гипотензия вызвана сепсисом / ССВО, начните обильно давать жидкости, чтобы восполнить потери, и лечите антибиотиками широкого спектра действия.Пациенту могут потребоваться прессоры, если артериальное давление не реагирует на жидкости.

6. Если есть опасения по поводу надпочечниковой недостаточности, как указано выше, начните прием стероидов в стрессовой дозе, но не забудьте добавить уровень кортизола, если возможно, кортизола AM.
7. Если в анамнезе есть подозрение на острую МР или АР, позвоните в кардиологию для статического эхо-сигнала у постели больного.
8. При серьезном AS старайтесь избегать редукторов остаточной нагрузки (например, ACEI) и редукторов предварительной нагрузки (т.е.е. нитраты, диуретики). Вызовите консультацию кардиолога и хирурга КТ.
9. При полной или высокой степени блокады сердца немедленно обратитесь в кардиологию и примите у постели больного атропин. Принимайте все бета-адреноблокаторы, блокаторы кальциевых каналов и дигоксин. Пациенту необходима кровать под наблюдением.
Б. Распространенные ловушки и побочные эффекты лечения этой клинической проблемы
1. Септический шок: Ловушки, с которыми часто сталкиваются врачи, — это недостаток или избыток жидкости.Пациентам можно вводить несколько болюсов физиологического раствора в диапазоне от 250 до 1000 куб. В общем, безопасно давать 1000 куб. См жидкости, если пациент не находится на диализе или не страдает хронической сердечной недостаточностью; в этом случае можно использовать болюс 250 куб.
Септический шок: Ловушки, с которыми часто сталкиваются врачи, — это недостаток или избыток жидкости.Пациентам можно вводить несколько болюсов физиологического раствора в диапазоне от 250 до 1000 куб. В общем, безопасно давать 1000 куб. См жидкости, если пациент не находится на диализе или не страдает хронической сердечной недостаточностью; в этом случае можно использовать болюс 250 куб.
После каждого болюса необходимо повторно обследовать пациента на перегрузку жидкостью путем аускультации легких и оценки растяжения яремных вен. Противопоказаний к употреблению агрессивных жидкостей при олигурии и гипотонии нет. Мониторинг диуреза полезен для оценки адекватной почечной перфузии.Во время и после болюсного введения необходимо обеспечить для перфузии мозга значение MAP более 60 мм рт. Также рассмотрите возможность переливания упакованных эритроцитов, если пациент страдает значительной анемией, т. Е. Hgb менее 10.
2. Застойная сердечная недостаточность: возникает еще одна ловушка, когда медицинские работники могут отказаться от приема всех антигипертензивных препаратов у пациентов с низким артериальным давлением (т. Е. Систолическими препаратами 100) с систолической сердечной недостаточностью. В целом, если у пациента нет других симптомов и обычно наблюдается низкое кровяное давление, не следует отказываться от всех гипотензивных средств, если у пациента нет симптомов.Таким образом, следует рассмотреть возможность уменьшения дозы некоторых гипотензивных средств или отказа от приема некоторых антигипертензивных средств.
Е. Систолическими препаратами 100) с систолической сердечной недостаточностью. В целом, если у пациента нет других симптомов и обычно наблюдается низкое кровяное давление, не следует отказываться от всех гипотензивных средств, если у пациента нет симптомов.Таким образом, следует рассмотреть возможность уменьшения дозы некоторых гипотензивных средств или отказа от приема некоторых антигипертензивных средств.
Какие доказательства?
Холленберг, Стивен, М., Паррилло, Джозеф Э. «Глава 38: Шок». ». Принципы внутренней медицины Харрисона. стр. 214-222.
Copyright © 2017, 2013 ООО «Поддержка принятия решений в медицине». Все права защищены.
Ни один спонсор или рекламодатель не участвовал, не одобрял и не платил за контент, предоставляемый Decision Support in Medicine LLC.Лицензионный контент является собственностью DSM и защищен авторским правом.
Результаты магнитно-резонансной томографии до и после лечения спонтанной внутричерепной гипотензии
Синдром спонтанной внутричерепной гипотензии характеризуется постуральной головной болью, низким давлением спинномозговой жидкости и результатами МРТ диффузного увеличения пахименингеального гадолиния без травм головы или спины или люмбальной пункции . 1 Мы сообщаем о результатах МРТ пациента со спонтанной внутричерепной гипотензией до и после лечения.
1 Мы сообщаем о результатах МРТ пациента со спонтанной внутричерепной гипотензией до и после лечения.
Женщина 44 лет обратилась с жалобой на сильную подострую головную боль, рвоту и диплопию. Ранее у нее был период сильной головной боли, который длился несколько недель и прошел спонтанно. Неврологическое обследование показало паралич левостороннего отводящего нерва, в остальном он был нормальным. МРТ-изображение мозга после введения гадолиния со спин-эхом, взвешенное по T1, показало диффузное и однородное утолщение и усиление менингеальной оболочки (рис. 1А). Для исключения менингита выполнена люмбальная пункция.Давление открытия CSF составляло 0 см вод. Ст. 2 O, и жидкость была получена после маневра Васальвы. Анализ ЦСЖ был нормальным даже после повторной люмбальной пункции. В ответ на запрос пациентка сказала, что головная боль уменьшилась, когда она провела несколько минут в положении лежа на спине, и усилилась, когда она была в вертикальном положении. В анамнезе не было люмбальной пункции, травм головы или спины. Установлен диагноз спонтанной внутричерепной гипотензии. Лечение состояло из экстрадурального пластыря крови (20 мл собственной крови) на уровне поясницы, головная боль и паралич шестого нерва разрешились в течение 24 часов.Контрольная МРТ (рис. 1B) через 3 недели после лечения не показала утолщения и увеличения менингеальных оболочек. Пациент был осмотрен через 6 месяцев после лечения, рецидивов не было.
Установлен диагноз спонтанной внутричерепной гипотензии. Лечение состояло из экстрадурального пластыря крови (20 мл собственной крови) на уровне поясницы, головная боль и паралич шестого нерва разрешились в течение 24 часов.Контрольная МРТ (рис. 1B) через 3 недели после лечения не показала утолщения и увеличения менингеальных оболочек. Пациент был осмотрен через 6 месяцев после лечения, рецидивов не было.
Осевые срезы Т1-взвешенной МРТ головного мозга после введения гадолиния до и после лечения. (A) Обширное усиление менингеальных мозгов до лечения; (B) это исчезло после лечения.
Диффузное усиление менингеального гадолиния на МРТ при внутричерепной гипотензии было впервые описано Морки.2 Считается, что это вызвано компенсаторной венозной вазодилатацией и, следовательно, приводит к более высокой концентрации гадолиния в сосудистой сети твердой мозговой оболочки и промежуточной жидкости. 3 Результаты МРТ в этом случае демонстрируют, что диффузное менингеальное усиление может исчезнуть после повышения давления спинномозговой жидкости посредством экстрадурального мазка крови. .
.
Pearls & Oy-sters: ятрогенная относительная гипотензия, приводящая к диффузным инфарктам внутренней пограничной зоны и коме.
PEARLS
Изолированная гипоперфузия с большей вероятностью вызывает инфаркты внутренней пограничной зоны и с меньшей вероятностью вызывает инфаркты корковой пограничной зоны.
Инфаркт кортикальной пограничной зоны должен вызывать подозрение на эмболическую этиологию.
Диффузные подкорковые инфаркты из-за гипоперфузии могут привести к плохому неврологическому исходу.
OY-STER
Пациентам с тяжелой гипертензией следует изначально понижать артериальное давление не более чем на 25%, чтобы снизить вероятность церебральной, коронарной или почечной ишемии.
ОТЧЕТЫ О ПРАКТИКЕ
Мы представляем 2 пациентов с неотложной гипертонической болезнью, у которых развились обширные водоразделительные инфаркты после того, как их кровяное давление было быстро снижено.
Первым пациентом был 50-летний мужчина, поступивший в внешнюю больницу с одышкой и исходным артериальным давлением 204/108 мм рт. Ему поставили диагноз «гипертоническая болезнь», и ему начали капельницу никардипина внутривенно, в результате чего его кровяное давление упало до 102/66 мм рт. Ст. В течение нескольких минут. Его кровяное давление оставалось в этом диапазоне в течение 2 часов, и он стал невосприимчивым. Были предприняты попытки повысить его кровяное давление с помощью жидкостей, хотя его уровень сознания не улучшился.МРТ с диффузионно-взвешенной визуализацией (DWI) впоследствии выявила многочисленные инфаркты в двусторонней внутренней пограничной зоне (IBZ) (рисунок, A). Визуализация сосудов выявила внутричерепной атеросклероз с умеренным сужением множественных артерий. Он был переведен в нашу больницу для дальнейшего лечения и оставался в вегетативном состоянии до выписки на 74-й день больницы.
Рисунок. (A) Последовательность диффузно-взвешенного изображения (DWI) МРТ из первого случая, (B) Последовательность DWI МРТ из второго случая и (C) пограничные зоны коры в красном и внутренние пограничные зоны в синем Второй пациент был 41-летним. — пожилой мужчина, поступивший в больницу с болью в груди, у которого было обнаружено расслоение нисходящей аорты с артериальным давлением 235/144 мм рт.Для предотвращения расширения расслоения было начато внутривенное введение никардипина, и пациент потерял сознание, когда артериальное давление упало до 114/52 мм рт.ст., где оно оставалось примерно 3 часа. Последующая МРТ DWI выявила многочисленные очаги ИБЗ и инфарктов мозолистого тела, представленные на рисунке. Б. Ультразвуковые исследования сонных артерий не выявили значительного стеноза наружных или внутренних сонных артерий. Последующая визуализация, проведенная через 2 месяца после первоначальной визуализации, показала ожидаемое развитие известных инфарктов без отмеченных новых инфарктов.Пациент скончался на 86-е сутки больницы, не приходя в сознание.
— пожилой мужчина, поступивший в больницу с болью в груди, у которого было обнаружено расслоение нисходящей аорты с артериальным давлением 235/144 мм рт.Для предотвращения расширения расслоения было начато внутривенное введение никардипина, и пациент потерял сознание, когда артериальное давление упало до 114/52 мм рт.ст., где оно оставалось примерно 3 часа. Последующая МРТ DWI выявила многочисленные очаги ИБЗ и инфарктов мозолистого тела, представленные на рисунке. Б. Ультразвуковые исследования сонных артерий не выявили значительного стеноза наружных или внутренних сонных артерий. Последующая визуализация, проведенная через 2 месяца после первоначальной визуализации, показала ожидаемое развитие известных инфарктов без отмеченных новых инфарктов.Пациент скончался на 86-е сутки больницы, не приходя в сознание.
ОБСУЖДЕНИЕ
Инсульты водораздела составляют приблизительно 10% всех ишемических инсультов и характеризуются инфарктом, локализованным в пограничных зонах между основными сосудистыми областями головного мозга. 1 Инсульты водораздела могут возникать в IBZ или корковой пограничной зоне (CBZ), как показано на рисунке C. Корковые пограничные зоны расположены на стыках дистальных ветвей передней, средней и задней церебральных артерий.Внутренние пограничные зоны расположены на стыках дистальных ветвей территорий передней, средней и задней церебральных артерий с глубокими перфорирующими артериями, включая лентикулостриатные артерии, артерию Гойбнера и переднюю хориоидальную артерию. Накапливаются данные о том, что различные модели инфарктов IBC и CBZ могут пролить свет на основной механизм повреждения. В частности, инфаркты IBZ с большей вероятностью будут вызваны изолированной недостаточностью перфузии, в то время как инфаркты CBZ более вероятны из-за тромбоэмболии с нарушением вымывания или клиренса эмболов в этих областях с относительно низким потоком. 2,3
1 Инсульты водораздела могут возникать в IBZ или корковой пограничной зоне (CBZ), как показано на рисунке C. Корковые пограничные зоны расположены на стыках дистальных ветвей передней, средней и задней церебральных артерий.Внутренние пограничные зоны расположены на стыках дистальных ветвей территорий передней, средней и задней церебральных артерий с глубокими перфорирующими артериями, включая лентикулостриатные артерии, артерию Гойбнера и переднюю хориоидальную артерию. Накапливаются данные о том, что различные модели инфарктов IBC и CBZ могут пролить свет на основной механизм повреждения. В частности, инфаркты IBZ с большей вероятностью будут вызваны изолированной недостаточностью перфузии, в то время как инфаркты CBZ более вероятны из-за тромбоэмболии с нарушением вымывания или клиренса эмболов в этих областях с относительно низким потоком. 2,3
Эти два случая помогают проиллюстрировать связь между наличием инфарктов IBZ и гемодинамическими нарушениями. Из серии из 120 пациентов с водоразделом инфаркты IBZ чаще связаны с тяжелым стенозом или окклюзией ICA или MCA, тогда как инфаркты CBZ чаще связаны с другими небольшими кортикальными инфарктами, указывающими на эмболию. 2 Аналогичным образом, исследование пациентов с поражением сонных артерий продемонстрировало, что небольшие эмболические поражения на DWI связаны с более низкой степенью стеноза ВСА, в то время как пациенты с более высокой степенью стеноза имеют меньше микроэмболических сигналов (MES), обнаруживаемых с помощью транскраниальной допплерографии. 4 Это контрастирует с другой серией пациентов со стенозом сонной артерии, где MES наблюдались у пациентов с и без инфаркта IBZ, что позволяет предположить, что микроэмболия может играть роль для некоторых пациентов, особенно в контексте нарушения гемодинамики. 5 IBZ считается более уязвимым для снижения церебральной перфузии из-за анатомических характеристик церебральных артериол в этой области.
Из серии из 120 пациентов с водоразделом инфаркты IBZ чаще связаны с тяжелым стенозом или окклюзией ICA или MCA, тогда как инфаркты CBZ чаще связаны с другими небольшими кортикальными инфарктами, указывающими на эмболию. 2 Аналогичным образом, исследование пациентов с поражением сонных артерий продемонстрировало, что небольшие эмболические поражения на DWI связаны с более низкой степенью стеноза ВСА, в то время как пациенты с более высокой степенью стеноза имеют меньше микроэмболических сигналов (MES), обнаруживаемых с помощью транскраниальной допплерографии. 4 Это контрастирует с другой серией пациентов со стенозом сонной артерии, где MES наблюдались у пациентов с и без инфаркта IBZ, что позволяет предположить, что микроэмболия может играть роль для некоторых пациентов, особенно в контексте нарушения гемодинамики. 5 IBZ считается более уязвимым для снижения церебральной перфузии из-за анатомических характеристик церебральных артериол в этой области. Эти сосуды являются наиболее дистальными ветвями ВСА, где перфузионное давление, вероятно, будет самым низким. 6 Кроме того, лентикулостриатные артерии имеют ограниченное коллатеральное кровоснабжение. Наконец, как и в этих двух случаях, пациенты с обширными инфарктами IBZ подвержены риску длительной госпитализации и имеют более высокую вероятность долгосрочной инвалидности, чем пациенты с инфарктами CBZ. 2
Эти сосуды являются наиболее дистальными ветвями ВСА, где перфузионное давление, вероятно, будет самым низким. 6 Кроме того, лентикулостриатные артерии имеют ограниченное коллатеральное кровоснабжение. Наконец, как и в этих двух случаях, пациенты с обширными инфарктами IBZ подвержены риску длительной госпитализации и имеют более высокую вероятность долгосрочной инвалидности, чем пациенты с инфарктами CBZ. 2
В отличие от IBZ, CBZ прилегает к кортикальной поверхности, где лептоменингеальные и дуральные анастомозы обеспечивают коллатеральное кровоснабжение, делая CBZ более устойчивым к прямым травмам из-за снижения церебральной перфузии. 7 Дополнительные доказательства того, что инфаркты CBZ с большей вероятностью могут быть вызваны эмболической этиологией, получены из недавнего исследования пациентов, перенесших транскатетерную аблацию фибрилляции предсердий. 8 В этом исследовании у 78 из 927 (8,4%) последовательных пациентов, перенесших аблацию, на послеоперационной МРТ был обнаружен острый немой инфаркт головного мозга. Эти тихие перипроцедуральные инфаркты гораздо чаще локализовались в CBZ, чем в IBZ, что согласуется с мнением о том, что эмболы с большей вероятностью вызывают повреждение в этих местах.
Эти тихие перипроцедуральные инфаркты гораздо чаще локализовались в CBZ, чем в IBZ, что согласуется с мнением о том, что эмболы с большей вероятностью вызывают повреждение в этих местах.
Эти случаи иллюстрируют 2 ключевых момента. Во-первых, у пациентов с тяжелой гипертонией быстрое и резкое снижение артериального давления может вызвать гипоперфузию головного мозга и кому даже без явной гипотензии. Пациентам с тяжелой артериальной гипертензией сначала следует снизить артериальное давление не более чем на 25%, чтобы снизить вероятность церебральной, коронарной или почечной ишемии. 9 Текущие рекомендации по лечению острого расслоения аорты рекомендуют ориентироваться на систолическое артериальное давление 100–120 мм H 2 O. 10 В этой настройке рекомендуется начальное быстрое снижение артериального давления на 25% с последующим дополнительным постепенным снижением в течение короткого промежутка времени для достижения целевого артериального давления. Кроме того, следует проводить серийные неврологические обследования для выявления ишемии и при необходимости принимать меры для увеличения перфузии мозга. Наконец, характер инфарктов водораздела может пролить свет на основной механизм инсульта. Хотя эти данные ни в коем случае не являются патогномоничными, похоже, что инфаркты IBZ с большей вероятностью связаны с гипоперфузией, в то время как инфаркты CBZ должны вызывать подозрение на эмболическую этиологию.
Кроме того, следует проводить серийные неврологические обследования для выявления ишемии и при необходимости принимать меры для увеличения перфузии мозга. Наконец, характер инфарктов водораздела может пролить свет на основной механизм инсульта. Хотя эти данные ни в коем случае не являются патогномоничными, похоже, что инфаркты IBZ с большей вероятностью связаны с гипоперфузией, в то время как инфаркты CBZ должны вызывать подозрение на эмболическую этиологию.
ВКЛАД АВТОРА
Донна Куровски: концепция и дизайн исследования, сбор данных, автор рукописи. Майкл Т. Маллен: концепция и дизайн исследования, критический пересмотр рукописи на предмет интеллектуального содержания. Стивен Р. Мессе: концепция и дизайн исследования, критический пересмотр рукописи на предмет интеллектуального содержания.
ФИНАНСИРОВАНИЕ ИССЛЕДОВАНИЙ
О целевом финансировании не сообщалось.
РАСКРЫТИЕ
Авторы сообщают об отсутствии раскрытия информации, относящейся к рукописи. Посетите Neurology.org для получения полной информации.
Посетите Neurology.org для получения полной информации.
Сноски
Для получения полной информации посетите сайт Neurology.org. Информация о финансировании и раскрытия, которые авторы сочтут актуальными, если таковые имеются, приведены в конце статьи.
- © 2016 Американская академия неврологии
Улучшение менингеальных функций при обследовании по поводу потери памяти
Отчет о болезни
Г-жа А., 80 лет, обратилась в клинику памяти по поводу забывчивости.Хотя ее потеря памяти медленно прогрессировала за последние 2 года, и ее симптомы не влияли на функции, ее дети заметили ее забывчивость и призвали ее пройти обследование. Она живет самостоятельно с тех пор, как развелась более 40 лет назад. Она управляет своими финансами, домом и готовкой. Миссис А. водит машину, хотя ее семья признается, что нервничает во время езды с ней. В ее основной повседневной деятельности заметных изменений не произошло. Она общительна и активна в книжном клубе, хотя ее дочь заявляет, что она не так активна, как раньше.
Она общительна и активна в книжном клубе, хотя ее дочь заявляет, что она не так активна, как раньше.
Анамнез г-жи А. важен для лечения заболеваний щитовидной железы, хирургии катаракты, выпадения мочевого пузыря и матки с помощью пессария.
Сначала ее осмотрел лечащий врач на предмет жалоб на когнитивные функции и назначил донепезил для симптоматического лечения за 1 месяц до обращения. У нее были результаты МРТ: усиление твердой мозговой оболочки над выпуклостью головного мозга и мозжечка с провисанием ствола головного мозга и 2-миллиметровой аневризмой переднего прохода.Эти результаты были повторно оценены с помощью компьютерной томографической ангиограммы (КТА) головы, подтвердившей 2-миллиметровую выступающую верхнюю ACA. Когда ее спросили, пациентка призналась, что у нее возникло ощущение в левой части головы, которое, по ее мнению, не было болезненным или проблематичным. В анамнезе не было хронических головных болей или других симптомов, указывающих на субарахноидальное кровоизлияние.
Когда г-жа А. обратилась в клинику памяти, ее первоначальная оценка по краткой шкале психического статуса (MMSE) составляла 28 из 30, а неврологический осмотр не дал результатов.Были рекомендованы и заказаны анализы крови для полной метаболической панели, общего анализа крови, поглощения флуоресцентных трепонемных антител, антинуклеарных антител, скорости оседания, протромбинового и частичного протромбинового времени, тиреотропного гормона (ТТГ), свободного тироксина (FT 4 ), витаминов. B 12 , фолиевая кислота, витамин D и гомоцистеин. За исключением повышенного уровня ТТГ 6,71 мМЕ на л и FT 4 1,1 нг на дл, все результаты были отрицательными.
Повторная МРТ головного мозга с контрастом и без него по-прежнему показала диффузное утолщение твердой мозговой оболочки и пахименингеального отдела во всех супратенториальных отделах (рисунок).На основании результатов МРТ с дифференциалом, включающим пахименингию, было принято решение перейти к люмбальной пункции (LP) для анализа спинномозговой жидкости (CSF) и давления открытия. Сообщалось о трудностях с получением СМЖ, и для сбора достаточного количества жидкости для тестирования требовалось наклонять стол. Давление открытия г-жи А. составляло 6 см. Процедуру перенесла хорошо, неврологических жалоб после процедуры не было. Анализ ликвора отрицательный на инфекционные, воспалительные и неопластические процессы.Уровень ангиотензинпревращающего фермента (АПФ) был слегка повышен с неизвестной значимостью. АПФ в сыворотке был в норме. Основываясь на развитии заметной потери памяти и легкого отказа от хобби, ее спинномозговая жидкость также была проанализирована на биомаркеры AD с обнаружением амилоида-β (Aβ) -42 341 пг на мл, фосфорилированного тау 180,2 пг на мл с Aβ до индекс тау (ATI) 0,5, что соответствует вероятной AD.
Сообщалось о трудностях с получением СМЖ, и для сбора достаточного количества жидкости для тестирования требовалось наклонять стол. Давление открытия г-жи А. составляло 6 см. Процедуру перенесла хорошо, неврологических жалоб после процедуры не было. Анализ ликвора отрицательный на инфекционные, воспалительные и неопластические процессы.Уровень ангиотензинпревращающего фермента (АПФ) был слегка повышен с неизвестной значимостью. АПФ в сыворотке был в норме. Основываясь на развитии заметной потери памяти и легкого отказа от хобби, ее спинномозговая жидкость также была проанализирована на биомаркеры AD с обнаружением амилоида-β (Aβ) -42 341 пг на мл, фосфорилированного тау 180,2 пг на мл с Aβ до индекс тау (ATI) 0,5, что соответствует вероятной AD.
Рисунок. МРТ с контрастированием. На аксиальном изображении видно дурально-пахименингеальное утолщение и диффузное усиление (А).На корональном изображении видно продолжающееся утолщение дурально-пахименингеальной оболочки и диффузное усиление (B). На сагиттальном изображении показано неконтрастное изображение с типичной возрастной атрофией (C). Осевое изображение с восстановлением инверсии с ослабленным флюидом (FLAIR) показывает рассеянный глиоз в перивентрикулярной области, вероятно, двустороннее хроническое заболевание белого вещества (D).
На сагиттальном изображении показано неконтрастное изображение с типичной возрастной атрофией (C). Осевое изображение с восстановлением инверсии с ослабленным флюидом (FLAIR) показывает рассеянный глиоз в перивентрикулярной области, вероятно, двустороннее хроническое заболевание белого вещества (D).
Пациент оставался клинически стабильным, и было запрошено повторное обследование, которое было выполнено через 2,5 месяца после первоначальной МРТ; утолщения твердой мозговой оболочки и пахименингеального отдела больше не было, размер желудочка был нормальным.Из-за низкого давления, наблюдаемого при LP, без очевидного источника утечки, были выполнены МРТ оси позвоночника и оценка ЛОР, но результатов не было.
Госпожа А. прошла повторное клиническое обследование через 5 месяцев после последней МРТ головного мозга. Эта оценка подтвердила постоянную клиническую стабильность с симптомами легкой потери памяти и отсутствием жалоб на головные боли или физические симптомы. Она продолжает симптоматическое лечение из-за своей первоначальной жалобы на снижение памяти, вторичное по отношению к вероятной БА.
Обсуждение
Болезнь Альцгеймера
год нашей эры — смертельное, дегенеративное и прогрессирующее заболевание головного мозга, которое является основной причиной деменции в США, поражая примерно 5 человек.7 миллионов человек. 1 Двумя патологическими признаками AD являются Aβ и гиперфосфорилированный тау-белок, который может способствовать воспалительному каскаду в головном мозге, который вызывает прогрессирование заболевания. Текущее лечение представляет собой симптоматическое облегчение, при этом в настоящее время нет известных методов лечения или лечения, изменяющих болезнь.
нашей эры может обеспечить связь между воспалением и неврологическим заболеванием, 2 , и мы сообщаем здесь случай с белой женщиной в возрасте 80 лет с диффузным дуральным и пахименингеальным усилением, обнаруженным случайно на МРТ во время ее обследования на снижение памяти.Обширный поиск литературы не нашел другого опубликованного случая или обсуждения внутричерепной гипотензии и когнитивного снижения, в которых также были обнаружены биомаркеры AD. Этот случай документирует эти результаты у здорового пациента.
Этот случай документирует эти результаты у здорового пациента.
Внутричерепная гипотензия
Внутричерепная гипотензия — это состояние, характеризующееся низким объемом спинномозговой жидкости и часто, но не всегда, низким давлением (<50 мм H 2 0) 3,4 . Чаще всего это происходит в результате спонтанной или связанной с LP утечки спинномозговой жидкости по нейроаксиальной оси, что приводит к потере объема спинномозговой жидкости. 5,6 Потеря объема спинномозговой жидкости обычно компенсируется скоплением жидкости в субдуральном пространстве и увеличением объема внутричерепной венозной крови. Низкий объем спинномозговой жидкости приводит к смещению головного мозга вниз, поскольку подъемная сила спинномозговой жидкости снижается, и это может привести к сопутствующим симптомам. 4 Классический симптом внутричерепной гипотензии — ортостатическая головная боль; тошнота, рвота, боль в шее и другие неврологические проявления из-за давления или растяжения черепных нервов или других структур мозга. 5-7
5-7
Внутричерепная гипотензия может быть диагностирована с помощью МРТ по трем классическим признакам увеличения и утолщения пахименингеального гадолиния, которые со временем становятся менее очевидными; провисание ствола мозга или грыжа миндалин; и сбор субдуральной жидкости. 3-6,8
Лечение обычно представляет собой консервативное лечение постельного режима, жидкости и кофеина, хотя, если состояние не исчезнет, может потребоваться определить место утечки и обработать его эпидуральной пластырем с кровью в поясничном отделе.Внутричерепная гипотензия обычно проходит в течение нескольких недель или месяцев.
Идиопатический гипертрофический пахименингит
Идиопатический гипертрофический пахименингит (ИГП) — редкое воспалительное состояние, которое приводит к локализованному или диффузному утолщению твердой мозговой оболочки и может быть первичным без установленной причины или вторичным, которое связано со многими идентифицируемыми причинами, обычно инфекционными или воспалительными (например, , нейросифилис, 9 бактериальный менингит, 10 гранулематоз Вегенера, 9,11,12 или узелковый полиартериит).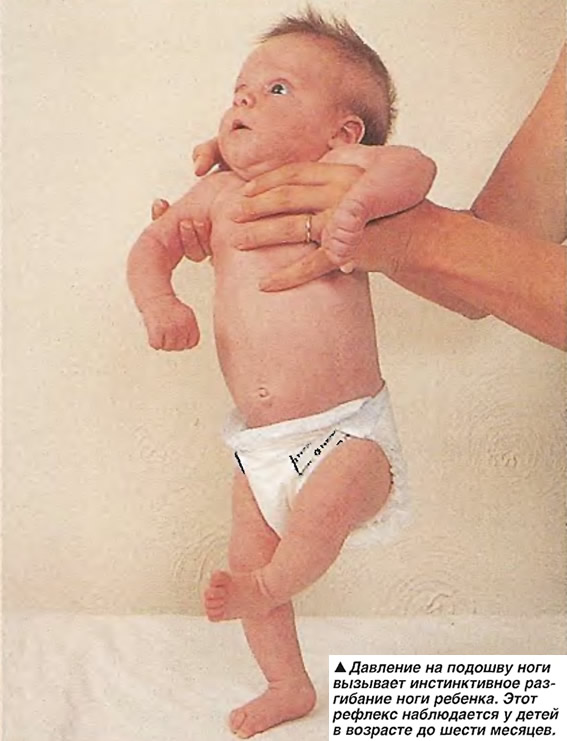
Наиболее частым симптомом IHP также является головная боль, хотя могут присутствовать и другие неврологические проявления, включая паралич черепных нервов, атаксию или нейроофтальмологические проявления. 9,13,14 Аномальное утолщение и усиление твердой мозговой оболочки обнаруживается на МРТ с усилением гадолинием, хотя паттерны усиления могут варьироваться как узловые, линейные или и то, и другое. 9 Диагноз обычно является клиническим, другие причины следует исключать с помощью анализа крови и спинномозговой жидкости. Биопсия твердой мозговой оболочки может подтвердить диагноз, если это необходимо, и может показать хронический воспалительный инфильтрат с лимфоцитами, палисадными гистиоцитами и различные уровни фиброза с отрицательным тестом на инфекционные агенты. 9
Гипертрофический пахименингит может поражать твердую мозговую оболочку черепа и твердую мозговую оболочку спинного мозга, чаще всего шейный и верхний грудной сегменты.
Лечение включает кортикостероиды и иммунодепрессанты. 15
Заключение
Первоначальное обследование когнитивных проблем миссис А. показало, что результаты МРТ указывают на диффузное очаговое утолщение и усиление менингеальной оболочки, что вызывает подозрение на воспалительное заболевание, такое как IHP.После того, как повторная МРТ, сделанная через месяц, подтвердила результаты, была проведена оценка LP и CSF. Вторичный IHP был исключен из разницы как из-за низкого давления открытия, так и из-за отрицательных результатов CSF. Г-жа А. не жаловалась на ортостатическую головную боль, самые классические симптомы внутричерепной гипотензии. Диагноз внутричерепной гипотензии был поставлен без документально подтвержденного источника утечки спинномозговой жидкости. Впоследствии первоначальные результаты МРТ диффузного усиления разрешились спонтанно. Этот случай подтверждает необходимость регулярной проверки давления открытия на LP, несмотря на отсутствие клинических симптомов.
AD были включены как часть анализа CSF, поскольку прогрессирующая потеря памяти и отказ от занятий у пациентки были подозрительными для продромального AD, а ее возраст и пол являются факторами риска AD. Биомаркеры АД, полученные при анализе ЦСЖ, подтверждают диагноз АД, и она продолжает наблюдаться в клинике. Поскольку она хорошо переносила донепезил без побочных эффектов, прием продолжали, несмотря на то, что он применялся не по назначению, поскольку ее функция не была нарушена. Ранняя диагностика важна для этой конкретной пациентки, поскольку она жила одна и независимо.Сейчас ее дочь получает медицинскую помощь, чтобы обеспечить безопасный и постоянный уход. <
Нима Хосравани, MS
Студент-медик
Медицинский колледж государственного университета Флориды
Орландо, Флорида
Анамария Шанли, MSN, ARNP-BC
Клиника Компас
Орландо, Флорида
Ира Дж. Гудман, MD
Директор по неврологии, Bioclinica
Доцент кафедры неврологии
Медицинский колледж Университета Центральной Флориды
Клиника Компас
Орландо, Флорида
Раскрытие информации
Др. Гудман является членом Консультативного совета по болезни Альцгеймера компании Eli Lilly и одним из ключевых лидеров общественного мнения Bioclinica. Его соавторы не имеют финансовых отношений, о которых следует раскрывать.
Гудман является членом Консультативного совета по болезни Альцгеймера компании Eli Lilly и одним из ключевых лидеров общественного мнения Bioclinica. Его соавторы не имеют финансовых отношений, о которых следует раскрывать.
Надпочечниковая недостаточность, вторичная по отношению к двусторонней диффузной большой В-клеточной лимфоме надпочечников: описание случая | ECE2019 | 21-й Европейский конгресс эндокринологов
Введение: Первичная лимфома надпочечников встречается крайне редко. На его долю приходится <1% экстранодальных лимфом.Обычно он поражает пожилых мужчин с двусторонним поражением надпочечников, что приводит к гипофункции надпочечников. Прогноз очень плохой из-за отсутствия оптимальных режимов химиотерапии.
История болезни: 71-летний мужчина с предшествующей историей инсулинозависимого диабета был госпитализирован в отделение неотложной помощи с симптомами прогрессирующей слабости, утомляемости, анорексии и потери веса на 15 кг за предыдущие 6 месяцев. Эти симптомы были связаны с гипотонией, тошнотой, рвотой и неустойчивой походкой.При физикальном обследовании пациент выглядел вялым, хронически больным, но настороженным. У него была ортостатическая гипотензия. Гиперпигментация кожи отсутствовала. Лабораторные анализы показали гипонатриемию (127 мэкв / л) и незначительно высокий уровень калия (5,6 мэкв / л), нормогликемию и анемию. Пациент первоначально отреагировал на внутривенное введение больших доз гидрокортизона с ремиссией симптомов. Но ортостатическая гипотензия и изменения ионограммы сохранялись, поэтому добавили флудрокортизон с хорошими результатами. Скрининг на злокачественные новообразования проводился с помощью компьютерной томографии (КТ) тела отверстия, которая показывала двусторонние образования надпочечников с размером более 10 HU.Дальнейшая оценка с помощью сканирования MNR надпочечников показала гипоинтенсивные узловые изображения в T1 и T2 в обоих надпочечниках. С узелком 4 см на правой железе и еще 4,5 см на левой.
Эти симптомы были связаны с гипотонией, тошнотой, рвотой и неустойчивой походкой.При физикальном обследовании пациент выглядел вялым, хронически больным, но настороженным. У него была ортостатическая гипотензия. Гиперпигментация кожи отсутствовала. Лабораторные анализы показали гипонатриемию (127 мэкв / л) и незначительно высокий уровень калия (5,6 мэкв / л), нормогликемию и анемию. Пациент первоначально отреагировал на внутривенное введение больших доз гидрокортизона с ремиссией симптомов. Но ортостатическая гипотензия и изменения ионограммы сохранялись, поэтому добавили флудрокортизон с хорошими результатами. Скрининг на злокачественные новообразования проводился с помощью компьютерной томографии (КТ) тела отверстия, которая показывала двусторонние образования надпочечников с размером более 10 HU.Дальнейшая оценка с помощью сканирования MNR надпочечников показала гипоинтенсивные узловые изображения в T1 и T2 в обоих надпочечниках. С узелком 4 см на правой железе и еще 4,5 см на левой. Они казались гиперинтенсивными в Out Phase и имели неоднородное усиление после гадолиния. Тест на АКТГ показал полное отсутствие ответа (базальный кортизол 0,3 мкг / дл после АКТГ Кортизол 30 мин: 0,4 мкг / дл. Метанефрины и катехоламины в моче были нормальными, за исключением феохромоцитомы. Была проведена срочная пункционная биопсия левого надпочечника, которая показала диффузную В-клеточная лимфома большого размера.Биопсия костного мозга не выявила лимфоматозного поражения. После того, как диагноз был поставлен, состояние пациента резко ухудшилось, и он скончался в результате своего состояния.
Они казались гиперинтенсивными в Out Phase и имели неоднородное усиление после гадолиния. Тест на АКТГ показал полное отсутствие ответа (базальный кортизол 0,3 мкг / дл после АКТГ Кортизол 30 мин: 0,4 мкг / дл. Метанефрины и катехоламины в моче были нормальными, за исключением феохромоцитомы. Была проведена срочная пункционная биопсия левого надпочечника, которая показала диффузную В-клеточная лимфома большого размера.Биопсия костного мозга не выявила лимфоматозного поражения. После того, как диагноз был поставлен, состояние пациента резко ухудшилось, и он скончался в результате своего состояния.
Заключение: Первичная лимфома надпочечника встречается крайне редко. Когда это происходит, наиболее распространенным подтипом является диффузная В-клеточная лимфома большого размера. Этот случай подчеркивает важность рассмотрения диффузной крупноклеточной В-клеточной лимфомы (PAL) как необычной причины недостаточности надпочечников. Особенно у пожилых пациентов с надпочечниковой недостаточностью, связанной с двусторонним образованием надпочечников.

 Это открытие было определено как диффузная пахименингеальная гиперинтенсивность на изображениях FLAIR.
Это открытие было определено как диффузная пахименингеальная гиперинтенсивность на изображениях FLAIR. , Крюгер Б.Р., Миллер Г.М. и др. Менингеальное усиление гадолиния при головных болях низкого давления. Ann Neurol 1991; 30: 294–95
, Крюгер Б.Р., Миллер Г.М. и др. Менингеальное усиление гадолиния при головных болях низкого давления. Ann Neurol 1991; 30: 294–95  Mayo Clin Proc 1997; 72: 400–13
Mayo Clin Proc 1997; 72: 400–13  Спектр скоплений субдуральной жидкости при спонтанной внутричерепной гипотензии. J Neurosurg 2005; 103: 608–13
Спектр скоплений субдуральной жидкости при спонтанной внутричерепной гипотензии. J Neurosurg 2005; 103: 608–13  Радиология 1997; 203: 257–62
Радиология 1997; 203: 257–62  Neurosurgery 1993; 32: 111–20
Neurosurgery 1993; 32: 111–20  Neurology 2004; 63: 1950–51
Neurology 2004; 63: 1950–51  Тиазид (т.е. гидрохлоротиазид, метолазон)
Тиазид (т.е. гидрохлоротиазид, метолазон) Гидралазин
Гидралазин Сократимость
Сократимость Внимательно изучите сердечный анамнез: боль в груди, одышка, отек ног.
Внимательно изучите сердечный анамнез: боль в груди, одышка, отек ног. Тампонада — оценка парадоксального пульса помогает исключить тампонаду. Накачать манжету до известного систолического артериального давления. Медленно спускайте воздух из манжеты до тех пор, пока не услышите впервые звуки Короткова. В этот момент зажмите манжету, отметьте артериальное давление и следите за расширением и сдуванием грудной клетки. Первые звуки Короткова слышны только при сдувании грудной клетки (выдохе).Теперь медленно разжимайте манжету, пока не услышите звуки Короткова при расширении грудной клетки (вдох) и выдувании (выдох). Это ваше второе давление. Если разница давлений превышает 12 мм рт. Ст., Имеется аномальный парадоксальный пульс, что указывает на возможную тампонаду.
Тампонада — оценка парадоксального пульса помогает исключить тампонаду. Накачать манжету до известного систолического артериального давления. Медленно спускайте воздух из манжеты до тех пор, пока не услышите впервые звуки Короткова. В этот момент зажмите манжету, отметьте артериальное давление и следите за расширением и сдуванием грудной клетки. Первые звуки Короткова слышны только при сдувании грудной клетки (выдохе).Теперь медленно разжимайте манжету, пока не услышите звуки Короткова при расширении грудной клетки (вдох) и выдувании (выдох). Это ваше второе давление. Если разница давлений превышает 12 мм рт. Ст., Имеется аномальный парадоксальный пульс, что указывает на возможную тампонаду.
 Однако имейте в виду, что он может быть ошибочно повышен в случаях почечной недостаточности, тромбоэмболии легочной артерии, митральной регургитации или любых состояний, вызывающих растяжение предсердий.
Однако имейте в виду, что он может быть ошибочно повышен в случаях почечной недостаточности, тромбоэмболии легочной артерии, митральной регургитации или любых состояний, вызывающих растяжение предсердий.

