Бифидобактерии для грудничка: Бифидобактерии: от матери к ребенку
Пробиотики для детей: что это такое и какая их польза?
Первыми в нем поселяются полезные пребиотики и пробиотики, чуть позже — энерококки, стафилококки и прочие участники микробного сообщества. Последних относят к условно-патогенной микрофлоре и в незначительном количестве они не опасны. Но как только их становится больше, у крохи начинаются проблемы с пищеварением.
Боли в животике, вздутие, метеоризм, поносы или наоборот – запоры – частые явления у грудничков, ведь их система ЖКТ все еще пребывает на стадии становления. Педиатры называют такое состояние дисбактериозом и назначают пробиотики для детей, чтобы помочь малышу и привести микрофлору кишечника в порядок.
Что такое пробиотики и как они могут помочь крохе справиться с дисбактериозом? Стоит ли давать грудничку такие препараты и не навредят ли они маленькому организму? Эти вопросы беспокоят всех без исключения молодых мам. Попробуем разобраться.
Что такое дисбактериоз и как с ним бороться?Современные педиатры не считают дисбактериоз болезнью.
Дисбактериоз начинается, когда количество этих полезных бактерий по отношению к условно-патогенным сокращается по тем или иным причинам. А причины могут быть следующими:
- Несформированность ЖКТ
У месячных малышей система желудочно-кишечного тракта еще незрелая и часто полезных микроорганизмов для стабильного функционирования кишечника просто не хватает. Проблема эта по мере взросления может решиться сама собой. Но до тех пор вы можете помочь своему крохе, давая детские пробиотики.
- Неправильный рацион
Как правило, дисбиозами страдают малыши, которых слишком рано перевели на прикорм или кормят смесями, не соответствующими их возрасту. Если проблемы с пищеварением начались у ребенка на грудном вскармливании, значит неправильно питается мама. В этом случае нужно пересмотреть свой рацион.
Если проблемы с пищеварением начались у ребенка на грудном вскармливании, значит неправильно питается мама. В этом случае нужно пересмотреть свой рацион.
Читайте также: Режим питания грудных детей
- Прием антибиотиков
Антибиотики убивают все бактерии – как патогенные, так и полезные. Поэтому, если кроха или мама, которая кормит грудью, проходила лечение такими препаратами, расстройство баланса микрофлоры обеспечено.
Читайте также: Питание кормящей мамы
Пробиотики для детей: что это и чем полезны?Пробиотиками называют биодобавки или препараты, которые содержат в составе полезные для нас микроорганизмы – лактобактерии и бифидобактерии. Они являются частью нормальной микрофлоры и нужны для корректной работы желудочно-кишечного тракта. Другими словами, это наш щит против патогенных организмов и токсинов.
Пробиотики – бактерии, которые участвуют в синтезе важных для организма витаминов и кислот (витамина В12 и фолиевой кислоты, например), а также стимулируют выработку жирных кислот, важных для нормального функционирования толстого кишечника.
Пребиотики – это не бактерии, а питательная среда для жизни пробиотиков. Их мы получаем вместе с продуктами питания. Особенность – в способности проникать в толстый кишечник, где они поддаются ферментации и создают идеальные условия для роста полезных бифидо- и лактобактерий.
Детские пробиотики сегодня представлены в огромном разнообразии, их можно купить в любой аптеке. И хотя эти препараты считаются безопасными, назначать их ребенку самостоятельно не стоит. Прежде чем давать их крохе, крайне важно проконсультироваться с врачом и пройти ряд анализов, чтобы точно определить, каких именно микроорганизмов не хватает, а каких – в избытке.
Полезные бактерии для детей до года:
- Лактобактерии для грудничка
Лактобактерии – микроорганизмы, задача которых – угнетать патогенную микрофлору в кишечнике крохи. Обычно ребенок получает их вместе с материнским молоком. Когда этого недостаточно, педиатры назначают специальные препараты, которые помогают восполнить недостаток этих бактерий в организме крохи и восстановить нормальный баланс микрофлоры.
- Бифидобактерии для новорожденных
Микрофлора детского кишечника почти на 90% состоит из бифидобактерий. Новорожденные получают эти микроорганизмы с молоком матери. Важность их невозможно переоценить. Бифидобактерии улучшают перистальтику кишечника, стимулируют формирование лимфоидного аппарата, транспортируют в организм незаменимые аминокислоты, способствуют усвоению кальция и железа – микроэлементов, которые крайне важны для физического и интеллектуального развития ребенка. Если детский организм по тем или иным причинам испытывает нехватку этих бактерий, восполнить их можно с помощью специальных препаратов.
Если у вашего крохи дисбактериоз, не спешите назначать ему пробиотические препараты и живые бактерии для младенцев самостоятельно. Главное правило – не навредить. Необходимость принимать такие препараты может определить только специалист, проведя целый ряд клинических и лабораторных исследований.
Подробнее
Бифидобактерии для новорожденных | Уроки для мам
Известно, что, находясь в материнской утробе, плод получает все необходимые питательные вещества через кровь. Его органы пищеварения и желудочно-кишечный тракт в этом периоде находятся как бы в режиме «ожидания».
Его органы пищеварения и желудочно-кишечный тракт в этом периоде находятся как бы в режиме «ожидания».
Полученные в виде препаратов лакто- и бифидобактерии для новорожденных иногда крайне важны, ведь организму малыша не всегда удается легко приспособиться в новой для него «нестерильной» среде.
Особенности формирования микрофлоры у грудничка
Оказывается, у маленьких детей живет немало различных микроорганизмов в кишечнике. Бифидобактерии и лактобактерии суммарно представляют собой около трети от общей массы испражнений крохи.
Родившись на свет, ребенок попадает в новую незнакомую среду, где большинство населяющих ее микроорганизмов, являются болезнетворными.
«Заселение» ЖКТ младенца преимущественно полезными бифидобактериями гарантирует ему выработку крепкого иммунитета.
Благодаря специально разработанным препаратам, бифидо- и лактобактерии для новорожденных на сегодняшний день доступны в удобной форме. Их назначают малышам для того, чтобы улучшить бактериальный баланс в кишечнике и подавить болезнетворные микроорганизмы.
Недостаток полезных и излишек патогенных бактерий: последствия
К условно патогенным микробам, участвующих в выстраивании микрофлоры младенца, относят следующие:
- клостридии;
- клебсиеллы;
- грибы рода Кандида.
Активное размножение таких микроскопических живых существ начинается тогда, если в организме ребенка недостаточно лакто- и бифидобактерий. Тогда возникает острая потребность в приеме препаратов, способных помочь иммунитету справиться с вредными «жителями» кишечника.
Когда бифидобактерий и лактобактерий становится меньше нормы, и преимущество в численности приобретают патогенные микроорганизмы, в организме грудничка начинаются проблемы. В частности:
- развиваются инфекционные процессы;
- возникает дисбактериоз;
- появляется жидкий стул, срыгивания становятся более частыми;
- возможен явно выраженный дискомфорт в животе у крохи.
Подобное состояние ребенка, как правило, не нуждается в специальной терапии.
Основные показания к применению лекарственных средств
Несмотря на безопасность и безвредность препаратов, содержащих необходимые бактерии, использовать их без особой надобности не следует. Как правило, педиатр назначит крохе соответствующие лекарства, если:
- постоянно возникают кишечные колики;
( Подробнее о том, как избавиться от коликов смотрите в курсе Мягкий животик>>> )
- вздувается периодически живот;
- частые и обильные срыгивания;
- мизерные прибавки в весе;
- расстройства, запоры, отсутствие нормального стула;
- наличие у матери сахарного диабета или серьезных инфекционных заболеваний;
- преждевременные сложные роды;
- беременность сопровождалась гестозом;
- невозможность грудного вскармливания.

Важно отметить, что кормление грудью малыша исключает надобность приема препаратов, содержащих бифидо- или лактобактерии. Все необходимое кроха получит через материнское молоко.
Как выбрать лучший пребиотик или пробиотик?
Чтобы выбрать из множества современных пробиотиков и пребиотиков (первые представляют собой однокомпонентные препараты, а вторые – набор из соответствующих микроорганизмов), в первую очередь, нужна консультация специалиста.
Лакто- и бифидобактерии для детей в должном количестве присутствуют в препаратах, давно завоевавших доверие специалистов. К ним относятся:
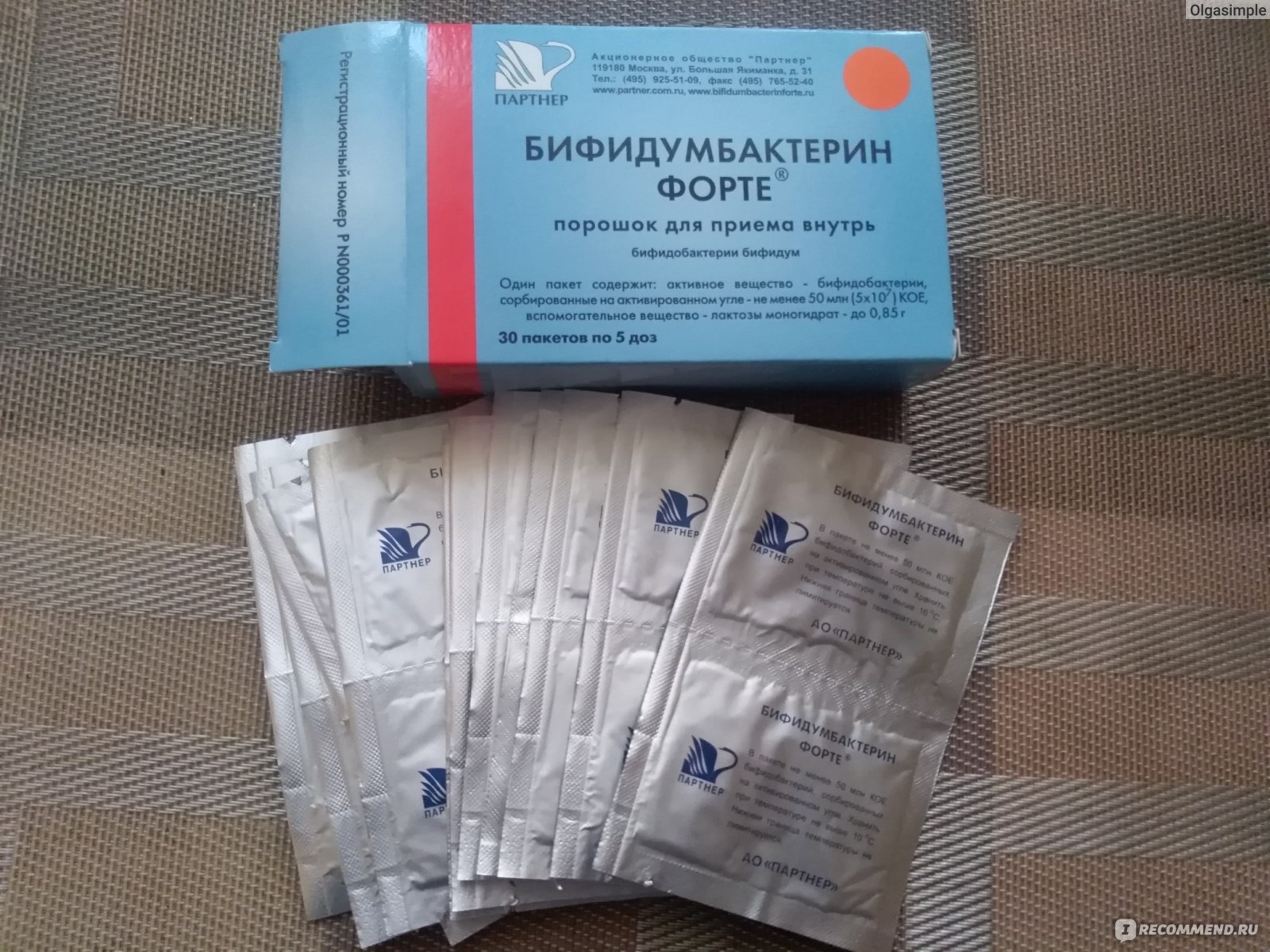
- Бифидумбактерин – лекарство, обладающее достаточно широким спектром действия, помогает не только при лечении дисбактериоза или кишечной инфекции, но и при терапии рахита, диатеза и аллергических высыпаний. В препарате содержатся преимущественно бифидобактерии. Для новорожденных Бифидумбактерин может быть опасен, поскольку в своем составе имеет лактозу. Она нередко служит сильным аллергеном.
 Самый распространенный аналог лекарства – Бифиформ. Подробнее о нем>>>
Самый распространенный аналог лекарства – Бифиформ. Подробнее о нем>>> - Ацилакт – еще один вид пробиотиков, который содержит лактобактерии. Назначают такой препарат при острых кишечных инфекциях, а также в качестве компонента комплексной терапии дерматита атопического. В сравнении с предыдущим пробиотиком, Ацилакт не содержит лактозу.
- Линекс – комплексный пребиотик, содержащий картофельный крахмал, лактозу, бифидобактерии и лактобактерии. Основным предназначением медикамента является лечение дисбактериоза.
- Лактобактерин назначают чаще всего как профилактический медикамент для устранения симптомов дисбактериоза.
Как принимать Лактобактерин?
Если есть сомнения в особенностях использования любого из вышеуказанных лекарственных средств (в т.ч. и Лактобактерина), инструкция по применению для новорожденных поможет избежать весьма распространенных ошибок.
Например, производитель данного медикамента оставляет в ней рекомендации по продолжительности курса лечения. В частности, при дисбактериозах, независимо от этиологии, 3-4 недели считаются наиболее оптимальным сроком.
В частности, при дисбактериозах, независимо от этиологии, 3-4 недели считаются наиболее оптимальным сроком.
При отсутствии ожидаемого результата лечения в течение 2-х недель стоит обратиться к врачам для получения направления на повторное обследование кишечной микрофлоры.
По итогам лабораторных исследований специалист должен произвести корректировку терапевтической схемы. Закрепить полученный лечебный эффект от Лактобактерина или добиться лучшего результата в случаях отсутствия изменений в работе ЖКТ ребенка можно, повторив курс приема медикамента.
Здесь же, в инструкции, производитель подробно описывает, как разводить и пить Лактобактерин для новорожденных:
- Чтобы дать малышу препарат, нужно содержимое флакона растворить кипяченой водой комнатной температуры из расчета 5 мл ( 1 ч.л.) воды на 1 дозу препарата.
- Выпить следует весь объем полученного лечебного раствора за 30-40 минут до приема пищи.
- В течение дня, в зависимости от возраста ребенка, ему может быть назначено от 3 до 5 доз 2-3 раза в сутки.

- Готовую смесь выпить необходимо быстро, иначе полезные свойства в ней быстро нейтрализуются.
Чем отличаются бифидо- от лактобактерий?
Вероятно, различие между бифидо- и лакто- сразу понятным становится немногим. Между тем, первые микроорганизмы населяют кишечник детей, находящихся на естественном вскармливании.
Вторая группа – лактобактерии, по мере уменьшения поступления в организм грудного молока вымещают бифидобактерии и селятся в ЖКТ вместо них. У взрослого человека численность живых бифидо- составляет в 20 раз меньше, чем у младенцев.
Для нормального функционирования органов пищеварения и ЖКТ в достаточном количестве должны присутствовать и лактобактерии, и бифидобактерии.
Разница между ними заключается также в том, что последние способствуют активизации всасывания ценных веществ в пределах желудочно-кишечного тракта. Они же помогают в процессе перистальтики обеспечивать нормальный процесс опорожнения от кишечных масс.
Основной задачей лактобактерий, в отличие от бифидо-, является образование из лактозы молочной кислоты, столь необходимой для полноценного переваривания пищи.
Исходя из опыта применения пробиотиков и пребиотиков для новорожденных и детей грудного возраста (до 1 года), предпочтительнее использовать лекарства в жидкой форме. Капельки сразу начинают действовать, попадая в организм.
Независимо от того, какое средство будет назначено специалистом – Линекс, Бифидумбактерин или Лактобактерин для новорожденных, отзывы о любом из них позволяют не сомневаться в правильности выбора.
Читайте также:
Автор: провизор Евгения Вирт
7 лучших пробиотиков для детей
Создана: 15.06.2019 Обновлено: 01.02.2021 16:58:57*Обзор лучших по мнению редакции expertology.ru. О критериях отбора. Данный материал носит субъективный характер, не является рекламой и не служит руководством к покупке. Перед покупкой необходима консультация со специалистом.
Пробиотики – это средства, содержащие живые микробы, благотворно влияющие на организм хозяина. Раньше под этим термином понимали исключительно препараты. содержащие компоненты нормальной микрофлоры, но сейчас в него включают любые «полезные» бактерии, например, термофильный стрептококк или ацидофильные лактобактерии. Впрочем, насчет пользы пробиотиков ожесточенные споры ведутся уже много лет.
содержащие компоненты нормальной микрофлоры, но сейчас в него включают любые «полезные» бактерии, например, термофильный стрептококк или ацидофильные лактобактерии. Впрочем, насчет пользы пробиотиков ожесточенные споры ведутся уже много лет.
Пробиотики: за и против
Современная медицина относится к ним достаточно настороженно. Если еще недавно дисбактериоз – нарушение соотношения между «полезными» и «вредными» бактериями считался самостоятельным заболеванием, требующим лечения, то сейчас само это понятие объявлено «вне закона».
Дисбиоз – измененный микробный баланс – считается вторичным синдромом, то есть следствием каких-то патологических изменений. Поэтому принимать пребиотики, не устранив причину дисбиоза считается примерно столь же разумным, как разбрасывать семена цветов на заросшем сорняками пустыре: неподготовленная почва не даст семенам прорасти, или, в случае с бактериями, прижиться.
К тому же, до сих пор нет четких критериев восстановления микробиома: современные методы исследования не позволяют точно определить микробный состав внутри организма. Даже между тем, что получается на выходе из кишечника и тем, что доезжает до лаборатории – огромная разница, так как множество видов микроорганизмов просто погибают в изменившихся условиях. Приходится ориентироваться только на симптомы. Поэтому многие специалисты просто объявили любые пробиотики бесполезными и категорически отвергают любые поводы для их использования.
Даже между тем, что получается на выходе из кишечника и тем, что доезжает до лаборатории – огромная разница, так как множество видов микроорганизмов просто погибают в изменившихся условиях. Приходится ориентироваться только на симптомы. Поэтому многие специалисты просто объявили любые пробиотики бесполезными и категорически отвергают любые поводы для их использования.
Тем не менее, заметим, что эксперты Всемирной Гастроэнтерологической Ассоциации все же считают пробиотики полезными. Например, применение пробиотических препаратов в комплексной терапии достоверно сокращает тяжесть и длительность острой инфекционной диареи (поноса) у детей. А смесь из 4 видов пробиотиков и 4 видов волокон клетчатки уменьшает выраженность печеночной энцефалопатии.
Всемирная Гастроэнтерологическая ассоциация приводит следующие показания для применения пробиотиков у детей:
- Профилактика и лечение колик у новорожденных.
- Лечение острого гастроэнтерита или говоря простым языком, пищевого отравления.

- Профилактика антибиотикоассоциированной диареи.
- Профилактика кишечных инфекций у детей, посещающих детские сады.
- Комплексное лечение болезней, вызванных хеликобактерией (гастриты, язвы желудка и двенадцатиперстной кишки, которые сейчас нередки и у детей).
- Комплексная терапия функциональных расстройств, связанных с болью в животе (например, синдрома раздраженного кишечника). Это состояния, при которых пациенты жалуются на боли, но при обследовании воспалительных или других изменений в желудочно-кишечном тракте врачи не обнаруживают.
- Комплексная терапия язвенного колита.
- Профилактика атопического у детей с наследственной предрасположенностью (один или оба родителя страдают нейродермитом (экземой), бронхиальной астмой или аллергическим насморком).
- Уменьшение выраженности симптомов связанных с непереносимостью лактозы.
Исходя из этих показаний, а также рекомендованных к использованию штаммов бактерий, мы и составляли рейтинг лучших пробиотиков для детей. Эти препараты безрецептурны и для профилактики проблем или в экстренных ситуациях, таких как пищевое отравление, их можно принимать до обращения к врачу. Но в любом случае консультация специалиста необходима. Поэтому, чтобы не провоцировать читателей на самолечение по интернету, мы разделили предлагаемые пробиотики на группы не по показаниям, а по возрасту предполагаемых потребителей.
Эти препараты безрецептурны и для профилактики проблем или в экстренных ситуациях, таких как пищевое отравление, их можно принимать до обращения к врачу. Но в любом случае консультация специалиста необходима. Поэтому, чтобы не провоцировать читателей на самолечение по интернету, мы разделили предлагаемые пробиотики на группы не по показаниям, а по возрасту предполагаемых потребителей.
Но для тех наших читателей, которые не боятся латинских названий, приводим конкретные штаммы бактерий, упомянутых в рекомендациях Всемирной Гастроэнтерологической Ассоциации и ситуации, в которых они наиболее эффективны:
- LGG или Lactobacillus rhamnosus GG – рекомендована для профилактики и в комплексном лечении острого гастроэнтерита, внутрибольничных инфекций и инфекций у детей, посещающих детский сад, функциональных гастроэнтерологических расстройств. Сейчас это одна из наиболее хорошо изученных и популярных бактерий, доказавших эффективность по данным исследований.

- Lactobacillus reuteri – наравне с LGG одна из самых хорошо изученных бактерий, особенно в педиатрии. Оптимальная для профилактики и лечения младенческих колик, также применяется для лечения острого гастроэнтерита и профилактики инфекций у детей, посещающих организованные коллективы. Может использоваться для профилактики атопического дерматита и некротического энтероколита у детей с предрасположенностью.
- Saccharomyces boulardii. Как и два предыдущих штамма может применяться для лечения острого гастроэнтерита. Также эффективна в профилактике антибиотико-ассоциированной диареи, некротического энтероколита, при эрадикации хеликобактерии.
- Streptococcus thermophilus эффективен для уменьшения симптомов непереносимости лактозы (и в этом качестве он может применяться в составе обычного термически необработанного йогурта). Также может использоваться в комплексной терапии функциональных расстройств ЖКТ и язвенного колита.
- Bifidobacterium bifidum может использоваться для профилактики внутрибольничной диареи, некротизирующего энтероколита у недоношенных.
 У детей постарше и взрослых – в комплексной терапии синдрома раздраженного кишечника.
У детей постарше и взрослых – в комплексной терапии синдрома раздраженного кишечника.
Как видим, список бактерий с доказанной исследованиями эффективностью довольно короткий. Поэтому в представленном далее рейтинге лучших пробиотиков для детей читатели не обнаружат многих широко разрекламированных пробиотиков или препаратов, содержащих комплекс из полудюжины или более бактерий. Когда речь идет о лекарствах или БАД «больше» далеко не означает «лучше».
Рейтинг лучших пробиотиков для детей
Лучшие пробиотики для детей до трех лет
Препараты для малышей этого возраста должны быть в каплях или порошке, предназначенном для растворения. Считается, что маленький ребенок не может проглотить таблетку и, тем более капсулу, рискуя поперхнуться. По составу же средства для детей этой группы нередко ничем не отличаются от препаратов, предназначенных для других возрастов и нередко бывает достаточно вскрыть капсулу и растворить полученный порошок в молоке или воде. Но официально педиатры не имеют права рекомендовать подобные методы. Поэтому мы выделили препараты для детей до трех лет в отдельную группу рейтинга лучших пробиотиков.
Но официально педиатры не имеют права рекомендовать подобные методы. Поэтому мы выделили препараты для детей до трех лет в отдельную группу рейтинга лучших пробиотиков.
Аципол малыш
Рейтинг пробиотика: 4.9
Масляная взвесь содержит Lactobacillus rhamnosus и Bifidobacterium longum, который поддерживает и усиливает действие лактобактерий. Перед употреблением флакон нужно встряхнуть чтобы равномерно распределить взвесь микроорганизмов. Можно использовать для детей с рождения. Рекомендуется принимать по 5 капель в сутки во время еды, смешав с грудным молоком или молочной смесью. При такой схеме флакона в 4.5 мл хватает на рекомендованный производителем курс лечения в 14 дней. Хранить открытый флакон можно не более 3 недель при комнатной температуре или в холодильнике (но не морозилке!).
Достоинства
- содержит штамм лактобактерий эффективный для профилактики и лечения младенческих колик, острых гастроэнтеритов;
- хватает на курс лечения,
- если верить производителю, достаточно 14 дней приема,
-
можно хранить вне холодильника, брать с собой.

Примадофилус Детский Реутери
Рейтинг пробиотика: 4.7
50 г порошка, содержащего Бифидобактерии Bifidobacterium longum, Bifidobacterium infantis, лактобактерии Lactobacillus acidophilus, Lactobacillus reuteri, Lactobacillus rhamnosus упакованы в пластиковую банку. Основной эффект обеспечивают 2 последних штамма, остальные работают как синергетики, то есть усиливают эффект. Предназначен для детей с рождения и до 5 лет, в сутки достаточно 1 чайной ложки (3 г.) средства, которую нужно развести водой, соком, грудным молоком или молочной смесью.
Из недостатков нужно отметить относительно высокую цену упаковки, которой хватает чуть более чем на 15 дней использования, при рекомендованном курсе в 2 – 4 недели
Достоинства
- не требует особых условий хранения,
- упаковки хватает на минимальный курс,
-
разрешен с рождения.

Нормобакт L
Рейтинг пробиотика: 4.5
Содержит Lactobacillus rhamnosus GG и фруктоолигосахариды – питательные вещества для этих бактерий. Разрешен к применению у детей старше 1 месяца. Содержимое пакетика надо растворить в 100 мл воды, смеси или сцеженного грудного молока – и этот момент, при всех достоинствах пробиотика, вызывает немало вопросов. Ежедневно в течение двух или более недель спаивать ложечкой 100 мл жидкости голодному грудному ребенку – не самое простое занятие. Напомним, что детям на грудном вскармливании не рекомендуют давать что бы то ни было из бутылочки с соской. Добыть еду оттуда проще, и малыш может отказаться брать грудь.
Рекомендованный курс 2 – 3 недели.
Достоинства
- в составе есть вещества. поддерживающие жизнедеятельность бактерий.
Недостатки
-
нужно растворять в 100 мл жидкости.

- высокая цена.
BioGaia, ProTectis, Baby, With Vitamin D, Digestive Health, Probiotic Supplement, 0.34 fl oz (10 ml)
Рейтинг пробиотика: 4.3
Мы включили это средство в рейтинг лучших пробиотиков для детей несмотря на то, что его можно заказать только в интернете. Это один из немногих препаратов, сочетающих пробиотик (лактобактерии Рейтери) с витамином D. Такого рода комплексы очень удобны для родителей, избавляя их от путаницы и размышлений, какой препарат малышу уже дали, а какой нет. Разрешен с рождения, в сутки ребенку до года достаточно 5 капель. Перед употреблением пузырек обязательно нужно взбалтывать, чтобы равномерно распределить микробную взвесь в масле. Средство можно хранить в холодильнике, но нельзя замораживать.
Тюбика хватает примерно на 1,5 месяца, если принимать согласно инструкции по 5 капель в сутки.
Можно принимать с рождения.
Достоинства
- комплексный эффект: способствует уменьшению интенсивности колик и профилактике гиповитаминоза Д.
Недостатки
- нужно заказывать в интернете и ждать доставки,
- относительно высокая цена.
Лучшие пробиотики для подросших детей
Как мы уже упоминали, эти препараты в основном отличаются только формой выпуска. С другой стороны, нередко дать ребенку таблетку или капсулу куда проще, чем разводить в воде порошок или смешивать капли с молоком.
Бифидумбактерин 1000
Рейтинг пробиотика: 4.8
Содержит Bifidobacterium bifidum и лактулозу – вещество, которое служит пищей для нормальной микрофлоры. Поскольку это таблетки, разрешены к применению у детей старше 3 лет. Принимать по 1 таблетке 3 раза в день во время еды, в течение месяца. Несмотря на то, что при такой схеме применения упаковки хватает на 10 дней, из-за невысокой цены этого пробиотика он все равно оказывается экономичнее большинства аналогичных средств.
Достоинства
- содержит вещество, поддерживающее размножение нормальной микрофлоры.
- экономичность.
Недостатки
- нужно принимать 3 раза в день, что не совсем удобно.
Регидрон Био
Рейтинг пробиотика: 4.6
Это средство предназначено для восстановления водно-электролитного баланса. Проще говоря – оно нужно чтобы отпаивать детей (и взрослых) при рвоте и поносе, восстанавливая потерянную жидкость и соли. Поэтому Lactobacillus rhamnosus GG и мальтодекстрина, стимулирующего рост и размножение полезных бактерий, оно содержит глюкозу, соли натрия и калия.
В упаковке 5 парных пакетов: с, собственно, пробиотиком и с электролитами. Оба пакета надо растворить в стакане чистой питьевой воды и принять внутрь. Напоминаем, при кишечной инфекции или пищевом отравлении, чтобы избежать рвоты, пить надо не залпом, а часто и понемногу: по несколько глотков или 1 – 2 чайной ложке, если речь идет о детях.
Разрешено к применению с возраста 3 лет.
Достоинства
- комплексное действие: восстанавливает микробный и водно-электролитный баланс.
Недостатки
- всего 5 пар саше в упаковке.
- высокая цена в пересчете на день приема.
Йогулакт
Рейтинг пробиотика: 4.4
Содержит 4 вида бактерий, из которых нам наиболее интересны Lactobacillus rhamnosus и Streptococcus thermophilus. Кроме бактерий, в состав этого пробиотика добавлен порошок молочной сыворотки и лактоза, обеспечивающие питание для бактерий. Так что, пожалуй, этот препарат можно назвать неким концентратом йогурта. Детям от года до 6 лет рекомендуется по 1 капсуле 1 в день, детям от 6 до 14 лет – 1 капсула 2 раза в день, после 14 лет – по 1 х 3 раза в день. Средство можно применять и детям от 3 месяцев, но для этого капсулу нужно разделить и растворить в молоке, что не очень удобно. Поэтому мы поместили его в раздел рейтинга лучших пробиотиков для детей старше 3 лет.
Поэтому мы поместили его в раздел рейтинга лучших пробиотиков для детей старше 3 лет.
Рекомендованный производителем курс 1 – 2 месяца, в упаковке 30 капсул. При том что цена за упаковку сравнима со стоимостью других пробиотиков, курс применения для ребенка до 6 лет обойдется дешевле, чем использование сходных препаратов этого типа.
С другой стороны не можем не отметить, что хотя термофильный стрептококк и снижает проявления непереносимости лактозы, однозначно утверждать, что дети с подобной проблемой нормально перенесут пробиотик с этим олигосахаридом было бы слишком рискованно.
Достоинства
- содержит вещества, поддерживающие рост и размножение бактерий,
- экономичность.
Недостатки
- не рекомендован при непереносимости лактозы.
| Оцените статью | |
Всего голосов: 0, рейтинг: 0 |
 Перед покупкой необходима консультация со специалистом.
Перед покупкой необходима консультация со специалистом.Пробиотики для детей для кишечника: список лучших препаратов
Пробиотики – это культуры бактерий, составляющие основу микрофлоры здорового кишечника. Организм малыша еще не полностью адаптирован к неблагоприятным агрессивным воздействиям. Он должен постоянно приноравливаться к появлению в рационе незнакомых продуктов. Поэтому пробиотики для детей играют особенную роль. Они необходимы для коррекции дисбактериоза и поддержания неокрепшей иммунной защиты.
История появления
Идея целенаправленного улучшения микрофлоры ЖКТ с помощью употребления продуктов, содержащих бактерии молочной кислоты, принадлежит И.И. Мечникову. Он предложил лечебную диету на основе простокваши, ферментированной Lactobacillus bolgaricus.
С развитием фармакологии теория Мечникова воплотилась в создание нового класса микробных препаратов, содержащих бифидо- и лактобактерии. Их применение во врачебной практике началось в 30-е годы 20 века. Однако название «пробиотик» было придумано гораздо позже. В нем сочетаются латинские и греческие слова «pro» и «bio». Вместе они значат «для жизни». Знакомый нам термин был предложен в 1977 году профессором микробиологии Р.В. Паркером. Он придумал его в качестве антагониста к слову «антибиотик», которое переводится как «против жизни».
Их применение во врачебной практике началось в 30-е годы 20 века. Однако название «пробиотик» было придумано гораздо позже. В нем сочетаются латинские и греческие слова «pro» и «bio». Вместе они значат «для жизни». Знакомый нам термин был предложен в 1977 году профессором микробиологии Р.В. Паркером. Он придумал его в качестве антагониста к слову «антибиотик», которое переводится как «против жизни».
Механизм действия
Пробиотики — это не химические лекарства, а иммунокорректоры микробиологического баланса человека. Для детей с незрелой пищеварительной системой они могут выступать в качестве «настройщика» правильного формирования кишечной микрофлоры. Роль кишечника для роста здорового малыша переоценить трудно. Этот орган наиболее важен для поддержания иммунитета, ведь именно в нем находится примерно 60% всех иммунных комплексов организма.
После приема внутрь, микроорганизмы достигают кишечника, где прикрепляются к слизистой оболочке. Вокруг них начинают расти колонии одноименных клеток. Таким образом, количество здоровой микрофлоры возрастает, а патогенной – снижается.
Вокруг них начинают расти колонии одноименных клеток. Таким образом, количество здоровой микрофлоры возрастает, а патогенной – снижается.
Функции пробиотиков
Нормальная микрофлора, образующая после приема пробиотических препаратов, выполняет в организме ребенка несколько существенных задач:
- Подавляет рост чужеродных бактерий.
- Корректирует иммунный статус детского организма, ускоряя синтез специфических иммуноглобулинов.
- Способствует нормализации функций пищеварения.
- Облегчает полноценное усвоение питательных веществ, в том числе кальция, который незаменим для построения крепкого костного скелета ребенка.
- Помогает выводить токсические вещества, образуемые патогенной флорой, в том числе при вирусных и бактериальных инфекциях.
- Выступает катализатором производства витаминов группы В и К.
Классификация пробиотиков
Российскими медицинскими органами разрешено более ста видов препараторов, в составе которых присутствуют полезные бактерии для детей разного возраста. Основная классификация проводится по роду составляющих бактерий.
Основная классификация проводится по роду составляющих бактерий.
Список пробиотиков по типу бактерий
- Escherichia Coli,
- лактобактерии,
- бифидобактерии,
- сахаромицеты,
- дрожжеподобные грибки,
- энтерококки.
Поколения современных пробиотиков
Еще одна систематизация учитывает хронологию появления более совершенных видов пробиотиков. Ученые фармакологи постоянно ведут поиск лучших пробиотических культур. Научные изыскания проводятся с целью выявления более устойчивых видов полезных бактерий, а также повышения их усвояемости организмом.
I поколение
К первой группе относят препараты какого-либо одного вида, например, лакто- или бифидобактерии.
II поколение
Пробиотики на основе споровых бактерий и дрожжеподобных грибков. Особенностью этих микроорганизмов является то, что они нетипичны для кишечника. К этому классу относятся Бактисубтил и Энтерол. Примерно через месяц после приема они полностью нейтрализуются организмом. Тем не менее, доказано их антагонистическое воздействие на патогенную флору.
Особенностью этих микроорганизмов является то, что они нетипичны для кишечника. К этому классу относятся Бактисубтил и Энтерол. Примерно через месяц после приема они полностью нейтрализуются организмом. Тем не менее, доказано их антагонистическое воздействие на патогенную флору.
III поколение
Полипрепараты, имеющие в составе совокупность нескольких микроорганизмов (Бифиформ Малыш, Линекс).
IV поколение
Пробиотики, которые содержат полезные бактерии, закрепленные на природном носителе — сорбенте. К ним относят Пробифор, Флорин форте.
V поколение
Симбиотики — многокомпонентные биопрепараты, содержащие комплекс «пробиотик+пребиотик». Пребиотики – неперевариваемые вещества, которые служат своего рода кормом для полезных бактерий. За счет подобных добавок они действуют более интенсивно. Примеры препаратов последнего поколения — Аципол и Бифилиз.
Лекарственные формы
Первоначально на фармакологическом рынке были представлены только сухие пробиотические культуры. После высушивания бактерий их жизнедеятельность приостанавливается. При попадании в благоприятную жидкую среду они снова активируются. Явное преимущество сухих форм – возможность длительного хранения (около двух лет).
После высушивания бактерий их жизнедеятельность приостанавливается. При попадании в благоприятную жидкую среду они снова активируются. Явное преимущество сухих форм – возможность длительного хранения (около двух лет).
Пробиотики в жидком виде содержат питательный раствор с живыми культурами бактерий. Это самые быстродействующие биопрепараты. Они начинают работать незамедлительно после того, как достигают кишечника.
Пробиотики для новорожденных
После рождения младенец начинает активно адаптироваться к непривычным для него условиям жизни. Наибольшую нагрузку испытывает его система пищеварения, которая встречается с множеством незнакомых микробов. Постепенно кишечник малыша начинает колонизироваться полезной микрофлорой. Их лучшим источником служит материнское молоко.
Искусственные молочные смеси не способны в полной мере восполнить необходимые микроэлементы. Поэтому у детей, лишенных грудного молока, возрастает риск развития дисбактериоза и других заболеваний.
При появлении первых признаков неблагополучия (кишечных колик, жидкого стула) педиатры назначают грудничкам безлактозные пробиотики. Физиологические особенности новорожденных таковы, что им можно давать исключительно бифидосодержащие препараты.
Малышам до года рекомендованы пробиотики в жидком виде. Они содержат максимальную концентрацию удобоваримых живых микроорганизмов и легко дозируются.
При каких детских болезнях помогают пробиотики?
Клинические исследования в области педиатрии подтвердили позитивный эффект пробиотических культур при многих заболеваний. Среди них:
1. Дисбактериоз.
Какой пробиотик выбрать, зависит от степени нарушения баланса микрофлоры. При незначительных отклонениях от нормы рекомендованы однокомпонентные биопрепараты. Причем дефицит лактобактерий не означает, что следует использовать только лактосодержащие составы. При дисбиозе II — III степени хорошие результаты показывают пробиотики последних поколений.
2. Диарея, ассоциированная с терапией антибиотиками.
В случае таких заболеваний у детей, как воспаление легких, гнойный отит, не обойтись без антибиотиков. При этом вместе с болезнетворными бактериями гибнет практически вся микрофлора кишечника. Нежелательным эффектом противомикробной терапии чаще всего становится диарея.
Чтобы избежать неблагоприятного симптома, врачи рекомендуют использовать схему лечения «антибиотик+пробиотик». При этом используются препараты, обладающие резистентностью к антибиотикам. По отзывам специалистов, достаточную степень устойчивости продемонстрировали лактобациллы, энтерококки и сахаромицеты.
3. ОРВИ, грипп.
Пробиотики – не только лечебное, но и отличное профилактическое средство. Курс полезных бактерий и витаминов поможет справиться с сезонными респираторными инфекциями. При этом предпочтение отдается комбинированным пробиотикам, имеющим хорошие иммунорегулирующие свойства.
Помимо перечисленных состояний, пробиотические препараты назначают в комплексной терапии следующих заболеваний у детей:
- Ротавирусной инфекции.
- Сальмонеллеза.
- Пищевых дерматозов.
- Воспалительных заболеваний ЖКТ, в частности вызываемых Helicobacter pylori.
- ЛОР-патологий: фарингитов, тонзиллитов, синуситов и т. д.
Эффективность пробиотических препаратов
Судя по отзывам родителей, эффективность полезных бактерий в лечении детского дисбактериоза неоднозначна. Не существует супер-пробиотика, способного гарантированно помочь в большинстве случаев. Многообещающая приставка, используемая некоторыми производителями детских пробиотиков, не более чем рекламный трюк. В их составе все те же знакомые нам лакто- и бифидобактерии, используемые много десятилетий назад.
Ответ на этот вопрос следует искать в плоскости диагностики первопричин, вызывающих нарушение микрофлоры. Если речь идет о таких безусловных факторах, как прием антибиотиков или кишечная инфекция, то грамотно подобранный врачом биопрепарат безусловно справится с поставленной задачей. Однако существуют и другие провоцирующие моменты, негативно влияющие на функцию пищеварения у детей. К ним относится:
Если речь идет о таких безусловных факторах, как прием антибиотиков или кишечная инфекция, то грамотно подобранный врачом биопрепарат безусловно справится с поставленной задачей. Однако существуют и другие провоцирующие моменты, негативно влияющие на функцию пищеварения у детей. К ним относится:
- нарушение режима питания;
- раннее введение в меню пищи, не подходящей по возрасту;
- употребление продуктов, содержащих большое количество химических добавок, газированной воды, фаст-фуда и пр.
В этих случаях прием биопрепаратов восстановит микрофлору только при условии коррекции рациона питания.
Современные исследования
Доказана ли эффективность лечения пробиотиками у детей? Безусловно. Одно из клинических испытаний проводилось в 2005 году в Израиле. В нем принимали участие 14 педиатрических клиник по всей стране. В наблюдении участвовали дети, подверженные респираторным заболеваниям. В результате длительного приема лакто- и бифидобактерий ОРВИ стали протекать у них в облегченной форме, без серьезных осложнений. Это позволило снизить необходимость применения антибиотиков. При этом было отмечено уменьшение продолжительности лихорадочных состояний и предотвращение кишечных расстройств.
В результате длительного приема лакто- и бифидобактерий ОРВИ стали протекать у них в облегченной форме, без серьезных осложнений. Это позволило снизить необходимость применения антибиотиков. При этом было отмечено уменьшение продолжительности лихорадочных состояний и предотвращение кишечных расстройств.
Новые научные разработки связаны с культивированием полезных бактерий, полученных из организма пациента. Идентичность полученных биопрепаратов собственной кишечной флоре позволит в недалеком будущем продуктивно лечить иммунодефициты, аллергические проявления и другие детские заболевания. Некоторые прогрессивные ученые-медики прогнозируют, что не за горами эпоха, когда пробиотики вытеснят антибиотики.
Мне нравится 1
Похожие посты
Оставить комментарий
Польза бифидо и лактобактерий
Бактерии бывают не только плохими, но и хорошими, полезными для организма. Нет, даже не так. Необходимыми для здоровья человека являются бифидо и лактобактерии.
Нет, даже не так. Необходимыми для здоровья человека являются бифидо и лактобактерии.
Что это такое пробиотики с лактобактериями и для чего они нужны?
Бифидо и лактобактерии представляют собой основную микрофлору кишечного тракта человека. Одним словом их можно назвать пробиотики – это те бактерии, у которых имеется доказанный положительный эффект для здоровья человека.
Положительный эффект связан с тем, что пока лакто и бифидобактерии проходят через желудочно-кишечный тракт, они участвуют в процессе пищеварения, метаболизме, укреплении иммунитета, закисляют внутреннюю среду, препятствуя росту патогенных бактерий. Также полезные бактерии способствуют выработке незаменимых аминокислот, витаминов группы «В», витамина «К» и «Д», способствуют усвоению других витаминов и микроэлементов, кальция, железа.
Регулярно употребляя кисломолочные продукты можно снизить уровень холестерина, риск заболевания раком, а также восстановить работу печени и почек. Восполнить недостаток бифидобактерий помогут также препараты, содержащие в составе бифидо и лактобактерии.
Восполнить недостаток бифидобактерий помогут также препараты, содержащие в составе бифидо и лактобактерии.
Бифидо и лактобактерии для детей
Больше всего недостаток лактобактерий испытывают дети. У детей частой проблемой является дисбактериоз (нарушение нормального соотношения бактерий в кишечнике). Именно из-за дисбактериоза большинство малышей мучаются коликами в животе.
Как можно влиять на микрофлору ребенка?
Это правильное питание, свежие овощи и фрукты, кисломолочные продукты, применение пре- и пробиотиков. Полезные бактерии укрепляют иммунитет, сглаживают повышенные спортивные, учебные и сезонные нагрузки. Пробиотики с лактобактериями следует употреблять для улучшения состава кишечной микрофлоры и для ее поддержки.
Бифидо и лактобактерии препараты
Существуют препараты пробиотиков, которые могут применяться в тех случаях, когда нет возможности использовать кисломолочные продукты, после курсов антибиотикотерапии, после переездов, при посещении детского сада, во время отпуска на море. Препараты изготавливаются с использованием живых бифидо-, лакто- и других полезных бактерий-симбионтов человека, которые накапливаются в препарате, одновременно гидролизуя натуральное молоко. Форма выпуска обеспечивает удобство и простоту в применении.
Препараты изготавливаются с использованием живых бифидо-, лакто- и других полезных бактерий-симбионтов человека, которые накапливаются в препарате, одновременно гидролизуя натуральное молоко. Форма выпуска обеспечивает удобство и простоту в применении.
Для самых маленьких выпускают Симбион и Симби-М, такие бифидо и лактобактерии для новорожденных безопасны и не вызывают аллергии, а даже, наоборот, рекомендованы к применению для лечения аллергических кожных болезней.
Подробно ознакомиться с каждым продуктом и приобрести пробиотики можно в нашем интернет-магазине «Островок детства».
Будьте здоровы!
Примадофилус детский для детей от 0 лет
1 А.В. Чаплин, Л.И. Кафарская и соавт. Изучение видового разнообразия бактерий рода
Bifidobacterium кишечной микрофлоры с использованием метода MALDI-TOF
масс-спектрометрии. АКТУАЛЬНЫЕ ВОПРОСЫ МИКРОБИОЛОГИИ. ВЕСТНИК РАМН/2015/ 70 (4).
АКТУАЛЬНЫЕ ВОПРОСЫ МИКРОБИОЛОГИИ. ВЕСТНИК РАМН/2015/ 70 (4).
Underwood MA et al. Bifidobacterium longum subspecies infantis: champion colonizer of the infant gut. Pediatr Res. 2015 January.
3Мухина Ю.Г., Шумилов П.В., Дубровская М.И., Ипатова М.Г. Синдром персистирующих диарей у детей. //Эффективная Фармакотерапия. Гастроэнтерология 3/2011.
4 European Society for Padiatric Gastroenterology, Hepatology and Nutrition/European
Society for Pediatric Infection Diseases. Evidence-based guidelines for the
management of acute gastroenteritis in children in Europe. J. Pediatric Gstroenter.
Nutr.2008; 46 (Suppl.2).
Evidence-based guidelines for the
management of acute gastroenteritis in children in Europe. J. Pediatric Gstroenter.
Nutr.2008; 46 (Suppl.2).
«Особенности течения и лечения ротавирусной инфекции у детей»// В. Н. Тимченко, Е. Б. Павлова, М. Д. Субботина, ЛЕЧАЩИЙ ВРАЧ, СЕНТЯБРЬ 2011, № 8
6 L.M. Foster, T.A. Tompkins and W.J. Dahl (2011). A comprehensive post-market review
of studies on a probiotic product containing Lactobacillus helveticus R0052 and
Lactobacillus rhamnosus R0011. Beneficial Microbes, December 2011; 2(4).
Beneficial Microbes, December 2011; 2(4).
Engelbrektson, A., et al. (2009). «Probiotics to minimize the disruption of faecal microbiota in healthy subjects undergoing antibiotic therapy.» J Med Microbiol 58(Pt 5): 663-670.
8 Beausoleil, M., et al. (2007). «Effect of a fermented milk combining Lactobacillus
acidophilus Cl1285 and Lactobacillus casei in the prevention of
antibiotic-associated diarrhea: a randomized, double-blind, placebo-controlled
trial. » Can J Gastroenterol 21(11): 732-736.
» Can J Gastroenterol 21(11): 732-736.
Lallemand Internal Report.
10«Восстановление микробиоценоза кишечника в комплексной терапии атопического дерматита у детей»// Мельникова И.Ю., Горюнова М.М.,Самсонова М.В. // «Вопросы современной педиатрии», № 4 за 2007
11 Follad N. et al. Effect of nutrient supplementation on atopic dermatitis in
children: A systematic review of probiotics, prebiotics, formula, and fatty acids. JAMA Dermatol. 2013; 149(3):350-5.
JAMA Dermatol. 2013; 149(3):350-5.
Vanessa Levin-Le Moal et al. Anti-Infective Activities of Lactobacillus Strains in the Human Intestinal Microbiota: from Probiotics to Gastrointestinal Anti-Infectious BiotherapeuticAgents. Clinical Microbiology Reviews 2014; 27(2):167-199.
13 Cazzola et al. (2010b) Efficacy of a synbiotic supplementation in the prevention of
common winter diseases in children: a randomized, double-
blind, placebo-controlled pilot study. Ther Adv Respir Dis 2010b, 4(5).
Ther Adv Respir Dis 2010b, 4(5).
Анализ на дисбактериоз у детей. Как сдавать кал для анализа. Расшифровка результатов анализа на дисбактериоз
Автор
Евтушенко-Сигаева Мария ВячеславовнаВедущий врач
Гастроэнтеролог
Что такое дисбактериоз
В норме состояние микрофлоры кишечника таково, что деятельность вредоносных бактерий успешно подавляется, а количество полезных бактерий соответствует потребностям организма. Но если необходимый баланс нарушается, кишечник перестаёт функционировать правильным образом. Подобное состояние и есть дисбактериоз.
Но если необходимый баланс нарушается, кишечник перестаёт функционировать правильным образом. Подобное состояние и есть дисбактериоз.
Зачем нужен анализ на дисбактериоз
Чтобы подтвердить, что проблемы со здоровьем вызваны дисбактериозом, необходимо сделать анализ на дисбактериоз.
Анализ на дисбактериоз позволяет установить концентрацию и определить соотношение:
- полезных микроорганизмов, таких как лактобактерии, бифидобактерии, кишечная палочка Escherichia coli с нормальными ферментативными свойствами;
- условно-патогенных, т.е. населяющих кишечник, но не всегда приводящих к заболеванию. (энтеробактерии, стафилококки, клостридии, грибы рода Candida). Болезненные проявления, наблюдаются, как правило, лишь в том случае, если количество подобных микроорганизмов резко возрастает и начинает превышать норму;
- патогенных, в норме в кишечнике отсутствующих (шигеллы, сальмонеллы).
Когда назначается анализ на дисбактериоз
Анализ на дисбактериоз назначается:
Анализ на дисбактериоз может назначить врач общей практики (терапевт, семейный врач, педиатр) или гастроэнтеролог.
Как сдавать анализ на дисбактериоз
Материалом для анализа является кал. Кал собирается в стерильный контейнер. Для анализа достаточно около 10 мл (меньше столовой ложки). Важно, чтобы в кал не попала моча. Собранный материал нужно доставить в лабораторию в течение 3-х часов.
Подготовка к анализу кала на дисбактериоз
За 3-4 дня до анализа необходимо прекратить прием слабительных препаратов. Также не следует пользоваться ректальными свечами.
Если Вы проходили рентгенографическое исследование желудка или кишечника с введением рентгеноконтрастного вещества, необходимо будет подождать, пока оно полностью выведется из организма, и только потом собрать материал для анализа. Также для анализа не подходит материал, полученный с помощью клизмы.
Расшифровка результатов анализа на дисбактериоз
Патогенные энтеробактерии – в норме отсутствуют. Их присутствие указывает на острую кишечную инфекцию. Энтеробактерии – сальмонеллы и шигеллы – являются возбудителями серьезного заболевания – дизентерии.
Энтеробактерии – сальмонеллы и шигеллы – являются возбудителями серьезного заболевания – дизентерии.
Бифидобактерии – обеспечивают расщепление и переваривание пищи, усвоение железа, нейтрализацию токсинов. Норма – 109-1010 КОЕ/г, у детей первого года жизни 1010-1011. Существенное снижение количества бифидобактерий – явный признак дисбактериоза.
Лактобактерии – расщепляют лактозу, поддерживают необходимый уровень кислотности толстой кишки, повышают активность фагоцитов – клеток иммунной защиты. Норма: 107-108 КОЕ/г, у детей первого года жизни 106-107.
Кишечная палочка (E.coli) с нормальной ферментативной активностью – препятствует развитию условно-патогенной микрофлоры, вырабатывает витамины группы B, способствует усвоению железа и кальция. Нормальное значение: 107-108 КОЕ/г. Результат ниже нормы может указывать на наличие кишечных паразитов – глистов.
Кишечная палочка (E.coli) со сниженной ферментативной активностью – не причиняет вреда, но и не приносит никакой пользы. В норме кишечная палочка с подобными свойствами должна составлять не более 105 КОЕ/г. Увеличение ее количества является признаком начинающегося дисбактериоза.
В норме кишечная палочка с подобными свойствами должна составлять не более 105 КОЕ/г. Увеличение ее количества является признаком начинающегося дисбактериоза.
Гемолитические кишечные палочки (E.coli) – способны вырабатывать токсины. В норме должны отсутствовать.
Нормы по условно-патогенным микроорганизмам:
- микробы рода протея – менее 102;
- условно-патогенные энтеробактерии – менее 104;
- энтерококки – 105-108, у детей до года 105-107;
- стафилококк золотистый (S.aureus.) и др. гемолитические стафилококки – отсутствуют;
- стафилококки (сапрофитные, эпидермальный) – менее 104;
- грибы рода Candida – менее 103;
- бактероиды – менее 107;
- клостридии – не более 105.
Не занимайтесь самолечением. Обратитесь к нашим специалистам, которые правильно поставят диагноз и назначат лечение.
Оцените, насколько был полезен материал
Спасибо за оценку
Микробиом кишечника младенцев и пробиотики, которые работают
Осенью 2018 года группа исследователей из Института науки Вейцмана в Израиле опубликовала данные о том, что коктейль из 11 штаммов Lactobacillus и Bifidobacterium оказал минимальное немедленное воздействие и не оказывает длительного воздействия на состав кишечного микробиома мышей или людей. Фактически, пробиотические бактерии не были обнаружены ни у одного из четырнадцати взрослых участников после прекращения приема добавок.
Фактически, пробиотические бактерии не были обнаружены ни у одного из четырнадцати взрослых участников после прекращения приема добавок.
Эти недавние открытия получили довольно много прессы и усилили растущее мнение среди общественности о том, что пробиотики — живые микроорганизмы, которые, как предполагается, приносят пользу человеку-хозяину, — не работают. Десятилетия исследований показали, что большинство пробиотиков не способны колонизировать кишечник человека и не оказывать ему длительного воздействия. Некоторые критики даже предположили, что пробиотики не могут быть многообещающим средством для лечения болезней или иного улучшения здоровья и благополучия. Но мы подумали: «Не выбрасывайте ребенка вместе с водой из ванны — наша работа показывает, что правильный пробиотик может работать в кишечнике младенца.Результаты, опубликованные нами в 2017 году, показали, что кормление грудных детей пробиотиком, который включал в себя специфический штамм Bifidobacterium longum подвид infantis ( B. infantis EVC001), приводило к 10-миллионному увеличению среднего уровня фекальных B. Infantis . Этот уровень сохранялся в течение одного месяца после употребления добавки, а уровни оставались повышенными в течение одного года после лечения.
infantis EVC001), приводило к 10-миллионному увеличению среднего уровня фекальных B. Infantis . Этот уровень сохранялся в течение одного месяца после употребления добавки, а уровни оставались повышенными в течение одного года после лечения.
Чтобы понять, почему микробиом кишечника младенца так сильно изменился за последнее столетие, мы попытались понять, как формируется микробиом кишечника младенца.
Колонизация кишечника младенца B. infantis имела защитные эффекты, такие как снижение уровней потенциальных кишечных патогенов и фекального эндотоксина, компонента внешней мембраны грамотрицательных организмов, вызывающих воспаление. Мы также обнаружили, что у младенцев, получавших пробиотик B. infantis , уменьшилось воспаление кишечника по сравнению с младенцами на грудном вскармливании, которые не получали пробиотик. Микробиомы кишечника младенцев B. infantis содержали меньше генов устойчивости к антибиотикам — признак меньшего количества патогенов — и демонстрировали меньшую деградацию муцина, гликопротеина, секретируемого кишечным эпителием, который защищает эпителиальные клетки от прямого контакта с кишечными микробами. Эти данные подтверждают более ранние выводы Марка Андервуда и его коллег из Калифорнийского университета в Дэвисе. В 2013 году команда Андервуда показала, что кормление недоношенных новорожденных другим штаммом, B. infantis ATCC15697, привело к большему увеличению фекальных Bifidobacterium и снижению уровней потенциальных патогенов по сравнению с младенцами, получавшими пробиотик, содержащий B. lactis .
Эти данные подтверждают более ранние выводы Марка Андервуда и его коллег из Калифорнийского университета в Дэвисе. В 2013 году команда Андервуда показала, что кормление недоношенных новорожденных другим штаммом, B. infantis ATCC15697, привело к большему увеличению фекальных Bifidobacterium и снижению уровней потенциальных патогенов по сравнению с младенцами, получавшими пробиотик, содержащий B. lactis .
В то время как научное сообщество и общественность сталкивались с неоднократными выводами о том, что пробиотические добавки, принимаемые взрослыми, не всегда эффективно колонизируют кишечник или приносят пользу, теперь у нас есть убедительные доказательства того, что микробиомы кишечника младенцев невероятно хорошо реагируют на определенные штаммы B. .Infantis . Вопрос был в том, почему.
Происхождение микробиома
Подсказки о микробиоме младенцев можно найти в статьях столетней давности о комменсальных бактериях в детских фекалиях. У. Р. Логан, клинический патолог из исследовательской лаборатории Королевского колледжа врачей в Эдинбурге, был первым, кто 100 лет назад сообщил, что бактерии в фекальных мазках младенцев, находящихся на грудном вскармливании, представляют собой почти монокультуру Bacillus bifidus , которая является сегодня известен как род Bifidobacterium .Напротив, в мазках кала младенцев, вскармливаемых смесями того времени, было обнаружено разнообразие бактерий, в том числе относительно небольшое количество Bifidobacterium , что больше похоже на микробное разнообразие, обнаруженное у младенцев, вскармливаемых грудью сегодня.
У. Р. Логан, клинический патолог из исследовательской лаборатории Королевского колледжа врачей в Эдинбурге, был первым, кто 100 лет назад сообщил, что бактерии в фекальных мазках младенцев, находящихся на грудном вскармливании, представляют собой почти монокультуру Bacillus bifidus , которая является сегодня известен как род Bifidobacterium .Напротив, в мазках кала младенцев, вскармливаемых смесями того времени, было обнаружено разнообразие бактерий, в том числе относительно небольшое количество Bifidobacterium , что больше похоже на микробное разнообразие, обнаруженное у младенцев, вскармливаемых грудью сегодня.
Эти поразительные изменения в составе микробиома кишечника, наблюдавшиеся за последнее столетие, согласуются с нашими недавними выводами о том, что pH кала у младенцев на грудном вскармливании резко увеличился с pH 5,0 до 6,5 за последние 100 лет, что связано с очевидной потерей из поколения в поколение Bifidobacterium и сопутствующее увеличение числа потенциальных патогенов. Снижение уровня Bifidobacterium в микробиоме кишечника младенцев, находящихся на грудном вскармливании, вероятно, является непреднамеренным последствием медицинской практики, которая может спасти жизни, но не поддерживает рост Bifidobacterium . Такая медицинская практика включает лечение антибиотиками, к которым чувствительны Bifidobacterium ; детская смесь, не содержащая того питания, которое требуется бактериям; и большее количество родов путем кесарева сечения, которые обходят путь, по которому бактерия передается от матери к ребенку.Эти медицинские практики связаны с повышенным риском аллергических и аутоиммунных заболеваний, распространенных в богатых ресурсами странах. Предполагается, что снижение уровня Bifidobacterium и увеличение провоспалительных микробов в раннем младенчестве происходит во время критического периода развития иммунной системы и, таким образом, может увеличивать риск иммунных заболеваний в более позднем возрасте.
Снижение уровня Bifidobacterium в микробиоме кишечника младенцев, находящихся на грудном вскармливании, вероятно, является непреднамеренным последствием медицинской практики, которая может спасти жизни, но не поддерживает рост Bifidobacterium . Такая медицинская практика включает лечение антибиотиками, к которым чувствительны Bifidobacterium ; детская смесь, не содержащая того питания, которое требуется бактериям; и большее количество родов путем кесарева сечения, которые обходят путь, по которому бактерия передается от матери к ребенку.Эти медицинские практики связаны с повышенным риском аллергических и аутоиммунных заболеваний, распространенных в богатых ресурсами странах. Предполагается, что снижение уровня Bifidobacterium и увеличение провоспалительных микробов в раннем младенчестве происходит во время критического периода развития иммунной системы и, таким образом, может увеличивать риск иммунных заболеваний в более позднем возрасте.
Чтобы понять, почему микробиом кишечника младенца так сильно изменился за последнее столетие, мы попытались понять, как формируется это сообщество. Колонизация кишечного микробиома младенцев начинается при родах с контакта с материнскими микробами — в основном вагинальными и фекальными микробами у младенцев, рожденных естественным путем, или преимущественно микробами кожи, рта и окружающей среды у младенцев, рожденных путем кесарева сечения. После рождения младенцы подвергаются бомбардировке огромным количеством микробов, обнаруживаемых в окружающей среде, в том числе в грудном молоке, но виды, которые становятся прочными членами микробного сообщества, часто передаются матерями младенцев через физический контакт.
Колонизация кишечного микробиома младенцев начинается при родах с контакта с материнскими микробами — в основном вагинальными и фекальными микробами у младенцев, рожденных естественным путем, или преимущественно микробами кожи, рта и окружающей среды у младенцев, рожденных путем кесарева сечения. После рождения младенцы подвергаются бомбардировке огромным количеством микробов, обнаруживаемых в окружающей среде, в том числе в грудном молоке, но виды, которые становятся прочными членами микробного сообщества, часто передаются матерями младенцев через физический контакт.
Дети продолжают приобретать виды кишечного микробиома от своих матерей и других членов общества в раннем возрасте. Это контрастирует с микробиомом кишечника взрослого человека, который стабилен и сопротивляется изменениям в основном потому, что доступное пространство и еда уже используются установленными микробами — экологические ниши просто заняты в кишечнике взрослого человека. Таким образом, логично, что пробиотик имеет больше шансов сохраниться в кишечнике младенца, где он сталкивается с меньшей конкуренцией, и, следовательно, с большей вероятностью будет иметь пищу, которую он может потреблять, и место, где он может расти. Пробиотик служит для младенца еще одним источником контакта с новыми бактериями.
Пробиотик служит для младенца еще одним источником контакта с новыми бактериями.
Осознавая это, мы начали задаваться вопросом: в наших исследованиях, какую экологическую нишу занял B. infantis , что поддерживало его устойчивость у младенцев еще долгое время после прекращения приема пробиотиков?
Изменяющийся микробиом младенцаИсторически микробиом кишечника грудного ребенка был почти монокультурой Bifidobacterium ( J Pathol Bacteriol , 18: 527–51, 1913).Микробиом кишечника младенцев на искусственном вскармливании был намного разнообразнее. Микробиом кишечника детей, вскармливаемых грудью, и микробиом кишечника детей, вскармливаемых искусственными смесями, теперь больше похожи на исторический микробиом кишечника детей, вскармливаемых грудным молоком, хотя современные дети, вскармливаемые грудью, имеют больше Bifidobacterium , чем современные дети, вскармливаемые молочными смесями. |
 Полную инфографику: WEB | PDF
Полную инфографику: WEB | PDFПодготовка к работе
Основным фактором, определяющим, какие бактерии процветают в кишечнике, является доступность их углеводных источников пищи.Таким образом, чтобы пробиотик работал у младенца, микроорганизмы должны быть выбраны таким образом, чтобы источник пищи, который они использовали, наиболее эффективно соответствовал доступному — пища, которая присутствует, но еще не потребляется другими бактериями. Мы решили определить, какие углеводы B. infantis потребляет в кишечнике младенца.
Естественно, мы обратились к грудному молоку, которое на протяжении миллионов лет было единственным продуктом питания, способным исключительно питать и защищать младенцев в течение первых шести месяцев жизни.Грудное молоко содержит питательные вещества, а также непитательные, биоактивные молекулы, включая углеводы, известные как олигосахариды грудного молока (HMOs). Еще в середине 1900-х годов Пол Дьёрдь, всемирно известный биохимик, диетолог и педиатр из больницы Пенсильванского университета, и его коллеги, неосознанно ссылаясь на больничные кассы, когда они предположили существование «бифидного фактора», чего-то уникального в мире. грудное молоко, которым кормили Bifidobacterium . Хотя люди не могут переваривать ОПЗ, оказывается, что Bifidobacterium , особенно B.Infantis , кан. В 2007 году наша группа в Калифорнийском университете в Дэвисе использовала инструменты на основе масс-спектрометрии в сочетании с микробиологией, чтобы показать, что B. infantis поглощает HMO в качестве единственного источника энергии, в то время как другие виды Bifidobacterium потребляют лишь некоторые HMO в дополнение к растениям. , углеводы животного и хозяйского происхождения.
грудное молоко, которым кормили Bifidobacterium . Хотя люди не могут переваривать ОПЗ, оказывается, что Bifidobacterium , особенно B.Infantis , кан. В 2007 году наша группа в Калифорнийском университете в Дэвисе использовала инструменты на основе масс-спектрометрии в сочетании с микробиологией, чтобы показать, что B. infantis поглощает HMO в качестве единственного источника энергии, в то время как другие виды Bifidobacterium потребляют лишь некоторые HMO в дополнение к растениям. , углеводы животного и хозяйского происхождения.
HMO представляют собой разнообразный класс сложных углеводных молекул, синтезируемых молочной железой. Имея приблизительно 200 различных молекулярных видов, они представляют собой третий по распространенности твердый компонент в грудном молоке после лактозы и жира.Поскольку ОПЗ сложны и различаются по структуре, они дороги в производстве. Современные смеси для младенцев могут содержать одну или две простые структуры HMO, но в меньшей концентрации, чем в грудном молоке. Детским смесям не хватает изобилия и сложности ОПЗ для избирательного питания полезных кишечных микробов, а также для связывания и нейтрализации патогенных микроорганизмов из кишечника.
Детским смесям не хватает изобилия и сложности ОПЗ для избирательного питания полезных кишечных микробов, а также для связывания и нейтрализации патогенных микроорганизмов из кишечника.
Виды бактерий в кишечнике младенца, способные потреблять HMO, можно рассматривать как ориентированный на молоко микробиом (MOM).Хотя B. infantis , по-видимому, является наиболее эффективным потребителем ОПЗ, другие виды Bifidobacterium , в частности B. breve и B. bifidum , могут потреблять и потребляют некоторые ОПЗ, но также потребляют растения, углеводы животного происхождения и хозяина. Виды Bifidobacterium , колонизирующие кишечник, изменяются на протяжении всей жизни в ответ на доступные углеводы в рационе хозяина. Например, B. infantis , B. breve и B.bifidum — это бифидобактерии MOM, которые обычно обнаруживаются в стуле детей, находящихся на исключительно грудном вскармливании, а B. longum и B. adolescentis , которые преимущественно потребляют углеводы растительного и животного происхождения, обычно обнаруживаются в стуле взрослых. Тем не менее, существуют различия и совпадения между видами, присутствующими на разных этапах жизни.
adolescentis , которые преимущественно потребляют углеводы растительного и животного происхождения, обычно обнаруживаются в стуле взрослых. Тем не менее, существуют различия и совпадения между видами, присутствующими на разных этапах жизни.
Основным фактором, определяющим, какие бактерии процветают в кишечнике, является доступность их углеводного источника пищи.
Из бифидобактерий MOM, обнаруженных в микробиоме кишечника младенца, разные виды могут иметь разное значение для микробиома.Например, когда мы давали младенцам исключительно грудного вскармливания добавку с пробиотиком B. infantis EVC001, в их кишечнике преобладали представители рода Bifidobacterium — относительная численность кишечного микробиома составляла более 80 процентов, а количество потенциальных патогенов составляло менее 10 процентов сообщества. С другой стороны, микробиомы кишечника младенцев, вскармливаемых исключительно грудью, которым не вводили B. infantis EVC001, имели гораздо более низкие уровни Bifidobacterium , с относительной численностью около 30 процентов, а потенциальные патогены составляли около 40 процентов микробов. в их интуиции, результаты, которые согласуются с предыдущей работой нашей группы и других.Эта почти монокультура Bifidobacterium , по-видимому, была вызвана B. infantis , что составляло около 90 процентов от общего количества Bifidobacterium у младенцев, получавших пробиотик. Напротив, B. longum были преобладающими Bifidobacterium кишечника в контрольной группе, за которыми следовали B. brev e и B. bifidum . Эти данные подчеркивают жизненно важное значение специфичности штамма пробиотиков и сочетание присутствия B.Infantis и грудное вскармливание для поддержания защитной среды кишечника у младенцев.
infantis EVC001, имели гораздо более низкие уровни Bifidobacterium , с относительной численностью около 30 процентов, а потенциальные патогены составляли около 40 процентов микробов. в их интуиции, результаты, которые согласуются с предыдущей работой нашей группы и других.Эта почти монокультура Bifidobacterium , по-видимому, была вызвана B. infantis , что составляло около 90 процентов от общего количества Bifidobacterium у младенцев, получавших пробиотик. Напротив, B. longum были преобладающими Bifidobacterium кишечника в контрольной группе, за которыми следовали B. brev e и B. bifidum . Эти данные подчеркивают жизненно важное значение специфичности штамма пробиотиков и сочетание присутствия B.Infantis и грудное вскармливание для поддержания защитной среды кишечника у младенцев.
Чтобы понять, как дополнительный B. infantis может настолько успешно победить другие микробы в кишечнике младенца, мы глубоко погрузились в его стратегию кормления. Оказывается, он разборчив в еде, питается исключительно в ОПЗ, а когда ОПЗ в изобилии, B. infantis жадно их пожирает. В отличие от других бифидобактерий MOM, B. infantis обладает всеми генами, необходимыми для полной внутренней деградации HMO, и предпочтительно использует HMO по сравнению с любым другим источником углеводов.Другие бифидобактерии MOM, такие как штаммы B. bifidum и B. breve , обладают способностью к росту только с подмножеством HMO. B. infantis , таким образом, имеет конкурентное преимущество, когда грудное молоко составляет весь рацион.
Оказывается, он разборчив в еде, питается исключительно в ОПЗ, а когда ОПЗ в изобилии, B. infantis жадно их пожирает. В отличие от других бифидобактерий MOM, B. infantis обладает всеми генами, необходимыми для полной внутренней деградации HMO, и предпочтительно использует HMO по сравнению с любым другим источником углеводов.Другие бифидобактерии MOM, такие как штаммы B. bifidum и B. breve , обладают способностью к росту только с подмножеством HMO. B. infantis , таким образом, имеет конкурентное преимущество, когда грудное молоко составляет весь рацион.
Исследование 2008 года, проведенное коллегами из Калифорнийского университета в Дэвисе и их соавторами, показало, как B. infantis быстро использует HMO: со связывающими белками для захвата HMO из просвета кишечника и переносчиками, которые направляют их в цитоплазму, расщепляя их на моносахариды. которые затем ферментируются в лактат и ацетат короткоцепочечных жирных кислот, которые секретируются из клетки. Эти конечные продукты поддерживают более низкий уровень pH в кишечной среде, поддерживая транспорт этих соединений в эпителий кишечника для использования хозяином и создавая нежелательную среду для потенциальных патогенов. Производство ацетата также блокирует проникновение токсичных молекул, продуцируемых патогенными бактериями, за счет усиления барьерной функции кишечника и ингибирования провоспалительных и апоптотических реакций. Недавние результаты одного исследования in vitro показали, что количество ацетата и лактата, вырабатываемых различными видами бифидобактерий, зависит от того, насколько хорошо они потребляют доступные им углеводы.Следовательно, если кормить потребляющим углеводы микробом его предпочтительным углеводом, у него будет больше возможностей производить больше своих защитных конечных продуктов.
Эти конечные продукты поддерживают более низкий уровень pH в кишечной среде, поддерживая транспорт этих соединений в эпителий кишечника для использования хозяином и создавая нежелательную среду для потенциальных патогенов. Производство ацетата также блокирует проникновение токсичных молекул, продуцируемых патогенными бактериями, за счет усиления барьерной функции кишечника и ингибирования провоспалительных и апоптотических реакций. Недавние результаты одного исследования in vitro показали, что количество ацетата и лактата, вырабатываемых различными видами бифидобактерий, зависит от того, насколько хорошо они потребляют доступные им углеводы.Следовательно, если кормить потребляющим углеводы микробом его предпочтительным углеводом, у него будет больше возможностей производить больше своих защитных конечных продуктов.
Другая причина, по которой B. infantis превосходит другие штаммы бифидобактерий в кишечнике младенцев, вскармливаемых грудью, заключается в том, что все процессы переваривания HMO происходят внутри бактериальной клетки. B. bifidum , с другой стороны, переваривает ОПЗ извне. Это внеклеточное пищеварение высвобождает простые углеводы и может обеспечивать перекрестное питание других видов Bifidobacterium , но также и перекрестное питание и, таким образом, открывает экологическую нишу для других, возможно, менее полезных микробов.Перекрестное кормление микробами разнообразит микробиом кишечника, который считается полезным для взрослых.
B. bifidum , с другой стороны, переваривает ОПЗ извне. Это внеклеточное пищеварение высвобождает простые углеводы и может обеспечивать перекрестное питание других видов Bifidobacterium , но также и перекрестное питание и, таким образом, открывает экологическую нишу для других, возможно, менее полезных микробов.Перекрестное кормление микробами разнообразит микробиом кишечника, который считается полезным для взрослых.
Но есть ли преимущество в наличии почти монокультуры Bifidobacterium у младенцев? Задав этот вопрос, мы сосредоточились на развитии иммунной системы.
Молоко-ориентированный микробиом Олигосахариды грудного молока (HMO) представляют собой сложные углеводы, которые микробные виды молочно-ориентированного микробиома (MOM) могут использовать в качестве источника пищи. Bifidobacterium infantis кодирует множество белков, которые специфически связывают и транспортируют все типы HMO в ее клетку и переваривают их внутри. © laurie o’keefe | |
© laurie o’keefe | B. infantis предпочтительно потребляет все виды ОПЗ по сравнению с любыми другими источниками углеводов.
|
© laurie o’keefe | B. bifidum питается только частью ОПЗ.
|
Преимущества
Bifidobacterium Снижение уровня Bifidobacterium в микробиомах кишечника младенцев и связанное с этим нарушение регуляции микробного сообщества с большим количеством потенциальных патогенов было предложено как один из возможных факторов увеличения числа аутоиммунных заболеваний, которые чума жителей богатых ресурсами стран. И наоборот, обсервационные исследования показали положительные иммунные эффекты наличия в фекальном микробиоме доминирования Bifidobacterium . В двух исследованиях с участием младенцев и детей раннего возраста в Бангладеш, численность фекалий B. infantis и Bifidobacterium в возрасте двух месяцев сильно коррелировала с улучшенными ответами на вакцины в возрасте шести месяцев и двух лет по сравнению с младенцами, не колонизированными B. или с низкой относительной численностью Bifidobacterium .
И наоборот, обсервационные исследования показали положительные иммунные эффекты наличия в фекальном микробиоме доминирования Bifidobacterium . В двух исследованиях с участием младенцев и детей раннего возраста в Бангладеш, численность фекалий B. infantis и Bifidobacterium в возрасте двух месяцев сильно коррелировала с улучшенными ответами на вакцины в возрасте шести месяцев и двух лет по сравнению с младенцами, не колонизированными B. или с низкой относительной численностью Bifidobacterium .
Кроме того, бифидобактерии с меньшей вероятностью, чем другие микробы, особенно потенциальные патогены, несут и разделяют гены устойчивости к противомикробным препаратам, что может привести к более высокому риску устойчивых к антибиотикам инфекций. В обсервационном исследовании младенцев из Бангладеш и Швеции преобладание кишечной Bifidobacterium было связано со значительным сокращением как числа, так и распространенности генов устойчивости к антибиотикам. Более того, по сравнению с младенцами из контрольной группы, вскармливаемых грудью, добавка B.Infantis EVC001 привел к снижению генов устойчивости к антибиотикам на 90 процентов, что в значительной степени обусловлено снижением уровней Escherichia , Clostridium и Staphylococcus — потенциально патогенных бактерий, которые играют важную роль в эволюции и распространение генов устойчивости к антибиотикам.
Более того, по сравнению с младенцами из контрольной группы, вскармливаемых грудью, добавка B.Infantis EVC001 привел к снижению генов устойчивости к антибиотикам на 90 процентов, что в значительной степени обусловлено снижением уровней Escherichia , Clostridium и Staphylococcus — потенциально патогенных бактерий, которые играют важную роль в эволюции и распространение генов устойчивости к антибиотикам.
В попытке восстановить микробиом кишечника младенцев с преобладанием Bifidobacterium , который был типичным для младенцев, вскармливаемых грудью 100 лет назад, мы решили провести рандомизированное контролируемое испытание с использованием B.Infantis EVC001 пробиотик. Учитывая, что не все штаммов B. infantis эффективно потребляют все ОПЗ, мы выбрали B. infantis EVC001, потому что мы знали, что этот штамм имеет полную кассету генов, необходимую для полного переваривания всех ОПЗ. Здоровые доношенные младенцы, находящиеся на грудном вскармливании, были рандомизированы для употребления B. infantis EVC001 в течение 21 дня подряд, начиная с 7-го дня после родов, или для отказа от пробиотика.
infantis EVC001 в течение 21 дня подряд, начиная с 7-го дня после родов, или для отказа от пробиотика.
ПРОБИОТИК, КОТОРЫЙ УДАР: полученные с помощью сканирующего электронного микроскопа микрофотографии образцов кала младенцев показывают значительное увеличение количества микробов Bifidobacterium у тех, кто получал пробиотик под названием EVC001 (справа), по сравнению с контрольной группой (слева).
По сравнению с контрольными младенцами, находившимися на грудном вскармливании, которые не получали пробиотик, добавка привела к увеличению в 10000000 раз в среднем уровней фекальных B. infantis и к увеличению фекальных Bifidobacterium на 79 процентов в течение периода приема добавок, и это все еще сохранялось. верно через месяц после приема добавок. Это означает, что колонизация Bifidobacterium продолжалась без продолжения приема пробиотиков. Кроме того, колонизация B.Infantis сохранялся до одного года, если младенцы продолжали потреблять грудное молоко и не подвергались воздействию антибиотиков. Важно отметить, что у младенцев, получавших добавки, наблюдалось 80-процентное снижение потенциальных кишечных патогенов, принадлежащих к семействам Enterobacteriaceae и Clostridiaceae , а также снижение содержания эндотоксина в фекалиях. Кроме того, мы наблюдали 2-кратное увеличение содержания лактата и ацетата в кале и 10-кратное снижение pH кала. Микробиомы и биохимия кишечника младенцев с добавками напоминают нормы, соблюдаемые столетие назад.
Важно отметить, что у младенцев, получавших добавки, наблюдалось 80-процентное снижение потенциальных кишечных патогенов, принадлежащих к семействам Enterobacteriaceae и Clostridiaceae , а также снижение содержания эндотоксина в фекалиях. Кроме того, мы наблюдали 2-кратное увеличение содержания лактата и ацетата в кале и 10-кратное снижение pH кала. Микробиомы и биохимия кишечника младенцев с добавками напоминают нормы, соблюдаемые столетие назад.
Мы также выявили некоторые подсказки о последствиях «модернизации» микробиома кишечника. Младенцы, находящиеся на грудном вскармливании с низким уровнем фекалий Bifidobacterium , выделяли в 10 раз больше HMO со стулом в течение двухмесячного периода исследования, чем младенцы, получавшие добавку B. infantis EVC001, что указывает на то, что HMO — третий по содержанию компонент в грудном молоке — были будет зря. Мы также обнаружили, что младенцы с низким содержанием фекальных Bifidobacterium имели в несколько раз более высокие уровни провоспалительных цитокинов в фекалиях
по сравнению с младенцами, в кишечных микробиомах которых преобладали Bifidobacterium после введения B. Infantis EVC001.
Infantis EVC001.
Взятые вместе, эти данные демонстрируют, что этот конкретный штамм B. infanti s, предоставленный в качестве пробиотика младенцам, находящимся на грудном вскармливании, резко колонизировал микробиом кишечника младенца во время и после приема добавок и благотворно реконструировал микробную, биохимическую и иммунологическую среду. в кишечнике младенца. Многие младенцы во всем мире никогда не получают B. infantis , но сочетание грудного вскармливания и приема пробиотиков с этой бактерией, по-видимому, создает питательную и защитную среду в кишечнике.
Многие младенцы во всем мире никогда не получают B. infantis , но сочетание кормления грудью и приема пробиотиков с этой бактерией, по-видимому, приводит к созданию питательной и защитной среды кишечника.
Наши результаты также подтверждают гипотезу о том, что неэффективность некоторых пробиотиков у взрослых отчасти связана с тем, что они вводят новый вид в устоявшееся сообщество с небольшим количеством открытых экологических ниш. Пробиотики могут не работать у младенцев, если существует несоответствие между потребностью в пробиотиках в углеводах и наличием высокоспецифичных углеводов, таких как HMO, в грудном молоке.Поскольку B. infantis эффективно потребляет почти все ОПЗ, обнаруженные в грудном молоке, он, вероятно, найдет открытую экологическую нишу, а затем вытеснит другие микробы, особенно провоспалительные патогены.
Пробиотики могут не работать у младенцев, если существует несоответствие между потребностью в пробиотиках в углеводах и наличием высокоспецифичных углеводов, таких как HMO, в грудном молоке.Поскольку B. infantis эффективно потребляет почти все ОПЗ, обнаруженные в грудном молоке, он, вероятно, найдет открытую экологическую нишу, а затем вытеснит другие микробы, особенно провоспалительные патогены.
Многие ученые работают над тем, чтобы понять, что на самом деле означает микробиом кишечника младенцев для здоровья на протяжении всей жизни. Между тем, мы обращаем наше внимание на другие вопросы: Чем отличаются модели колонизации Bifidobacterium в младенческих популяциях во всем мире от младенчества до отъема от груди? И какие твердые продукты поддерживают здоровье кишечника и иммунной системы? Работая при финансовой поддержке Национального института здоровья, мы сейчас проводим исследование, призванное понять, как углеводные структуры прикорма влияют на микробную функцию, которая будет поддерживать здоровый микробиом кишечника и развитие иммунной системы в позднем младенчестве и раннем детстве. Конечная цель — определить конкретные углеводные структуры в рационе, которые выборочно питают полезные кишечные микробы у детей в критический период иммунного развития для здоровья на протяжении всей жизни.
Конечная цель — определить конкретные углеводные структуры в рационе, которые выборочно питают полезные кишечные микробы у детей в критический период иммунного развития для здоровья на протяжении всей жизни.
Дженнифер Смиловиц — заместитель директора программы исследований человека в Институте пищевых продуктов для здоровья и научный сотрудник Департамента пищевых наук и технологий Калифорнийского университета в Дэвисе. Диана Хазард Тафт — научный сотрудник лаборатории Дэвида Миллса в Департаменте пищевых наук и технологий и член Института пищевых продуктов для здоровья в Калифорнийском университете в Дэвисе.
Влияние материнских бифидобактерий на создание бифидобактерий, колонизирующих кишечник у младенцев.
Гуарнер Ф., Малагелада Дж. Р. 2003. Флора кишечника в состоянии здоровья и болезней. Ланцет 361 : 512–519
Артикул Google ученый
Caicedo RA, Schanler RJ, Li N, Neu J 2005 Развивающаяся экосистема кишечника: последствия для новорожденных. Pediatr Res 58 : 625–628
Артикул Google ученый
Ротими В.О., Дурден Б.И. 1981 Развитие бактериальной флоры у здоровых новорожденных. J Med Microbiol 14 : 51–62
CAS Статья Google ученый
Маки Р.И., Сгир А., Гаскинс Х.Р. 1999 Микробная экология развития желудочно-кишечного тракта новорожденных. Am J Clin Nutr 69 : 1035S – 1045S
CAS Статья Google ученый
Бенно И, Савада К., Мицуока Т. 1984 Микрофлора кишечника младенцев: состав фекальной флоры у младенцев, находящихся на грудном и искусственном вскармливании. Microbiol Immunol 28 : 975–986
CAS Статья Google ученый
Fujii T, Ohtsuka Y, Lee T, Kudo T, Shoji H, Sato H, Nagata S, Shimizu T, Yamashiro Y 2006 Bifidobacterium breve усиливает передачу сигналов трансформирующего фактора роста бета1, регулируя экспрессию Smad7 у недоношенных детей. J Pediatr Gastroenterol Nutr 43 : 83–88
Артикул Google ученый
Thibault H, Aubert-Jacquin C, Goulet O 2004 Влияние длительного потребления ферментированной детской смеси (с Bifidobacterium breve, c50 и Streptococcus thermophilus, 065) на острую диарею у здоровых младенцев. J Pediatr Gastroenterol Nutr 39 : 147–152
J Pediatr Gastroenterol Nutr 39 : 147–152
CAS Статья Google ученый
Björkstén B, Sepp E, Julge K, Voor T, Mikelsaar M 2001 Развитие аллергии и микрофлора кишечника в течение первого года жизни. J Allergy Clin Immunol 108 : 516–520
Артикул Google ученый
He F, Ouwehand AC, Isolauri E, Hashimoto H, Benno Y, Salminen S 2001 Сравнение адгезии слизистой оболочки и идентификация видов бифидобактерий, выделенных от здоровых и аллергических младенцев. FEMS Immunol Med Microbiol 30 : 43–47
CAS Статья Google ученый
Кукконен К., Савилахти Е., Хахтела Т., Юнтунен-Бакман К., Корпела Р., Пусса Т., Тууре Т., Куйтунен М. 2007 Пробиотики и пребиотические галактоолигосахариды в профилактике аллергических заболеваний: рандомизированный, двойной слепой , плацебо-контролируемое исследование. J Allergy Clin Immunol 119 : 192–198
CAS Статья Google ученый
Судо Н., Савамура С., Танака К., Айба И., Кубо С., Кога Ю. 1997 Требование кишечной бактериальной флоры для развития системы производства IgE, полностью восприимчивой к индукции оральной толерантности. J Иммунол 159 : 1739–1745
CAS PubMed Google ученый
Китадзима Х., Сумида Я.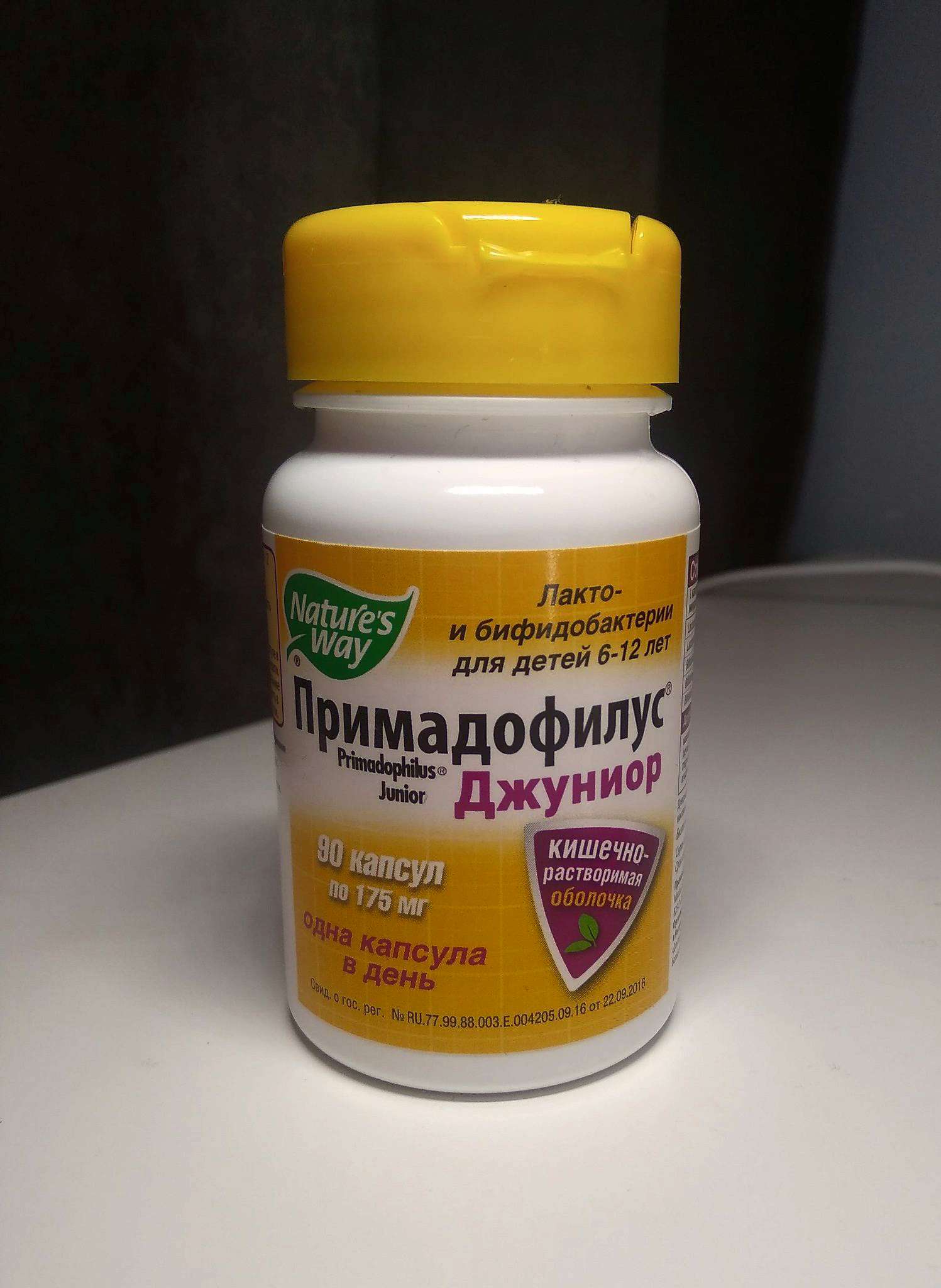 , Танака Р., Юки Н., Такаяма Х., Фудзимура М. 1997 Раннее введение Bifidobacterium breve недоношенным детям: рандомизированное контролируемое исследование. Arch Dis Child Fetal Neonatal Ed 76 : F101 – F107
, Танака Р., Юки Н., Такаяма Х., Фудзимура М. 1997 Раннее введение Bifidobacterium breve недоношенным детям: рандомизированное контролируемое исследование. Arch Dis Child Fetal Neonatal Ed 76 : F101 – F107
CAS Статья Google ученый
Fryklund B, Tullus K, Berglund B, Burman LG 1992 Важность окружающей среды и фекальной флоры младенцев, медперсонала и родителей как источников грамотрицательных бактерий, колонизирующих новорожденных в трех неонатальных отделениях. Инфекция 20 : 253–257
CAS Статья Google ученый
Муроно К., Фудзита К., Йошикава М., Сайджо М., Иньяку Ф., Какехаши Х., Цукамото Т. 1993 Приобретение нематин энтеробактерий младенцами, доставленными в больницы. J Педиатр 122 : 120–125
J Педиатр 122 : 120–125
CAS Статья Google ученый
Tannock GW, Fuller R, Smith SL, Hall MA 1990 Плазмидное профилирование членов семейства энтеробактерий, лактобактерий и бифидобактерий для изучения передачи бактерий от матери к младенцу. J Clin Microbiol 28 : 1225–1228
CAS PubMed PubMed Central Google ученый
Грёнлунд М.М., Лехтонен О.П., Эерола Э., Керо П. 1999 Фекальная микрофлора у здоровых младенцев, рожденных разными способами: стойкие изменения кишечной флоры после кесарева сечения. J Pediatr Gastroenterol Nutr 28 : 19–25
Артикул Google ученый
Chen J, Cai W., Feng Y 2007 Развитие кишечных бифидобактерий и лактобактерий у новорожденных, находящихся на грудном вскармливании. Clin Nutr 26 : 559–566
CAS Статья Google ученый
Clement BG, Kitts CL 2000 Выделение ДНК, пригодной для ПЦР, из человеческих фекалий с помощью набора для анализа ДНК почвы. Биотехнологии 28 : 640–642, 644, 646
CAS Статья Google ученый
Геймонде М., Саката С., Каллиомаки М., Исолаури Э., Бенно Ю., Салминен С. 2006 Влияние потребления лактобацилл GG матерью на передачу и формирование фекальной бифидобактериальной микробиоты у новорожденных. J Pediatr Gastroenterol Nutr 42 : 166–170
Артикул Google ученый
Мацуки Т., Ватанабе К., Танака Р., Фукуда М., Ойадзу Х. 1999 Распределение видов бифидобактерий в микрофлоре кишечника человека, исследованной с помощью видоспецифичных праймеров, нацеленных на ген 16S рРНК. Appl Environ Microbiol 65 : 4506–4512
CAS PubMed PubMed Central Google ученый
Мацуки Т., Ватанабе К., Фудзимото Дж., Кадо Ю., Такада Т., Мацумото К., Танака Р. 2004 Количественная ПЦР с видоспецифичными праймерами, нацеленными на ген 16S рРНК, для анализа кишечных бифидобактерий человека. Appl Environ Microbiol 70 : 167–173
CAS Статья Google ученый
Бьюн Р., Надкарни М.А., Чхур К.Л., Мартин Ф. И., Жак Н.А., Хантер Н. 2004 Количественный анализ различных видов Lactobacillus , присутствующих при распространенном кариесе зубов. J Clin Microbiol 42 : 3128–3136
И., Жак Н.А., Хантер Н. 2004 Количественный анализ различных видов Lactobacillus , присутствующих при распространенном кариесе зубов. J Clin Microbiol 42 : 3128–3136
CAS Статья Google ученый
Ely EW, Girard TD, Shintani AK, Jackson JC, Gordon SM, Thomason JW, Pun BT, Canonico AE, Light RW, Pandharipande P, Laskowitz DT 2007 Полиморфизм аполипопротеина E4 как генетическая предрасположенность к делирию в критических состояниях пациенты. Crit Care Med 35 : 112–117
CAS Статья Google ученый
Grönlund MM, Gueimonde M, Laitinen K, Kociubinski G, Grönroos T., Salminen S, Isolauri E 2007 Материнское грудное молоко и кишечные бифидобактерии определяют композиционное развитие Bifidobacterium microbiota у младенцев с риском аллергических заболеваний .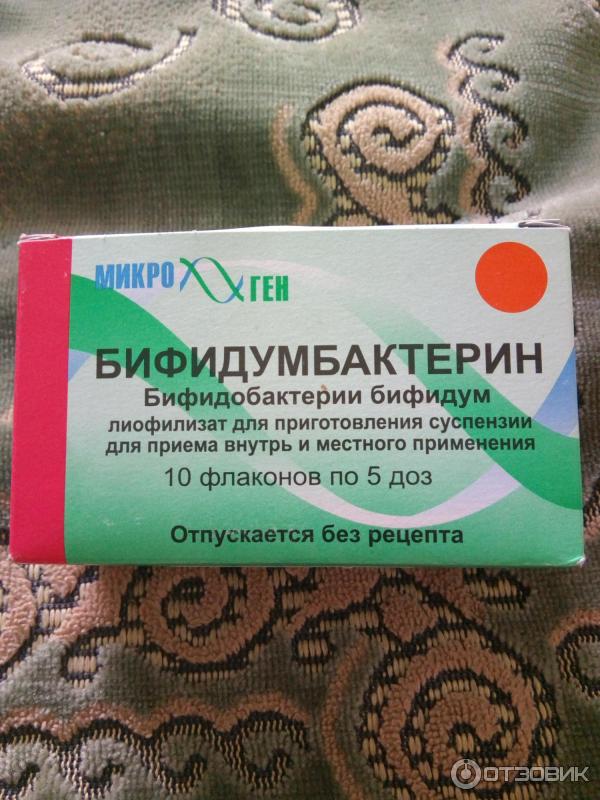 Clin Exp Allergy 37 : 1764–1772
Clin Exp Allergy 37 : 1764–1772
Артикул Google ученый
Shadid R, Haarman M, Knol J, Theis W., Beermann C, Rjosk-Dendorfer D, Schendel DJ, Koletzko BV, Krauss-Etschmann S 2007 Влияние галактоолигосахаридов и длинноцепочечных фруктоолигосахаридов на добавление материнской пищи и во время беременности неонатальная микробиота и иммунитет — рандомизированное двойное слепое плацебо-контролируемое исследование. Am J Clin Nutr 86 : 1426–1437
CAS Статья Google ученый
Levison ME, Corman LC, Carrington ER, Kaye D 1977 Количественная микрофлора влагалища. Am J Obstet Gynecol 127 : 80–85
CAS Статья Google ученый
Редондо-Лопес В., Кук Р.Л., Собел Дж.Д. 1990 Новая роль лактобацилл в контроле и поддержании бактериальной микрофлоры влагалища. Rev. Infect Dis 12 : 856–872
CAS Статья Google ученый
Newburg DS 2000 Олигосахариды в материнском молоке и бактериальная колонизация. J Pediatr Gastroenterol Nutr 30 : S8 – S17
CAS Статья Google ученый
Кунц С., Рудлофф С., Байер В., Кляйн Н., Штробель С. 2000 Олигосахариды в грудном молоке: структурные, функциональные и метаболические аспекты. Annu Rev Nutr 20 : 699–722
CAS Статья Google ученый
Хаарман М., Кнол Дж. 2005 Количественные ПЦР-анализы в реальном времени для выявления и количественного определения фекальных видов Bifidobacterium у младенцев, получающих пребиотическую смесь для младенцев. Appl Environ Microbiol 71 : 2318–2324
CAS Статья Google ученый
Penders J, Thijs C, Vink C, Stelma FF, Snijders B, Kummeling I, van den Brandt PA, Stobberingh EE 2006 Факторы, влияющие на состав кишечной микробиоты в раннем детстве. Педиатрия 118 : 511–521
Статья Google ученый
Schultz M, Göttl C, Young RJ, Iwen P, Vanderhoof JA 2004 Введение оральных пробиотических бактерий беременным женщинам вызывает временную инфантильную колонизацию. J Pediatr Gastroenterol Nutr 38 : 293–297
J Pediatr Gastroenterol Nutr 38 : 293–297
Артикул Google ученый
Эволюция популяции кишечных Bifidobacterium у здоровых японских младенцев в течение первых трех лет жизни: количественная оценка
Пендерс, Дж. и др. . Факторы, влияющие на состав микробиоты кишечника в раннем детстве. Педиатрия 118 , 511–521 (2006).
Артикул PubMed Google ученый
Кениг, Дж. Э. и др. . Последовательность микробных консорциумов в развивающемся микробиоме кишечника младенца. Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 108 , 4578–4585 (2011).
ADS CAS Статья PubMed Google ученый
Turroni, F. и др. . Разнообразие бифидобактерий в кишечной микробиоте младенцев. PLoS One 7 , e36957 (2012).
ADS CAS Статья PubMed PubMed Central Google ученый
Вентура, М., Туррони, Ф., Лугли, Г. А. и Ван Синдерен, Д. Бифидобактерии и люди: наши особые друзья, от экологических до геномных перспектив. J. Sci. Food Agric. 94 , 163–168 (2014).
CAS Статья PubMed Google ученый
Backhed, F. и др. . Динамика и стабилизация микробиома кишечника человека в течение первого года жизни. Клеточный микроб-хозяин 17 , 690–703 (2015).
Артикул PubMed Google ученый
Бокулич Н.А. и др. . Антибиотики, способ родов и диета влияют на созревание микробиома в молодом возрасте. Sci. Пер. Med. 8 , 343ra82 (2016).
Артикул PubMed PubMed Central Google ученый
Мацуки Т. и др. .Ключевой генетический фактор использования фукозиллактозы влияет на развитие микробиоты кишечника младенца. Nat. Commun. 7 , 11939 (2016a).
ADS CAS Статья PubMed PubMed Central Google ученый
Tojo, R. et al. . Кишечная микробиота в здоровье и болезни: роль бифидобактерий в гомеостазе кишечника. World J. Gastroenterol. 20 , 15163–76 (2014).
Артикул PubMed PubMed Central Google ученый
Milani, C. и др. . Оценка состава сообщества бифидобактерий в кишечнике человека с помощью протокола целевого секвенирования ампликонов (ITS). FEMS Microbiol. Ecol. 90 , 493–503 (2014).
CAS PubMed Google ученый
Euzeby, J. P. « Bifidobacterium» . Список названий прокариот, стоящих в номенклатуре. Доступно в Интернете по адресу: http://www.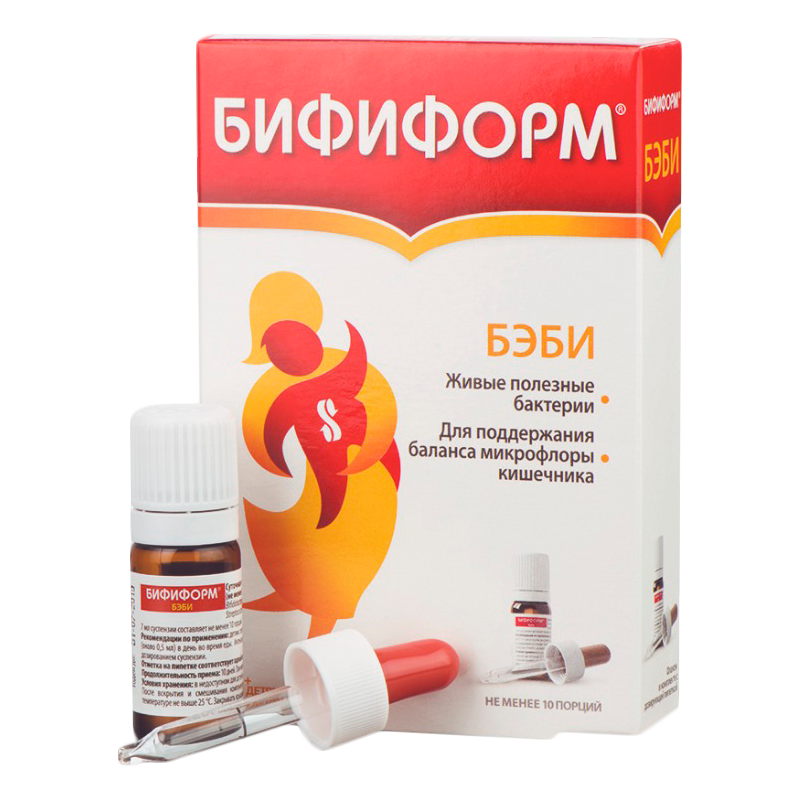 bacterio.net/bifidobacterium.html (2016).
bacterio.net/bifidobacterium.html (2016).
Палмер К., Бик Э. М., ДиДжиулио Д. Б., Релман Д. А. и Браун П. О. Развитие микробиоты кишечника младенца у человека. PLoS Biol. 5 , e177 (2007).
Артикул PubMed PubMed Central Google ученый
Роджер, Л.С., Костабиле, А., Холланд, Д. Т., Хойлс, Л. и Маккартни, А. Л. Исследование популяций фекальных Bifidobacterium у младенцев, вскармливаемых грудью и искусственными смесями, в течение первых 18 месяцев жизни. Микробиология 156 , 3329–3341 (2010).
CAS Статья PubMed Google ученый
Вернер, Дж. Дж. и др. . Влияние обучающих наборов на классификацию высокопроизводительных исследований генов 16S рРНК бактерий. ISME J. 6 , 94–103 (2012).
CAS Статья PubMed Google ученый
Домингес-Белло, М. Г. и др. . Способ доставки определяет приобретение и структуру исходной микробиоты в различных средах обитания новорожденных. Proc. Natl. Акад. Sci. США 107 , 11971–11975 (2010).
ADS Статья PubMed PubMed Central Google ученый
Нагпал Р. и Ямаширо Ю. Микробный состав кишечника в молодом возрасте. J. Pediatr. Biochem.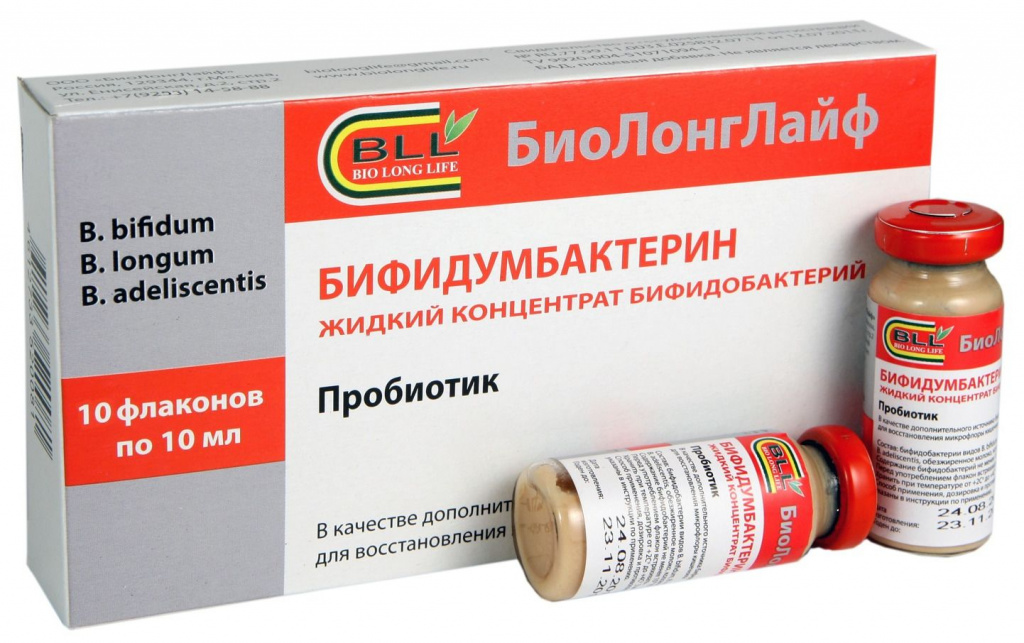 5 , 41–50 (2015).
5 , 41–50 (2015).
Артикул Google ученый
Нагпал Р. и др. . Точный количественный анализ микробиоты мекониевых бактерий у здоровых доношенных детей, рожденных вагинально или путем кесарева сечения. Фронт. Microbiol. 7 , 1997, DOI: 10.3389 / fmicb.2016.01997 (2016).
Артикул PubMed PubMed Central Google ученый
Мацуда, К., Цуджи, Х., Асахара, Т., Кадо, Ю. и Номото, К. Чувствительное количественное определение комменсальных бактерий с помощью рРНК-целевой обратной транскрипции-ПЦР. Заявл. Environ. Microbiol. 73 , 32–39 (2007).
CAS Статья PubMed Google ученый
Мацуда, К. и др. . Создание аналитической системы для фекальной микробиоты человека, основанной на обратной транскрипции и количественной ПЦР, нацеленной на многокопийные молекулы рРНК. Заявл. Environ. Microbiol. 75 , 1961–1969 (2009).
CAS Статья PubMed PubMed Central Google ученый
Мацуда, К. и др. . Чувствительная количественная оценка клеток Clostridium difficile с помощью количественной ПЦР с обратной транскрипцией, нацеленной на молекулы рРНК. Заявл. Environ. Microbiol. 78 , 5111–5118 (2012).
CAS Статья PubMed PubMed Central Google ученый
Кубота, Х. и др. . Обнаружение кишечных каталазонегативных, грамположительных кокков с помощью рРНК-целевой обратной транскрипции-ПЦР. Заявл. Environ. Microbiol. 76 , 5440–5451 (2010).
CAS Статья PubMed PubMed Central Google ученый
Hasegawa, S. и др. . Дисбактериоз кишечника и снижение уровня липополисахарид-связывающего белка в сыворотке при болезни Паркинсона. PLoS One 10 , e0142164 (2015).
Артикул PubMed PubMed Central Google ученый
Куракава Т. и др. . Разнообразие кишечной группы Clostridium coccoides в популяции Японии, как показано с помощью количественной ПЦР с обратной транскрипцией.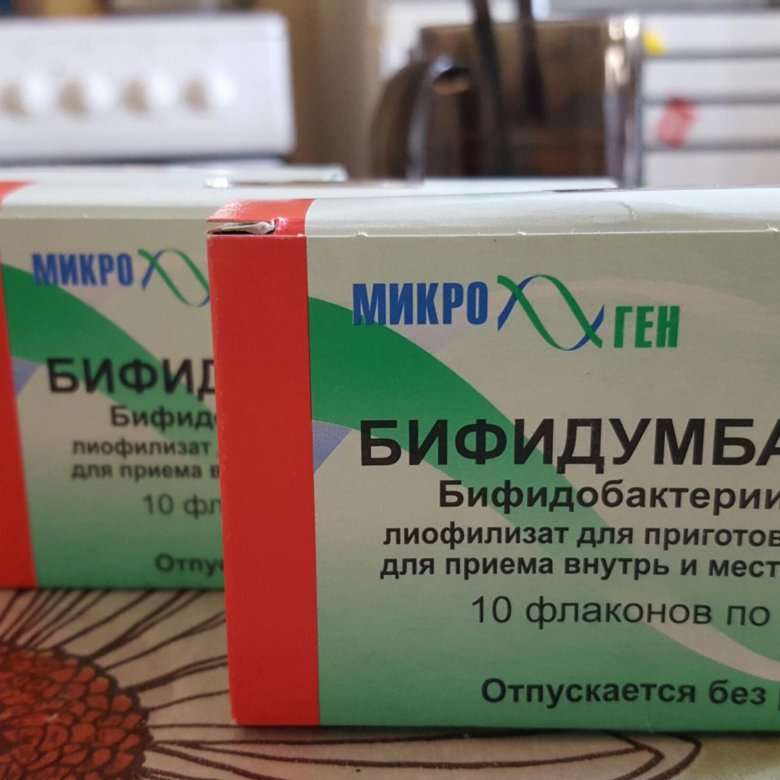 PLoS One 10 , e0126226 (2015a).
PLoS One 10 , e0126226 (2015a).
Артикул PubMed PubMed Central Google ученый
Цуджи, Х. и др. . Молекулярный мониторинг развития кишечной микробиоты у японских младенцев. Benef. Микробы. 3 , 113–125 (2012).
CAS Статья PubMed Google ученый
Экбург, П. Б. и др. . Разнообразие микробной флоры кишечника человека. Наука 308 , 1635–1638 (2005).
ADS Статья PubMed PubMed Central Google ученый
Милани, К. и др. . Оценка фекальной микробиоты: оптимизированный протокол анализа генов 16S рРНК с ионным потоком. PLoS One 8 , e68739 (2013).
ADS CAS Статья PubMed PubMed Central Google ученый
Таннок, Г. У., Ли, П. С., Вонг, К. Х. и Лоули, Б. Почему не у всех младенцев есть бифидобактерии в стуле? Фронт.Microbiol. 7 , 834 (2016).
Артикул PubMed PubMed Central Google ученый
Куракава Т. и др. . Создание чувствительной системы анализа вагинальной микробиоты человека на основе рРНК-целевой обратной транскрипции-количественной ПЦР. J. Microbiol. Методы 111 , 93–104 (2015b).
J. Microbiol. Методы 111 , 93–104 (2015b).
CAS Статья PubMed Google ученый
Фавье, К. Ф., Воган, Э. Э., Де Вос, В. М. и Аккерманс, А. Д. Молекулярный мониторинг последовательности бактериальных сообществ у новорожденных людей. Заявл. Environ. Microbiol. 68 , 219–226 (2002).
CAS Статья PubMed PubMed Central Google ученый
Зоетендал, Э. Г., Раджилик-Стоянович, М. и де Вос, В. М. Высокопроизводительный анализ разнообразия и функциональности микробиоты желудочно-кишечного тракта. Кишечник 57 , 1605–1615 (2008).
CAS Статья PubMed Google ученый
Klaassens, E. S. и др. . Анализ геномных микрочипов смешанных видов фекалий выявляет дифференциальные транскрипционные реакции бифидобактерий у младенцев, вскармливаемых грудью и смесью. Заявл. Environ. Microbiol. 75 , 2668–2676 (2009).
CAS Статья PubMed PubMed Central Google ученый
Turroni, F. и др. . Микробиомный анализ популяции бифидобактерий в дистальном отделе кишечника человека. ISME J. 3 , 745–751 (2009).
CAS Статья PubMed Google ученый
Янг, С. Л. и др. .Виды бифидобактерий по-разному влияют на экспрессию маркеров клеточной поверхности и цитокинов дендритных клеток, собранных из пуповинной крови. Clin. Диаг. Лаборатория. Иммунол. 11 , 686–690 (2004).
Clin. Диаг. Лаборатория. Иммунол. 11 , 686–690 (2004).
PubMed PubMed Central Google ученый
Гор, К. и др. . Bifidobacterium pseudocatenulatum связан с атопической экземой: вложенное исследование случай-контроль, посвященное изучению фекальной микробиоты младенцев. J. Allergy Clin. Иммунол. 121 , 135–140 (2008).
Артикул PubMed Google ученый
Tannock, G. W. et al. . Сравнение составов микробиоты стула младенцев, которых кормили смесью из козьего молока, смесью на основе коровьего молока или грудным молоком. Заявл. Environ. Microbiol. 79 , 3040–3048 (2013).
CAS Статья PubMed PubMed Central Google ученый
Яцуненко Т. и др. . Микробиом кишечника человека в зависимости от возраста и географии. Природа 486 , 222–227 (2012).
ADS CAS PubMed PubMed Central Google ученый
Маркл, Дж. Г. и др. . Половые различия в микробиоме кишечника управляют гормонально-зависимой регуляцией аутоиммунитета. Наука 339 , 1084–1088 (2013).
ADS CAS Статья PubMed Google ученый

Dominianni, C. et al. . Пол, индекс массы тела и потребление пищевых волокон влияют на микробиом кишечника человека. PLoS One 10 , e0124599 (2015).
Артикул PubMed PubMed Central Google ученый
Aagaard, K. et al. .Плацента содержит уникальный микробиом. Sci. Пер. Med. 6 , 237ra65 (2014).
Артикул PubMed PubMed Central Google ученый
Collado, M.C., Rautava, S., Aakko, J., Isolauri, E. & Salminen, S. Колонизация кишечника человека может инициироваться внутриутробно различными микробными сообществами в плаценте и околоплодных водах. Sci. Репутация 6 , 23129 (2016).
Репутация 6 , 23129 (2016).
ADS CAS Статья PubMed PubMed Central Google ученый
Мартин Р. и др. . События в раннем возрасте, включая способ родоразрешения и тип кормления, братьев и сестер и пол, формируют развивающуюся микробиоту кишечника. PLoS One 11 , e0158498 (2016).
Артикул PubMed PubMed Central Google ученый
Satokari, R., Gronroos, T., Laitinen, K., Salminen, S. & Isolauri, E. , ДНК Bifidobacterium и Lactobacillus в плаценте человека. Lett. Appl. Microbiol. 48 , 8–12 (2009).
CAS Статья PubMed Google ученый
Макино, Х. и др. . Передача штаммов кишечных бифидобактерий от матери ребенку влияет на раннее развитие микробиоты ребенка, рожденного естественным путем. PLoS One 8 , e78331 (2013).
ADS Статья PubMed PubMed Central Google ученый
Мюллер, Н. Т., Бакакс, Э., Комбеллик, Дж., Григорян, З. и Домингес-Белло, М. Г. Развитие микробиома младенца: мама имеет значение. Trends Mol. Med. 21 , 109–117 (2015).
Артикул PubMed Google ученый
Хармсен, Х. Дж. и др. . Анализ развития кишечной флоры у детей, находящихся на грудном вскармливании и на искусственном вскармливании, с использованием методов молекулярной идентификации и обнаружения. J. Pediatr. Гастроэнтерол. Nutr. 30 , 61–67 (2000).
J. Pediatr. Гастроэнтерол. Nutr. 30 , 61–67 (2000).
CAS Статья PubMed Google ученый
Шарбонно, М. Р. и др. . Микробная перспектива биологии развития человека. Природа 535 , 48–55 (2016).
ADS CAS Статья PubMed PubMed Central Google ученый
Макино, Х. и др. . Мультилокусное последовательное типирование штаммов бифидобактерий из фекалий младенцев и грудного молока: устойчиво ли распределяются бифидобактерии во время грудного вскармливания? Benef. Микробы 6 , 563–572 (2015).
CAS Статья PubMed Google ученый
Ванденплас, Ю., Захарова, И., Дмитриева, Ю. Олигосахариды в детских смесях: больше доказательств для подтверждения роли пребиотиков. Br. J. Nutr. 113 , 1339–1344 (2015).
CAS Статья PubMed Google ученый
Ehara, T. et al. .Комбинированные эффекты пребиотических олигосахаридов на рост бифидобактерий и экспрессию генов-хозяев в упрощенной модели смешанной культуры и новорожденных мышей. Br. J. Nutr. 116 , 270–278 (2016).
CAS Статья PubMed Google ученый
Мацуки Т. и др. . Смесь для младенцев с галактоолигосахаридами (OM55N) стимулирует рост местных бифидобактерий у здоровых доношенных детей. Benef. Микробы 7 , 453–461 (2016b).
Benef. Микробы 7 , 453–461 (2016b).
CAS Статья PubMed Google ученый
Fukuda, S. et al. . Бифидобактерии могут защитить от энтеропатогенной инфекции за счет выработки ацетата. Природа 469 , 543–547 (2011).
ADS CAS Статья PubMed Google ученый
Jakobsdottir, G., Xu, J., Molin, G., Ahrne, S. & Nyman, M. Диета с высоким содержанием жиров снижает образование бутирата, но увеличивает содержание сукцината, воспаления, жира в печени и холестерина у крыс при соблюдении диеты. волокно противодействует этим эффектам. PLoS One 8 , e80476 (2013).
ADS Статья PubMed PubMed Central Google ученый
Мацуки Т. и др. .Количественная ПЦР с видоспецифичными праймерами, нацеленными на ген 16S рРНК, для анализа кишечных бифидобактерий человека. Заявл. Environ. Microbiol. 70 , 167–73 (2004).
CAS Статья PubMed PubMed Central Google ученый
Инагаки, А., Итикава, Х. и Саката, Т. Ингибирующее действие янтарной кислоты на пролиферацию эпителиальных клеток слизистой оболочки толстой кишки у крыс. J. Nutr. Sci. Витаминол. (Токио) 53 , 377–379 (2007).
CAS Статья Google ученый
Таннахилл, Г. М. и др. . Сукцинат представляет собой воспалительный сигнал, который индуцирует IL-1β через HIF-1α. Природа 496 , 238–242 (2013).
ADS CAS Статья PubMed PubMed Central Google ученый
Mevissen-Verhage, E. A., Marcelis, J. H. & de Vos, M. N. Harmsen-van Amerongen, W. C. & Verhoef, J. Bifidobacterium , Bacteroides и Clostridium spp. в образцах фекалий младенцев, находящихся на грудном и искусственном вскармливании, с добавками железа и без них. J. Clin. Microbiol. 25, , 285–289 (1987).
CAS PubMed PubMed Central Google ученый
Matsuki, T., Watanabe, K., Tanaka, R., Fukuda, M. и Oyaizu, H. Распределение видов бифидобактерий в микрофлоре кишечника человека, исследованных с помощью видоспецифичных праймеров, нацеленных на ген 16S рРНК. Заявл. Environ. Microbiol. 65 , 4506–4512 (1999).
CAS PubMed PubMed Central Google ученый
Хаарман М. и Кнол Дж. Количественные ПЦР-анализы в реальном времени для идентификации и количественного определения видов Bifidobacterium в фекалиях у младенцев, получающих пребиотическую смесь для грудных детей. Заявл. Environ. Microbiol. 71 , 2318–2324 (2005).
CAS Статья PubMed PubMed Central Google ученый
Sakata, S. и др. . Независимый от культуры анализ фекальной микробиоты у младенцев, со специальной ссылкой на Bifidobacterium разновидностей. FEMS Microbiol. Lett. 243 , 417–423 (2005).
ADS CAS Статья PubMed Google ученый
Grönlund, M. M., Grześkowiak,., Isolauri, E. & Salminen, S. Влияние микробиоты кишечника матери на колонизацию кишечника у младенца. Кишечные микробы 2 , 227–233 (2011).
Артикул PubMed Google ученый
Grzeskowiak, L. и др. . Микробиота кишечника Bifidobacterium у бразильских новорожденных в возрасте одного месяца. Анаэроб 35 , 54–58 (2015).
Анаэроб 35 , 54–58 (2015).
Артикул PubMed Google ученый
Миками, К. и др. . Влияние материнских бифидобактерий на создание бифидобактерий, колонизирующих кишечник у младенцев. Pediatr. Res. 65 , 669–674 (2009).
Артикул PubMed Google ученый
Села Д. А. и др. . Последовательность генома Bifidobacterium longum subsp. infantis раскрывает адаптацию к усвоению молока в микробиоме младенца. Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 105 , 18964–18969 (2008).
ADS CAS Статья PubMed PubMed Central Google ученый
Б.
 infantis уменьшает воспаление кишечника у младенцев
infantis уменьшает воспаление кишечника у младенцевВ недавнем исследовании, опубликованном в Pediatric Research , исследователи продемонстрировали, что колонизация младенцев определенным штаммом пробиотических бактерий —B. Infantis EVC001 — снижает воспаление кишечника до 55 раз по сравнению с младенцами, получающими только грудное молоко.
Марк Андервуд, профессор педиатрии и заведующий неонатологией детской больницы Калифорнийского университета в Дэвисе
Предыдущие исследования показали, что Bifidobacterium longum infantis (B.Infantis), штамм бактерий, естественным образом обитающих в кишечнике младенцев, почти полностью уничтожен у младенцев, рожденных в промышленно развитых странах. Считается, что это резкое снижение заболеваемости B. infantis связано с современными методами здравоохранения, такими как более широкое использование антибиотиков, кормление смесью и родоразрешение.
Исследователи предполагают, что недостаток B. infantis в кишечнике может быть причиной недавнего роста аутоиммунных заболеваний.
infantis в кишечнике может быть причиной недавнего роста аутоиммунных заболеваний.
«Если отсутствие B. infantis сыграло роль в росте заболеваний, связанных с воспалением, повторное введение его в раннем возрасте могло бы значительно снизить частоту возникновения некоторых из этих состояний», — сказал Марк Андервуд, соавтор исследования, и профессор педиатрии и заведующий отделением неонатологии детской больницы Калифорнийского университета в Дэвисе.
B. infantis и воспаление кишечника
В ходе исследования были изучены 37 семейств бактерий, обычно встречающихся в кишечнике младенцев, включая семейства, содержащие штаммы бактерий, продаваемые в качестве пищевых добавок. Bifidobacteriaceae были единственным семейством кишечных бактерий, которое, как было обнаружено, коррелировало со значительным снижением ключевых маркеров воспаления.
Медицинские работники ищут признаки воспаления кишечника, измеряя ключевые маркеры, такие как цитокины, кальпротектин и эндотоксин. Исследование показало, что младенцы, получавшие B. infantis EVC001, вырабатывали значительно более низкие уровни этих трех маркеров по сравнению с младенцами в контрольной группе.
Исследование показало, что младенцы, получавшие B. infantis EVC001, вырабатывали значительно более низкие уровни этих трех маркеров по сравнению с младенцами в контрольной группе.
Младенцы, колонизированные B. infantis EVC001, показали значительное снижение провоспалительных цитокинов — пептидов, связанных с повышенной кишечной проницаемостью, состоянием, которое может влиять на развитие диабета 1 типа.
Младенцы с низким содержанием Bifidobacterium показали уровни калпротектина — белка, выделяемого при воспалении кишечника — аналогично тем, которые, как было показано, вызывают вдвое больший риск астмы и атопического дерматита у доношенных детей.У младенцев с более высоким содержанием Bifidobacterium уровень фекального кальпротектина был ниже.
Наконец, у младенцев с высоким уровнем Bifidobacterium концентрация фекального эндотоксина в четыре раза ниже, что вызывает воспаление на основе TLR4 — ключевой фактор в начале некротического энтероколита (НЭК), распространенного кишечного состояния среди очень недоношенных новорожденных, которое часто со смертельным исходом.
Было показано, что уменьшение воспаления сохраняется при измерении через 30 дней после последнего кормления B. infantis EVC001.Это указывает на то, что этот бактериальный штамм может быть уникальным по своей способности колонизировать кишечник для постоянного защитного эффекта.
Соавторы исследования включают исследователей из Evolve Biosystems Inc, Университета Небраски и Калифорнийского университета в Дэвисе.
Олигосахариды грудного молока и бифидобактерии кишечника младенцев: молекулярные стратегии их использования
Основные моменты
- •
В этом обзоре представлены последние обновления, касающиеся полезной роли олигосахаридов грудного молока в микробиоме кишечника младенцев.
- •
Сначала мы пересмотрели различные структуры HMO, чтобы позже обсудить их влияние на микробиом кишечника.
- •
Мы предоставляем обновленный взгляд на молекулярные механизмы, разработанные видами Bifidobacterium , включая недавние геномные и транскриптомные исследования.

- •
Наконец, представлен современный взгляд на попытки воспроизвести эффект HMO на микробиом кишечника.
Реферат
Грудное молоко — золотой стандарт детского питания.Помимо обеспечения необходимых питательных веществ для новорожденного, он содержит несколько биоактивных молекул, которые обеспечивают защиту и стимулируют правильное развитие. Олигосахариды грудного молока (HMO) — это сложные углеводы, которых много в грудном молоке. Интересно, что эти молекулы не дают энергии младенцу. Напротив, эти олигосахариды играют ключевую роль в формировании здорового кишечного микробиома младенца, в котором преобладают полезные кишечные микробы, такие как Bifidobacterium. Новые аналитические методы для анализа гликанов и секвенирование микробных сообществ нового поколения сыграли важную роль в улучшении нашего понимания положительной роли олигосахаридов грудного молока в микробиоме кишечника, а также в геномных и молекулярных стратегиях Bifidobacterium для их использования. олигосахариды.Более того, были описаны и успешно подтверждены новые подходы к моделированию воздействия HMO на микробиом кишечника, включая включение синтетических HMO и олигосахаридов коровьего молока в детскую смесь. В этом обзоре обсуждаются последние достижения в отношении влияния ОПЗ на поддержание здорового микробиома кишечника с акцентом на молекулярную основу обогащения полезными Bifidobacterium и новые подходы к воспроизведению эффекта ОПЗ с использованием синтетических или бычьих олигосахаридов.
олигосахариды.Более того, были описаны и успешно подтверждены новые подходы к моделированию воздействия HMO на микробиом кишечника, включая включение синтетических HMO и олигосахаридов коровьего молока в детскую смесь. В этом обзоре обсуждаются последние достижения в отношении влияния ОПЗ на поддержание здорового микробиома кишечника с акцентом на молекулярную основу обогащения полезными Bifidobacterium и новые подходы к воспроизведению эффекта ОПЗ с использованием синтетических или бычьих олигосахаридов.
Ключевые слова
Олигосахариды грудного молока
Микробиом кишечника грудного ребенка
Bifidobacterium
Гликозилгидролазы
Сокращения
HMOолигосахариды грудного молока
00030003AlcNAcAlcNAc 9 -0002AlcNAc 9-N -ацетиллактозамин
SBPрастворенный белок, связывающий раствор
BMOолигосахариды коровьего молока
Рекомендуемые статьи Цитирующие статьи (0)
Полный текст © 2017 Elsevier Ltd. Все права защищены.
Все права защищены.
Рекомендуемые статьи
Цитирующие статьи
Добавка с бифидобактериями колонизирует кишечник детей, находящихся на грудном вскармливании
Добавление активированных бактерий Bifidobacterium infantis ( B. infantis ) для младенцев, находящихся на грудном вскармливании, положительно влияет на микробы кишечника младенцев , согласно недавнему исследованию, проведенному исследователями из Калифорнийского университета в Дэвисе и Evolve BioSystems Inc., работа будет представлена 9 июня на ежегодном собрании Американского общества питания в Бостоне Бетани Хенрик, директором отдела иммунологии и диагностики в Evolve BioSystems от имени соисследователя исследования Дженнифер Смиловиц, заместителя директора по исследованиям на людях в Институте пищевых продуктов для здоровья Калифорнийского университета в Дэвисе.
Присутствие B. infantis в кишечнике младенцев связано с пользой для здоровья, и эти бактерии питаются грудным молоком. Однако эти полезные бактерии присутствуют в значительно более низких количествах у младенцев, находящихся на грудном вскармливании, в развитых странах, чем в развивающихся странах.
Однако эти полезные бактерии присутствуют в значительно более низких количествах у младенцев, находящихся на грудном вскармливании, в развитых странах, чем в развивающихся странах.
Матери и младенцы, участвовавшие в исследовании, получали либо B. infantis , либо поддержку лактации, либо только поддержку лактации в период от семи до 21 дня после рождения.Бактерии быстро прижились у младенцев, вытесняя другие кишечные бактерии, связанные с кишечными проблемами и иммунными заболеваниями, такими как астма, аллергия и аутоиммунные заболевания. Кроме того, добавление B. infantis также изменило биохимический состав детских фекалий. Эти благоприятные изменения длились до года у младенцев, которые находились на грудном вскармливании.
Эти результаты предлагают возможный метод улучшения здоровья кишечного микробиома и предотвращения связанных с иммунитетом заболеваний у детей, находящихся на грудном вскармливании, в развитых странах.
Информация о презентации
Название : Bifidobacterium longum subsp. Infantis стабильно восстанавливает микробиом кишечника младенца в течение первого года жизни
Infantis стабильно восстанавливает микробиом кишечника младенца в течение первого года жизни
Сессия : Пищевая микробиология: влияние на микробиом кишечника посредством выбора диеты и образа жизни для воздействия на здоровье
Время : суббота, 9 июня, 13:00
(PDF) Сравнительное исследование бифидобактерий у младенцев и взрослых людей
3
Хотя предполагалось, что проглатывание плодом околоплодных вод является пренатальным источником
микроорганизмов, колонизирующих желудочно-кишечный тракт [1], на самом деле колонизация
начинается во время и после рождения, источником микроорганизмов являются фекальные и вагинальные бактерии матери
, пища, окружающая среда, контакт кожи с другими людьми и
воздух [2, 3].Факультативные бактерии, такие как стрептококки, стафилококки, энтерококки и
Enterobacteriaceae, первыми колонизируют кишечник из-за наличия высокого уровня кислорода
, но поскольку эти микроорганизмы снижают уровень кислорода, кишечник
среда становится более благоприятной для роста таких анаэробов, как бифидобактерии,
Bacteroides и клостридии [4, 5]. Двумя основными детерминантами раннего состава микробиоты кишечника
Двумя основными детерминантами раннего состава микробиоты кишечника
являются способ доставки и переваривание грудного молока или молочной смеси.
Однако следует отметить, что в настоящее время большинство смесей для младенцев содержат пребиотические соединения
, которые усиливают рост бифидобактерий. В ходе этого исследования было подтверждено, что 3 из 10
младенцев получали молочные смеси, содержащие пребиотики. Один ребенок
употреблял молочную смесь, не содержащую пребиотиков, и нет информации о
молочной смеси, потребляемой другими детьми (Таблица 1). Микроорганизмы проникают
в желудочно-кишечный тракт новорожденного из влагалищной и перианальной областей матери [6].
Подобные микробные популяции наблюдаются у матерей и их младенцев, когда младенцы
рожают естественным путем [7]. С другой стороны, кесарево сечение лишает новорожденного
материнской вагинальной и фекальной микробиоты. Chen et al. сравнили уровни
бифидобактерий и лактобактерий у младенцев на грудном вскармливании, рожденных вагинально, с
у младенцев на грудном вскармливании, рожденных с помощью кесарева сечения, и показали, что у младенцев, рожденных вагинально
, были более высокие популяции как бифидобактерий, так и лактобацилл,
, и они пришли к выводу, что популяция бифидобактерий была более нарушена, чем
лактобактерий у младенцев, рожденных путем кесарева сечения [8].


 Самый распространенный аналог лекарства – Бифиформ. Подробнее о нем>>>
Самый распространенный аналог лекарства – Бифиформ. Подробнее о нем>>>


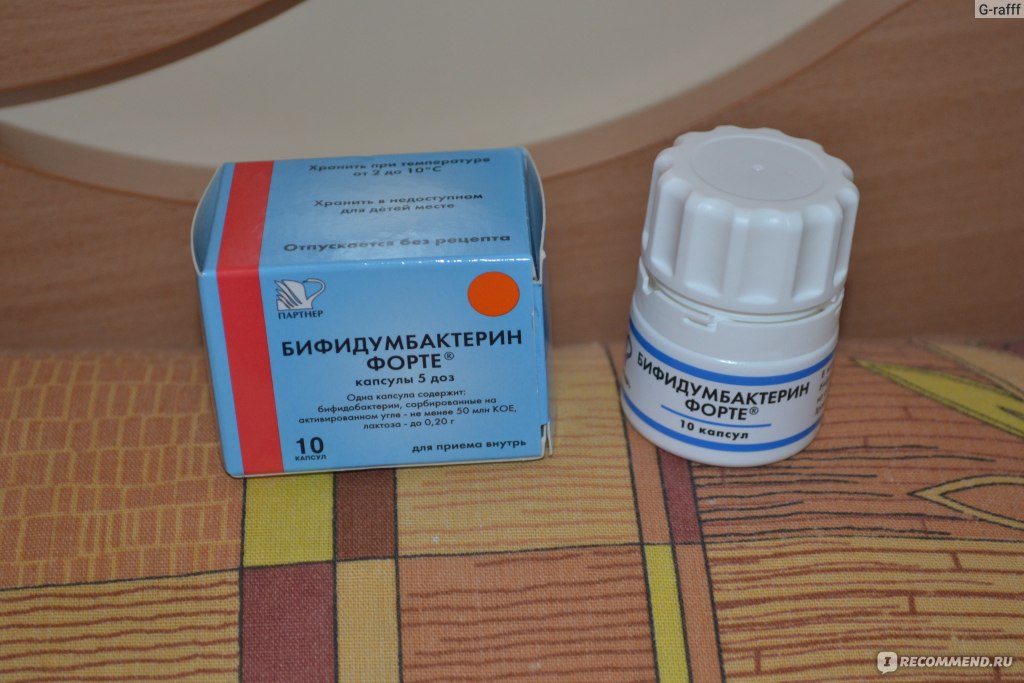 У детей постарше и взрослых – в комплексной терапии синдрома раздраженного кишечника.
У детей постарше и взрослых – в комплексной терапии синдрома раздраженного кишечника.


 Другие виды Bifidobacterium переваривают только некоторые ОПЗ, а некоторые делают это извне. Переваривание HMO с помощью MOM Bifidobacterium приводит к выработке лактата и ацетата короткоцепочечных жирных кислот, которые секретируются в просвет кишечника. Эти молекулы снижают pH в кишечной среде, что улучшает их транспорт в эпителий для использования хозяином и создает нежелательную среду для потенциальных патогенов, таких как E.coli .
Другие виды Bifidobacterium переваривают только некоторые ОПЗ, а некоторые делают это извне. Переваривание HMO с помощью MOM Bifidobacterium приводит к выработке лактата и ацетата короткоцепочечных жирных кислот, которые секретируются в просвет кишечника. Эти молекулы снижают pH в кишечной среде, что улучшает их транспорт в эпителий для использования хозяином и создает нежелательную среду для потенциальных патогенов, таких как E.coli .