Акдс прививка от чего делают: Национальный календарь профилактических прививок
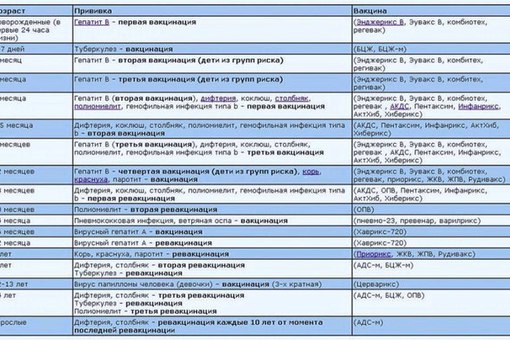
| Вид прививки | Возраст ребенка | Примечания |
| Первая вакцинация против вирусного гепатита В | Проводится новорожденному в первые сутки жизни | Инъекция делается в роддоме внутримышечно в плечо или бедро ребенка. Требуется письменное согласие на вакцинацию матери. |
| Вакцинация против туберкулеза (БЦЖ-М) | Проводится новорожденному на 3-7 день жизни | Инъекция делается в роддоме внутрикожно в левое плечо. Требуется письменное согласие на вакцинацию матери. Другие прививки можно проводить не ранее чем через 1 месяц после БЦЖ. |
| Вторая вакцинация против вирусного гепатита В | Проводится ребенку после 1 месяца от рождения | Если сроки были сдвинуты, то через 1 месяц после первой. Прививка делается в детской поликлинике после осмотра педиатра и письменного согласия матери. |
| Первая вакцинация против дифтерии, коклюша, столбняка (АКДС) | Проводится ребенку в 3 месяца | Прививка делается в детской поликлинике после осмотра педиатра и письменного согласия матери. Ребенок должен быть совершенно здоров и после болезни должен пройти месяц. Инъекция проводится внутримышечно в плечо, бедро или под лопатку. Детям до года чаще всего делают в бедро. |
| Первая вакцинация против полиомиелита | Проводится ребенку в 3 месяца | Прививка делается в детской поликлинике после осмотра педиатра и письменного согласия матери. Вакцина против полиомиелита делается в один день с АКДС. Инактивированная полиомиелитная вакцина вводится подкожно под лопатку или в плечо, а также может быть введена внутримышечно в бедро. Вакцины закупаются за рубежом, поэтому заблаговременно узнавайте о ее наличие в поликлинике. Вакцинация производится трехкратно с интервалом в 45 дней. |
| Первая вакцинация против гемофильной инфекции | Проводится ребенку в 3 месяца | Прививка делается в детской поликлинике после осмотра педиатра и письменного согласия матери. Вакцина против гемофильной инфекции делается в один день с АКДС и вакциной против полиомиелита. Вводится внутримышечно в бедро или плечо, но при этом это должна быть другая рука или нога, в которую еще не производились инъекции. |
| Вторая вакцинация против дифтерии, коклюша, столбняка (АКДС) | Проводится ребенку в 4,5 месяца | Прививка делается в детской поликлинике после осмотра педиатра и письменного согласия матери через 45 дней после первой вакцинации. Инъекция вводится внутримышечно в плечо, бедро или под лопатку. |
| Вторая вакцинация против полиомиелита | Проводится ребенку в 4,5 месяца | Прививка делается в детской поликлинике после осмотра педиатра и письменного согласия матери. Вакцинация от полиомиелита выполняется в один день с АКДС через 45 дней после первой вакцинации. Инъекция выполняется подкожно в плечо, под лопатку или внутримышечно в бедро. Вакцинация от полиомиелита выполняется в один день с АКДС через 45 дней после первой вакцинации. Инъекция выполняется подкожно в плечо, под лопатку или внутримышечно в бедро. |
| Вторая вакцинация против гемофильной инфекции | Проводится ребенку в 4,5 месяца | Прививка делается в детской поликлинике после осмотра педиатра и письменного согласия матери. Вакцинация от гемофильной инфекции проводится в один день с АКДС через 45 дней после первой вакцинации. Инъекция выполняется внутримышечно в бедро или плечо, но при этом это должна быть другая рука или нога, в которую еще не производились инъекции. |
| Третья вакцинация против дифтерии, коклюша, столбняка (АКДС) | Проводится ребенку в 6 месяцев | Прививка делается в детской поликлинике после осмотра педиатра и письменного согласия матери через 45 дней после второй вакцинации. Инъекция вводится внутримышечно в плечо, бедро или под лопатку. |
| Третья вакцинация против полиомиелита | Проводится ребенку в 6 месяцев | Прививка делается в детской поликлинике после осмотра педиатра и письменного согласия матери. |
| Третья вакцинация против гемофильной инфекции | Проводится ребенку в 6 месяцев | Прививка делается в детской поликлинике после осмотра педиатра и письменного согласия матери. Вакцинация проводится в один день с АКДС через 45 дней после второй вакцинации. Инъекция проводится внутримышечно в бедро или плечо. |
| Третья вакцинация против вирусного гепатита В | Проводится ребенку в 6 месяцев | Прививка проводится в детской поликлинике после осмотра педиатра и письменного согласия матери через 6 месяцев после первой прививки. Инъекция проводится внутримышечно в плечо или бедро. |
| Вакцинация против кори, эпидемического паротита, краснухи (КПК) | Проводится ребенку в 1 год | Прививка проводится в детской поликлинике после осмотра педиатра и письменного согласия матери. Инъекция вводится подкожно в бедро или плечо. Инъекция вводится подкожно в бедро или плечо. |
| Первая ревакцинация против дифтерии, коклюша, столбняка | Проводится ребенку в 18 месяцев | Прививка проводится в детской поликлинике после осмотра педиатра и письменного согласия матери через год после законченой вакцинации. Способы введения те же. |
| Первая ревакцинация против полиомиелита | Проводится ребенку в 18 месяцев | Прививка проводится в детской поликлинике после осмотра педиатра и письменного согласия матери совместно с АКДС. Живая оральная полиомиелитная вакцина закапывается в рот на лимфоидную ткань глотки. Пить и есть в течение часа строго запрещается. |
| Вторая ревакцинация против полиомиелита | Проводится ребенку в 20 месяцев | Прививка проводится в детской поликлинике после осмотра педиатра и письменного согласия матери через 2 месяца после первой ревакцинации живой оральной полиомиелитной вакциной. |
| Ревакцинация против кори, краснухи, эпидемического паротита | Проводится ребенку в 6 лет | Вакцинация проводится в детской поликлинике после осмотра педиатра и письменного согласия матери через 6 месяцев после вакцинации. Основным условием применения вакцины является отсутствие в анамнезе перенесенных заболеваний: кори, краснухи, эпидемического паротита до 6 лет. Способ введения тот же. |
| Вторая ревакцинация против дифтерии, столбняка (АДС) | Проводится ребенку в 6-7 лет | Вакцинация проводится в детской поликлинике после осмотра педиатра и письменного согласия матери через 5 лет после первой ревакцинации. Инъекция вводится внутримышечно под лопатку. |
| Ревакцинация против туберкулеза | Проводится ребенку в 7 лет | Вакцинация проводится в детской поликлинике после осмотра педиатра и письменного согласия матери при отрицательной реакции Манту. Инъекция вводится внутрикожно в левое плечо. |
| Третья ревакцинация против дифтерии, столбняка | Проводится подростку в 14 лет | Вакцинация проводится в детской поликлинике после осмотра педиатра и письменного согласия матери через 7 лет после второй ревакцинации. Инъекция вводится внутримышечно под лопатку. |
| Третья ревакцинация против полиомиелита | Проводится подростку в 14 лет | Вакцинация проводится в детской поликлинике после осмотра педиатра и письменного согласия матери через 12 лет 2 месяца после второй ревакцинации. Живая оральная полиомиелитная вакцина закапывается на поверхность небных миндалин, чтобы сформировался иммунитет. Нельзя пить и есть в течение часа после прививки. |
Вакцинация детей. Особенности, противопоказания.
Вакцинация детей вызывает огромное количество вопросов и споров у родителей. Делать или не делать прививку ребенку? Как выбрать оптимальный момент для вакцинации? Какую вакцину выбрать? На эти и многие другие вопросы ответила врач-педиатр сети многопрофильных клиник «ДИАЛАЙН» Старостина Анастасия Витальевна
Как укрепить иммунитет ребенка?
Одним из способов специфической профилактики инфекционных болезней является вакцинация.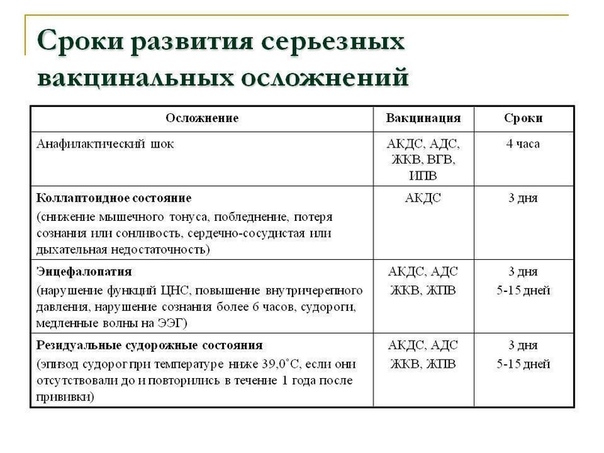
Вакцины помогают развить иммунитет, имитируя инфекцию, но эта «имитация» инфекции не вызывает болезни. Благодаря вакцинации иммунная система получает защиту против инфекции. Эта защита строго специфична. Например, прививка АКДС защищает лишь от коклюша, дифтерии, столбняка. Вакцина от гриппа гарантирует защиту от гриппа, но не защищает от большинства простудных заболеваний.
Бесспорно, вакцинация, имитация инфекции может вызвать незначительные симптомы, такие как лихорадка, припухлость, боль в месте укола. Это являются нормой, так организм создает иммунитет. Отличительной особенностью вакцин является защита от самой инфекции и от её осложнений.
Не лучше ли переболеть инфекцией, выработать естественный иммунитет?
Многие инфекционные заболевания, такие как корь, дифтерия, коклюш, столбняк смертельно опасны. Особенно подвержены этим болезням и риску осложнений дети первых 2-х лет жизни, младенцы.
Особенно подвержены этим болезням и риску осложнений дети первых 2-х лет жизни, младенцы.
Таким образом, без вакцин ребенок рискует тяжело заболеть, получить риск осложнений, инвалидности и даже смерти от таких болезней, как корь, коклюш, столбняк, гемофильная инфекция. Основные риски вакцинации связаны с такими побочными эффектами, как лихорадка, покраснение, отек, боль в месте укола, которые самостоятельно исчезают в течение нескольких дней.
Серьезные побочные эффекты вакцинации в виде тяжелой аллергической реакции очень редки, встречаются в 1-2 случаях на миллион. Профилактические преимущества прививок намного больше, чем возможные осложнения от перенесенной настоящей инфекции. Важно своевременно начать вакцинопрофилактику и защитить своего малыша от инфекционных болезней и риска осложнений.
Есть ли противопоказания к вакцинации?
Конечно же, существуют противопоказания к вакцинопрофилактике. На сновании осмотра ребенка, беседы с родителями доктор определяет, разрешена ли прививка или нет. В случае острого заболевания, ОРВИ например, разумно отложить вакцинацию до периода выздоровления. Связано это не с тем, что прививка может навредить, а с тем, что в случае осложнения ОРВИ, оно может быть истолковано как следствие проведенной вакцинации, что напугает родителей и приведет к необоснованному отказу от прививок в будущем. В случае обострения хронических заболеваний, бронхиальной астмы, атопического дерматита, вакцинацию следует отложить до периода максимально полной ремиссии.
В случае острого заболевания, ОРВИ например, разумно отложить вакцинацию до периода выздоровления. Связано это не с тем, что прививка может навредить, а с тем, что в случае осложнения ОРВИ, оно может быть истолковано как следствие проведенной вакцинации, что напугает родителей и приведет к необоснованному отказу от прививок в будущем. В случае обострения хронических заболеваний, бронхиальной астмы, атопического дерматита, вакцинацию следует отложить до периода максимально полной ремиссии.
Очень часто родители отказываются от вакцинации, если у их детей есть аллергия или хронические заболевания, но это в корне неправильно. Дети-аллергики, а также дети с хроническими заболеваниями нуждаются в проведении прививок, т.к. инфекционные болезни у них протекают тяжелее, чем у здоровых детей. Например, коклюш для больного бронхиальной астмой очень опасен. Ветряная оспа способна вызывать эндокардит у больных с пороками сердца.
Каким вакцинам отдать предпочтение, российским или импортным?
Всё вакцины безопасны и эффективны в плане выработки иммунитета. Удобство зарубежных в их комбинации. Например, вакцина Пентаксим защищает сразу от 5 болезней: коклюш, дифтерия, столбняк, полиомиелит, гемофильная инфекция. При выборе отечественных прививок ребенок вынужден получить 3 укола, т.к. АКДС это одна вакцина, один шприц, полиомиелит, вторая и вакцина от гемофильной инфекция третий укол. Большинство вакцин отлично комбинируются друг с другом. Допустимо вводить несколько вакцин одновременно. Это сокращает количество посещений поликлиники. Комбинация вакцин позволяет своевременно, в короткие сроки уберечь малыша от болезней. Затягивая вакцинацию на длительные сроки, мы увеличиваем шанс ребенка встретить настоящий вирус или бактерию и заболеть, серьезной инфекцией.
Удобство зарубежных в их комбинации. Например, вакцина Пентаксим защищает сразу от 5 болезней: коклюш, дифтерия, столбняк, полиомиелит, гемофильная инфекция. При выборе отечественных прививок ребенок вынужден получить 3 укола, т.к. АКДС это одна вакцина, один шприц, полиомиелит, вторая и вакцина от гемофильной инфекция третий укол. Большинство вакцин отлично комбинируются друг с другом. Допустимо вводить несколько вакцин одновременно. Это сокращает количество посещений поликлиники. Комбинация вакцин позволяет своевременно, в короткие сроки уберечь малыша от болезней. Затягивая вакцинацию на длительные сроки, мы увеличиваем шанс ребенка встретить настоящий вирус или бактерию и заболеть, серьезной инфекцией.
Есть ли какие-то сезонные вакцинации?
Близится осенний период, а значит время простуд и гриппа. Вакцина против гриппа является хорошей идеей для всех семьи. Очень важно защитить свою семью от гриппа и вакцинироваться вместе.
Младенцы младше 6 месяцев не могут получить вакцину в силу раннего возраста, но если родители и старшие дети вакцинируются, это защитит не только их, но и малыша. Это важно, т.к. младенцы более подвержены риску серьезных осложнений от гриппа, таких как пневмония, например.
Это важно, т.к. младенцы более подвержены риску серьезных осложнений от гриппа, таких как пневмония, например.
Важно понимать, что сама прививка от гриппа не вызывает болезни. Да, переболеть ОРВИ на протяжении осенне-зимнего периода можно. Но грипп это не обычная простуда. Это тяжелая инфекция, которая протекает с минимальными катаральными симптомами, т.е. насморк и кашель будет менее выражены, а вот лихорадка, нарушение общего самочувствия, головная и мышечные боли преобладать. Частым осложнением гриппа является пневмония, которая очень тяжело поддается лечению. Поэтому проще не допустить развитие этих событий, чем пустить ситуацию на самотек.
Сезон гриппа проходит с октября по май. Начинать вакцинацию можно уже с конца августа — начала сентября. Но допустимо сделать прививку и в сезон гриппа, вплоть до апреля — мая месяца.
Кому показана прививка от гриппа?
- Всем детям старше 6 месяцев .
- Родителям, опекунам детей, которые посещают детские сады, школы.

- Лицам старше 65 лет.
- Беременным и планирующим беременность, а также лактирующим женщинам.
- Лицам с иммунодефицитами, онкологическим больным.
- Военнослужащим, а также детям, находящимся в закрытых коллективах (дома ребенка, школы интернаты)
- Взрослым, подростки и детям с хроническим заболеванием, такими как астма.
Если у Вас возникли вопросы по поводу вакцинации, если вы сомневаетесь стоит или нет вакцинировать своего ребенка, с каких прививок начать мы будем рады ответить на ваши вопросы и помочь с выбором.
Мифы и правда о прививках
Благодаря прививкам навсегда исчезли чума и холера, истребляющие государства и континенты.
Вакцинация стёрла с лица земли чёрную (натуральную) оспу, смертность от которой достигала 40%, а у выживших людей навсегда оставляла обезображивающие рубцы на лице и теле. Окончательное исчезновение оспы в мире было объявлено на Ассамблее ВОЗ в 1980 году. С того же времени была прекращена сама вакцинация от оспы. В наше время благодаря прививкам удалось остановить распространение полиомиелита в большинстве стран.
С того же времени была прекращена сама вакцинация от оспы. В наше время благодаря прививкам удалось остановить распространение полиомиелита в большинстве стран.
Без прививок сейчас в мире бушевали бы эпидемии опасных инфекций, распространяясь по всему миру гораздо быстрее, чем два века назад.
Какие мифы о прививках наиболее распространены
Вся правда о прививках — волнующая тема для родителей и животрепещущая — для СМИ. Рассмотрим, как опровергают врачи некоторые мифы о прививках.
Миф № 1 — о вакцинах, содержащих ртуть
«Вакцины содержат ртуть в качестве консерванта и провоцируют развитие аутизма у детей»
Правда такова — в составе некоторых вакцин действительно в качестве консерванта содержится этил ртути (мертиолят или тимеросал). Этил ртути используется для защиты вакцины от попадания в неё микробов. Однако незначительное количество тимеросала в 1 дозе 6 мкг не может навредить здоровью. По нормативам ВОЗ, грудной ребёнок, может, без опасения для здоровья получать в неделю 5 мкг ртути. К тому же мертиолят выводится из организма меньше чем за неделю, в то время как метил ртути может находиться до 40 дней. В действительности, содержание ртути в продуктах питания, которые мы употребляем, намного выше, чем в 1 дозе вакцины. К примеру, в креветках содержится ртути 27 мкг на 1 кг. В тунце, который мы употребляем, ртути содержится до 165 на 1 кг, а в жареном палтусе 70 мкг на 1 кг.
К тому же мертиолят выводится из организма меньше чем за неделю, в то время как метил ртути может находиться до 40 дней. В действительности, содержание ртути в продуктах питания, которые мы употребляем, намного выше, чем в 1 дозе вакцины. К примеру, в креветках содержится ртути 27 мкг на 1 кг. В тунце, который мы употребляем, ртути содержится до 165 на 1 кг, а в жареном палтусе 70 мкг на 1 кг.
Тем не менее под давлением общественности производители стали создавать вакцины без добавления тимеросала. В настоящее время в РФ имеются в продаже тимеросал содержащие и без него вакцины. Россия выпускает вакцину от гепатита B «Комбиотех» без содержания мертиолята (тимеросал). Отказ от прививок вакцинами, которые содержат мертиолят, однако, не смог остановить нарастание аутизма во всех странах, потому что природа аутизма генетически обусловлена и не связана с прививками.
Миф № 2 — о заработке государства на прививках
«Государство и врачи зарабатывают деньги на вакцинации, а дети страдают от прививок»
Правда — в обязанности врачей входит обеспечение прививками населения, но они не получают за это премию либо другой вид денежного вознаграждения. Что касается прибыли государства от прививок, то, напротив, оно берёт на себя охрану населения от инфекций и обеспечивает бесплатную вакцинацию по календарю. Кроме того, дорогостоящий процесс создания вакцин также финансируется государственным бюджетом.
Что касается прибыли государства от прививок, то, напротив, оно берёт на себя охрану населения от инфекций и обеспечивает бесплатную вакцинацию по календарю. Кроме того, дорогостоящий процесс создания вакцин также финансируется государственным бюджетом.
Миф № 3 — прививки хуже инфекций
«Прививки более страшны, чем сама инфекция»
Правда о прививке — каждый лекарственный препарат, в том числе вакцины, имеют допустимые побочные действия. Осложнения после прививки развиваются в отдельных случаях, а вот после перенесённой болезни — гораздо чаще и тяжелее. По информации ВОЗ такое осложнение, как вакциноассоциированный паралитический полиомиелит наблюдается в 1 случае из 1500000 прививок. Такое осложнение, к тому же чаще развивается после применения живой оральной вакцины. В России сейчас стоит вопрос о прекращении использования живой и замены её на инактивированную вакцину. В случае же заражения полиомиелитом параличи по статистике развиваются в каждом десятом случае. При прошедшей эпидемии полиомиелита в Африке почти в каждом классе школ имелся искалеченный параличом ученик.
При прошедшей эпидемии полиомиелита в Африке почти в каждом классе школ имелся искалеченный параличом ученик.
По другим инфекциям статистика осложнений также печальна. Заболевание дифтерией заканчивается летальным исходом в 1 случае из 20. При эпидемии кори осложнение в виде пневмонии развивается в 6 случаях из 100. Энцефалит как осложнение кори выявляется в 1 случае из 1000. Прививка же от кори в большинстве случаев протекает в форме лёгкой реакции на месте инъекции.
Миф № 4 — о прививке вакциной АКДС
«Прививка АКДС даёт слишком много реакций, и вакцину нужно отменить»
Правда действительно совпадает с нареканиями. Однако нужно учесть, что тяжёлые побочные реакции от прививки вакциной АКДС даёт только её коклюшный компонент. В 70-х годах в Японии прививка АКДС была отменена. Три последующих года без вакцинации повлекли за собой подъем заболеваемости коклюшем, приведший к 41 смертельному исходу на 13 000 заболевших. Инфекцию удалось погасить возобновлением прививок с применением другой, более лёгкой вакцины. Во многих странах, в том числе в России, для поддержания иммунитета от коклюша при ревакцинации стала применяться бесклеточная вакцина «Инфанрикс». Она настолько же эффективна, как цельноклеточная АКДС, но даёт намного меньше реакций.
Во многих странах, в том числе в России, для поддержания иммунитета от коклюша при ревакцинации стала применяться бесклеточная вакцина «Инфанрикс». Она настолько же эффективна, как цельноклеточная АКДС, но даёт намного меньше реакций.
Миф № 5 — о вине прививок в смерти детей
«Вакцинация повинна во внезапной младенческой смерти»
Правда — в мифах о прививках циркулирует неподтвержденная научно идея о связи вакцинации с внезапной смертью детей раннего детского возраста. Так называемый синдром внезапной младенческой или детской смерти (СВМС или СВДС).
Внезапная смерть взрослого человека или младенца известна не только врачам во всём мире. Из общего числа внезапных летальных исходов детская смертность составляет не более 9%. Чаще всего синдром регистрируется в США, Новой Зеландии, Англии, России. Большинство случаев младенческой смертности в возрасте 2–4 месяцев регистрируется как раз во время проведения прививок. В связи с этим исследования, проведённые в институте США, не смогли доказать причастность прививок к синдрому детской смертности.
Миф № 6 — о вреде прививок для детей до года
«Нужно подождать с прививками до года, когда ребёнок окрепнет, и тогда уже прививать»
Правда в том, что у ребёнка до шестимесячного возраста имеются в организме защитные материнские антитела. По истечении 6 месяцев он ещё может получать антитела против инфекций с молоком матери. При искусственном вскармливании иммунная система ребёнка после 6 месяце очень уязвима против инфекций. В этом возрасте ребёнок начинает активную жизнь и контактирует с родственниками и соседями, подвергаясь риску инфицирования.
К 6 месяцам ребёнок по календарю прививок успевает получить защиту против туберкулёза, гепатита B, дифтерии, коклюша, столбняка и полиомиелита. Таким образом, прививки гарантируют малышу безопасное знакомство с окружающим миром.
Миф № 7 — о вреде прививки против гепатита
«Гепатитная вакцина разрушает печень»
Правда такова, что прививка от гепатита B не может оказать отрицательного воздействия на печень, так как вакцина не метаболизируется в ней. Сложные химические процессы расщепления и трансформации вакцины происходят в плазме крови, а не в печёночных клетках. Антиген вакцины захватывается кровяными клетками, после чего в ответ иммунные клетки индуцируют антитела против вируса гепатита.
Сложные химические процессы расщепления и трансформации вакцины происходят в плазме крови, а не в печёночных клетках. Антиген вакцины захватывается кровяными клетками, после чего в ответ иммунные клетки индуцируют антитела против вируса гепатита.
Миф № 8 — о замалчивании вреда от прививок
«Государство замалчивает действительное число случаев побочного действия прививок»
Правда состоит в том, что согласно закону «Об иммунопрофилактике инфекционных заболеваний» все случаи побочного действия вакцин входят в государственную статистику. Случаи осложнений после прививок врачи докладывают в Федеральную службу по защите прав населения — Роспотребнадзор. Система регистрации и расследования осложнений после прививок в России на самом деле действует.
Миф № 9 — лучше переболеть, чем сделать прививку
«Прививка не обеспечивает 100% защиту от инфекции, тогда уж лучше переболеть»
Правда в том, что целью прививки является не только предупреждение от заражения, но также избавление от тяжёлых форм инфекций со смертельным исходом. Даже если прививка даст защиту не на 100%, а меньше, то в случае заражения человек переболеет более лёгкой формой инфекционного заболевания. В таком случае у заражённого пациента не будет тяжёлых осложнений, которые могут привести к инвалидности на всю жизнь.
Даже если прививка даст защиту не на 100%, а меньше, то в случае заражения человек переболеет более лёгкой формой инфекционного заболевания. В таком случае у заражённого пациента не будет тяжёлых осложнений, которые могут привести к инвалидности на всю жизнь.
Миф № 10 — о вреде комбинированных прививок
«Если уж прививать ребёнка, то не одновременно от нескольких инфекций, а раздельно, через интервал, чтобы не перегружать его иммунную систему»
Правда в том, что даже детский организм в состоянии воспринять одновременно 10 тысяч антигенов и выработать иммунитет. В комбинированной вакцине АКДС — 3002 антигена. А в комбинированной пятивалентной вакцине «Пентаксим» — всего 45 антигенов. Иммунная система при этом не напрягается, а тренируется. Комбинированные вакцины при совместном применении содержат меньше добавок, чем сумма тех же вакцин раздельно. Это значит, что риск аллергических реакций от комбинированных прививок в итоге уменьшается.
Кроме того, с вакциной человек получает меньше антигенов, чем с пищей, воздухом и водой. Ведь только в воздухе содержится неисчислимое количество различных антигенов микробов. А питьевая вода всегда содержит антигены в виде палочек и бактерий, которые мы не видим невооружённым глазом. И к такой армии антигенов организм адаптируется и вырабатывает антитела. Вы замечали, что, когда мы приезжаем в другую местность, где меняется питьевая вода, первое время случается расстройство пищеварительного тракта. Это происходит, потому что иммунная система ещё не выработала антитела к бактериальному составу местной воды. Но вот проходит 2–3 дня, и наша иммунная система выработала антитела, которые автоматически продолжают успешно бороться с бактериями местной воды.
Ведь только в воздухе содержится неисчислимое количество различных антигенов микробов. А питьевая вода всегда содержит антигены в виде палочек и бактерий, которые мы не видим невооружённым глазом. И к такой армии антигенов организм адаптируется и вырабатывает антитела. Вы замечали, что, когда мы приезжаем в другую местность, где меняется питьевая вода, первое время случается расстройство пищеварительного тракта. Это происходит, потому что иммунная система ещё не выработала антитела к бактериальному составу местной воды. Но вот проходит 2–3 дня, и наша иммунная система выработала антитела, которые автоматически продолжают успешно бороться с бактериями местной воды.
В заключение подчеркнём, что большинство мифов о вакцинации рождаются от медицинской неосведомлённости и страха перед неизвестным. Надеемся, что наши ответы внесли ясность и позволят изменить отношение людей к вакцинации.
В России производство вакцин осуществляется в государственных НИИ. Наблюдение за качеством выпускаемых вакцин ведёт НИИ стандартизации и контроля медицинских биологических препаратов им. Л. А. Тарасевича. Все вакцины проходят лабораторные и клинические испытания на безопасность применения. Случаи реакций на прививку врачи сообщают в Роспотребнадзор. Закупка импортных вакцин и их регистрация в России проводятся под контролем Министерства Здравоохранения.
Л. А. Тарасевича. Все вакцины проходят лабораторные и клинические испытания на безопасность применения. Случаи реакций на прививку врачи сообщают в Роспотребнадзор. Закупка импортных вакцин и их регистрация в России проводятся под контролем Министерства Здравоохранения.
пять бед – один ответ
Фото: НПО «Микроген»
В апреле этого года первая отечественная пентавакцина для профилактики пяти «детских» инфекций получила регистрацию Минздрава России. Вакцина создана предприятием холдинга «Нацимбио» Госкорпорации Ростех и предназначена для детей в возрасте шести месяцев. Новый препарат заменит иностранные аналоги и может войти в Национальный календарь прививок.
Всеобщий тренд: от моно- к поливакцинам
Новая пентавакцина аАКДС–ГепB+Hib – это препарат комбинированного действия, который способен защитить организм ребенка от пяти распространенных и опасных инфекций: дифтерии, столбняка, коклюша, гепатита B и гемофильной инфекции.
Профилактические прививки против дифтерии, коклюша и столбняка в России и многих других странах начали широко проводиться с конца 1950-х гг. Всем известная АКДС (адсорбированная коклюшно-дифтерийно-столбнячная вакцина) считается обязательной для планового проведения на всей территории России.
Ребенку для формирования достаточного количества антител, обеспечивающих защиту от коклюша, столбняка и дифтерии, вводятся три дозы вакцины АКДС – первая в возрасте 3 месяцев, вторая – в 4,5 месяцев, третья – в полгода. Одновременно с АКДС положено делать прививки от полиомиелита, гемофильной инфекции, а в 6 месяцев – еще и от гепатита B.
Комбинированные вакцины «пять в одном» за рубежом применяются уже около 15 лет. До недавнего времени в России сделать прививку одновременно от пяти заболеваний можно было только иностранными препаратами. Новая отечественная пентавакцина разработки «Нацимбио» по своим характеристикам ничем не уступает зарубежным аналогам. При этом, как отметил исполнительный директор Ростеха Олег Евтушенко, регистрация первой российской пентавакцины – еще один шаг к обеспечению иммунобиологической независимости страны.
При этом, как отметил исполнительный директор Ростеха Олег Евтушенко, регистрация первой российской пентавакцины – еще один шаг к обеспечению иммунобиологической независимости страны.
Многокомпонентная вакцина признана не только иммунологами, но и родителями во всем мире. Причины популярности поливакцины нетрудно объяснить: зачем лишний раз делать по несколько прививок в виде разных препаратов, когда можно обойтись одним уколом. Если раньше иммунизация ребенка в возрасте шести месяцев от коклюша, дифтерии, столбняка, гепатита В и гемофильной инфекции подразумевала несколько разных уколов, то сейчас это одна инъекция, что конечно же меньше травмирует младенца и уменьшает количество визитов в поликлинику.
Переход от моно- к поливакцинам можно считать всеобщим трендом. «Реализуя проекты импортозамещения в иммунобиологии, мы параллельно решаем серьезную проблему, связанную с необходимостью модернизации Национального календаря профилактических прививок в части перехода от моно- к поливакцинам. В ближайшей перспективе мы предложим рынку три поливакцины от социально значимых заболеваний», – прокомментировал гендиректор «Нацимбио» Андрей Загорский.
В ближайшей перспективе мы предложим рынку три поливакцины от социально значимых заболеваний», – прокомментировал гендиректор «Нацимбио» Андрей Загорский.
Стойкий иммунитет с минимальной нагрузкой на организм
Главная цель любых иммунологических мероприятий – создать у человека стойкий иммунитет к какой-то инфекции с минимальной нагрузкой на организм. Считается, что основной ущерб наносится консервирующими и вспомогательными веществами в препарате. Поэтому объединение нескольких вакцин в одну, позволяет в 2-3 раза уменьшить количество так называемых балластных веществ и консервантов.
Кстати, отечественная пентавакцина вовсе не имеет в своем составе мертиолята – антисептика, применяемого в ситуациях, когда вакцины производят в многодозовых флаконах, для предотвращения бактериального инфицирования растворов.
Мертиолят – это органическое соединение ртути. Сегодня в интернете можно обнаружить многочисленные дискуссии о достоинствах и недостатках мертиолята.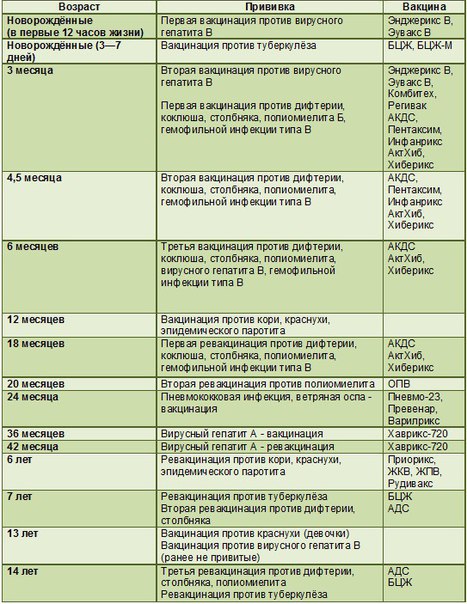 Множество исследований, проведенных во всем мире, доказали, что он не способен причинить вред организму ребенка. Говоря другими словами, доказательная медицина опасность мертиолята подтвердить не смогла. Несмотря на это, производители переходят на вакцины в одноразовых и однодозовых шприцах, что в любом случае намного удобней.
Множество исследований, проведенных во всем мире, доказали, что он не способен причинить вред организму ребенка. Говоря другими словами, доказательная медицина опасность мертиолята подтвердить не смогла. Несмотря на это, производители переходят на вакцины в одноразовых и однодозовых шприцах, что в любом случае намного удобней.
Еще одно преимущество новой вакцины «Микрогена» – снижение нагрузки на иммунитет. Препарат содержит в два раза меньше столбнячного антигена и в полтора раза меньше дифтерийного, сохраняя иммунологическую активность, сопоставимую с зарубежными препаратами. Также в новой вакцине содержится в два раза меньше антигена гепатита В по сравнению с моновакцинами против этого заболевания.
И, пожалуй, одно из главных достоинств отечественной пентавакцины – наличие в ее составе бесклеточного коклюшного компонента, в отличие от цельноклеточного в АКДС. Именно цельная бактерия возбудителя коклюша обладает очень реактогенной оболочкой. Освобождение микробной клетки от ненужных белков помогло создать бесклеточный коклюшный компонент, который гарантирует прививке высокий уровень безопасности. Можно с уверенностью сказать, что сводится к нулю риск развития вакцинного коклюша у детей с неврологическими заболеваниями, имеющих медотвод от цельноклеточной вакцины АКДС.
Освобождение микробной клетки от ненужных белков помогло создать бесклеточный коклюшный компонент, который гарантирует прививке высокий уровень безопасности. Можно с уверенностью сказать, что сводится к нулю риск развития вакцинного коклюша у детей с неврологическими заболеваниями, имеющих медотвод от цельноклеточной вакцины АКДС.
АКДС беременным: от столбняка и других болезней
Во время беременности вы можете разными способами заботиться о здоровье малыша и своем. Одна из прививок, которую вам может порекомендовать сделать врач, это АКДС — прививка от столбняка, коклюша и дифтерии. Она поможет защитить ребенка от серьезных заболеваний. Из этой статьи вы узнаете, что такое вакцина АКДС, когда ее стоит делать и в чем ее польза.
Что такое АКДС
АКДС расшифровывается как адсорбированная коклюшно-дифтерийно-столбнячная вакцина. Эта комплексная прививка защищает вас от трех болезней:
столбняка;
дифтерии;
коклюша.

Как долго действует вакцина АКДС
Прививку следует повторять каждые десять лет. Беременным женщинам обычно рекомендуется делать прививку на определенном сроке беременности, чтобы она могла также защитить от коклюша новорожденного малыша.
Когда делают прививку АКДС
Во время планового осмотра врача в третьем триместре, на седьмом месяце беременности, ваш врач может обсудить с вами вакцинацию. Если врач не предложил сделать прививку, спросите почему.
Кому необходима прививка АКДС
Прививка от столбняка, коклюша и дифтерии рекомендована взрослым, подросткам, медицинским работникам и беременным женщинам. Любой, кто находится в близком контакте с ребенком в возрасте до 12 месяцев также должен быть привит.
Почему прививку АКДС делают во время беременности
Эту прививку делают беременным женщинам, так как она защищает малыша от коклюша сразу после рождения.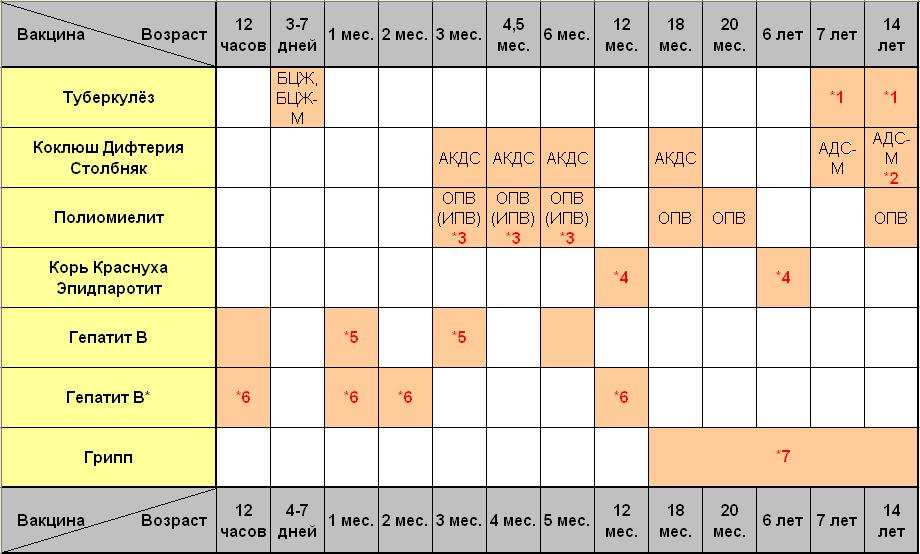 После вакцинации в вашем организме будет высокий уровень антител, которые передадутся ребенку, защищая его от коклюша с рождения до момента, когда ему можно будет сделать первую прививку.
Самое ранний возраст, когда можно вакцинировать малыша, — 2 месяца.
Подробнее о графике вакцинации младенца — в календаре детских прививок.
После вакцинации в вашем организме будет высокий уровень антител, которые передадутся ребенку, защищая его от коклюша с рождения до момента, когда ему можно будет сделать первую прививку.
Самое ранний возраст, когда можно вакцинировать малыша, — 2 месяца.
Подробнее о графике вакцинации младенца — в календаре детских прививок.
Безопасна ли прививка АКДС во время беременности?
Да. Вакцина изготовлена из неактивных бактерий и безопасна во время беременности. По мнению экспертов, риска осложнений беременности, связанных с вакциной АКДС, нет.
Когда нужно делать прививку АКДС
Прививку можно сделать на любом этапе беременности, но наилучшим моментом считается срок между 27-й и 36-й неделей.
Для выработки антител вашему организму нужно около двух недель, поэтому вакцинация в третьем триместре гарантирует, что антитела передадутся ребенку до его рождения. Если вы не можете сделать прививку АКДС во время беременности, обсудите с врачом, сможете ли вы сделать ее сразу после родов, до того как покинуть роддом.
Также рекомендуется делать прививку АКДС при каждой беременности, так как защитные функции вакцины в одной беременности не действуют во время другой.
Если вы не можете сделать прививку АКДС во время беременности, обсудите с врачом, сможете ли вы сделать ее сразу после родов, до того как покинуть роддом.
Также рекомендуется делать прививку АКДС при каждой беременности, так как защитные функции вакцины в одной беременности не действуют во время другой.
Нужно ли делать прививку АКДС всем близким членам семьи?
Да, потому что риск заразиться коклюшем от непривитого человека для малыша выше. Все, кто будет контактировать с младенцем, пока ему не исполнится год, должны быть привиты вакциной АКДС в последние десять лет или минимум за две недели до контакта с ребенком.
Прививка АКДС поможет защитить вас от таких болезней, как столбняк, дифтерия и коклюш. Эта же прививка защитит от коклюша и вашего малыша в первые два месяца жизни, пока ему не сделают отдельную прививку.
Забота о малыше начинается с беременности. А когда он появится на свет, хлопот заметно прибавится, поэтому вам будет удобно заказать товар первой необходимости — подгузники — заранее по выгодной цене.
Вакцинация детей
Прививки это – возможность уберечь ребенка от заражения инфекционными заболеваниями
Вакцинопрофилактика для детей в последние годы приобрела большую популярность. Многочисленные печатные и электронные издания «для мам» наперебой рассказывают о том, что прививки могут быть опасны для ребенка, а потому родителям следует отказываться от вакцинации своих детей. К огромному сожалению детских врачей, многие родители внимают рекомендациям этих «горе-специалистов», в результате чего количество детей, заболевших инфекционными заболеваниями, постоянно возрастает.
Отказываться или делать прививки ребенку
Всем тем родителям, которые задумывают о том, чтобы отказаться от вакцинопрофилактики, следует помнить: детские прививки – это не пережиток советского пришлого, это – возможность уберечь ребенка от заражения инфекционными заболеваниями, в том числе и теми, которые могут стоить ему жизни.
Родители, отказывающие своему малышу в проведении вакцинации, как правило, объясняют свое поведение тем, что их ребенок – аллергик, а потому у него может развиться чрезмерно острая постпрививочная реакция. Возразить здесь можно следующее.
Возразить здесь можно следующее.
Во-первых, современные вакцины создаются при помощи новых высокотехнологичных методов, а потому крайне редко приводят к развитию сильной аллергической реакции. Во-вторых, график прививок всегда составляется персонально для каждого ребенка с учетом состояния его здоровья. Ни один педиатр никогда не возьмет на себя ответственность назначить ребенку прививку, если это не будет позволять здоровье маленького пациента.
Второй фактор риска, который, по мнению некоторых родителей, существует в деле вакцинопрофилактики для детей, — это опасность заражения ребенка инфекционным заболеванием посредством самой прививки. Но и эти страхи абсолютно беспочвенны. В последние годы практически не применяются вакцины, содержащие в себе живые возбудители инфекционных заболеваний. Наоборот, все более широкую популярность приобретают генно-инженерные вакцины, которые вообще не включают в свой состав патогенный микроорганизм, а потому ни при каком, даже самом фантастическом, стечении обстоятельств не могут привести к развитию инфекции.
В-третьих, данные научных исследований не подтверждают наличие медицинских противопоказаний для вакцинации детям с пищевой аллергией и атопическим дерматитом, и даже напротив — свидетельствуют о защитном эффекте вакцинопрофилактики против аллергических заболеваний.
Перед проведением вакцинации здоровым детям нет необходимости в сдаче анализов. Объем необходимого дополнительного обследования для детей с хроническими заболеваниями определяет врач-педиатр в ходе предвакцинального осмотра.
Прививки детям перед садиком
Вакцинация детей регулируется Национальным календарем профилактических прививок. Этот документ регламентирует сроки вакцинации и виды прививок. В него входят:
- Вакцинация против вирусного гепатита B (1-й день, 1 месяц, 6 месяцев)
- Вакцинация против туберкулеза (3-7-й день)
- Вакцинация против дифтерии, коклюша, столбняка (3 месяца, 4.5 месяцев, 6 месяцев, 18 месяцев)
- Вакцинация против полиомиелита (3 месяца, 4.
 5 месяцев, 6 месяцев, 18 месяцев, 20 месяцев)
5 месяцев, 6 месяцев, 18 месяцев, 20 месяцев) - Вакцинация против гемофильной инфекции (3 месяца, 4.5 месяцев, 6 месяцев, 18 месяцев)
- Вакцинация против пневмококковой инфекции (3 месяца, 4.5 месяцев, 15 месяцев)
- Вакцинация против кори, краснухи и эпидемического паротита (12 месяцев)
Помимо вакцинаций, входящих в национальный календарь прививок, у вас есть возможность защитить малыша и от других значимых инфекций, таких как: ротавирусная инфекция, менингококковая инфекция и других. Подробности можно получить у врача-педиатра и/или иммунолога.
Наиболее актуальные вопросы, которые беспокоят многих мам:
Что давать ребенку перед прививками?
Питание перед проведением вакцинации не должно отличаться от повседневного рациона. Не стоит давать ребенку экзотические фрукты, впервые пробовать новые продукты. Если малыш находится на грудном вскармливании, маме также следует воздержаться от употребления новой пищи. В противном случае аллергическую реакцию на пищевые продукты будет сложно отличить от негативной реакции на прививку.
В противном случае аллергическую реакцию на пищевые продукты будет сложно отличить от негативной реакции на прививку.
Можно ли купать ребенка перед прививкой?
Перед прививкой ребенок может и должен вести активный образ жизни: купаться, играть и гулять. Разумеется, его стоит беречь от переохлаждения, сквозняков и общения с простуженными детьми. Ограничений относительно купания перед прививкой нет.
Когда нельзя делать прививку?
Прививку стоит отложить, если ребенок простудился, у него повышена температура. Также, с осторожностью следует проводить вакцинацию детям, иммунитет которых ослаблен (после тяжелого заболевания, операции). Еще одно противопоказание – это аллергия на один из компонентов вакцины. Стоит сказать, что перечисленные выше факторы – это не повод отказываться от прививок. Их эффективность и безопасность давно доказаны клинически. Как только состояние ребенка стабилизируется, Вы сможете провести вакцинацию.
Перед прививкой ребенку необходимо проконсультироваться с педиатром.
Какие прививки нужно делать взрослым – Картина дня – Коммерсантъ
Взрослых в плановом порядке (по Национальному календарю) прививают против дифтерии, столбняка, гепатита В, кори, краснухи, гриппа, а также по эпидемическим показаниям (в рамках региональных программ иммунизации) — против пневмококковой инфекции, гепатита А, дизентерии, клещевого энцефалита и других инфекций.
Против дифтерии и столбняка. Для иммунизации взрослых, так же, как и детей старшего возраста, применяется ослабленный дифтерийно-столбнячный анатоксин — АДС-м. Чтобы сохранить иммунитет, прививки взрослым должны проводиться каждые десять лет (без ограничения возраста).
Прививки против гепатита В проводят непривитым взрослым до 55 лет. Массовая иммунизация населения (детей и взрослых) против гепатита В началась с 2006 года, и многие взрослые до сих пор остаются непривитыми. Особенно актуальны прививки против гепатита В для лиц отдельных профессий, прежде всего медицинских работников, имеющих контакт с кровью.
Прививки против кори. Взрослых, не болевших корью ранее, не привитых или привитых против кори однократно, прививают в возрасте до 35 лет. До 55 лет включительно прививают взрослых, относящихся к группам риска (медицинские работники, работники образовательных организаций и пр.). После двукратного введения вакцины, так же, как и после переболевания корью, формируется стойкий длительный иммунитет к этой инфекции. Иммунизация по эпидемическим показаниям проводится лицам, имевшим контакт с больным корью (или при подозрении на заболевание), не болевшим корью ранее, не привитым, привитым однократно, без ограничения возраста. Иммунизация против кори по эпидемическим показаниям проводится как можно быстрее — в первые 72 часа с момента контакта с больным.
Прививки против краснухи. Взрослых (только девушек или женщин до 25 лет включительно), не болевших краснухой ранее, не привитых или привитых однократно, иммунизируют против краснухи двукратно.
Прививки против пневмококковой инфекции. Они показаны взрослым, особенно пожилым (после 65 лет), имеющим любые хронические заболевания, особенно угнетающие иммунитет (сахарный диабет, заболевания крови, болезни печени, ВИЧ-инфекция и др.). Для лиц более молодого возраста эта прививка также актуальна, особенно для лиц определенных профессий (медицинских работников, работников образования, торговли, транспорта), то есть тех, чья профессия связана с широким кругом общения.
Они показаны взрослым, особенно пожилым (после 65 лет), имеющим любые хронические заболевания, особенно угнетающие иммунитет (сахарный диабет, заболевания крови, болезни печени, ВИЧ-инфекция и др.). Для лиц более молодого возраста эта прививка также актуальна, особенно для лиц определенных профессий (медицинских работников, работников образования, торговли, транспорта), то есть тех, чья профессия связана с широким кругом общения.
Прививки против гепатита А. Рекомендованы лицам, проживающим в регионах, неблагополучных по заболеваемости гепатитом А, а также лицам, подверженным профессиональному риску заражения (медицинским работникам, работникам сферы обслуживания населения, занятым на предприятиях пищевой промышленности, а также обслуживающим водопроводные и канализационные сооружения), путешественникам, отбывающим в страны с высокой заболеваемостью и низким уровнем гигиены, военнослужащим, беженцам. Прививки проводятся двукратно с интервалом 6–12 месяцев.
Прививки против шигеллезов (дизентерии). Проводят лицам, занятым в сфере общественного питания и коммунального благоустройства, работникам медицинских организаций инфекционного профиля. Массовую иммунизацию населения проводят при угрозе возникновения эпидемии или вспышки (при стихийных бедствиях).
Проводят лицам, занятым в сфере общественного питания и коммунального благоустройства, работникам медицинских организаций инфекционного профиля. Массовую иммунизацию населения проводят при угрозе возникновения эпидемии или вспышки (при стихийных бедствиях).
Прививки против клещевого энцефалита. Проводят населению, проживающему на эндемичных по этому заболеванию территориях. Прививки проводят в соответствии с инструкцией по применению препарата (как правило, требуется введение не менее двух доз вакцины с последующей ревакцинацией).
В очагах инфекции взрослым проводят прививки против менингококковой инфекции, эпидемического паротита, ветряной оспы, брюшного тифа, холеры. На эндемичных территориях населению или отдельным группам риска также могут проводиться прививки против: туляремии, лептоспироза, чумы, бруцеллеза, бешенства, сибирской язвы, лихорадки Ку, желтой лихорадки (при выезде в страны, где эта инфекция регистрируется).
Фото: Из личного архива
Сергей Бутрий, педиатр, сотрудник клиник «Рассвет» (Москва) и «Медис» (Иваново), автор книги «Здоровье ребенка. Современный подход. Как научиться справляться с болезнями и собственной паникой»:
Современный подход. Как научиться справляться с болезнями и собственной паникой»:
— Люди, рожденные до 1990-х годов, обычно еще не вакцинированы от гепатита B. Соответственно, всем им надо пройти полную вакцинацию. Нужно также раз в десять лет ревакцинироваться от дифтерии и столбняка. Это основа основ, а остальное по необходимости. Я привит дополнительно против гепатита А (вакцина вводится двукратно и защищает на 20 лет, затем требуется однократный бустер). Схема: перед первой весной две прививки, перед второй — одна и дальше раз в три года по одной дозе вакцины. Что касается кори, то люди после 1990 года рождения, скорее всего, привиты двукратно, но тем, кто рожден раньше, я бы рекомендовал привиться, потому что раньше считалось, что одной дозы хватает на всю жизнь, а потом это опровергли и включили в рекомендации вторую.
Фото: Из личного архива
Валерий Иванов, член Союза педиатров России и Американской академии педиатрии, медицинский блогер:
— Взрослым необходимо сдать анализ на корь, и если нет данных о прививке и нет антител, то надо привиться. Второе — ветряная оспа: если человек не болел, то нужно привить двукратно с интервалом не менее месяца. Пожилым людям я бы рекомендовал привиться от опоясывающего герпеса, но эта вакцина сейчас недоступна в России. Опоясывающий герпес — это вторая форма вируса ветрянки: когда человек отболел ветрянкой, у него вирус переходит в латентную форму в нейронах черепных нервов, нервных узлов. В пожилом возрасте, когда иммунитет снижается, вирус просыпается, и у человека бывают обострения в виде опоясывающего герпеса — это болезненные пузырьки, которые доставляют сильный дискомфорт. Такая прививка есть в календаре США. Она называется Shingrix. Также я бы рекомендовал взрослым прививки от гриппа и гепатита А, потому что взрослые болеют гепатитом А сильнее, чем дети. Если в детстве не сделаны прививки от гепатита В, то также нужно сделать. В США также развита вакцинация пожилых от пневмококковой инфекции: после 65 лет там прививают вакциной «Превенар 13» (PVC13), а через год — вакциной «Пневмо 23» или «Пневмовакс 23» (PPSV23).
Второе — ветряная оспа: если человек не болел, то нужно привить двукратно с интервалом не менее месяца. Пожилым людям я бы рекомендовал привиться от опоясывающего герпеса, но эта вакцина сейчас недоступна в России. Опоясывающий герпес — это вторая форма вируса ветрянки: когда человек отболел ветрянкой, у него вирус переходит в латентную форму в нейронах черепных нервов, нервных узлов. В пожилом возрасте, когда иммунитет снижается, вирус просыпается, и у человека бывают обострения в виде опоясывающего герпеса — это болезненные пузырьки, которые доставляют сильный дискомфорт. Такая прививка есть в календаре США. Она называется Shingrix. Также я бы рекомендовал взрослым прививки от гриппа и гепатита А, потому что взрослые болеют гепатитом А сильнее, чем дети. Если в детстве не сделаны прививки от гепатита В, то также нужно сделать. В США также развита вакцинация пожилых от пневмококковой инфекции: после 65 лет там прививают вакциной «Превенар 13» (PVC13), а через год — вакциной «Пневмо 23» или «Пневмовакс 23» (PPSV23).
Когда он у нас будет?
Введение
Некоторые из наиболее важных достижений в медицине прошлого века включали разработку вакцин для защиты от вирусов, таких как:
Но один вирус все еще мешает тем, кто хочет создать вакцину для защиты от него: ВИЧ.
ВИЧ был впервые обнаружен в 1984 году. Министерство здравоохранения и социальных служб США тогда заявило, что надеется получить вакцину в течение двух лет.
Однако, несмотря на многочисленные испытания возможных вакцин, действительно эффективная вакцина все еще недоступна.Почему так сложно победить эту болезнь? И где мы находимся в процессе?
Разработать вакцину от ВИЧ так сложно, потому что она отличается от других типов вирусов. ВИЧ не соответствует типичным подходам к вакцинам по нескольким причинам:
1. Иммунная система почти всех людей «слепа» к ВИЧ
Иммунная система, которая борется с болезнью, не реагирует на вирус ВИЧ. Он производит антитела к ВИЧ, но они только замедляют течение болезни. Они этого не останавливают.
Они этого не останавливают.
2.Вакцины обычно делаются для имитации иммунной реакции выздоровевших людей
Однако почти ни один человек не выздоровел после заражения ВИЧ. В результате не возникает иммунной реакции, имитируемой вакцинами.
3. Вакцины защищают от болезней, а не от инфекции
ВИЧ — это инфекция, пока она не перейдет в стадию 3, или СПИД. При большинстве инфекций вакцины дают организму больше времени, чтобы избавиться от инфекции самостоятельно, прежде чем болезнь возникнет.
Однако у ВИЧ есть долгий период бездействия, прежде чем он перейдет в СПИД.В этот период вирус скрывается в ДНК человека, инфицированного вирусом. Организм не может найти и уничтожить все скрытые копии вируса, чтобы вылечить себя. Итак, вакцина, позволяющая выиграть время, не сработает с ВИЧ.
4. Убитые или ослабленные вирусы ВИЧ не могут использоваться в вакцине.
Большинство вакцин изготавливаются с использованием убитых или ослабленных вирусов. Однако убитый ВИЧ не способствует возникновению иммунного ответа в организме. Любая живая форма вируса слишком опасна для использования.
Однако убитый ВИЧ не способствует возникновению иммунного ответа в организме. Любая живая форма вируса слишком опасна для использования.
5.Вакцины обычно эффективны против редко встречающихся заболеваний.
К ним относятся дифтерия и гепатит B. Но люди с известными факторами риска заражения ВИЧ могут ежедневно контактировать с ВИЧ. Это означает, что вероятность заражения выше, чем вакцина.
6. Большинство вакцин защищают от вирусов, попадающих в организм через респираторную или желудочно-кишечную систему.
Этим двумя путями в организм попадает больше вирусов, поэтому у нас больше опыта в борьбе с ними.Но ВИЧ чаще всего попадает в организм через половые органы или кровь. У нас меньше опыта защиты от вирусов, попадающих в организм таким образом.
7. Большинство вакцин тщательно тестируются на моделях животных.
Это помогает гарантировать, что они будут безопасными и эффективными до того, как они будут испытаны на людях. Однако хорошей животной модели ВИЧ не существует. Никакие испытания, проведенные на животных, не показали, как люди отреагируют на испытанную вакцину.
Никакие испытания, проведенные на животных, не показали, как люди отреагируют на испытанную вакцину.
8.Вирус ВИЧ быстро мутирует
Вакцина нацелена на вирус в определенной форме. Если вирус изменится, вакцина может больше не действовать на него. ВИЧ быстро мутирует, поэтому сложно создать вакцину против него.
Несмотря на эти препятствия, исследователи продолжают попытки найти вакцину. Существует два основных типа вакцин: профилактическая и лечебная. Исследователи исследуют оба варианта на ВИЧ.
Большинство вакцин являются профилактическими, что означает, что они предотвращают заражение человека.С другой стороны, терапевтические вакцины используются для усиления иммунного ответа организма на борьбу с болезнью, уже имеющейся у человека. Лечебными вакцинами также считаются терапевтические вакцины.
Терапевтические вакцины исследуются для нескольких состояний, например:
Теоретически вакцина против ВИЧ преследует две цели. Во-первых, его можно давать людям, не инфицированным ВИЧ, чтобы предотвратить заражение вирусом. Это сделало бы ее профилактической вакциной.
Это сделало бы ее профилактической вакциной.
Но ВИЧ также является хорошим кандидатом в терапевтическую вакцину.Исследователи надеются, что терапевтическая вакцина против ВИЧ может снизить вирусную нагрузку на человека.
Исследователи пробуют множество различных подходов к разработке вакцины против ВИЧ. Возможные вакцины изучаются как для профилактического, так и для терапевтического использования.
В настоящее время исследователи работают со следующими типами вакцин:
- Пептидные вакцины используют небольшие белки ВИЧ, чтобы вызвать иммунный ответ.
- Вакцины с рекомбинантными субъединичными белками используют более крупные фрагменты белков ВИЧ.
- Живые векторные вакцины используют вирусы, не относящиеся к ВИЧ, для переноса генов ВИЧ в организм, чтобы вызвать иммунный ответ. В вакцине против оспы используется этот метод.
- Комбинации вакцин , или комбинации «прайм-буст», используют две вакцины одну за другой для создания более сильного иммунного ответа.

- Вакцины с вирусоподобными частицами используют неинфекционный двойник ВИЧ, который содержит некоторые, но не все белки ВИЧ.
- Вакцины на основе ДНК используют ДНК ВИЧ для запуска иммунного ответа.
Исследование вакцины против ВИЧ, известное как исследование HVTN 505, завершилось в октябре 2017 года. В нем изучается профилактический подход с использованием живой векторной вакцины.
Ослабленный вирус простуды под названием Ad5 был использован для того, чтобы заставить иммунную систему распознавать (и, таким образом, иметь возможность бороться) с белками ВИЧ. Для участия в исследовании было привлечено более 2500 человек.
Исследование было остановлено, когда исследователи обнаружили, что вакцина не предотвращает передачу ВИЧ и не снижает вирусную нагрузку.Фактически, 41 человек, получавший вакцину, заразился ВИЧ, в то время как только 30 человек, получавших плацебо, заразились им.
Нет доказательств того, что вакцина повысила вероятность заражения ВИЧ у людей на человек. Однако после предыдущей неудачи Ad5 в 2007 году в исследовании под названием STEP, исследователи начали беспокоиться, что все, что заставляет иммунные клетки атаковать ВИЧ, может увеличить риск заражения вирусом.
Однако после предыдущей неудачи Ad5 в 2007 году в исследовании под названием STEP, исследователи начали беспокоиться, что все, что заставляет иммунные клетки атаковать ВИЧ, может увеличить риск заражения вирусом.
Одним из самых успешных клинических испытаний на сегодняшний день было исследование военного США по ВИЧ в Таиланде в 2009 году.В исследовании, известном как RV144, использовалась комбинация профилактических вакцин. Он использовал «первичный» (вакцина ALVAC) и «бустерный» (вакцина AIDSVAX B / E).
Эта комбинированная вакцина оказалась безопасной и в некоторой степени эффективной. Комбинация снизила скорость передачи на 31 процент по сравнению с прививкой плацебо.
Снижения на 31 процент недостаточно, чтобы стимулировать широкое использование этой комбинации вакцин. Однако этот успех позволяет исследователям изучить, почему вообще был какой-либо профилактический эффект.
В последующем исследовании под названием HVTN 100 тестировалась модифицированная версия схемы лечения RV144 в Южной Африке. HVTN 100 использовал другой бустер для усиления вакцины. Участники испытания также получили на одну дозу вакцины больше, чем люди в RV144.
HVTN 100 использовал другой бустер для усиления вакцины. Участники испытания также получили на одну дозу вакцины больше, чем люди в RV144.
В группе из примерно 200 участников испытание HVTN 100 показало, что вакцина улучшала иммунный ответ людей, связанный с риском заражения ВИЧ. На основе этих многообещающих результатов сейчас проводится более крупное последующее исследование под названием HVTN 702. HVTN 702 проверит, действительно ли вакцина предотвращает передачу ВИЧ.
HVTN 702 также будет проходить в Южной Африке и привлекать около 5400 человек. HVTN 702 впечатляет, потому что это первое крупное испытание вакцины против ВИЧ за семь лет. Многие люди надеются, что это приведет к созданию нашей первой вакцины против ВИЧ. Результаты ожидаются в 2021 году.
Текущее испытание вакцины, начавшееся в 2015 году, проводится в рамках Международной инициативы по вакцине против СПИДа (IAVI). В этом испытании профилактической вакцины изучаются люди в:
- США
- Руанде
- Уганде
- Таиланде
- ЮАР
Испытание применяет стратегию вакцины с живыми переносчиками вируса, использующую вирус Сендай для передачи генов ВИЧ. Он также использует комбинированную стратегию со второй вакциной для усиления иммунного ответа организма. Сбор данных из этого исследования завершен. Результаты ожидаются в 2022 году.
Он также использует комбинированную стратегию со второй вакциной для усиления иммунного ответа организма. Сбор данных из этого исследования завершен. Результаты ожидаются в 2022 году.
Другой важный подход, изучаемый в настоящее время, — это использование векторной иммунопрофилактики.
При таком подходе вирус, не связанный с ВИЧ, направляется в организм, чтобы проникнуть в клетки и произвести так называемые широко нейтрализующие антитела. Это означает, что иммунный ответ будет нацелен на все штаммы ВИЧ. Большинство других вакцин нацелены только на один штамм.
IAVI в настоящее время проводит подобное исследование под названием IAVI A003 в Соединенном Королевстве. Исследование завершилось в 2018 году, и результаты ожидаются в ближайшее время.
Согласно отчету за 2018 год, в 2017 году на исследования вакцины против ВИЧ было потрачено 845 миллионов долларов. На сегодняшний день было протестировано более 40 потенциальных вакцин.
Создание работоспособной вакцины продвигается медленно. Но с каждой неудачей мы узнаем больше, что можно использовать в новых попытках.
Но с каждой неудачей мы узнаем больше, что можно использовать в новых попытках.
Чтобы получить ответы на вопросы о вакцине против ВИЧ или информацию об участии в клинических испытаниях, лучше всего начать с поставщика медицинских услуг.Они могут ответить на вопросы и предоставить подробную информацию о любых клинических испытаниях, которые могут подойти.
вакцин против ВИЧ | HIV.gov
Что такое вакцины и для чего они нужны?
Вакцины — это продукты, изготовленные из очень небольшого количества слабых или мертвых микробов (таких как вирусы, бактерии или токсины), которые могут вызывать заболевания. Они помогают вашей иммунной системе быстрее и эффективнее бороться с инфекциями.
Когда вы получаете вакцину, она запускает ваш иммунный ответ, помогая вашему организму бороться с микробом и запоминать его, чтобы оно могло атаковать его, если микроб снова вторгнется.А поскольку вакцины состоят из очень небольшого количества слабых или мертвых микробов, они не вызывают у вас болезни.
Вакцины обычно вводятся путем инъекции, но иногда их можно вводить через рот или через назальный спрей. Они широко используются для профилактики таких заболеваний, как полиомиелит, ветряная оспа, корь, эпидемический паротит, краснуха, грипп (грипп), гепатиты А и В и вирус папилломы человека (ВПЧ).
Узнайте больше о том, как вакцины защищают вас и других.
Есть ли вакцина для предотвращения ВИЧ?
№В настоящее время нет вакцины, которая предотвратила бы заражение ВИЧ или вылечила бы тех, у кого он есть.
Однако ученые работают над его разработкой. NIH инвестирует в различные подходы к профилактике ВИЧ, включая безопасную и эффективную профилактическую вакцину против ВИЧ. Эти исследовательские усилия включают в себя два поздних многонациональных клинических испытания вакцин под названиями Imbokodo и Mosaico.
Другое исследование, проводимое при поддержке NIH, направлено на предоставление дополнительных вариантов профилактики ВИЧ, которые являются безопасными, эффективными, желательными для различных групп населения и масштабируемыми по всему миру, чтобы помочь положить конец глобальной пандемии.
Узнайте больше о том, как Национальный институт аллергии и инфекционных заболеваний, входящий в состав NIH, приближается к разработке вакцины против ВИЧ.
Загрузить информационный бюллетень «Прогресс NIAID на пути к созданию вакцины против ВИЧ»
Зачем нам нужна вакцина для предотвращения ВИЧ?
Сегодня больше людей, живущих с ВИЧ, чем когда-либо, имеют доступ к жизненно важному лечению с помощью лекарств от ВИЧ (так называемая антиретровирусная терапия или АРТ), что полезно для их здоровья. Когда люди, живущие с ВИЧ, достигают и поддерживают подавление вируса путем ежедневного приема лекарств от ВИЧ в соответствии с предписаниями, они могут оставаться здоровыми и практически не иметь риска передачи ВИЧ половым путем своим партнерам.Кроме того, другие люди, подверженные высокому риску заражения ВИЧ, могут иметь доступ к доконтактной профилактике (ДКП) или АРТ, используемым для предотвращения ВИЧ. Тем не менее, к сожалению, в 2018 году у 37 968 человек была диагностирована ВИЧ-инфекция в Соединенных Штатах, а в 2019 году примерно 1,7 миллиона человек во всем мире впервые заразились ВИЧ. Чтобы контролировать и в конечном итоге положить конец ВИЧ-инфекции во всем мире, нам нужен мощный набор инструментов профилактики ВИЧ, которые будут широко доступны для всех, кто получит от них пользу.
Чтобы контролировать и в конечном итоге положить конец ВИЧ-инфекции во всем мире, нам нужен мощный набор инструментов профилактики ВИЧ, которые будут широко доступны для всех, кто получит от них пользу.
Вакцины исторически были наиболее эффективным средством предотвращения и даже искоренения инфекционных заболеваний.Они безопасно и с минимальными затратами предотвращают болезни, инвалидность и смерть. Подобно вакцинам против оспы и полиомиелита, профилактическая вакцина против ВИЧ может помочь спасти миллионы жизней.
Разработка безопасных, эффективных и доступных вакцин, которые могут предотвратить заражение ВИЧ-инфекцией у неинфицированных людей, является высшим приоритетом исследований в области ВИЧ для Национального института здоровья, учитывая его революционный потенциал в плане контроля и, в конечном итоге, прекращения пандемии ВИЧ / СПИДа.
Долгосрочная цель — разработать безопасную и эффективную вакцину, защищающую людей во всем мире от заражения ВИЧ. Однако даже если вакцина защищает только некоторых людей, которые прошли вакцинацию, или даже если она обеспечивает меньшую защиту, чем полную защиту за счет снижения риска заражения, она все равно может иметь большое влияние на скорость передачи и помочь контролировать пандемию, особенно в отношении группы населения с высоким риском заражения ВИЧ. Частично эффективная вакцина может уменьшить количество людей, инфицированных ВИЧ, что еще больше сократит количество людей, которые могут передать вирус другим. Существенно уменьшив количество новых инфекций, мы можем остановить эпидемию.
Однако даже если вакцина защищает только некоторых людей, которые прошли вакцинацию, или даже если она обеспечивает меньшую защиту, чем полную защиту за счет снижения риска заражения, она все равно может иметь большое влияние на скорость передачи и помочь контролировать пандемию, особенно в отношении группы населения с высоким риском заражения ВИЧ. Частично эффективная вакцина может уменьшить количество людей, инфицированных ВИЧ, что еще больше сократит количество людей, которые могут передать вирус другим. Существенно уменьшив количество новых инфекций, мы можем остановить эпидемию.
Можно ли предотвратить или лечить?
Препараты от ВИЧ значительно улучшили качество жизни людей, живущих с ВИЧ и СПИДом, но пока не могут вылечить инфекцию. Человек с высоким риском заражения ВИЧ может принять таблетку, чтобы предотвратить инфекцию, но ему придется принимать по одной каждый день. Этот метод, называемый ПрЭП, не эффективен на 100%.
Вот почему исследователи работают над созданием вакцины против ВИЧ.
Вакцина предотвращает или контролирует конкретную инфекцию, обучая иммунную систему организма бороться с ней.За прошедшие годы ученые создали вакцины от болезней, включая брюшной тиф, корь, полиомиелит, грипп и оспу. На поиск вакцины против ВИЧ было потрачено больше денег, чем на любую другую вакцину в истории.
Несмотря на то, что с момента открытия вируса прошли десятилетия, у нас до сих пор нет вакцины от него. Почему? Его разработка — почти всегда долгий процесс. Впервые вирус полиомиелита был идентифицирован в 1908 году, но только в 1955 году первая вакцина была одобрена!
Продолжение
Вакцина против ВИЧ еще сложнее, потому что:
- Существует множество типов ВИЧ, и продолжают формироваться новые типы.
- У ВИЧ есть хитрые способы «перехитрить» иммунную систему.
- Ученые до сих пор не до конца понимают, какие части иммунной системы работают против ВИЧ.
Несмотря на сложные проблемы, многие исследователи надеются на перспективы вакцины против ВИЧ.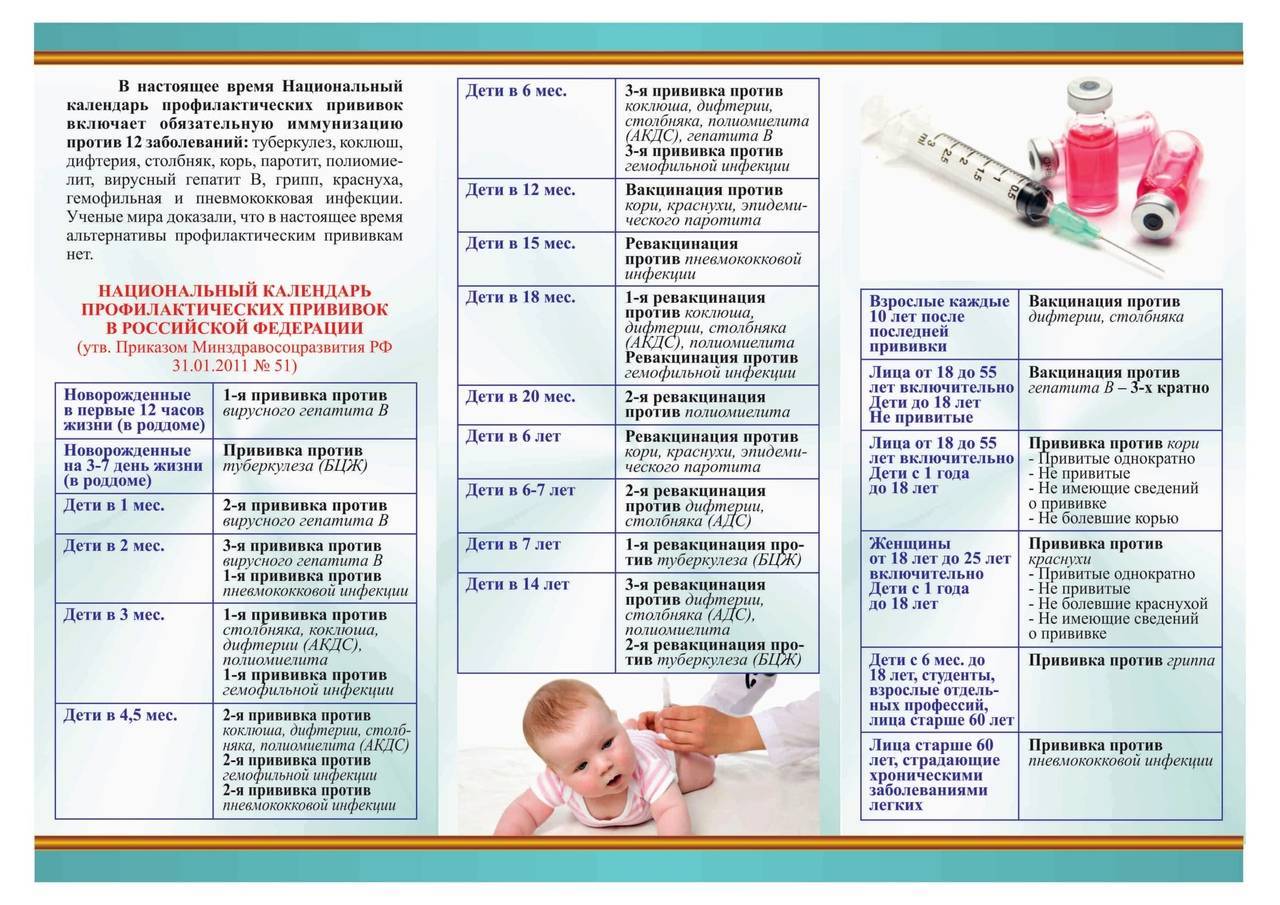
Два вида вакцин
Профилактическая вакцина научит вашу иммунную систему «распознавать» и бороться с ВИЧ до того, как вирус вызовет инфекцию и заставит вас заболеть. Они предназначены для людей, не инфицированных ВИЧ.Когда-нибудь вакцина сможет предотвратить заражение ВИЧ у всех, большинства или некоторых людей.
Профилактическая вакцина не может заразить вас ВИЧ, поскольку не содержит живых вирусов. Но это может побудить вашу иммунную систему вырабатывать антитела, которые обнаружатся в анализе крови и дадут ложноположительный результат.
Терапевтическая вакцина поможет контролировать инфекцию и замедлить прогрессирование болезни. Они работают, усиливая вашу иммунную систему, чтобы найти и убить ВИЧ-инфицированные клетки, а также предотвращая или ограничивая создание копий самого себя.Их тестируют на людях, которые уже являются ВИЧ-инфицированными, но имеют здоровую иммунную систему.
Испытания вакцин и клинические испытания
Сначала вакцины против ВИЧ тестируются в лабораториях и на животных. Тогда на одну вакцину против ВИЧ могут потребоваться годы тестирования на людях, прежде чем она станет приемлемой для населения.
Тогда на одну вакцину против ВИЧ могут потребоваться годы тестирования на людях, прежде чем она станет приемлемой для населения.
Вакцина для предотвращения ВИЧ обычно проходит три фазы клинических испытаний для проверки ее безопасности и эффективности. Предполагается, что люди на всех трех этапах продолжают практиковать безопасный секс.Это , а не человек, которые сознательно заразились ВИЧ после вакцинации.
Каждая фаза должна пройти хорошо, чтобы перейти к следующей.
- Этап I длится от 12 до 18 месяцев. Небольшое количество здоровых, ВИЧ-отрицательных добровольцев помогают исследователям проверить безопасность и определить оптимальные дозы.
- Фаза II может длиться до 2 лет. Сотни здоровых, ВИЧ-отрицательных добровольцев помогают исследователям улучшить дозировку и проверить, насколько хорошо реагирует иммунная система.
- Фаза III может длиться от 3 до 4 лет с участием тысяч здоровых, ВИЧ-отрицательных добровольцев.
Положительные признаки
Некоторые люди не заражаются ВИЧ, даже после того, как они подверглись воздействию ВИЧ более одного раза. Похоже, что другие инфицированные не страдают от болезни в течение десяти или более лет. Эти примеры предполагают, что некоторые иммунные системы способны бороться с ВИЧ.
Похоже, что другие инфицированные не страдают от болезни в течение десяти или более лет. Эти примеры предполагают, что некоторые иммунные системы способны бороться с ВИЧ.
Продолжение
В исследованиях в пробирках редкие антитела действительно работают против ВИЧ.
Вакцины успешно защитили обезьян от родственника ВИЧ. Даже когда вакцины не защищали обезьян полностью, они позволяли им жить намного дольше.В разработке находится более 100 вакцин, и, по крайней мере, две в настоящее время находятся на поздней стадии, в стадии проведения многонациональные клинические испытания вакцин.
Выяснение того, что работает в этих случаях, может дать ключ к разгадке процесса разработки вакцины против ВИЧ.
Разработка вакцины против ВИЧ-инфекции
ОСНОВНЫЕ МОМЕНТЫ- Исследователи работают над вакциной против ВИЧ с 1980-х годов, но прогресс в создании эффективной вакцины был намного медленнее, чем предполагалось.
- Поиск хотя бы частично эффективной вакцины по-прежнему имеет решающее значение для противодействия ВИЧ.

- Наибольшее сокращение числа новых инфекций будет достигнуто за счет комбинации PrEP, универсального антиретровирусного лечения для людей, уже живущих с ВИЧ, и вакцины.
- Вакцина от ВИЧ — это более реалистичная перспектива сегодня, чем десять лет назад, и оптимистичный прогноз доступности вакцины против ВИЧ заключается в том, что она может быть доступна к 2030 году.
Изучите эту страницу, чтобы узнать больше о необходимости вакцины против ВИЧ, проблемах в разработке вакцины, прогрессе в разработке вакцины и создании эффективной вакцины против ВИЧ.
Что такое вакцина против ВИЧ?
На сегодняшний день эффективной вакцины против ВИЧ не существует. Вакцина, которая может предотвратить инфекцию, научит иммунную систему реагировать на ВИЧ, вырабатывая антитела, которые могут связываться с вирусом и не давать ему инфицировать клетки, или путем стимулирования других иммунных реакций, убивающих вирус.
Ни одна вакцина не эффективна на 100%, и, вероятно, то же самое и с ВИЧ. Некоторые люди, получившие вакцину, не будут достаточно сильно реагировать на вакцину и не будут защищены, как в случае вакцины от сезонного гриппа . Но поиск хотя бы частично эффективной вакцины по-прежнему имеет решающее значение для противодействия ВИЧ, поскольку все успешные стратегии ликвидации болезни включают вакцину в свой арсенал.
Некоторые люди, получившие вакцину, не будут достаточно сильно реагировать на вакцину и не будут защищены, как в случае вакцины от сезонного гриппа . Но поиск хотя бы частично эффективной вакцины по-прежнему имеет решающее значение для противодействия ВИЧ, поскольку все успешные стратегии ликвидации болезни включают вакцину в свой арсенал.
По оценкам ЮНЭЙДС, 1,8 миллиона человек заразились ВИЧ в 2017 году, 36,9 миллиона человек жили с ВИЧ и 21,7 миллиона получали антиретровирусную терапию. Несмотря на резкое улучшение доступа к антиретровирусной терапии и свидетельства в некоторых регионах мира о том, что расширение масштабов лечения привело к сокращению числа новых случаев ВИЧ-инфекции, потребность в вакцине против ВИЧ все еще существует.
Модель, разработанная Международной инициативой по вакцине против СПИДа, показала, что даже если цели ЮНЭЙДС по расширению масштабов лечения будут достигнуты к 2020 году, вакцина, которая остановит 70% инфекций, снизит количество новых инфекций на 44% в первые 10 лет после прогнозируемого внедрение в 2027 году. К 2070 году вакцина с эффективностью 70% снизит количество новых инфекций на 78%.
К 2070 году вакцина с эффективностью 70% снизит количество новых инфекций на 78%.
Модель также показала, что вакцина с эффективностью 70% будет иметь большее влияние на новые инфекции, чем доконтактная профилактика (PrEP).Наибольшее сокращение числа новых инфекций будет достигнуто за счет комбинации PrEP, универсального антиретровирусного лечения для людей, уже живущих с ВИЧ, и вакцины.
В этом исследовании предполагалось, что вакцина обеспечит защиту только на пять лет, прежде чем людям понадобится повторная прививка. Стоимость введения такой вакцины все равно будет значительно ниже, чем стоимость лечения PrEP или ВИЧ. За счет предотвращения новых инфекций и снижения затрат на профилактику вакцина против ВИЧ повысит устойчивость ответа на ВИЧ.
Другое модельное исследование показало, что вакцина с 50% -ной эффективностью окажет наибольшее влияние на восток и юг Африки. Даже если все эти страны достигнут целей ЮНЭЙДС по расширению масштабов лечения к 2020 году, внедрение вакцины предотвратит к 2035 году примерно 7 миллионов новых случаев инфицирования.
Исследователи работали над вакциной против ВИЧ с 1980-х годов, но прогресс в создании эффективной вакцины был намного медленнее, чем ожидалось.
Большинство вакцин против других болезней стимулируют выработку антител, которые «нейтрализуют» вирусную инфекционность, но в случае ВИЧ нейтрализующие антитела не устраняют инфекцию.Это связано с тем, что ВИЧ так быстро воспроизводится и мутирует так быстро, что антитела, вырабатываемые против вируса, быстро становятся неэффективными против новых вирусов. Ежедневно производятся миллионы новых вирусов, и каждый из них немного отличается от вирусов предыдущих поколений. Антитела против ВИЧ могут быть эффективными только в том случае, если они могут связываться с участками вируса, которые мало различаются между вирусами.
Другая проблема заключается в том, что ВИЧ имеет несколько подтипов, которые сконцентрированы в разных регионах мира.Например, подтип B распространен в Северной Америке и Европе, но подтип C распространен в южной и восточной Африке.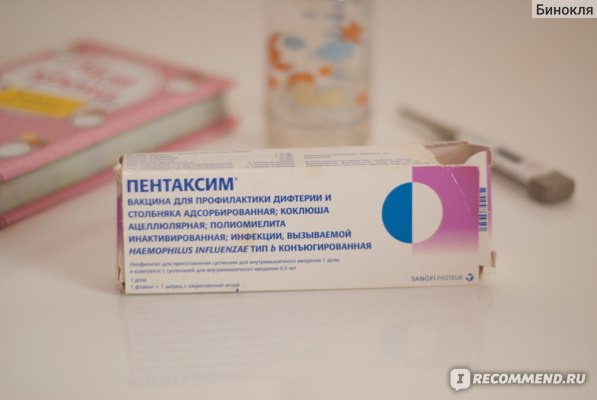 Любая вакцина должна быть либо эффективной против всех подтипов, либо против разных подтипов должны быть разработаны разные вакцины.
Любая вакцина должна быть либо эффективной против всех подтипов, либо против разных подтипов должны быть разработаны разные вакцины.
Вакцина может также стимулировать производство клеток иммунной системы, называемых Т-лимфоцитами, которые могут очищать ВИЧ-инфицированные клетки. Но ВИЧ также эволюционировал, чтобы подавить некоторые иммунные реакции, которые важны на ранних стадиях вирусной инфекции.
Еще одна проблема в разработке вакцины — найти эффективные способы безопасной доставки белков ВИЧ, которые позволят иммунной системе распознавать ВИЧ и реагировать на него без установления инфекции. ВИЧ интегрируется в человеческие клетки и использует эти клетки для воспроизводства, поэтому живые или ослабленные цельновирусные вакцины непригодны для использования при ВИЧ. Вместо этого белки ВИЧ должны быть сконструированы таким образом, чтобы сделать их безвредными, но все же распознаваемыми иммунной системой. Эти белки или последовательности вирусного материала должны быть доставлены с помощью вектора — другого безвредного вируса, такого как канареечная оспа или вирус простуды, — который представляет их иммунной системе.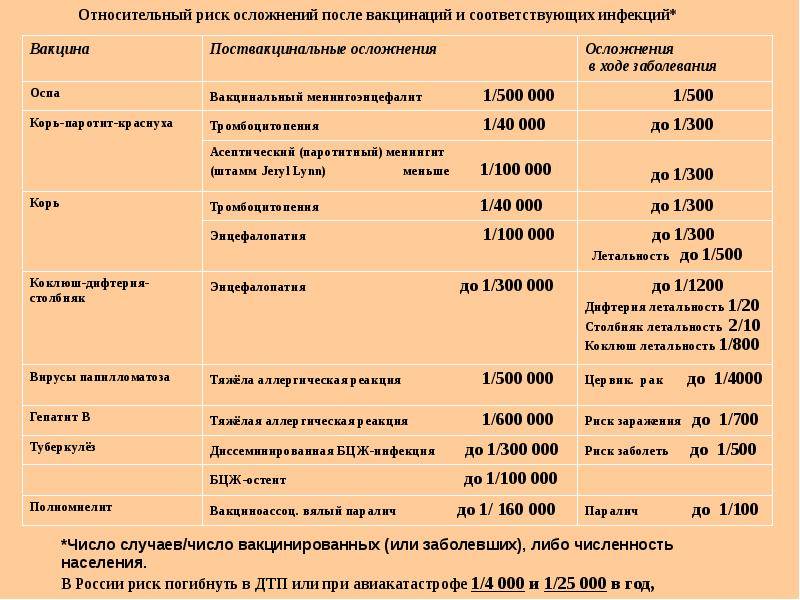
Исследователи все еще работают над тем, чтобы понять, что они называют «коррелятами защиты» — маркеры иммунной системы, которые показывают, что человек защищен от ВИЧ после вакцинации. Эти измерения должны быть основаны на наблюдениях в клинических испытаниях и исследованиях на животных. Прогресс в определении коррелятов защиты был медленным из-за отсутствия моделей на животных. Животные не могут быть инфицированы вирусом иммунодефицита человека, поэтому исследования необходимо проводить на обезьянах с использованием обезьяньего эквивалента SIV или конструкции, называемой SHIV.
Первое крупное испытание вакцины против ВИЧ сообщило о результатах в 2003 году. В этом испытании была протестирована вакцина под названием AIDSVax, которая объединила фрагменты поверхностного белка gp120 ВИЧ из ВИЧ подтипа B. Вакцина была разработана для производства нейтрализующих антител против gp120 . Испытания показали, что вакцина не обеспечивает защиты по сравнению с фиктивной вакциной. Испытание вакцины с использованием того же дизайна, но с комбинацией последовательностей gp120 из подтипов A и E, также не показало защитного эффекта.
Испытание вакцины с использованием того же дизайна, но с комбинацией последовательностей gp120 из подтипов A и E, также не показало защитного эффекта.
Другая стратегия вакцины, использующая векторный вирус для доставки последовательностей белков ВИЧ для стимуляции клеточного иммунитета , а не выработки антител, была протестирована в исследовании STEP.В качестве переносчика пробной вакцины использовался аденовирус, вызывающий симптомы простуды. Исследование STEP было остановлено в 2007 году после того, как анализ показал, что вакцина не снизила риск заражения.
Последующий анализ показал, что люди с наивысшим уровнем ранее существовавших антител к аденовирусам имели более высокий риск заражения, чем люди, получившие фиктивную вакцину. Результаты исследования показали, что необходимы дополнительные исследования для разработки вакцин, вызывающих защитные Т-клеточные реакции против ВИЧ.
В 2009 году испытание RV144 сообщило о небольшом снижении риска заражения в испытании с использованием подхода с первичной буст-вакциной — первое испытание, в котором это было сделано. В ходе испытания был протестирован вакцинационный подход, при котором люди получали «первичную» дозу ALVAC-HIV, вектор канареек, содержащий три генно-инженерные последовательности генов ВИЧ, и бустерную дозу с использованием вакцины AIDSVax gp120. «Первичная» вакцина была разработана для стимуляции клеточного иммунного ответа, в то время как цель бустерной вакцины заключалась в том, чтобы стимулировать нейтрализующие ответы антител.Прайм-буст-вакцинация снизила риск заражения на 31%, что значительно снизило риск.
В ходе испытания был протестирован вакцинационный подход, при котором люди получали «первичную» дозу ALVAC-HIV, вектор канареек, содержащий три генно-инженерные последовательности генов ВИЧ, и бустерную дозу с использованием вакцины AIDSVax gp120. «Первичная» вакцина была разработана для стимуляции клеточного иммунного ответа, в то время как цель бустерной вакцины заключалась в том, чтобы стимулировать нейтрализующие ответы антител.Прайм-буст-вакцинация снизила риск заражения на 31%, что значительно снизило риск.
Результат испытания RV144 стал неожиданностью для исследователей вакцин. Они предположили, что одним из эффектов вакцины будет выработка сильного ответа Т-лимфоцитов CD8, что приведет к снижению вирусной нагрузки у тех, кто заразился, несмотря на вакцинацию. Но вакцина не вызвала сильных ответов Т-лимфоцитов CD8 и не вызвала сильных ответов антител.
Результаты испытания RV144 показывают, с какой проблемой сталкиваются ученые, пытаясь определить, как определить, стоит ли испытывать потенциальную вакцину в крупных клинических испытаниях. Результаты испытаний предполагают, что вакцина может потребоваться для стимуляции антител и клеточного иммунного ответа на ВИЧ, и что клеточные ответы зависят от специфических ответов антител.
Результаты испытаний предполагают, что вакцина может потребоваться для стимуляции антител и клеточного иммунного ответа на ВИЧ, и что клеточные ответы зависят от специфических ответов антител.
Версия вакцины, испытанная в испытании RV144, впоследствии была испытана в Южной Африке в исследовании HVTN 100. Эта вакцина содержала последовательности вируса ВИЧ подтипа C, который чаще всего встречается в южной части Африки, и использовала другой график дозирования, разработанный для получения более сильных ответов на вакцину.Исследование показало, что вакцина вызывает сильный ответ антител на белки оболочки ВИЧ. Вакцина вызвала особенно сильные ответы антител, которые коррелировали с защитой от инфекции в исследовании RV144.
Текущие испытания вакцины: Ухамбо и Имбокодо Модифицированная вакцина RV144, испытанная в испытании HVTN100, сейчас проходит испытания в большом исследовании фазы 3, HVTN 702 (также известном как Uhambo), в южной части Африки. Исследование, в котором примут участие 5400 человек, призвано показать, снижает ли вакцина риск заражения как минимум на 50% и продлевает ли период защиты по сравнению с исследованием RV144. Результаты исследования ожидаются к 2021 году.
Результаты исследования ожидаются к 2021 году.
Второе крупное исследование вакцины, HVTN 705 (также известное как Imbokodo), тестирует первичную буст-вакцину другой конструкции, которая показала многообещающие эффекты в предварительных исследованиях. Вакцина, которая будет тестироваться в HVTN 705, сочетает в себе «первичную» вакцину, в которой используется аденовирусный вектор для доставки «мозаичных» белков, предназначенных для выработки ответов против широкого спектра вирусов, и бустер ВИЧ подтипа C, предназначенный для стимуляции выработки антител против белок оболочки ВИЧ gp140.
Эта вакцина, разработанная фармацевтической компанией Janssen, тестируется на 2600 женщинах в возрасте от 18 до 35 лет в южной и восточной Африке. Результаты ожидаются к 2022 году.
Если вакцина, протестированная в исследовании HVTN 702, окажется эффективной, это не приведет к немедленному лицензированию и развертыванию вакцины. Вместо этого исследователи говорят, что они будут использовать результаты исследования, чтобы улучшить вакцину и узнать, как расширить производство вакцины.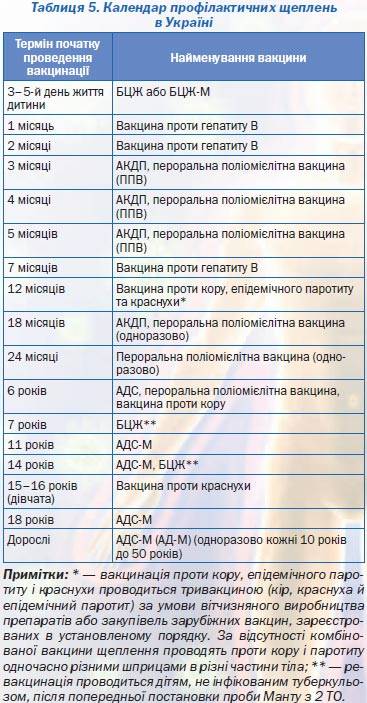 То же самое и с исследованием HVTN 705.
То же самое и с исследованием HVTN 705.
Будущие подходы к разработке вакцины против ВИЧ
Также разрабатываются несколько других многообещающих подходов к разработке вакцины против ВИЧ.
Широко нейтрализующие антитела могут распознавать множество различных штаммов ВИЧ. Они нацелены на области ВИЧ, которые не мутируют и мало различаются между вирусными подтипами. Эти антитела вырабатывают менее 20% людей, живущих с ВИЧ. Широко нейтрализующие антитела можно выделить и воспроизвести в лаборатории. Инфузии широко нейтрализующих антител проходят испытания в качестве метода профилактики ВИЧ в клиническом испытании AMP, результаты которого должны быть представлены в 2020 году.В нескольких других исследованиях тестируются различные комбинации нейтрализующих антител широкого спектра действия.
Другие исследования тестируют ДНК-вакцины против ВИЧ . ДНК-вакцины предназначены для решения проблем, связанных с использованием целых вирусов или попытками создания рекомбинантных вирусных последовательностей, которые могут стимулировать сильные иммунные ответы.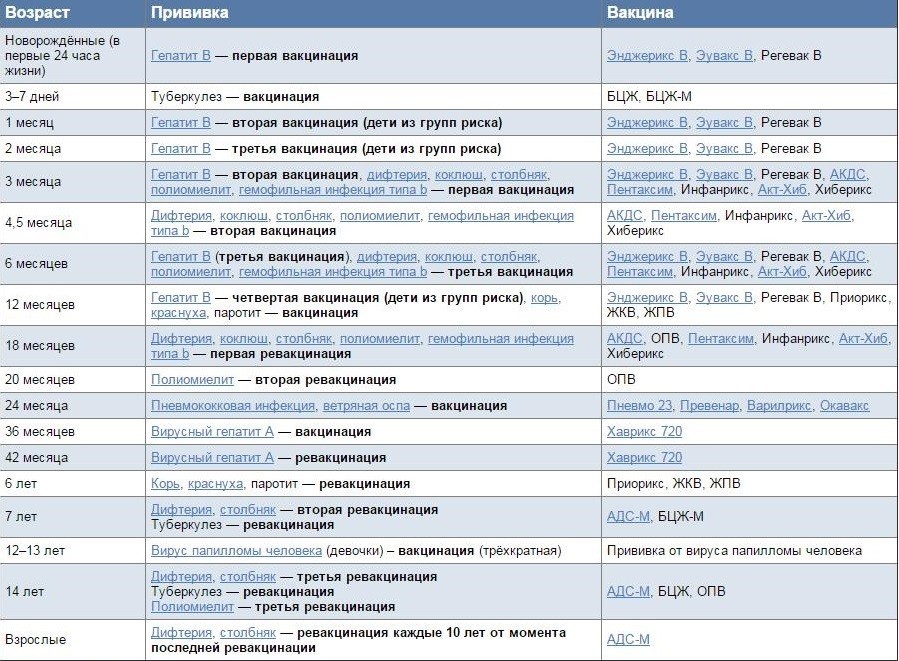 ДНК-вакцины доставляют ДНК, которая содержит код определенных вирусных белков. Клетки захватывают ДНК и производят белки, которые распознаются иммунной системой, что приводит к более сильным иммунным ответам, чем вакцины на основе вирусных векторов.Некоторые ДНК-вакцины находятся на ранней стадии исследований на людях.
ДНК-вакцины доставляют ДНК, которая содержит код определенных вирусных белков. Клетки захватывают ДНК и производят белки, которые распознаются иммунной системой, что приводит к более сильным иммунным ответам, чем вакцины на основе вирусных векторов.Некоторые ДНК-вакцины находятся на ранней стадии исследований на людях.
ПОМОГИТЕ НАМ ПОМОГИТЕ ДРУГИМ
Avert.org помогает предотвратить распространение ВИЧ и улучшить сексуальное здоровье, предоставляя людям достоверную и актуальную информацию.
Мы предоставляем все это БЕСПЛАТНО, но для поддержания работы Avert.org нужны время и деньги.
Можете ли вы поддержать нас и защитить наше будущее?
Помогает каждый вклад, даже самый маленький.
Этические вопросы разработки вакцин
Помимо этических проблем, возникающих при всех формах медицинских исследований, испытания вакцины против ВИЧ поднимают несколько собственных.
Участники испытаний должны иметь доступ к стандартному медицинскому обслуживанию в дополнение к тестируемому вмешательству. Стандарт оказания помощи в профилактике ВИЧ быстро меняется, поскольку все больше и больше стран начинают предоставлять PrEP. Наличие в будущем вагинального кольца, содержащего антиретровирусный препарат, также повлияет на стандарты ухода за женщинами при испытаниях вакцин.
Стандарт оказания помощи в профилактике ВИЧ быстро меняется, поскольку все больше и больше стран начинают предоставлять PrEP. Наличие в будущем вагинального кольца, содержащего антиретровирусный препарат, также повлияет на стандарты ухода за женщинами при испытаниях вакцин.
Получение экспериментальной вакцины может снизить пользу, которую участники испытаний могут получить от будущей более эффективной вакцины, а также может создать у участников впечатление, что они защищены от ВИЧ.Это ложное чувство безопасности может побудить участников пойти на риск во время и после испытания, ведущий к ВИЧ-инфекции.
Люди, которые принимают участие в испытаниях вакцины и получают активную вакцину, могут иметь положительный результат теста на антитела к ВИЧ. Участникам испытаний требуется конфиденциальность и защита от дискриминации, как и людям, живущим с ВИЧ.
Испытания вакцины также поднимают вопросы относительно лечения людей, инфицированных, несмотря на вакцинацию. Испытания предназначены для измерения вирусной нагрузки у инфицированных людей, чтобы выяснить, оказывает ли вакцина какое-либо влияние на естественное течение ВИЧ после заражения. Но поскольку в настоящее время руководства рекомендуют лечение для всех, живущих с ВИЧ, насколько этично откладывать лечение после заражения во время испытания вакцины? И если лечение предоставляется немедленно, когда оно недоступно для других вне исследования, поощряет ли это участие в исследовании?
Но поскольку в настоящее время руководства рекомендуют лечение для всех, живущих с ВИЧ, насколько этично откладывать лечение после заражения во время испытания вакцины? И если лечение предоставляется немедленно, когда оно недоступно для других вне исследования, поощряет ли это участие в исследовании?
Что произойдет, если будет обнаружена высокоэффективная вакцина?
Оптимистичный прогноз доступности вакцины против ВИЧ заключается в том, что она может быть доступна к 2030 году. Более пессимистичный взгляд заключается в том, что разработка вакцины, которая будет признана достаточно эффективной, чтобы оправдать финансирование широкомасштабных кампаний вакцинации в России, может занять от 20 до 30 лет. регионы, где ВИЧ является эндемичным.
Решающим фактором, определяющим скорость, с которой вакцина станет доступной, является вопрос минимальной эффективности, необходимой для того, чтобы сделать ее рентабельной.
Ни одна вакцина не защищает каждого, кто ее получает. Эффективность вакцины против сезонного гриппа сильно меняется от года к году. Вопрос для исследователей вакцины против ВИЧ: следует ли внедрить вакцину, которая снижает риск заражения на 50%, немедленно или следует продолжить исследования в надежде, что вакцина с эффективностью 90% станет возможной через несколько лет?
Эффективность вакцины против сезонного гриппа сильно меняется от года к году. Вопрос для исследователей вакцины против ВИЧ: следует ли внедрить вакцину, которая снижает риск заражения на 50%, немедленно или следует продолжить исследования в надежде, что вакцина с эффективностью 90% станет возможной через несколько лет?
Моделирование Международной инициативы по вакцине против СПИДа показывает, что даже если вакцина эффективна только на 30%, она снизит количество новых инфекций на 44% за 10 лет при использовании вместе с универсальным лечением и ДКП.Обзор всех исследований экономической эффективности вакцины против ВИЧ показал, что эффективность вакцины гораздо менее важна, чем стоимость лечения ВИЧ или уровень передачи ВИЧ при определении того, будет ли вакцина рентабельной. Если вакцина будет признана готовой для широкого использования людьми, потребуется адекватное финансирование, чтобы гарантировать закупку вакцины. Для увеличения объемов производства производителям потребуются гарантии. После проверки производственных процессов для обеспечения стабильно высокого качества партий вакцины необходимо будет получить лицензию на вакцину в каждой стране, где она будет использоваться.
После проверки производственных процессов для обеспечения стабильно высокого качества партий вакцины необходимо будет получить лицензию на вакцину в каждой стране, где она будет использоваться.
Национальным властям также необходимо будет решить, кому сделать вакцинацию в первую очередь. Эти решения, вероятно, будут приниматься для каждой отдельной страны и будут зависеть от эффективности и стоимости вакцины, а также от скорости передачи. Например, некоторые страны с высоким уровнем заболеваемости ВИЧ среди молодых женщин могут решить отдать приоритет девочкам-подросткам и молодым женщинам. В других странах с концентрированными эпидемиями приоритетными группами могут быть потребители инъекционных наркотиков, работники секс-бизнеса или мужчины, практикующие секс с мужчинами.
Вакцина против ВИЧ — это сегодня более реалистичная перспектива, чем десять лет назад. Исследования показали некоторые доказательства того, что современные разработки вакцин могут вызывать сильные иммунные реакции, защищающие некоторых людей от ВИЧ-инфекции.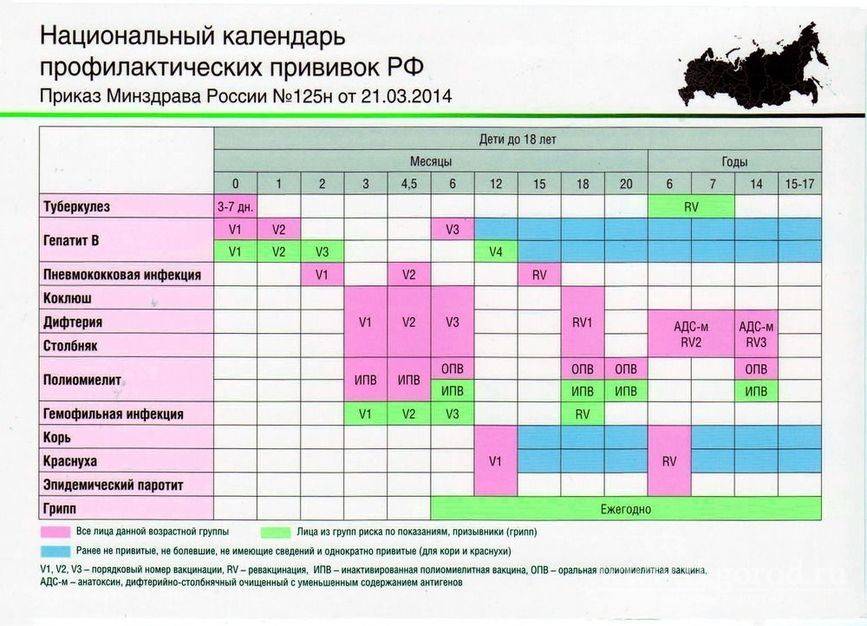 Результаты более крупных исследований между 2021 и 2022 годами, вероятно, предоставят гораздо больше информации о сроках создания эффективной вакцины.
Результаты более крупных исследований между 2021 и 2022 годами, вероятно, предоставят гораздо больше информации о сроках создания эффективной вакцины.
Почему так сложно сделать вакцину от ВИЧ?
История разработки вакцины против ВИЧ отмечена многочисленными неудачами и разочарованиями, и каждый очевидный «прорыв» представляет собой еще больше проблем и препятствий, которые необходимо преодолеть.Часто кажется, что на один шаг вперед исследователи сталкиваются с непредвиденным препятствием на один или даже два шага назад.
В некотором смысле это справедливая оценка, учитывая, что нам еще предстоит увидеть жизнеспособную вакцину-кандидат. С другой стороны, ученые действительно добились огромных успехов в последние годы, лучше понимая сложную динамику ВИЧ-инфекции и реакцию организма на такую инфекцию. Эти достижения настолько воодушевляют, что некоторые теперь считают, что вакцина станет возможной в течение следующих 15 лет (среди них — лауреат Нобелевской премии и соавтор исследования ВИЧ Франсуаза Барре-Синусси).
Еще неизвестно, будет ли такая вакцина доступной, безопасной и простой для введения и распространения среди населения всего мира. Но что мы знаем наверняка, так это то, что необходимо будет устранить ряд ключевых препятствий, если какой-либо такой кандидат когда-либо выйдет за пределы стадии проверки концепции.
Международная инициатива по вакцине против СПИДа (IAVI)Как ВИЧ препятствует разработке вакцины
С самой фундаментальной точки зрения усилиям по разработке вакцины против ВИЧ препятствует генетическое разнообразие самого вируса.Цикл репликации ВИЧ не только быстрый (немногим более 24 часов), но и подвержен частым ошибкам, производя мутировавшие копии самого себя, которые рекомбинируют в новые штаммы по мере передачи вируса от человека к человеку. Разработка единой вакцины, способной уничтожить более 60 доминантных штаммов, а также множество рекомбинантных штаммов — и на глобальном уровне — становится еще более сложной задачей, когда обычные вакцины могут защитить только от ограниченного числа вирусных штаммов.
Во-вторых, борьба с ВИЧ требует надежного ответа со стороны иммунной системы, и это снова приводит к ее отказу.Традиционно специализированные белые кровяные тельца, называемые Т-лимфоцитами CD4, инициируют ответ, передавая сигнал клеткам-киллерам к месту инфекции. По иронии судьбы, это те самые клетки, на которые нацелен ВИЧ. Поступая таким образом, ВИЧ снижает способность организма защищаться, поскольку популяция CD4 систематически истощается, что в конечном итоге приводит к нарушению защитных механизмов, называемому иммунным истощением.
Наконец, искоренению ВИЧ препятствует способность вируса скрываться от иммунной защиты организма.Вскоре после заражения, пока другой ВИЧ свободно циркулирует в кровотоке, подмножество вируса (называемого провирусом) внедряется в скрытые клеточные убежища (называемые скрытыми резервуарами). Попав внутрь этих клеток, ВИЧ защищен от обнаружения.
Вместо инфицирования и уничтожения клетки-хозяина, латентный ВИЧ делится вместе с хозяином с сохранением своего генетического материала. Это означает, что даже если ВИЧ, находящийся в свободном обращении, погибнет, «скрытый» ВИЧ может дать реактивную реакцию и запустить инфекцию заново.
Это означает, что даже если ВИЧ, находящийся в свободном обращении, погибнет, «скрытый» ВИЧ может дать реактивную реакцию и запустить инфекцию заново.
Преодоление препятствий
В последние годы стало ясно, что преодоление этих препятствий потребует многоаспектной стратегии и что единый подход вряд ли позволит достичь целей, необходимых для разработки стерилизующей вакцины.
Таким образом, основные компоненты этой стратегии должны касаться:
- Способы нейтрализации множества генетических штаммов ВИЧ
- Способы вызвать соответствующий иммунный ответ, необходимый для защиты
- Способы поддержания целостности иммунной системы
- Способы очистить и убить латентные вирусы
Прогресс достигается по многим из этих предложенных стратегий с разным уровнем эффективности и успеха, и его можно примерно определить следующим образом:
Стимулирующие широко нейтрализующие антитела
Среди людей, живущих с ВИЧ, есть группа людей, известных как элитные контролеры (ЭК), которые, по-видимому, обладают способностью подавлять репликацию вируса без антиретровирусной терапии.
В последние годы ученые начали выявлять конкретные генетические мутации, которые, по их мнению, вызывают этот естественный защитный ответ. Среди них — подмножество специализированных защитных белков, известных как широко нейтрализующие антитела (или bNAb).
Антитела защищают организм от конкретного болезнетворного агента (патогена). Большинство из них не являются нейтрализующими антителами широкого спектра действия, что означает, что они убивают только один или несколько типов патогенов.
Некоторые недавно обнаруженные bNAb обладают способностью убивать широкий спектр вариантов ВИЧ — до 95% в некоторых случаях — тем самым ограничивая способность вируса инфицировать и распространяться.
На сегодняшний день ученым еще предстоит определить эффективные средства для индукции ответа bNAb до уровней, при которых он может считаться защитным, и что для развития такого ответа, вероятно, потребуются месяцы или даже годы. Еще больше усложняет ситуацию тот факт, что мы еще не знаем, может ли стимуляция этих bNAb быть вредной — могут ли они действовать против собственных клеток организма и свести на нет какую-либо пользу от лечения.
При этом большое внимание уделяется прямой инокуляции bNAb людям с установленной ВИЧ-инфекцией.Один из таких bNAb, известный как 3BNC117, по-видимому, не только блокирует заражение новых клеток, но также очищает ВИЧ-инфицированные клетки. Такой подход может однажды позволить использовать альтернативный или дополнительный подход к терапии для людей, уже инфицированных этим вирусом.
Восстановление иммунной целостности
Даже если бы ученые смогли эффективно стимулировать производство bnAb, это, вероятно, потребовало бы надежного иммунного ответа. Это считается серьезной проблемой, поскольку сам ВИЧ вызывает истощение иммунной системы, активно убивая «вспомогательные» Т-клетки CD4.
Кроме того, способность организма бороться с ВИЧ с помощью так называемых «убийц» Т-лимфоцитов CD8 со временем постепенно ослабевает, поскольку организм подвергается так называемому иммунному истощению. Во время хронической инфекции иммунная система будет постоянно регулировать себя, чтобы гарантировать, что она не будет ни чрезмерно стимулирована (вызывая аутоиммунные заболевания), ни недостаточно стимулирована (позволяя патогенам беспрепятственно распространяться).
В частности, при длительной ВИЧ-инфекции может происходить недостаточная активация, поскольку клетки CD4 постепенно уничтожаются, и организм становится менее способным идентифицировать патоген (ситуация аналогична ситуации у больных раком).Когда это происходит, иммунная система непреднамеренно «тормозит» соответствующую реакцию, делая ее все менее и менее способной защищаться.
Ученые из Университета Эмори начали изучать возможность использования клонированных антител под названием ипилимумаб , которые могут «ослабить тормоза» и активизировать производство Т-клеток CD8.
Одно из наиболее восторженно принятых исследований, в настоящее время находящихся на испытаниях на приматах, включает использование отключенной «оболочки» обычного вируса герпеса, называемого ЦМВ, в которую вставляются не вызывающие болезни фрагменты SIV (версия ВИЧ для приматов). .Когда субъектам вводят генетически измененный ЦМВ, организм реагирует на «ложную» инфекцию ускорением выработки Т-клеток CD8 для борьбы с тем, что, по их мнению, является SIV.
Что делает модель ЦМВ особенно привлекательной, так это то, что вирус герпеса не выводится из организма, как вирус простуды, а продолжает размножаться. Приносит ли это долговременную иммунную защиту, еще предстоит определить, но это убедительное доказательство правильности концепции.
Пнуть и убить скрытый ВИЧ
Одно из самых серьезных препятствий на пути разработки вакцины против ВИЧ — это скорость, с которой вирус способен создавать скрытые резервуары, чтобы избежать обнаружения иммунной системой.Считается, что это может произойти всего за четыре часа в случае передачи через анальный секс — быстро от очага инфекции к лимфатическим узлам — до четырех дней при других типах передачи половым или несексуальным путем.
На сегодняшний день мы не совсем уверены, насколько обширными или большими могут быть эти резервуары, ни с какой их способностью вызывать возврат вируса (т. Е. Возвращение вируса) у тех, кто, как считается, не инфицирован.
Некоторые из наиболее агрессивных аспектов исследования включают в себя так называемую стратегию «удар-убийство» с использованием стимулирующих агентов, которые могут «вытолкнуть» латентный ВИЧ из укрытия, тем самым позволяя второстепенному агенту или стратегии «убить» недавно обнаруженный вирус. .
.
В этом отношении ученые добились определенного успеха, используя препараты, называемые ингибиторами HDAC, которые традиционно применялись для лечения эпилепсии и расстройств настроения. Хотя исследования показали, что новые препараты HDAC способны «разбудить» спящий вирус, ни одному из них еще не удалось очистить резервуары или даже уменьшить их размер. В настоящее время надежды возлагаются на совместное использование HDAC и других новых лекарственных средств (включая PEP005, используемый для лечения одного из видов рака кожи, связанного с солнцем).
Однако более проблематичным является тот факт, что ингибиторы HDAC потенциально могут вызывать токсичность и подавление иммунных ответов.В результате ученые также изучают класс лекарств, называемых агонистами TLA, которые, по-видимому, способны стимулировать иммунный ответ, а не «вытряхивать» вирус из укрытия. Ранние исследования на приматах были многообещающими, не только с измеримым сокращением латентных резервуаров, но и со значительным увеличением активации клеток-киллеров CD8.
Расследование происхождения СПИДа: некоторые этические аспекты
Десять лет назад журнал Journal of Medical Ethics отклонил заявление о происхождении СПИДа на том основании, что его длина в 19 000 слов была слишком длинной.В статье независимого ученого Луи Паскаля утверждалось, что СПИД мог возникнуть из-за непреднамеренно зараженных вакцин против полиомиелита, используемых в Африке в конце 1950-х годов. Впоследствии я организовал публикацию произведения Паскаля в качестве рабочего документа в моем университете. 1 Вскоре после этого редактор журнала Journal of Medical Ethics написал откровенную редакционную статью, объясняющую решение журнала не публиковаться. 2
Когда Паскаль впервые выразил озабоченность в конце 1980-х годов, связь вакцин против полиомиелита с происхождением СПИДа полностью не входила в научную повестку дня.Сегодня к нему относятся гораздо серьезнее — например, он стимулировал значительные научные исследования. Следовательно, сейчас уместно пересмотреть некоторые из вопросов, поднятых Паскалем, и изучить те, которые возникли с тех пор. В этой статье рассматриваются четыре основных вопроса. Следует ли придерживаться теории вакцины против полиомиелита? Следует ли обвинять кого-либо в происхождении СПИДа? Следует ли использовать действия по диффамации, когда они препятствуют обсуждению научных идей? Обязано ли научное сообщество придерживаться неортодоксальных теорий? Но прежде чем углубляться в эти вопросы, будет полезно обрисовать теорию вакцины против полиомиелита и реакцию научного сообщества на нее.
Следовательно, сейчас уместно пересмотреть некоторые из вопросов, поднятых Паскалем, и изучить те, которые возникли с тех пор. В этой статье рассматриваются четыре основных вопроса. Следует ли придерживаться теории вакцины против полиомиелита? Следует ли обвинять кого-либо в происхождении СПИДа? Следует ли использовать действия по диффамации, когда они препятствуют обсуждению научных идей? Обязано ли научное сообщество придерживаться неортодоксальных теорий? Но прежде чем углубляться в эти вопросы, будет полезно обрисовать теорию вакцины против полиомиелита и реакцию научного сообщества на нее.
Ученые широко согласны с тем, что ВИЧ, вирус иммунодефицита человека, ответственный за СПИД, возник из вирусов иммунодефицита обезьян (SIV), которые были переданы человеку от обезьян или шимпанзе в Африке. Вопрос в том, как это сделать. Традиционная теория заключалась в том, что кровь обезьяны попала в людей через охотника, разделывающего обезьяну, из-за того, что люди ели недоваренное мясо обезьяны, через укус обезьяны или другими подобными способами. Это называется теорией «охотника на разрез» или «теории естественного переноса».
Это называется теорией «охотника на разрез» или «теории естественного переноса».
Паскаль предположил, что передача ВИО людям могла произойти случайно в результате вакцинации против полиомиелита, введенной сотням тысяч людей в Центральной Африке в 1957–1960 гг., В рамках первой в мире кампании массовой вакцинации от полиомиелита, проводимой пионером полиомиелита Хилари. Копровски. Эти вакцины против полиомиелита, сделанные из модифицированного, менее вирулентного штамма живого вируса полиомиелита, культивировались на почках обезьян, что создавало возможность заражения вирусами вирусной инфекции. Обезьяны могут переносить SIV без симптомов.Скрининг на ВИО не мог быть проведен, так как они не были обнаружены до 1985 года.
Самым ярким доказательством этой теории является совпадение во времени и пространстве между кампаниями вакцинации Копровски в Африке от полиомиелита и ранними доказательствами СПИДа. Большинство первых ВИЧ-положительных образцов крови и случаев СПИДа приходится на те регионы, где проводилась вакцинация от полиомиелита. Самый ранний известный образец крови с положительной реакцией на ВИЧ взят из Киншасы — места вакцинации — в 1959 году. Кроме того, есть прецедент: известно, что от обезьяньего вируса SV-40 заражены вакцины против полиомиелита, которые были введены миллионам людей. 3
Самый ранний известный образец крови с положительной реакцией на ВИЧ взят из Киншасы — места вакцинации — в 1959 году. Кроме того, есть прецедент: известно, что от обезьяньего вируса SV-40 заражены вакцины против полиомиелита, которые были введены миллионам людей. 3
Паскаль безуспешно отправлял статьи по этой теории в несколько научных журналов в несколько научных журналов. После совета тогдашнего редактора журнала Journal of Medical Ethics о подходящем стиле и длине, Паскаль представил новый документ, затрагивающий как научные, так и этические аспекты, но на 19 000 слов он был намного длиннее, чем предусматривалось. Журнал Journal of Medical Ethics В редакционной статье изложена теория и, не поддерживая ее, говорится, что тезис Паскаля «является важным и тщательно аргументированным и должен быть серьезно воспринят работниками в области СПИДа». 4 Редакция также сообщила подробности о том, как получить газету, что привело к десяткам запросов на копии в последующие годы.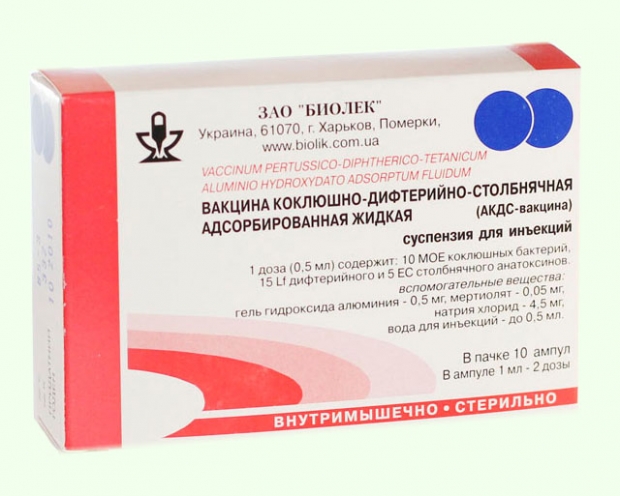
Спустя несколько месяцев после публикации статьи Паскаля ее затмило независимое изложение той же теории, сделанное журналистом Томом Кертисом в массовом журнале Rolling Stone. 5 В то время как научное сообщество проигнорировало статьи Паскаля, по иронии судьбы, публикация в журнале «Rolling Stone » заставила ученых более серьезно отнестись к теории с комментариями и письмами в ведущих научных журналах.В последующие годы были и другие публикации об этой теории, в том числе активистом по борьбе со СПИДом Блейном Элсвудом, 6 , который первоначально поощрял Кертиса исследовать эту историю, а затем и журналиста Джулиана Крибба. 7 Моя собственная роль заключалась в том, чтобы писать комментарии к динамике научного сообщества, выявленной в ответах на теорию 8, 9 и позже, чтобы обеспечить веб-сайт соответствующими документами. 10
Во второй половине 1990-х годов внимание к теории уменьшилось, хотя доказательства были сильнее, чем раньше. Ситуация кардинально изменилась в 1999 году с публикацией эпической книги Эдварда Хупера « Река , 11 », которая предоставила новые объемные свидетельства в виде хорошо написанного рассказа. Ведущий биолог-эволюционист Уильям Д. Гамильтон призвал Королевское общество провести собрание для обсуждения теории, хотя трагически он умер до того, как оно было проведено. На встрече было представлено много новых научных работ, касающихся происхождения СПИДа. 12
Ситуация кардинально изменилась в 1999 году с публикацией эпической книги Эдварда Хупера « Река , 11 », которая предоставила новые объемные свидетельства в виде хорошо написанного рассказа. Ведущий биолог-эволюционист Уильям Д. Гамильтон призвал Королевское общество провести собрание для обсуждения теории, хотя трагически он умер до того, как оно было проведено. На встрече было представлено много новых научных работ, касающихся происхождения СПИДа. 12
НАДЕЖНОСТЬ НЕОРТОДОКСНЫХ ТЕОРИЙ
Объем соответствующих данных и научная сложность дискуссии сейчас намного больше, чем когда Паскаль впервые представил свои идеи.Однако этические аспекты остаются относительно неизученными, хотя они не менее важны. По логике, ни один из четырех обсуждаемых здесь основных вопросов не зависит от теории вакцины против полиомиелита, имеющей определенный уровень научной достоверности. Действительно, если бы теория была широко признана правдоподобной, некоторые вопросы могли бы даже не возникнуть! Тем не менее, прежде чем отвечать на вопросы, может быть полезно обсудить правдоподобие теории вакцины против полиомиелита сегодня и когда Паскаль писал свою статью.
При обсуждении научной теории, которая не принимается большинством научного сообщества, не существует единого стандартного критерия для оценки ее достоверности. Некоторые критерии, которые могут быть использованы, включают: (1) одобрение некоторыми уважаемыми учеными; (2) серьезное внимание в общей научной прессе; (3) последующее оправдание; (4) исследование, проведенное в ответ на теорию, и (5) одобрение информированных неспециалистов. «Одобрение» здесь означает одобрение как правдоподобную теорию или теорию, заслуживающую изучения, но не обязательно верить в ее правильность.Если теория удовлетворяет нескольким из этих критериев или полностью удовлетворяет одному или двум, ее можно назвать более правдоподобной, чем теория, которая удовлетворяет меньшему количеству критериев или удовлетворяет им более слабо.
(1) Теория вакцины против полиомиелита была одобрена как правдоподобная несколькими ведущими учеными примерно в то время, когда Паскаль представлял свои идеи. 13, 14 Совсем недавно несколько ученых, участвовавших в заседании Королевского общества, сочли эту теорию правдоподобной. 15, 16
13, 14 Совсем недавно несколько ученых, участвовавших в заседании Королевского общества, сочли эту теорию правдоподобной. 15, 16
(2) Серьезное внимание в научной прессе уделяется редакционным статьям и новостям в ведущих научных журналах, а также популярным комментариям ведущих ученых. После того, как в 1992 г. была опубликована информация о теории вакцины против полиомиелита, в целом ряде подобных материалов теория вакцины против полиомиелита была серьезно затронута. Например, известный ученый Джаред Даймонд, комментируя конкурирующие теории происхождения СПИДа, включил теорию вакцины против полиомиелита как возможность, достойную серьезного обсуждения. 17 После публикации книги The River в 1999 г. в ряде обзоров книг ученых в научных журналах теория вакцины против полиомиелита воспринималась достаточно серьезно, даже когда рецензенты не поддерживали ее лично. 18, 19
(3) Последующее подтверждение теории может ретроспективно добавить веса утверждению о том, что ранее она заслуживала рассмотрения.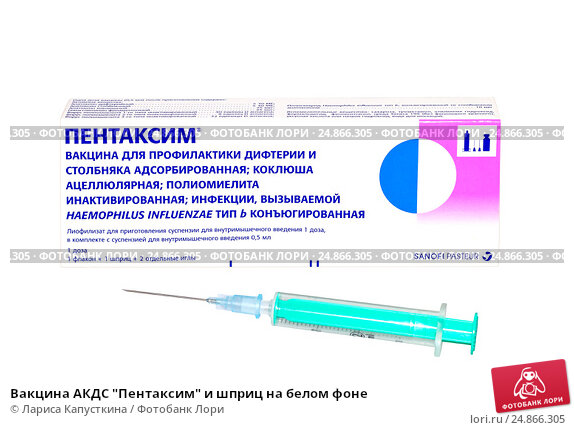 Теория вакцины против полиомиелита не получила подтверждения в том смысле, что она широко признана учеными.Однако можно сказать, что работа Паскаля частично подтверждена в том смысле, что десять лет спустя, после многочисленных дополнительных исследований, некоторые ученые считают, что теория по-прежнему заслуживает рассмотрения.
Теория вакцины против полиомиелита не получила подтверждения в том смысле, что она широко признана учеными.Однако можно сказать, что работа Паскаля частично подтверждена в том смысле, что десять лет спустя, после многочисленных дополнительных исследований, некоторые ученые считают, что теория по-прежнему заслуживает рассмотрения.
(4) Одним из критериев ценности теории является то, стимулирует ли она исследования. Конечно, теория не обязательно должна быть правильной, чтобы стимулировать исследования, но этот критерий отражает, воспринимается ли теория серьезно. Многие из материалов, представленных на заседании Королевского общества, сообщают об обширных исследованиях, инициированных теорией вакцины против полиомиелита; некоторые из этих исследований привели к пониманию происхождения СПИДа, а некоторые, кроме того, включали открытие новой информации и разработку новых методов (например, для математического анализа эволюции ВИЧ).Во многом это исследование было стимулировано публикацией The River , но без более ранних работ, таких как Паскаля, Хупер не предпринял бы массового расследования, кульминацией которого стала его книга.
(5) Наконец, теория может быть более правдоподобной, если она одобрена как заслуживающая внимания или исследования информированными неспециалистами. Этот критерий особенно важен, когда теория не относится к одной дисциплине, так что она не может быть полностью исследована или оценена какой-либо отдельной группой специалистов, и когда есть веские основания полагать, что теория может быть противопоставлена ненаучным. причины, такие как угроза прибыли или репутации.Тщательное исследование теории вакцины против полиомиелита определенно требует навыков в нескольких областях, включая эпидемиологию, филогенетику, архивные исследования и журналистские расследования. Таким образом, можно утверждать, что информированная оценка неспециалистов актуальна, поскольку специалисты из любой области имеют лишь частичную точку зрения. Раанон Гиллон, редактор журнала Journal of Medical Ethics в 1992 г., мог считаться информированным неспециалистом, когда он заявил, что к теории вакцины против полиомиелита следует относиться серьезно. 4 В последнее время многие обзоры The River , опубликованные в газетах и журналах, можно было рассматривать как одобрение неспециалистов.
4 В последнее время многие обзоры The River , опубликованные в газетах и журналах, можно было рассматривать как одобрение неспециалистов.
Таким образом, почти по каждому из этих критериев подтверждается правдоподобность теории вакцины против полиомиелита.Существует множество других нестандартных теорий происхождения СПИДа, от экспериментов с биологической войной до микробов из космоса 22 ; ни одна из этих теорий не имеет ничего общего с правдоподобностью теории вакцины против полиомиелита согласно пяти критериям.
После вступительной части настало время перейти к четырем вопросам происхождения СПИДа, которые имеют важные этические аспекты. Как отмечалось ранее, для ответа на эти вопросы не требуется, чтобы теория вакцины против полиомиелита имела определенный уровень правдоподобия, но, тем не менее, может быть полезно знать, что, хотя теория была и остается яростной оппозицией некоторыми учеными по пяти критериям, изложенным здесь ее не следует рассматривать как диковинную, а скорее как неортодоксальную теорию, которую некоторые ученые и информированные неспециалисты рассмотрели и до сих пор считают заслуживающей исследования.
СЛЕДУЕТ ИССЛЕДОВАТЬ ПРОИСХОЖДЕНИЕ СПИДА?
С тех пор, как была впервые представлена теория вакцины против полиомиелита, многие люди высказали предположение, что происхождение СПИДа не является подходящей темой для исследования. Эта точка зрения систематически не аргументировалась в печати, но обычно высказывается в частных беседах и переписке. Есть два основных аргумента в пользу противодействия расследованию происхождения СПИДа: (1) все доступные ресурсы должны быть направлены на изучение того, как уменьшить распространение СПИДа и разработать методы лечения; (2) текущие усилия по вакцинации могут оказаться под угрозой, если люди будут полагать, что СПИД возник в результате вакцинации от полиомиелита.
Один из ответов на первое обоснование состоит в том, что информация о происхождении СПИДа может привести к пониманию, которое может помочь нынешним усилиям по борьбе со СПИДом. Например, исследования шимпанзе могут показать, как они могут жить с ВИО и не страдать от обезьяньей версии СПИДа. Если вакцинация привела к СПИДу, то некоторые вакцинированные не пострадали бы, некоторые заразились бы СПИДом, а некоторые, возможно, развили бы иммунитет, особенно если возможен молекулярный иммунитет. 23 Следовательно, поиск выживших вакцин может выявить некоторых из них, у которых есть иммунитет к SIV / ВИЧ, что даст представление о том, как это можно продвигать.
Если вакцинация привела к СПИДу, то некоторые вакцинированные не пострадали бы, некоторые заразились бы СПИДом, а некоторые, возможно, развили бы иммунитет, особенно если возможен молекулярный иммунитет. 23 Следовательно, поиск выживших вакцин может выявить некоторых из них, у которых есть иммунитет к SIV / ВИЧ, что даст представление о том, как это можно продвигать.
Ценность изучения происхождения болезней широко признана. Классический пример — холера в Лондоне в середине 1800-х годов. Вместо того, чтобы просто лечить жертв, Джон Сноу изучал паттерны болезни и, не зная о возбудителе, сделал вывод, что причиной этого является живой агент, передающийся от человека человеку, и что вода из насоса на Брод-стрит была одним из путей передачи. 24 Таким образом, возникает соблазн предположить, что сомнения по поводу изучения происхождения СПИДа связаны с чем-то более глубоким, чем озабоченность потраченными впустую усилиями.Это подводит нас ко второму обоснованию: если люди считают, что вакцинация привела к СПИДу, то нынешние усилия по вакцинации могут оказаться под угрозой.
Такая общественная реакция была бы необоснованной, поскольку основной риск нового заболевания от вакцинации касается всего вида, а не отдельных людей. Если теория СПИДа о происхождении вакцины против полиомиелита верна, возможно, несколько сотен или тысяч человек были непреднамеренно инфицированы ВИП / ВИЧ в результате прямой вакцинации. Все остальные из десятков миллионов случаев заражения ВИЧ и смерти от СПИДа произошли «обычными» путями, такими как половой акт.Но хотя страх перед вакцинацией может быть необоснованным, страх может быть вполне реальным.
Один из способов подойти к этому вопросу — утверждать, что теорию не следует исследовать, если отрицательные последствия, возникающие из-за того, что теория считается правильной, перевешивают выгоды от полученных знаний. Это поднимает множество дополнительных вопросов, например, как оцениваются и сравниваются вероятные последствия, и кто несет ответственность за принятие решений о том, следует ли исследовать теорию.
Другой подход состоит в изучении социального контекста, в котором воспринимаются теории, и, при необходимости, попытке его изменить. Одним из элементов контекста происхождения проблемы СПИДа является вера в то, что вакцинация — это беспримесный товар, вера, широко пропагандируемая популяризаторами вакцинации. (Это, в свою очередь, является элементом более широкого убеждения в том, что медицинское вмешательство обязательно полезно.) В этом контексте информация о негативных последствиях особенно разрушительна. Возможный ответ — продвижение вакцинации с большей открытостью в отношении опасностей, таких как небольшой риск того, что вакцинация против полиомиелита может привести к полиомиелиту.Если бы представители общественности имели более реалистичное представление о рисках вакцинации и медицинских экспериментов, то расследование теорий происхождения СПИДа не представляло бы такой опасности для программ вакцинации, а вместо этого могло бы стоять или падать в большей степени на основе их собственные достоинства.
Знание происхождения СПИДа может служить необходимым предупреждением об опасности определенных биологических процедур. Если бы люди считали, что вакцины против полиомиелита привели или даже могли привести к СПИДу, это резко увеличило бы озабоченность по поводу современных процедур.Большинство вакцин против полиомиелита сегодня все еще выращивают на почках обезьян. Одна из первоначальных проблем Паскаля заключалась в том, что вакцины против полиомиелита могут заразить человеческий вид другими ВИО, каждая из которых способна вызвать миллионы смертей. Хотя современные вакцины тщательно проверяются на вирусы иммунодефицита, всегда есть риск ошибки. В 1992 году Институт Вистар в Филадельфии, где производились некоторые вакцины Копровски, создал комитет для оценки теории вакцины против полиомиелита. Было обнаружено, что эта теория крайне маловероятна, но тем не менее рекомендовано больше не производить вакцины против полиомиелита с использованием почек обезьян. 25
Помимо вакцинации, другие виды переноса между видами могут привести к появлению новых опасных болезней. Ксенотрансплантация, такая как пересадка печени павиана человеку, — это способ обезьяньих вирусов найти хозяина-человека, особенно с учетом того, что для таких трансплантаций требуются препараты, подавляющие иммунитет. В более общем плане подобные виды рисков связаны с некоторыми типами генной инженерии. Более того, как ВИО не были известны в 1950-х годах, так и прионы, участвующие в болезни коровьего бешенства, были неизвестны до 1990-х годов, и в будущем могут быть обнаружены дополнительные переносчики болезней.Признание возможности того, что СПИД возник в результате вакцинации против полиомиелита, может привлечь внимание ученых, регулирующих органов и общественности к подобным рискам.
Ксенотрансплантация, такая как пересадка печени павиана человеку, — это способ обезьяньих вирусов найти хозяина-человека, особенно с учетом того, что для таких трансплантаций требуются препараты, подавляющие иммунитет. В более общем плане подобные виды рисков связаны с некоторыми типами генной инженерии. Более того, как ВИО не были известны в 1950-х годах, так и прионы, участвующие в болезни коровьего бешенства, были неизвестны до 1990-х годов, и в будущем могут быть обнаружены дополнительные переносчики болезней.Признание возможности того, что СПИД возник в результате вакцинации против полиомиелита, может привлечь внимание ученых, регулирующих органов и общественности к подобным рискам.
НУЖНО ЛИ ВИНОВАТЬ УЧЕНЫХ?
Если СПИД возник в результате заражения вакциной против полиомиелита, кто или что виноват? В качестве альтернативы, уместно и полезно ли вообще обвинять?
Вина имеет несколько измерений. Один из них — это юридическая ответственность, которая решается судами и учеными-юристами. Другой — воспитательная ценность.Человек, которого обвиняют в действии, может (а может и не извлечь) урок, а процесс обвинения может служить предупреждением для других. Однако здесь основное внимание уделяется тому, кто или что несет ответственность за происхождение СПИДа.
Другой — воспитательная ценность.Человек, которого обвиняют в действии, может (а может и не извлечь) урок, а процесс обвинения может служить предупреждением для других. Однако здесь основное внимание уделяется тому, кто или что несет ответственность за происхождение СПИДа.
Участники с обеих сторон спора единодушно отрицают, что кто-либо, участвовавший в кампаниях вакцинации против полиомиелита в Африке, несет ответственность за СПИД, потому что в то время не были обнаружены ВИО и, таким образом, не была признана возможность передачи болезни. Заражение, если оно произошло, было непреднамеренным и поэтому не заслуживает порицания.
Более сложным является вопрос о том, что можно было бы назвать «структурной ответственностью», а именно о роли таких факторов, как конкуренция и колониализм. Например, можно утверждать, что система научной репутации с ее вознаграждением для ученых, успешно заявивших о своих приоритетах, побуждает пионеров полиомиелита идти на риск. (Пионеры утверждают, что они законно пошли на риск ради тех, кто в противном случае мог бы заразиться полиомиелитом, в то время вызывающим всеобщее опасение смертельной болезнью — скорее, чем сегодня СПИД.) В этом виновата репутация системы, а не отдельного человека. Точно так же колониализм можно обвинить в легкости, с которой люди третьего мира были доступны для ранних кампаний массовой вакцинации. Такому виду структурной ответственности уделялось мало внимания, возможно, отчасти потому, что те же факторы — конкуренция и неоколониализм — продолжают играть важную роль в современной науке.
(Пионеры утверждают, что они законно пошли на риск ради тех, кто в противном случае мог бы заразиться полиомиелитом, в то время вызывающим всеобщее опасение смертельной болезнью — скорее, чем сегодня СПИД.) В этом виновата репутация системы, а не отдельного человека. Точно так же колониализм можно обвинить в легкости, с которой люди третьего мира были доступны для ранних кампаний массовой вакцинации. Такому виду структурной ответственности уделялось мало внимания, возможно, отчасти потому, что те же факторы — конкуренция и неоколониализм — продолжают играть важную роль в современной науке.
В обществах, характеризующихся индивидуализмом, существует сильная тенденция сосредотачиваться на индивидуальной ответственности, что приводит к тому, что можно назвать «культурой обвинения» — например, в которой пациенты склонны подавать в суд на врачей за любую неудачную операцию.Часто есть тенденция обвинять жертву, например, когда бедных обвиняют в своей бедности. 26 Эта тенденция обнаруживается в психологических исследованиях, где «фундаментальная ошибка атрибуции» заключается в том, что ответственность за события возлагается на людей, а не на структурные факторы. Обвинение отдельных лиц позволяет системе сорваться с крючка. Таким образом, давление в пользу системных изменений направлено на поиск козлов отпущения. Вывод из этой аргументации заключается в том, что прежде чем даже думать о возложении ответственности на ученых, приоритетом должно быть извлечение общих уроков для практической научной деятельности.
Обвинение отдельных лиц позволяет системе сорваться с крючка. Таким образом, давление в пользу системных изменений направлено на поиск козлов отпущения. Вывод из этой аргументации заключается в том, что прежде чем даже думать о возложении ответственности на ученых, приоритетом должно быть извлечение общих уроков для практической научной деятельности.
ДОЛЖНЫ БЫТЬ ИСПОЛЬЗОВАНЫ ДЕЙСТВИЯ ПО ПОВРЕЖДЕНИЮ?
В конце 1992 года Копровски подал в суд на Тома Кертиса и Rolling Stone за клевету. Дело так и не дошло до суда, поскольку было урегулировано путем выплаты Rolling Stone одного доллара Копровски и публикации «разъяснения». 27 Тем не менее, судебный иск обошелся Rolling Stone в полмиллиона долларов и отговорил Кертиса и других от проведения дальнейшего расследования и публикации о теории вакцины против полиомиелита.Копровски также подал в суд на Associated Press из-за статьи другого журналиста.
Юридически Копровски, безусловно, имел право подать иск. Обсуждая этот и другие дела, Майкл Кертис, однако, решительно утверждал, что действия по диффамации оказывают разрушительное воздействие на открытое обсуждение, которое необходимо для поиска истины в научных вопросах, и что «комплексная критика» должна иметь усиленную юридическую защиту. 28 Этот разрушительный эффект может произойти несмотря на благородные намерения истца.В конечном счете, изменения в законе или юридической практике необходимы для того, чтобы полностью решить проблему сдерживания научных дискуссий в связи с клеветой, что является лишь одним из аспектов значительно возросшего в последние десятилетия использования судебных исков для подавления свободы слова. 29, 30 Если бы такая тяжба существовала в более раннюю эпоху, то можно было бы провокационно спросить, как бы повлияли на расследование Джона Сноу по холере, если бы ему подали в суд за клевету со стороны Southwark and Vauxhall Company, поставщика для насоса Broad Street?
Обсуждая этот и другие дела, Майкл Кертис, однако, решительно утверждал, что действия по диффамации оказывают разрушительное воздействие на открытое обсуждение, которое необходимо для поиска истины в научных вопросах, и что «комплексная критика» должна иметь усиленную юридическую защиту. 28 Этот разрушительный эффект может произойти несмотря на благородные намерения истца.В конечном счете, изменения в законе или юридической практике необходимы для того, чтобы полностью решить проблему сдерживания научных дискуссий в связи с клеветой, что является лишь одним из аспектов значительно возросшего в последние десятилетия использования судебных исков для подавления свободы слова. 29, 30 Если бы такая тяжба существовала в более раннюю эпоху, то можно было бы провокационно спросить, как бы повлияли на расследование Джона Сноу по холере, если бы ему подали в суд за клевету со стороны Southwark and Vauxhall Company, поставщика для насоса Broad Street?
ДОЛЖНА БЫТЬ ОТВЕТСТВЕННОСТЬ ЗА ИССЛЕДОВАНИЕ НЕОРТОДОКСНЫХ ТЕОРИЙ?
Одно из самых горячих заявлений Паскаля заключалось в том, что научное сообщество обязано уделить некоторое внимание теории вакцины против полиомиелита. В частности, он считал, что редакторы обязаны либо опубликовать его статьи, либо предоставить веские причины, по которым теория, которую он предлагает, должна быть отклонена. Он утверждал, что, если теория окажется верной, последствия будут настолько велики, что необходимы веские аргументы, чтобы оправдать отказ.
В частности, он считал, что редакторы обязаны либо опубликовать его статьи, либо предоставить веские причины, по которым теория, которую он предлагает, должна быть отклонена. Он утверждал, что, если теория окажется верной, последствия будут настолько велики, что необходимы веские аргументы, чтобы оправдать отказ.
Утверждение Паскаля можно обобщить: теория заслуживает серьезного рассмотрения, если комбинация ее следствий и вероятность того, что она верна, достаточно велики. Предположим, что у теории есть 1% шанс быть верной, но следствием этого будет полное изменение идей в этой области или большие социальные последствия.Тогда можно было бы утверждать, что теория требует 1% или более исследовательских усилий и места в журнале. Это аналогично страховому полису: вероятность бедствия мала, но последствия велики, поэтому считается, что стоит отложить небольшую долю денег или усилий на маловероятный случай.
На практике лишь немногие ученые посвящают время и ресурсы исследованию неортодоксальных теорий. Во многих случаях это положительное препятствие для карьеры. 31 Конечно, нет дополнительного финансирования для тех ученых, которые готовы посвятить часть своей энергии исследованию или проверке нестандартных идей.Лишь немногие редакторы требуют публикаций и изучения взглядов, далеких от ортодоксальности. (Очень немногие журналы, такие как Medical Hypotheses и Speculations in Science and Technology , активно продвигают это.) Кроме того, некоторые ученые громко очерняют «второстепенные» теории и области и тех, кто их защищает. Отнюдь не чувствуя себя обязанным исследовать аномалии и вызовы парадигмам, даже сочувствующие ученые, похоже, не могут взяться за это из-за нехватки времени, в то время как многие проявляют активную враждебность.Что касается происхождения СПИДа, то некоторые противники теории вакцины против полиомиелита утверждали, что, поскольку она неверна (как они считают), ее не следует исследовать дальше.
Во многих случаях это положительное препятствие для карьеры. 31 Конечно, нет дополнительного финансирования для тех ученых, которые готовы посвятить часть своей энергии исследованию или проверке нестандартных идей.Лишь немногие редакторы требуют публикаций и изучения взглядов, далеких от ортодоксальности. (Очень немногие журналы, такие как Medical Hypotheses и Speculations in Science and Technology , активно продвигают это.) Кроме того, некоторые ученые громко очерняют «второстепенные» теории и области и тех, кто их защищает. Отнюдь не чувствуя себя обязанным исследовать аномалии и вызовы парадигмам, даже сочувствующие ученые, похоже, не могут взяться за это из-за нехватки времени, в то время как многие проявляют активную враждебность.Что касается происхождения СПИДа, то некоторые противники теории вакцины против полиомиелита утверждали, что, поскольку она неверна (как они считают), ее не следует исследовать дальше.
Ориентация большинства ученых на текущие парадигмы и исследовательские программы, особенно при наличии финансирования, хорошо задокументирована в социологии науки. Критики утверждали, что открытость для неоднозначных взглядов может быть более продуктивной. 32 Конечно, есть много случаев, таких как дрейф континентов, когда впоследствии были возрождены дискредитированные теории.Комитет Wistar пришел к выводу, что теория вакцины против полиомиелита крайне маловероятна, отметив, что «наиболее убедительным доказательством является случай с моряком из Манчестера, который, по всей видимости, был инфицирован ВИЧ-1 еще до того, как в Конго были начаты испытания полиовируса». 33 Однако несколько лет спустя доказательства этого случая оказались неверными, 34 снова обнажили риск преждевременного опровержения теории.
Критики утверждали, что открытость для неоднозначных взглядов может быть более продуктивной. 32 Конечно, есть много случаев, таких как дрейф континентов, когда впоследствии были возрождены дискредитированные теории.Комитет Wistar пришел к выводу, что теория вакцины против полиомиелита крайне маловероятна, отметив, что «наиболее убедительным доказательством является случай с моряком из Манчестера, который, по всей видимости, был инфицирован ВИЧ-1 еще до того, как в Конго были начаты испытания полиовируса». 33 Однако несколько лет спустя доказательства этого случая оказались неверными, 34 снова обнажили риск преждевременного опровержения теории.
Если наука выиграет от более тщательного изучения сложных идей, то этическое ожидание от ученых посвятить некоторую часть своих усилий этим целям будет способствовать достижению этой прагматической цели.Однако для достижения этого потребуются существенные изменения в нынешних экономических системах и системах вознаграждения, основанных на коллегах, которые стимулируют исследования.
Осознание рутинного давления против неортодоксальности плюс дополнительное давление, когда оппоненты угрожают финансированию или статусу доминирующих ученых или интересам их покровителей, должно заставить наблюдателей скептически относиться к заявлениям о том, что сомнительные взгляды не заслуживают внимания.
ЗАКЛЮЧЕНИЕ
На первый взгляд, происхождение СПИДа является научным вопросом, но, как показано здесь, научные дискуссии пронизаны этическими проблемами.Что наиболее поразительно, так это то, как этические соображения использовались как средство продолжения дискуссии. Противники теории вакцины против полиомиелита утверждали, что происхождение СПИДа не требует расследования, ссылаясь на этические проблемы, а именно на максимальную эффективность усилий по борьбе со СПИДом и минимизацию ущерба кампаниям вакцинации. Выдвигались обвинения в несправедливом обвинении в происхождении СПИДа. Действия по диффамации основаны на заявлениях о нанесении ущерба репутации. Паскаль утверждал, что научное сообщество несет ответственность за рассмотрение сложных теорий, которые имеют серьезные социальные последствия.
Паскаль утверждал, что научное сообщество несет ответственность за рассмотрение сложных теорий, которые имеют серьезные социальные последствия.
В то время как этические аспекты могут быть изучены по отдельности, существует дополнительное измерение к процессу, когда этические соображения используются как средство для продолжения дискуссии. Использование этических утверждений в качестве инструментов для разжигания социальных противоречий поднимает этические аспекты второго порядка в отношении использования этих утверждений. Таким образом, дебаты о СПИДе происходят из сложного сочетания научных знаний, этики и использования власти.
Благодарности
Я благодарю Эда Хупера, Джулиана Савулеску, Стива Вунша и двух анонимных рецензентов за комментарии к более ранним версиям этой статьи.
ССЫЛКИ
- ↵
- ↵
Гиллон Р . Поразительный тезис из 19 000 слов о происхождении СПИДа: следовало ли JME опубликовать его? J Med Ethics, 1992; 18: 3–4.

- ↵
Шах К. , Натансон Н. Воздействие SV40 на человека: обзор и комментарии. Am J Epidemiol1976; 103: 1–12.
- ↵
- ↵
Кертис Т .Происхождение СПИДа. Rolling Stone 1992 19 марта: 54–61, 106, 108.
- ↵
Элсвуд BF , Стрикер РБ. Вакцины против полиомиелита и происхождение СПИДа. Med Hypotheses, 1994; 42: 347–54; erratum 1995; 44 : 226.
- ↵
Крибб J . Белая смерть. Сидней: Ангус и Робертсон, 1996.
- ↵
Мартин Б. .Экспертная оценка и происхождение СПИДа — пример отклоненных идей. Bioscience 1993; 43: 624–7.
- ↵
Мартин Б.
 . Политическое опровержение научной теории: вакцины против полиомиелита и происхождение СПИДа. Health Care Anal1998; 6: 175–9.
. Политическое опровержение научной теории: вакцины против полиомиелита и происхождение СПИДа. Health Care Anal1998; 6: 175–9. - ↵
- ↵
Hooper E . Река: путешествие к источнику ВИЧ и СПИДа [отредактированная] . Хармондсворт: Пингвин, 2000.
- ↵
Weiss RA , Wain-Hobson S, ред. Истоки ВИЧ и эпидемии СПИДа. Материалы дискуссионной встречи. Филос Транс Соц Лондон Би Биол Наука, 2001; 356: 777–977.
- ↵
Lecatsas G , Александр JJ. Безопасное тестирование вакцины против полиовируса и происхождение ВИЧ-инфекции у человека. S Afr Med J1989; 76: 451.
- ↵
Гамильтон WD .Теория СПИДа против иска [письмо]. В: Cribb J. Белая смерть.
 Сидней, Ангус и Робертсон, 1996: 254–7. (Письмо У. Д. Гамильтона включено в приложение к книге Крибба.)
Сидней, Ангус и Робертсон, 1996: 254–7. (Письмо У. Д. Гамильтона включено в приложение к книге Крибба.) - ↵
Burr T , Хайман Дж. М., Майерс Г. Происхождение синдрома приобретенного иммунодефицита: дарвинистский или ламаркистский? Philos Trans R Soc London B Biol Sci2001; 356: 877–87.
- ↵
Нельсон-Риз WA .Ответственность за истину в исследованиях. Philos Trans R Soc London B Biol Sci2001; 356: 849–51.
- ↵
Алмазный J . Загадочное происхождение СПИДа. Nat Hist1992; 101: 24–9.
- ↵
Sharp P . Спорная гипотеза о ВИЧ / СПИДе. Lancet1999; 354: 1129.
- ↵
Уэйн-Хобсон С . Отзыв о Река. Nat Med1999; 5: 1117–18.
- ↵
Альтман Л.
 К. . Новая книга бросает вызов теориям происхождения СПИДа. New York Times 1999 30 ноября: D1, D6.
К. . Новая книга бросает вызов теориям происхождения СПИДа. New York Times 1999 30 ноября: D1, D6. - ↵
Портер R . Тканевые войны. Лондонское обозрение книг 2 марта 2000 г., 22:22.
- ↵
Ледерер Р . Происхождение и распространение СПИДа: виноват ли Запад? Информационный бюллетень о скрытых действиях 1987, 28: 43–54; 1988; 29 : 52–65.
- ↵
Багасра О . ВИЧ и молекулярный иммунитет: перспективы вакцины против СПИДа. Натик, Массачусетс: Книги по биотехнике, 1999.
- ↵
Кэмерон Д. , Джонс И.Г. Джон Сноу, насос с Брод-стрит и современная эпидемиология. Int J Epidemiol1983; 12: 393–6.
- ↵
- ↵
Райан З.
 . Обвинение жертвы. Лондон: Орбах и Чемберс, 1971.
. Обвинение жертвы. Лондон: Орбах и Чемберс, 1971. - ↵
Аноним . Обновление «Происхождение СПИДа». Rolling Stone 1993 декабрь 9:39.
- ↵
Кертис МК . Суды над обезьянами: наука, клевета и подавление инакомыслия. Уильям Мэри Билл Райтс, J1995; 4: 507–93.
- ↵
Донсон FJL . Юридическое запугивание. Лондон: Free Association Books, 2000.
- ↵
Pring GW , Canan P. SLAPP: получение судебного иска за высказывание. Philadelphia: Temple University Press, 1996.
- ↵
Мартин Б. , изд. Противостояние экспертам. Олбани, Нью-Йорк: Государственный университет Нью-Йорка, 1996.

- ↵
Фейерабенд П . Против метода: очерк анархической теории познания. Лондон: NLB, 1975.
- ↵
- ↵
Zhu T , Ho DD. Был ли ВИЧ в 1959 году? Nature1995; 374: 503–4.
исследований вакцинации против СПИДа с использованием модели вируса иммунодефицита кошек Ex vivo: защита от интраклезного заражения, системного или слизистого, вводимого ослабленной вакциной
РЕФЕРАТ
Инфекция домашних кошек вирусом иммунодефицита кошек (FIV) представляет собой ценную систему, через которую изучить критерии для антиленвирусных вакцин на естественных видах хозяев.Здесь мы исследовали, может ли вакцинация штаммом FIV, аттенуированным в результате длительного роста in vitro, защитить от полностью вирулентного, высокогетерологичного интракладного заражения. Результаты показали, что вакцинный вирус вызывал инфекцию низкой степени тяжести без обнаруживаемых патологических эффектов и давал длительный стерилизующий иммунитет, если заражение было доставлено внутрибрюшинно в виде бесклеточного вируса, но не против связанного с клетками интравагинального заражения. Однако в последнем случае репликация и патологические последствия заражающего вируса заметно подавлялись.Вместе с аналогичными результатами, полученными на моделях макак-резусов, эти результаты должны дать толчок к разработке ослабленных вакцин против FIV, которые будут протестированы в контролируемых исследованиях на полевых кошках. Полевые исследования могут дать ответы на некоторые из существующих проблем безопасности, связанных с ослабленными вакцинами против СПИДа для людей.
Однако в последнем случае репликация и патологические последствия заражающего вируса заметно подавлялись.Вместе с аналогичными результатами, полученными на моделях макак-резусов, эти результаты должны дать толчок к разработке ослабленных вакцин против FIV, которые будут протестированы в контролируемых исследованиях на полевых кошках. Полевые исследования могут дать ответы на некоторые из существующих проблем безопасности, связанных с ослабленными вакцинами против СПИДа для людей.
Несмотря на многочисленные стратегии, включающие модели на животных и клинические испытания на людях-добровольцах, эффективные вакцины против вируса иммунодефицита человека типа 1 (ВИЧ-1) остаются глобальным приоритетом здравоохранения.По оценкам, ВИЧ-1 вызывает более 15 000 новых инфекций каждый день. Более того, почти 90% новых случаев инфицирования происходит в странах с ограниченными ресурсами, в основном у женщин, инфицированных половым путем, или у новорожденных, инфицированных во время беременности или кормления грудью (69), что указывает на то, что основным входом для ВИЧ-1 является слизистая оболочка. В этих группах, где лекарственная терапия недоступна, а инфраструктура здравоохранения слабая, спрос на вакцину против СПИДа, как никогда, велик.
В этих группах, где лекарственная терапия недоступна, а инфраструктура здравоохранения слабая, спрос на вакцину против СПИДа, как никогда, велик.
Вакцины остаются методом выбора для борьбы с вирусными инфекциями с точки зрения безопасности, эффективности и стоимости.Идеальная вакцина должна обеспечивать длительную и широкую защиту, предпочтительно после однократной прививки, а также должна быть недорогой и легко вводимой (41, 54, 56, 64). Живые аттенуированные вирусные вакцины удовлетворяют этим требованиям, поскольку однократной дозы вакцины обычно достаточно для того, чтобы вызвать устойчивый и продолжительный иммунный ответ у хозяина. Таким образом, возможно, что аттенуированная лентивирусная вакцина может вызывать широкий защитный иммунитет более эффективно, чем вакцины с инактивированным вирусом или субъединичные вакцины.В то время как живые вакцины в настоящее время считаются непрактичными для клинических испытаний на людях из соображений безопасности, исследования, проведенные на животных моделях, предоставляют полезную информацию об иммунных механизмах вакцинальной защиты. Этот подход успешно применялся в моделях обезьяньих вирусов иммунодефицита обезьян и обезьян-человека на макаках-резусах, хотя все еще существует неопределенность относительно относительной важности различных иммунных эффекторов (1, 2, 15, 17, 22, 33-35, 40, 51, 65, 67, 74).Однако резус-модели не подходят для тестирования вакцин в естественных условиях инфицирования и, следовательно, не обеспечивают окончательного доказательства того, что данный подход к вакцинации действительно работает в полевых условиях.
Этот подход успешно применялся в моделях обезьяньих вирусов иммунодефицита обезьян и обезьян-человека на макаках-резусах, хотя все еще существует неопределенность относительно относительной важности различных иммунных эффекторов (1, 2, 15, 17, 22, 33-35, 40, 51, 65, 67, 74).Однако резус-модели не подходят для тестирования вакцин в естественных условиях инфицирования и, следовательно, не обеспечивают окончательного доказательства того, что данный подход к вакцинации действительно работает в полевых условиях.
Инфекция домашних кошек вирусом иммунодефицита кошек (FIV) представляет собой ценную систему для изучения патогенеза вирусов иммунодефицита и оценки противовирусных вакцин у естественных видов хозяев. Течение инфекции, механизмы персистенции, патогенез и генетическое разнообразие FIV аналогичны ВИЧ-1, что позволяет определить защитные иммунные механизмы, которые могут быть важны для рациональной разработки безопасных и эффективных вакцин против ВИЧ-1.Более чем 10-летние эксперименты по вакцинации против FIV показали, что полная защита (стерилизующий иммунитет) может быть достигнута только с помощью определенных вакцин. Кроме того, наблюдаемая вакцинальная защита ограничивается заражением гомологичным или слегка гетерологичным вирусом (подробные обзоры см. В ссылках 21 и 68). Взятые вместе, эти исследования показывают, что вакцины против FIV работают лучше, когда вирусная инфекция вводится системно, а не через слизистые оболочки (23, 24), и что защита, обеспечиваемая инактивированными вакцинами, требует нескольких иммунизирующих доз и является относительно недолгой (9, 47).
Кроме того, наблюдаемая вакцинальная защита ограничивается заражением гомологичным или слегка гетерологичным вирусом (подробные обзоры см. В ссылках 21 и 68). Взятые вместе, эти исследования показывают, что вакцины против FIV работают лучше, когда вирусная инфекция вводится системно, а не через слизистые оболочки (23, 24), и что защита, обеспечиваемая инактивированными вакцинами, требует нескольких иммунизирующих доз и является относительно недолгой (9, 47).
Долгосрочное размножение в культуре тканей широко использовалось для разработки живых аттенуированных противовирусных вакцин. Это первое исследование, в котором изучается, может ли вакцинация штаммом FIV, оказавшимся непатогенным в результате длительного роста in vitro, защитить от полностью вирулентного, высокогетерологичного интракладного заражения. Результаты показали, что вакцина обеспечивала длительный стерилизующий иммунитет, если заражение проводилось внутрибрюшинно, но не при интравагинальном введении.Однако в последнем случае репликация и патологические последствия заражающего вируса заметно подавлялись.
МАТЕРИАЛЫ И МЕТОДЫ
Животные, вирусы и дизайн эксперимента. В исследовании использовались кошки, не содержащие специфических патогенов по женским особям (Iffa Credo, L’Asbrege, Франция). И контрольная группа, и вакцинированные были 9 месяцев в возрасте и свободны от инфекционного FIV, вируса лейкемии кошек и вирус-специфических антител на момент начала исследования. Животные были размещены индивидуально в нашем помещении для животных с контролируемым климатом в соответствии с правилами Европейского сообщества.Вакцинный вирус представлял собой штамм Petaluma FIV (Pet), продуцируемый хронически инфицированными клетками FL4 (75; щедрый подарок Джанет К. Ямамото, Гейнсвилл, Флорида). В нашей лаборатории клетки FL4 обычно разделяют 1: 5 два раза в неделю. Исходный вирусный материал, использованный в качестве вакцины (FL-381), представлял собой бесклеточный супернатант, собранный при пассаже клеток 381, и был инокулирован внутривенно 316 инфекционными дозами для культуры ткани (TCID 50 ) в 1 мл на кошку. Штамм FIV (GL8) для заражения Glasgow-8 и линия Q201 интерлейкин-2-зависимых Т-клеток кошек (72), в которых размножался этот вирус, были любезно предоставлены Маргарет Дж.Хози, Глазго, Великобритания. Внутрибрюшинное заражение состояло из 1 мл бесклеточного супернатанта и содержало 30 TCID 50 . Вместо этого проводили интравагинальное заражение первичными бластами, которые были на ~ 60% положительны на FIV по поверхностной иммунофлуоресценции. Их получали путем стимуляции объединенных in vitro мононуклеарных клеток периферической крови (PBMC) от независимых неинфицированных кошек конканавалином A (инфицирование GL8 при множественности инфицирования 0,0015) и путем сбора через 8 дней.Желаемое количество инфицированных клеток помещали в переднюю часть влагалища в 100 мкл стерильного апирогенного физиологического раствора с использованием гладких кончиков пипеток, чтобы предотвратить разрывы тканей. После инокуляции выделений из влагалища не наблюдалось.
Штамм FIV (GL8) для заражения Glasgow-8 и линия Q201 интерлейкин-2-зависимых Т-клеток кошек (72), в которых размножался этот вирус, были любезно предоставлены Маргарет Дж.Хози, Глазго, Великобритания. Внутрибрюшинное заражение состояло из 1 мл бесклеточного супернатанта и содержало 30 TCID 50 . Вместо этого проводили интравагинальное заражение первичными бластами, которые были на ~ 60% положительны на FIV по поверхностной иммунофлуоресценции. Их получали путем стимуляции объединенных in vitro мононуклеарных клеток периферической крови (PBMC) от независимых неинфицированных кошек конканавалином A (инфицирование GL8 при множественности инфицирования 0,0015) и путем сбора через 8 дней.Желаемое количество инфицированных клеток помещали в переднюю часть влагалища в 100 мкл стерильного апирогенного физиологического раствора с использованием гладких кончиков пипеток, чтобы предотвратить разрывы тканей. После инокуляции выделений из влагалища не наблюдалось.
Шесть кошек были вакцинированы вакцинным вирусом FL-381, а затем ежедневно контролировались на предмет клинических проявлений и через регулярные промежутки времени на предмет вирусной РНК в плазме, вирусной ДНК и инфекционности в PBMC, вирус-специфических антител и лимфопролиферативных ответов, циркулирующих CD4. Подсчет + -Т-лимфоцитов и результаты стандартных гематохимических тестов.Через 18 месяцев после вакцинации (pv) четырем вакцинированным и четырем неинфицированным контрольным кошкам соответствующего возраста внутрибрюшинно вводили GL8, а затем наблюдали в течение 15 месяцев с использованием анализов, позволяющих отличить контрольный вирус от существующего ранее FL-381, а также по описанным параметрам. над. В конце этого периода (33 месяца p.v.), поскольку они все еще не содержали GL8, четыре вакцинированных вместе с еще шестью контрольными кошками были заражены интравагинально. Восемь месяцев спустя (41 месяц с.v.), пять из шести контрольных кошек и все вакцины по-прежнему не содержали GL8, и поэтому им была введена более крупная интравагинальная контрольная проба и наблюдение продолжалось еще 1 год. Наконец, через 50 месяцев p.v. двух вакцинированных, которых не подвергали воздействию, вместе с контрольной кошкой, которая сопротивлялась обеим интравагинальным заражениям, были заражены внутрибрюшинно точно так, как описано выше, а также наблюдались в течение 1 года (рис.
Подсчет + -Т-лимфоцитов и результаты стандартных гематохимических тестов.Через 18 месяцев после вакцинации (pv) четырем вакцинированным и четырем неинфицированным контрольным кошкам соответствующего возраста внутрибрюшинно вводили GL8, а затем наблюдали в течение 15 месяцев с использованием анализов, позволяющих отличить контрольный вирус от существующего ранее FL-381, а также по описанным параметрам. над. В конце этого периода (33 месяца p.v.), поскольку они все еще не содержали GL8, четыре вакцинированных вместе с еще шестью контрольными кошками были заражены интравагинально. Восемь месяцев спустя (41 месяц с.v.), пять из шести контрольных кошек и все вакцины по-прежнему не содержали GL8, и поэтому им была введена более крупная интравагинальная контрольная проба и наблюдение продолжалось еще 1 год. Наконец, через 50 месяцев p.v. двух вакцинированных, которых не подвергали воздействию, вместе с контрольной кошкой, которая сопротивлялась обеим интравагинальным заражениям, были заражены внутрибрюшинно точно так, как описано выше, а также наблюдались в течение 1 года (рис. 1).
1).
Схема предварительного заражения и вызова. Контрольные кошки, использованные в экспериментах по заражению, были опущены для простоты.PB — инфицированные первичные бласты; в / в, внутривенно.
Дифференциальные измерения виремии в плазме. Число геномов РНК FL-381 и GL8 в плазме первоначально рассчитывали путем определения процентного содержания каждого штамма в образцах с помощью gag вложенной обратной транскриптазы (RT) -PCR с последующим ограничением на основе флуоресценции анализ полиморфизма длины фрагмента (ПДРФ), который использует различия сайтов рестрикции в продуктах ПЦР (см. ниже). Затем проценты использовали для расчета количества копий геномов РНК FL-381 и GL8 из общего количества геномов FIV, как определено с помощью gag RT-конкурентной ПЦР (59).С января 1999 года, что соответствует первому внутривагинальному заражению, этот подход был заменен анализами штамм-специфической RT-TaqMan-PCR (RT-TM-PCR), в которых использовались штамм-специфические праймеры и зонды, разработанные с использованием несовпадений, обнаруженных при выравнивании нуклеотидной последовательности gag (рис. 2). Для оценки специфичности анализа области p24 обоих штаммов клонировали в плазмиды pGEM (Promega, Милан, Италия), разводили в 10 раз и амплифицировали параллельно с обоими штамм-специфическими наборами олигонуклеотидов.Количество входных копий было правильно оценено с использованием наборов гомологичных олигонуклеотидов: FL-381 был недооценен в 10 6 для GL8-специфических олигонуклеотидов, а GL8 был недооценен в 10 4 для FL- 381-специфические олигонуклеотиды (данные не показаны). Образцы плазмы обрабатывали, как описано в другом месте (60). Вкратце, геномы РНК экстрагировали из плазмы с помощью набора QIAamp Viral RNA (Qiagen, Милан, Италия), подвергали обратной транскрипции антисмысловым праймером FL-381 AS (900 нМ) или GL8 AS (300 нМ), а затем амплифицировали с помощью смысловой праймер FL-381 S или GL8 S (300 нМ) и зонд 6-карбоксифлуоресцеин (FAM) / 6-карбокситетраметилродамин (TAMRA) FL-381 PR или GL8 PR (200 нМ).Амплификацию проводили с помощью Universal PCR Master Mix (Applied Biosystems, Монца, Италия) в реакционном объеме 50 мкл и протоколе амплификации по умолчанию (50 циклов) на приборе ABI Prism 7700 Sequence Detection System (Applied Biosystems).
2). Для оценки специфичности анализа области p24 обоих штаммов клонировали в плазмиды pGEM (Promega, Милан, Италия), разводили в 10 раз и амплифицировали параллельно с обоими штамм-специфическими наборами олигонуклеотидов.Количество входных копий было правильно оценено с использованием наборов гомологичных олигонуклеотидов: FL-381 был недооценен в 10 6 для GL8-специфических олигонуклеотидов, а GL8 был недооценен в 10 4 для FL- 381-специфические олигонуклеотиды (данные не показаны). Образцы плазмы обрабатывали, как описано в другом месте (60). Вкратце, геномы РНК экстрагировали из плазмы с помощью набора QIAamp Viral RNA (Qiagen, Милан, Италия), подвергали обратной транскрипции антисмысловым праймером FL-381 AS (900 нМ) или GL8 AS (300 нМ), а затем амплифицировали с помощью смысловой праймер FL-381 S или GL8 S (300 нМ) и зонд 6-карбоксифлуоресцеин (FAM) / 6-карбокситетраметилродамин (TAMRA) FL-381 PR или GL8 PR (200 нМ).Амплификацию проводили с помощью Universal PCR Master Mix (Applied Biosystems, Монца, Италия) в реакционном объеме 50 мкл и протоколе амплификации по умолчанию (50 циклов) на приборе ABI Prism 7700 Sequence Detection System (Applied Biosystems). Образцы и контроли (отрицательные и положительные) тестировали в двух и трех экземплярах, соответственно, и несколько контрольных образцов без матрицы также случайным образом вкрапывались в каждый планшет для амплификации. Последовательные 10-кратные разведения (от 10 1 до 10 7 ) транскриптов РНК FL-381 и GL8 gag p24 использовали для получения стандартных кривых.Прецизионность и воспроизводимость внутри- и межисследований оценивали, как описано ранее (26, 42, 60). Чувствительность обоих анализов составляла 200 копий на мл плазмы, как оценивали путем извлечения и амплификации FIV-отрицательной плазмы с добавлением серийных 10-кратных разведений транскриптов РНК.
Образцы и контроли (отрицательные и положительные) тестировали в двух и трех экземплярах, соответственно, и несколько контрольных образцов без матрицы также случайным образом вкрапывались в каждый планшет для амплификации. Последовательные 10-кратные разведения (от 10 1 до 10 7 ) транскриптов РНК FL-381 и GL8 gag p24 использовали для получения стандартных кривых.Прецизионность и воспроизводимость внутри- и межисследований оценивали, как описано ранее (26, 42, 60). Чувствительность обоих анализов составляла 200 копий на мл плазмы, как оценивали путем извлечения и амплификации FIV-отрицательной плазмы с добавлением серийных 10-кратных разведений транскриптов РНК.
Нуклеотидное выравнивание области FIV p24 gag , обнаруженное с помощью вложенной и TM-PCR. Гомологические области обозначены точками. Заштрихованные прямоугольники представляют сайты Pst, I, один присутствует как в FL-381, так и в GL8, а другой только в FL-381, которые использовались для различения двух штаммов после повторной изоляции в культуре ткани. Положения внешнего (M21 и M22) и внутреннего (308S и 308AS) вырожденных вложенных праймеров ПЦР указаны вдоль выравнивания. Также показаны локализации FL-381- и GL8-специфичных праймеров и зондов TM-PCR.
Положения внешнего (M21 и M22) и внутреннего (308S и 308AS) вырожденных вложенных праймеров ПЦР указаны вдоль выравнивания. Также показаны локализации FL-381- и GL8-специфичных праймеров и зондов TM-PCR.
Для лучшего сравнения и поскольку нагрузки РНК, определенные с помощью RT-TM-PCR, были в среднем на 1 логарифмическую единицу выше, чем те, которые были определены с помощью RT-конкурентной ПЦР (М. Пистелло, личные наблюдения), все образцы плазмы были повторно проанализированы ретроспективно, и Здесь представлены только количественные данные, полученные с помощью анализа RT-TM-PCR.
Дифференциальное обнаружение и количественное определение провируса. Штамм-специфическая нагрузка провируса первоначально рассчитывалась из общей провирусной нагрузки и процентного содержания каждого штамма в образцах, как определено с помощью конкурентной ПЦР и комбинированного анализа вложенной ПЦР-ПДРФ в gag области соответственно (59). С начала 1999 года этот метод был заменен ТМ-ПЦР, и предыдущие образцы были повторно проанализированы с помощью последнего метода. ТМ-ПЦР выполняли, как описано для ОТ-ТМ-ПЦР, за исключением того, что реакционный объем составлял 25 мкл и геномную ДНК экстрагировали из лейкоцитарной пленки с использованием мини-набора QIAamp DNA Blood Mini (Qiagen).Стандартные кривые получали с 10-кратными разведениями плазмид FL-381 и GL8 gag p24. Чувствительность анализа составляла 100 копий плазмиды на фоне 1 мкг геномной ДНК для обоих вирусов.
ТМ-ПЦР выполняли, как описано для ОТ-ТМ-ПЦР, за исключением того, что реакционный объем составлял 25 мкл и геномную ДНК экстрагировали из лейкоцитарной пленки с использованием мини-набора QIAamp DNA Blood Mini (Qiagen).Стандартные кривые получали с 10-кратными разведениями плазмид FL-381 и GL8 gag p24. Чувствительность анализа составляла 100 копий плазмиды на фоне 1 мкг геномной ДНК для обоих вирусов.
Выделение вируса и подсчет инфекционных PBMC. FIV выделяли из PBMC путем совместного культивирования 10 6 PBMC, разделенных Ficoll-Hypaque, с кошачьими Т-лимфоидными клетками MBM и тестирования супернатантных жидкостей на RT один раз в неделю. Культуры, считающиеся отрицательными, не показали признаков RT ни в одном образце, собранном в течение 5-недельного периода культивирования.Количество инфекционных единиц в PBMC определяли путем предельного разведения (48).
Дифференциация FL-381 и GL8 в положительных культурах. Различение FL-381 и GL8 в RT-положительных культурах осуществляли с помощью RFLP-анализа продуктов ПЦР gag . Геномную ДНК, экстрагированную из положительных совместных культур, амплифицировали вложенной ПЦР с вырожденными праймерами, чтобы обеспечить амплификацию как FL-381, так и GL8. Наборы праймеров M21-M22 и 308S-308AS использовали в первом и втором раундах амплификации, соответственно.Затем ампликоны расщепляли ферментом Pst I (New England Biolabs, Беверли, Массачусетс), выбранным на основании наличия двух и одного сайтов рестрикции Pst I в области gag p24 FL- 381 и GL8 соответственно (рис. 2). Вкратце, 15 мкл продуктов ПЦР разбавляли до 50 мкл в рестрикционном буфере Pst I и расщепляли ферментом при 37 ° C в течение 2 часов. В конце концов, рестрикционные паттерны анализировали в 2% агарозных гелях. Анализ имел более низкую чувствительность (500 копий) как для геномов FL-381, так и для GL8 и был способен обнаруживать любой геном, смешанный 1/100 с другим.
Геномную ДНК, экстрагированную из положительных совместных культур, амплифицировали вложенной ПЦР с вырожденными праймерами, чтобы обеспечить амплификацию как FL-381, так и GL8. Наборы праймеров M21-M22 и 308S-308AS использовали в первом и втором раундах амплификации, соответственно.Затем ампликоны расщепляли ферментом Pst I (New England Biolabs, Беверли, Массачусетс), выбранным на основании наличия двух и одного сайтов рестрикции Pst I в области gag p24 FL- 381 и GL8 соответственно (рис. 2). Вкратце, 15 мкл продуктов ПЦР разбавляли до 50 мкл в рестрикционном буфере Pst I и расщепляли ферментом при 37 ° C в течение 2 часов. В конце концов, рестрикционные паттерны анализировали в 2% агарозных гелях. Анализ имел более низкую чувствительность (500 копий) как для геномов FL-381, так и для GL8 и был способен обнаруживать любой геном, смешанный 1/100 с другим.
Серология. Образцы плазмы были протестированы на антитела против цельного антигена FIV с помощью иммуноферментного анализа (ELISA) (48). Нейтрализующие антитела (NA) были измерены против 10 TCID 50 Pet или GL8 с использованием клеток MBM в качестве индикатора и 50% ингибирования продукции RT в качестве считываемых значений и были выражены точно так, как описано ранее (18).
Нейтрализующие антитела (NA) были измерены против 10 TCID 50 Pet или GL8 с использованием клеток MBM в качестве индикатора и 50% ингибирования продукции RT в качестве считываемых значений и были выражены точно так, как описано ранее (18).
Анализ лимфопролиферации. Очищенные фиколлом PBMC инкубировали в течение 4 дней с 0,1 мкг градиентно очищенного, обработанного ультразвуком Pet, выращенного в клетках FL-4, а затем подвергали импульсному воздействию [ 3 H] тимидина в течение 18 часов (48).Индекс стимуляции рассчитывали как отношение радиоактивности, включенной PBMC в присутствии антигена, к радиоактивности, включенной в отсутствие антигена. Только индексы стимуляции ≥2 считались показательными для FIV-специфической лимфопролиферации.
Подсчет лимфоцитов. Кровь с антикоагулянтом ЭДТА была обработана для анализа проточной цитометрии, и было получено количество CD4 + и CD8 + Т-лимфоцитов (48).
РЕЗУЛЬТАТЫ
Низкая степень инфицирования, вызванная вакцинным вирусом. Вакцинный вирус FL-381 вводили внутривенно шести кошкам в дозе 316 TCID 50 на животное. Как показано на фиг. 1, инфекцию, установленную вакцинным вирусом в отсутствие заражения, контролировали в течение 18 (кошки 521, 560, 575 и 576) или 50 (кошки 580 и 590) месяцев. Все вакцинированные легко заразились, о чем свидетельствует пиковые уровни виремии через 1 месяц после введения, но у них развилась инфекция, которая оставалась очень легкой. Фактически, стационарная плазменная виремия и провирусная виремия наблюдались с 12 месяцев с.v. и далее (рис. 3A и B) только изредка превышали 4000 копий РНК на мл и 1000 копий ДНК на мкг геномной ДНК, соответственно, и попытки повторно изолировать вирус в культуре иногда приводили к отрицательным результатам (данные не показаны). Антитела против FIV, определенные с помощью ELISA и чувствительного анализа NA против гомологичного вируса, стали обнаруживаться у всех животных сразу после вакцинации и оставались на высоком уровне на протяжении всего периода наблюдения, в то время как специфические для FIV лимфопролиферативные ответы были положительными только спорадически (данные не указаны.
Вакцинный вирус FL-381 вводили внутривенно шести кошкам в дозе 316 TCID 50 на животное. Как показано на фиг. 1, инфекцию, установленную вакцинным вирусом в отсутствие заражения, контролировали в течение 18 (кошки 521, 560, 575 и 576) или 50 (кошки 580 и 590) месяцев. Все вакцинированные легко заразились, о чем свидетельствует пиковые уровни виремии через 1 месяц после введения, но у них развилась инфекция, которая оставалась очень легкой. Фактически, стационарная плазменная виремия и провирусная виремия наблюдались с 12 месяцев с.v. и далее (рис. 3A и B) только изредка превышали 4000 копий РНК на мл и 1000 копий ДНК на мкг геномной ДНК, соответственно, и попытки повторно изолировать вирус в культуре иногда приводили к отрицательным результатам (данные не показаны). Антитела против FIV, определенные с помощью ELISA и чувствительного анализа NA против гомологичного вируса, стали обнаруживаться у всех животных сразу после вакцинации и оставались на высоком уровне на протяжении всего периода наблюдения, в то время как специфические для FIV лимфопролиферативные ответы были положительными только спорадически (данные не указаны. показано).Что наиболее важно, все вакцинированные оставались клинически здоровыми в течение различных длительных периодов перед вакцинацией, о чем свидетельствуют периодические клинические осмотры и рутинные гематохимические анализы, а количество циркулирующих CD4 + -Т-лимфоцитов оставалось практически стабильным или претерпевало временное умеренное снижение (рис. 3C) . Таким образом, в совокупности эти данные показали, что вирус долгосрочной культуры ткани, использованный в качестве вакцины, вызывал продуктивные инфекции, которые оставались низкосортными и не вызывали заметных клинических последствий в течение> 4 лет, демонстрируя, возможно, большую степень ослабления, чем когда тот же вирус использовались для инокуляции кошек в нижнем пассаже in vitro (7, 31, 59).Вирусологический и иммунологический статус вакцинированных во время заражения детализирован в Таблице 1. Следует отметить, что в эти периоды NA вакцины вируса были относительно высокими, как и ожидалось для штамма FIV, адаптированного к культуре ткани, в то время как NA для вирус контрольного заражения был либо очень низким, либо отсутствовал, как и ожидалось для гетерологичного первичного изолята FIV (18).
показано).Что наиболее важно, все вакцинированные оставались клинически здоровыми в течение различных длительных периодов перед вакцинацией, о чем свидетельствуют периодические клинические осмотры и рутинные гематохимические анализы, а количество циркулирующих CD4 + -Т-лимфоцитов оставалось практически стабильным или претерпевало временное умеренное снижение (рис. 3C) . Таким образом, в совокупности эти данные показали, что вирус долгосрочной культуры ткани, использованный в качестве вакцины, вызывал продуктивные инфекции, которые оставались низкосортными и не вызывали заметных клинических последствий в течение> 4 лет, демонстрируя, возможно, большую степень ослабления, чем когда тот же вирус использовались для инокуляции кошек в нижнем пассаже in vitro (7, 31, 59).Вирусологический и иммунологический статус вакцинированных во время заражения детализирован в Таблице 1. Следует отметить, что в эти периоды NA вакцины вируса были относительно высокими, как и ожидалось для штамма FIV, адаптированного к культуре ткани, в то время как NA для вирус контрольного заражения был либо очень низким, либо отсутствовал, как и ожидалось для гетерологичного первичного изолята FIV (18).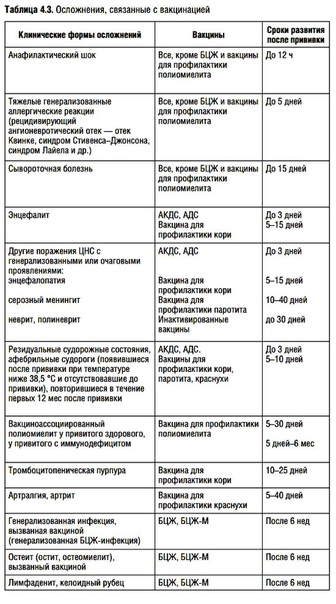
Динамика инфицирования вакцинным вирусом FL-381 у вакцинированных кошек. (A) Виремия плазмы, определенная с помощью FL-381-специфической RT-TM-PCR.(B) Нагрузка провируса, определенная с помощью FL-381-специфичной TM-PCR. (C) Циркулирующие CD4 + Т-лимфоциты, как определено с помощью проточной цитометрии. Сплошные линии — индивидуальные вакцинированные кошки; пунктирная линия — среднее значение для шести неинфицированных кошек того же возраста; ⋄, кат. 521; ♦, кат 560; ☆, кот 575; ★, кот 576; •, кат 580; ○, кошка 590.
ТАБЛИЦА 1.Вирусологический и иммунологический статус вакцинированных во время заражения
Полная защита от внутрибрюшинного заражения. Вакцинированные 521, 560, 575 и 576 вместе с четырьмя контрольными наивными кошками (644, 652, 668 , и 3063), внутрибрюшинно вводили 30 TCID 50 бесклеточного GL8, а затем систематически контролировали в течение 15 месяцев.
Как и ожидалось для вирулентного вируса, такого как GL8 (30, 31), несмотря на инокулированную меньшую дозу, репликация контрольного вируса у наивных кошек была более яркой, чем репликация вируса вакцины. Плазменная виремия достигла пика на уровнях от 18 240 до 31 100 копий на мл через 1 месяц после заражения (p.c.), а затем снизилась и стабилизировалась на уровне от ~ 10 000 до 15 000 копий на мл через 6 месяцев. Провирусные нагрузки в PBMC следовали примерно параллельной кинетике со значениями, которые через 1 месяц р.c. варьировала от 1770 до 3716 копий на мкг геномной ДНК и впоследствии быстро снижалась до среднего устойчивого уровня ~ 1500 копий. Количественное повторное выделение из PBMC, выполненное в выбранное время, также показало высокое количество инфекционных единиц (таблица 2). Антитела против FIV уже присутствовали через 1 месяц после операции. у всех кошек и после этого неуклонно увеличивался титр (рис. 4С). С другой стороны, проточная цитометрия выявила быструю потерю циркулирующих CD4 + Т-лимфоцитов, количество которых уменьшилось более чем вдвое к 2 месяцам с.c. и затем восстановился через 6 месяцев, но так и не вернулся к значениям до испытания (рис. 4D).
РИС. 4.Результат внутрибрюшинного заражения GL8, проведенного через 18 месяцев p.v. у четырех вакцинированных кошек и четырех контрольных животных. (A) Виремия плазмы, определенная с помощью GL8 (непрерывные линии) — и FL-381 (пунктирные линии) RT-TM-PCR. (B) Провирусные нагрузки, определенные с помощью GL8 (непрерывные линии) и FL-381 (пунктирные линии) -специфической RT-TM-PCR. (C) Титры антител ELISA к целому антигену FIV. Титры выражены как обратные величине самого высокого разведения сыворотки, которое дает показания оптической плотности, по крайней мере, в три раза выше, чем значения, полученные с 10 контрольными FIV-отрицательными образцами сыворотки.(D) Циркулирующие CD4 + Т-лимфоциты по данным проточной цитометрии. См. Условные обозначения вакцинированных в легенде к рис. 2.
ТАБЛИЦА 2.Инфекционные единицы и генотип FIV, повторно выделенные из PBMC вакцинированных и контрольных кошек после заражения
Напротив, у вакцинированных не было указаний на то, что вирус для контрольного заражения реплицируется или присутствует, что определяется по неоднократно отрицательному GL8-специфическому Анализы RT-TM-PCR и TM-PCR (рис. 4A и B), RFLP-генотипирование вируса, повторно выделенного из PBMC (таблица 2), и стабильное количество CD4 + -T-лимфоцитов (рис.4D). Кроме того, ранее существовавшие уровни вакцинного вируса в плазме (фиг. 4A), вакцинного провируса в PBMC (фиг. 4B) и противовирусных антител (фиг. 4C) не изменились относительно значений до заражения или показали незначительные колебания во времени. За исключением кошки 521, от которой вирус можно было получить только с третьего месяца п.п. Впоследствии зараженные вакцинированные дали положительные культуры только на FL-381 во все время тестирования, и количество обнаруженных инфекционных единиц, как правило, было ниже, чем у их невакцинированных аналогов (таблица 2).В целом эти результаты показали, что вакцинированные кошки были полностью защищены от интраперитонеального заражения GL8, которое легко заразило всех невакцинированных контрольных животных.
Частичная защита от заражения слизистой. Через пятнадцать месяцев после заражения, описанного выше (33 месяца p.v.), вакцинированных проверяли на способность противостоять заражению слизистой. GL8 вводили интравагинально в форме ассоциированного с клетками вируса, поскольку предыдущие результаты показали, что внеклеточный FIV малоэффективен для установления инфекции этим путем (12, 13, 48).Инокулят состоял из 2 × 10 4 первичных бластов, которые были инфицированы 8 днями ранее GL8 и были положительными на 60% вируса, как определено поверхностной иммунофлуоресценцией. Однако этот инокулят оказался слабым, так как только одна из шести совпадающих наивных контрольных кошек была явно инфицирована после заражения, в то время как у одной было небольшое количество вирусных геномов, обнаруживаемых в плазме и PBMC только через 1 и 2 месяца после заражения. Так как в результате этого первого заражения слизистой оболочки было получено мало новой информации (таблица 2), в конце 8-месячного периода наблюдения мы повторно проверили четырех вакцинированных и пять контрольных групп, которые не стали постоянно инфицированными после первого заражения слизистой оболочки, используя более крупный интравагинальный инокулят 10 5 GL8-инфицированных первичных бластов.Это заражение было более эффективным, так как три контрольных кошки были явно инфицированы, при этом плазменные виремии и кривые провируса были немного запазданы по сравнению с кривыми, наблюдаемыми после внутрибрюшинного заражения, но достигали гораздо более высоких уровней, а также другие параметры инфекции (количественное выделение вируса, анти- Развитие антител к FIV и снижение количества CD4 ( + -Т-лимфоцитов) также четко указывало на то, что кошки были инфицированы (фиг. 5 и таблица 2). Трое из четырех вакцинированных также не сопротивлялись контрольному заражению, поскольку у них была РНК GL8 в плазме и ДНК GL8 в PBMC из первого отбора образцов, проведенного через 1 месяц p.c. ПДРФ-генотипирование вирусов, повторно выделенных у этих животных, подтвердило наличие суперинфекции, поскольку было обнаружено, что все положительные культуры содержат как вакцинный вирус, так и GL8. Однако кривые репликации GL8, наблюдаемые у вакцинированных, были намного ниже, чем у невакцинированных кошек, что демонстрирует замечательную сдержанность заражающего вируса (фиг. 5 и таблица 2). Кроме того, титры противовирусных антител не увеличивали p.c. (Рис. 5C), а количество CD4 + -Т-лимфоцитов оставалось практически неизменным на протяжении всего периода наблюдения, за исключением кошки 560, которая показала временное, хотя и резкое снижение через 1 месяц p.c. (Рис. 5D). Примечательно, что вирусная нагрузка вакцины также не изменилась у этих животных, за исключением маргинального и временного увеличения, наблюдаемого у кошки 575 в первые месяцы п.с. В совокупности эти результаты показали, что аттенуированная вакцина не обеспечивала полной защиты от заражения слизистой оболочкой GL8, но, тем не менее, сильно сдерживала как ее репликацию, так и ее негативные последствия для количества циркулирующих CD4 + -Т-лимфоцитов.
РИС. 5.Результат интравагинального заражения GL8, проведенного 41 месяц p.v. у четырех вакцинированных кошек, показанных на фиг. 4, и четырех неопытных контрольных. Подробности см. В легенде к рис. 4.
Полная защита от внутрибрюшинного заражения является продолжительной. В экспериментах, описанных выше, вакцинированные оказались полностью защищены от внутрибрюшинного заражения через 18 месяцев p.v. но только частично защищен от заражения слизистой, введенный через 41 месяц после введения. Чтобы оценить, связано ли это различие с другим способом доставки контрольного заражения или с более длительным периодом времени, прошедшим после вакцинации, через 50 месяцев p.v. двух вакцинированных, 580 и 590, которые никогда ранее не заражали, были привиты внутрибрюшинно бесклеточным GL8, точно так же, как в эксперименте с внутрибрюшинным заражением, описанном выше. Невакцинированную кошку 138, которая не заразилась в предыдущих экспериментах, также заражали аналогичным образом и использовали в качестве контроля. В то время как последняя кошка легко заразилась, с индексами инфицирования, аналогичными показателям, наблюдаемым после предыдущего внутрибрюшинного заражения, у двух вакцинированных не было обнаружено никаких изменений в ранее существовавших вирусологических и иммунологических ситуациях, и в течение 12 месяцев наблюдения постоянно оказывались отрицательные на GL8 (данные не показаны. и таблица 2).Таким образом, способность вакцинированных полностью противостоять внутрибрюшинному заражению GL8 не уменьшалась со временем p.v.
ОБСУЖДЕНИЕ
Это исследование было направлено на изучение остаточной патогенности для своего естественного вида-хозяина долгосрочного FIV, выращенного in vitro, и способности вируса защищать от вирулентного и высокогетерологичного вируса той же клады, вводимого системно. или слизисто. Вакцинный вирус, FL-381, представлял собой Pet (клады A), продуцируемый хронически инфицированными клетками FL4, которые подверглись 381 пассажу в культуре, что соответствует> 3 годам.Клетки FL4 были созданы 12 лет назад Ямамото и ее группой (75) и с тех пор распространились по многим лабораториям. Длительное размножение in vitro является классическим методом производства аттенуированных живых вирусных вакцин, и, хотя новые подходы многообещающие (8, 17, 29, 38, 44, 53, 65), он все еще широко используется для разработки современных вакцин (5 , 46). Этот метод также оказался успешным в ослаблении FIV, что продемонстрировано настоящим исследованием и предыдущими результатами (6, 59). В частности, было обнаружено, что вирус, продуцируемый клетками FL4, снова приобретает широкую устойчивость к нейтрализации (7) и повторно приобретает частично вирулентный фенотип после продолжительной реадаптации in vivo и последующей реокуляции в наивных кошках (31).Здесь, однако, инфекции низкой степени злокачественности, установленные FL-381, характеризовались полным отсутствием выявляемых патологических эффектов в течение по крайней мере 4 лет, несмотря на достаточно хорошо сохранившуюся репликационную способность вируса. Последнее могло быть важной особенностью в определении значительной защитной активности, продемонстрированной FL-381 у кошек. Результаты, показывающие, что мутанты вируса иммунодефицита обезьян с заметно сниженной репликативной эффективностью обладают плохой защитой, на самом деле показали, что существенное сохранение репликационной способности важно для того, чтобы аттенуированные антиленвирусные вакцины были потенциально эффективными (19, 20, 35, 45).
Контрольный вирус, GL8, происходил из клады A, как и вакцинный вирус, но отличался от него на 10% на уровне аминокислот в Env, таким образом показывая степень расхождения между самыми широкими до сих пор обнаруженными между изолятами FIV тот же клад (4). Важно отметить, что этот контрольный вирус проходил только ограниченное количество раз in vitro, и в предыдущих экспериментах было чрезвычайно трудно или невозможно защитить от него (30). Важность тестирования вакцинной защиты с помощью вирулентных лентивирусов обсуждалась ранее (52, 73).Действительно, при прививке наивным кошкам GL8 также оказался очень вирулентным в наших руках, о чем свидетельствуют витиеватые кривые репликации и наблюдаемое быстрое снижение циркулирующих CD4 + Т-лимфоцитов. По нашему опыту, снижение количества Т-лимфоцитов CD4 + является наиболее чувствительным показателем для оценки тяжести инфекции FIV у кошек, особенно в краткосрочных исследованиях (47, 59).
Вакцинированных сначала заражали через 18 месяцев, когда репликация FL-381 оказалась устойчивой.В это время нагрузки FL-381 в плазме и PBMC были в целом низкими, хотя лишь иногда ниже пороговых значений обнаружения, а циркулирующие CD4 + Т-лимфоциты были в пределах нормы. Первую контрольную пробу вводили внутрибрюшинно, чтобы изучить, как вакцинированные кошки справляются с системной доставкой вируса, и в результате была получена полная защита. Фактически, в течение 15-месячного наблюдения зараженные кошки были свободны от GL8, что было определено всеми проведенными исчерпывающими тестами.К ним относятся чувствительные анализы для обнаружения РНК и ДНК GL8 и распознавания штаммов повторно изолированного вируса. В соответствии с этими данными, у зараженных вакцинированных также не было обнаружено изменений в существовавших ранее общих уровнях виремии и количестве подмножеств лимфоцитов, которые могли бы указывать на суперинфекцию вирулентным FIV. Примечательно, что в следующем эксперименте кошек интраперитонеально инфицировали через 50 месяцев p.v. также оказалось, что они полностью защищены, что показывает, что устойчивость к системному заражению, обеспечиваемая ослабленной вакциной, была не только устойчивой, но и долгоживущей.
В природе передача ВИК в основном происходит через укушенные раны, хотя возможны и другие пути, например, через слизистые оболочки (58). Тем не менее, передача ВИЧ половым путем имеет первостепенное значение для ВИЧ, и поэтому вагинальные или ректальные проблемы обычно используются для проверки защиты от вакцины при FIV (23), а также на других моделях животных (16, 40, 50, 71). Таким образом, мы исследовали, могут ли вакцинированные, которые сопротивлялись внутрибрюшинному заражению, противостоять интравагинальному заражению.Поскольку бесклеточный FIV ранее оказался малоэффективным в инициировании инфекции при доставке этим путем (12, 48), в данном случае заражение состояло из первичных бластов, инфицированных in vitro. Считается, что инфицированные клетки представляют собой важный элемент в передаче лентивирусов через поверхности слизистой оболочки (25, 28, 66), и в предыдущем исследовании кошек, иммунизированных фиксированными инфицированными FIV клетками и зараженных системным путем, было доказано, что они защищены в течение более длительного периода. против инфицированных клеток, чем против бесклеточного вируса (47).В соответствии с предыдущими данными о штамме FIV клады B (48), мы столкнулись с некоторыми трудностями при заражении кошек вагинальным путем: первый инокулят из 2 × 10 4 инфицированных клеток вызвал явные инфекции только у одной из шести невакцинированных контрольных кошек. и последующий инокулят 10 5 клеток не смог заразить двух из пяти таких кошек. Однако у всех контрольных кошек, которые были инфицированы этими прививками слизистых оболочек, наблюдались инфекции, которые были немного задержаны, но более устойчивы по сравнению с инфекциями после внутрибрюшинной прививки бесклеточного вируса.Это было выявлено по постоянно очень высокой вирусной нагрузке и значительному падению циркулирующих CD4 + Т-лимфоцитов и согласуется с предыдущими сообщениями, показывающими, что путь воздействия, а также клеточная ассоциация инокулята значительно влияют на кинетику ранних лентивирусных инфекций. (13, 14, 32). Более того, вакцинация не всегда обеспечивала стерилизующий иммунитет против этого типа заражения, поскольку GL8 легко обнаруживался у трех из четырех вакцинированных, начиная с первого отбора образцов, проведенного через 1 месяц p.c. Это может отражать другую форму заражения, присущую ему неравную дозу вируса или тот факт, что вирус контрольного заражения расширился локально перед системным распространением (14, 57), таким образом, возможно, ускользнув от вакцинного иммунитета более эффективно, чем после внутрибрюшинного заражения. Однако вакцинированные в значительной степени контролировали заражающий вирус даже при интравагинальной доставке, о чем свидетельствовали гораздо более низкие нагрузки GL8, чем в невакцинированном контроле, и по существу стабильное количество циркулирующих CD4 + -Т-лимфоцитов.Хотя один вакцинированный показал снижение CD4 + Т-лимфоцитов через 1 месяц после операции, на самом деле этот эффект был чрезвычайно временным.
В частности, было обнаружено, что зараженный вирус сохраняется у вакцинированных кошек с интравагинальным заражением в течение по крайней мере 1 года. Это согласуется с данными, полученными на макаках, показывающими, что защита, достигаемая с помощью живой аттенуированной вакцины, не позволяет уничтожить контрольный лентивирус, как только он прижился в организме хозяина (39). Интересно отметить, что положительные эффекты аттенуированной вакцины, испытанной здесь, имели место, несмотря на то, что относительно высокие титры NA, обнаруженные у вакцинированных кошек, были специфичными для вакцинного вируса, но были по существу неэффективными против гетерологичного контрольного вируса.Это открытие предполагает, что NA, возможно, играла роль в сдерживании вакцинного вируса, но не играла роли в борьбе с заражающим вирусом. В недавнем исчерпывающем исследовании Abel et al. (1), защита от патогенного вируса обезьяньего иммунодефицита, наблюдаемая у макак, инфицированных вирусом обезьяньего иммунодефицита человека, была связана с комбинацией цитотоксических Т-лимфоцитов и ответов альфа-интерферона. В настоящем исследовании анализ клеточно-опосредованной иммунной реактивности вакцинированных был ограничен тестированием лимфопролиферативных ответов на цельный антиген FIV, которые были очень скромными на протяжении всего периода наблюдения.Идентификация механизмов, ответственных за защиту, обеспечиваемую аттенуированной вакциной против FIV, испытанной здесь, потребует более детального анализа многочисленных врожденных и адаптивных защитных механизмов, которые могут быть задействованы.
В последнее время суперинфекции вызывают тревогу из-за увеличения числа смешанных инфекций с двумя или более штаммами вируса — даже разных ветвей — у пациентов с ВИЧ-1 (3, 36, 62) и, как следствие, увеличения тяжести заболевания (10, 43). Более того, появление суперинфекций поставило под сомнение возможность вакцинации против СПИДа, особенно живыми вакцинами (27, 37).Показывая, что кошки, инфицированные аттенуированным FIV, были полностью и надежно защищены от заражения вирулентным и высокогетерологичным вирусом той же клады, вводимой системно, и от болезни, когда тот же контрольный вирус вводился через слизистые оболочки, настоящие результаты предполагают, что тяжелые суперинфекции являются существенная проблема только тогда, когда существующий ранее вирус является полностью вирулентным и способен поставить под угрозу иммунную систему хозяина. Напротив, вирусы, которые все еще способны к значительной репликации, но не способны серьезно влиять на функции иммунной системы, оказываются ценными с профилактической точки зрения и способны либо предотвращать внутрикладные суперинфекции, либо минимизировать их патологические последствия, в зависимости от пути воздействия.Также примечательно, что в предыдущих исследованиях кошачьих инфекций тот же штамм FIV, культивированный для меньшего количества пассажей in vitro, чем описано здесь, также проявлял значительные долгосрочные положительные эффекты против суперинфекции полностью вирулентным FIV другой клады (59). Таким образом, вместе с аналогичными результатами, полученными на моделях обезьян (1, 2, 15, 17, 22, 33-35, 40, 51, 55, 61, 65, 67, 74), эти результаты должны дать импульс развитию ослабленных Вакцины против FIV. Если штамм FIV, используемый для вакцинации в настоящем исследовании, также окажется безопасным и защитным для новорожденных и молодых котят, свободных от специфических патогенов (70), его можно, например, протестировать в контролируемых исследованиях на полевых кошках, подобных уже проведенному. проводится с фиксированной вакциной на основе инфицированных клеток (49).Помимо оценки безопасности и эффективности в естественных условиях, результаты могут дать ответы на некоторые из существующих проблем безопасности, связанных с аттенуированными вакцинами против СПИДа у людей (11, 26), а также основания для установления молекулярных основ аттенуации. получены путем длительного размножения in vitro.
БЛАГОДАРНОСТИ
Эта работа была поддержана Министерством делла Салюте-Супериоре ди Санита, «Programma per l’AIDS», и Министром делль’Иструционе, dell’Università e della Ricerca, Programma Cofinanziamento 2001.
СНОСКИ
- Получено 13 марта 2003 г.
- Принято 11 июля 2003 г.
- Copyright © 2003 Американское общество микробиологии
СПРАВОЧНИКИ
- 1.000
Abel, K., L Комптон, Т. Рурк, Д. Монтефиори, Д. Лу, К. Ротэуслер, Л. Фриттс, К. Бост и К. Дж. Миллер. 2003. Защита обезьяньего вируса иммунодефицита человека SHIV89.6 от интравагинального заражения патогенным SIVmac239 не зависит от пути иммунизации и связана с комбинацией цитотоксических Т-лимфоцитов и ответов альфа-интерферона.J. Virol.77 : 3099-3118.
- 2.↵
Almond, N., and J. Stott. 1999. Живая аттенуированная SIV — модель вакцины от СПИДа. Иммунол. Lett.66 : 167-170.
- 3.↵
Альтфельд, М., Т.М. Аллен, XG Yu, MN Johnston, D. Agrawal, BT Korber, DC Montefiori, DH O’Connor, BT Davis, PK Lee, EL Maier, J. Харлоу, П. Дж. Гоулдер, К. Брандер, Е. С. Розенберг и Б. Д. Уокер. 2002 г.Суперинфекция ВИЧ-1, несмотря на широкие ответы CD8 + Т-клеток, содержащие репликацию первичного вируса. Nature420 : 434-439.
- 4.↵
Бахманн, М. Х., Д. Л. Содора, М. Маттиасон-Дубард, Г. Х. Джич, А. Г. Родриго, П. Маццетти, Э. А. Гувер и Дж. И. Маллинс. 1997. Генетическое разнообразие вируса иммунодефицита кошек: двойная инфекция, рекомбинация и различные скорости эволюции между кладами последовательностей оболочки. J. Virol.71 : 4241-4253.
- 5.
Баджетт, М. Р., А. Ауэр, Л. Е. Кармайкл, К. Р. Пэрриш и Дж. Дж. Булл. 2002. Эволюционная динамика ослабления вирусов. J. Virol.76 : 10524-10529.
- 6.
Барлоу, Дж. Э., Т. У. Норт, К. Л. Оксфорд, К. М. Ремингтон, С. Дандекар, М. Н. Эллис и Н. К. Педерсен. 1993. Инфекция кошек вирусом иммунодефицита кошек в качестве модели для проверки влияния определенных факторов отбора на инфекционность и вирулентность образующихся вариантов лентивируса.Антивирь. Res.22 : 259-272.
- 7.↵
Бендинелли, М., М. Пистелло, Д. Дель Мауро, Дж. Каммарота, Ф. Магги, А. Леонильди, С. Джаннеккини, К. Бергамини и Д. Маттеуччи. 2001. Во время реадаптации in vivo адаптированный к культуре ткани штамм вируса иммунодефицита кошек возвращается к широкой устойчивости к нейтрализации в разное время у отдельных хозяев, но через изменения в одном и том же положении поверхностного гликопротеина. J. Virol. 75, : 4584-4593.
- 8.↵
Berkhout, B., K. Verhoef, G. Marzio, B. Klaver, M. Vink, X. Zhou, and A. T. Das. 2002. Условная репликация вируса как подход к созданию безопасной живой аттенуированной вакцины против вируса иммунодефицита человека. J. Neurovirol. 8, : , 134-137.
- 9.↵
Бишоп, С. А., К. Р. Стоукс, Т. Дж. Граффид-Джонс, К. В. Уайтинг, Дж. Э. Хамфрис, Р. Осборн, М. Папанастасопулу и Д. А. Харбор. 1996. Вакцинация фиксированными клетками, инфицированными вирусом иммунодефицита кошек (FIV): защита, прорыв и специфичность ответа.Vaccine14 : 1243-1250.
- 10.
Блэкард, Дж. Т., Д. Э. Коэн и К. Х. Майер. 2002. Суперинфекция и рекомбинация вируса иммунодефицита человека: текущее состояние знаний и возможные клинические последствия. Clin. Заразить. Дис.34 : 1108-1114.
- 11.
Блоуер, С. М., К. Коелле, Д. Э. Киршнер и Дж. Миллс. 2001. Живые аттенуированные вакцины против ВИЧ: прогнозирование компромисса между эффективностью и безопасностью.Proc. Natl. Акад. Sci. USA98 : 3618-3623.
- 12.
Буркхард, М. Дж., Л. А. Оберт, Л. Л. О’Нил, Л. Дж. Диль и Э. А. Гувер. 1997. Передача через слизистые оболочки вируса клеточно-ассоциированного и внеклеточного иммунодефицита кошек. AIDS Res. Гм. Retrovir.13 : 347-355.
- 13.↵
Буркхард, М. Дж., К. К. Матиасон, К. О’Халлоран и Э. А. Гувер. 2002. Кинетика ранней инфекции FIV у кошек, подвергшихся воздействию вагинального или внутривенного пути.AIDS Res. Гм. Retrovir.18 : 217-226.
- 14.↵
Баттерворт, Дж. Л., Р. В. Инглиш, Х. Л. Джордан и М. Б. Томпкинс. 2001. Распространение иммунных клеток в женских половых путях у неинфицированных и инфицированных FIV кошек. Вет. Иммунол. Immunopathol.83 : 37-51.
- 15.↵
Коннор, Р., Д. Монтефиори, Дж. Бинли, Дж. Мур, С. Бонхёффер, А. Гетти, Э. Фенамор, К. Шеридан, Д. Хо, П. Дейли , и П.Маркса. 1998. Временные анализы репликации вируса, иммунных ответов и эффективности у макак-резусов, иммунизированных живой ослабленной вакциной против вируса иммунодефицита обезьян. J. Virol.72 : 7501-7509.
- 16.↵
Крейндж, М. П., А. М. Уатмор, С. А. Шарп, Н. Кук, Н. Полянская, С. Лич, Дж. Д. Смит, Э. В. Руд, М. Дж. Деннис и Г. А. Холл. 1997 г. Макаки, инфицированные живым аттенуированным SIVmac, защищены от суперинфекции через слизистую оболочку прямой кишки.Вирусология 229 : 143-154.
- 17.↵
Daniel, M.D., F. Kirchhoff, S.C. Czajak, P.K.Sehgal и R.C. Desrosiers. 1992. Защитные эффекты живой ослабленной вакцины против SIV с делецией в гене nef . Наука 258 : 1938-1941.
- 18.↵
Дель Мауро, Д., Д. Маттеуччи, С. Джаннеккини, Ф. Магги, М. Пистелло и М. Бендинелли. 1998. Анализы аутологичной и гетерологической нейтрализации изолятов вируса первичного иммунодефицита кошек.J. Virol. 72, : , 2199-2207.
- 19.↵
Денесвр, К., Р. Ле Гран, Ф. Буассен-Канс, Л. Чакрабарти, Б. Хертрель, Б. Васлин, Д. Дормонт и П. Сониго. 1995. Сильно аттенуированный SIVmac142 является иммуногенным, но не защищает от заражения SIVmac251. AIDS Res. Гм. Retrovir.11 : 1397-1406.
- 20.↵
Десрозье, Р. К., Дж. Д. Лифсон, Дж. С. Гиббс, С. К. Чаяк, А. Я. Хоу, Л. О. Артур и Р.П. Джонсон. 1998. Идентификация сильно аттенуированных мутантов вируса иммунодефицита обезьян. J. Virol.72 : 1431-1437.
- 21.↵
Старейшина, JH, GA Dean, EA Hoover, JA Hoxie, MH Malim, L. Mathes, JC Neil, TW North, EE Sparger, MB Tompkins, WA Tompkins, J. Yamamoto, N Yuhki, NC Pedersen и RH Miller. 1998. Уроки кошки: вирус иммунодефицита кошек как инструмент для разработки стратегии вмешательства против вируса иммунодефицита человека типа 1.AIDS Res. Гм. Retrovir.14 : 797-801.
- 22.↵
Эносе, Ю., М. Уи, А. Мияке, Х. Судзуки, Х. Уэсака, Т. Кувата, Дж. Кунисава, Х. Киёно, Х. Такахаши, Т. Миура , и М. Хаями. 2002. Защита интраназальной иммунизацией непатогенного SHIV с удаленным nef против интравагинального заражения гетерологичным патогенным SHIV. Вирусология 298 : 306-316.
- 23.↵
Финерти, С., К. Р. Стокс, Т. Дж.Грифид-Джонс, Т. Дж. Хиллман, Н. А. Ривз, К. В. Уайтинг, В. М. Шаапер, К. Далсгаард и Д. А. Харбор. 2000. Иммунизация слизистой оболочки экспериментальными вакцинами против вируса иммунодефицита кошек (FIV) индуцирует как антитела, так и Т-клеточные ответы, но не защищает от ректального заражения FIV. Vaccine18 : 3254-3265.
- 24.↵
Финерти, С., К. Р. Стокс, Т. Дж. Граффид-Джонс, Т. Дж. Хиллман, Ф. Дж. Барр и Д. А. Харбор. 2001. Прицельная иммунизация лимфатических узлов может защитить кошек от заражения слизистой оболочки вирусом иммунодефицита кошек.Vaccine20 : 49-58.
- 25.↵
Fultz, P. N., Q. Wei, and L. Yue. 1999. Ректальная передача вируса иммунодефицита человека типа 1 шимпанзе. J. Infect. Dis.179 : 418-421.
- 26.↵
Гото, Ю., Я. Нисимура, К. Баба, Т. Мизуно, Ю. Эндо, К. Масуда, К. Оно и Х. Цудзимото. 2002. Связь вирусной РНК-нагрузки плазмы с прогнозом у кошек, естественно инфицированных вирусом иммунодефицита кошек.J. Virol. 76, : 10079-10083.
- 27.↵
Гоулдер, П. Дж. Р. и Б. Д. Уокер. 2002. Суперинфекция ВИЧ-1 — предостережение. N. Engl. J. Med. 347 : 756-758.
- 28.↵
Гупта, П., К. Б. Коллинз, Д. Ратнер, С. Уоткинс, Г. Дж. Наус, Д. В. Ландерс и Б. К. Паттерсон. 2002. Память CD4 (+) Т-клетки являются наиболее ранними обнаруживаемыми клетками, инфицированными вирусом иммунодефицита человека типа 1 (ВИЧ-1), в ткани слизистой оболочки женских половых органов во время передачи ВИЧ-1 в системе культивирования органов.J. Virol. 76, : 9868-9876.
- 29.↵
Хози, MJ, JN Flynn, MA Rigby, C. Cannon, T. Dunsford, NA Mackay, D. Argyle, BJ Willett, T. Miyazawa, DE Onions, O. Jarrett, and JC Neil. 1998. ДНК-вакцинация обеспечивает значительную защиту от инфицирования вирусом иммунодефицита кошек, не вызывая выявляемых антивирусных антител. J. Virol.72 : 7310-7319.
- 30.↵
Хози, М.J., T. Dunsford, D. Klein, B.J. Willett, C. Cannon, R. Osborne, J. MacDonald, N. Spibey, N. Mackay, O. Jarrett, and J. C. Neil. 2000. Вакцинация инактивированным вирусом, но не вирусной ДНК, снижает вирусную нагрузку после заражения гетерологичным и вирулентным изолятом вируса иммунодефицита кошек. J. Virol. 74 : 9403-9411.
- 31.↵
Хози, М. Дж., Б. Дж. Уиллет, Д. Кляйн, Т. Х. Дансфорд, К. Кэннон, М. Шимоджима, Дж. К. Нил и О. Джарретт. 2002. Эволюция эффективности репликации после заражения молекулярно клонированным вирусом иммунодефицита кошек с низкой вирулентностью. J. Virol. 76, : , 6062-6072.
- 32.↵
Игнатиус, Р., К. Теннер-Рач, Д. Мессмер, А. Гетти, Дж. Бланшар, А. Лаккей, К. Руссо, С. Смит, П. А. Маркс, Р. М. Штейнман , П. Рац и М. Поуп. 2002. Повышенное инфицирование макрофагами при подкожной инокуляции макак-резус дендритными клетками или Т-клетками, нагруженными вирусом иммунодефицита обезьян, но не бесклеточным вирусом.J. Virol. 76, : , 9787-9797.
- 33.↵
Johnson, R. P. 2002. Механизмы защиты от заражения вирусом иммунодефицита обезьян. Vaccine20 : 1985-1987.
- 34.
Джонсон Р. П. и Р. К. Дерозье. 1998. Защитный иммунитет, индуцированный живым ослабленным вирусом иммунодефицита обезьян. Curr. Мнение. Immunol.10 : 436-443.
- 35.↵
Джонсон, Р.П., Дж. Д. Лифсон, С. К. Чаяк, К. С. Коул, К. Х. Мэнсон, Р. Гликман, Дж. Янг, Д. К. Монтефиори, Р. Монтеларо, М. С. Вайанд и Р. К. Дерозье. 1999. Высокоаттенуированные вакцинные штаммы вируса иммунодефицита обезьян защищают от вагинального заражения: обратная зависимость степени защиты от уровня ослабления. J. Virol.73 : 4952-4961.
- 36.↵
Йост, С., М. К. Бернар, Л. Кайзер, С. Йерли, Б. Хиршель, А. Самри, Б. Отран, Л.Э. Го, Л. Перрин. 2002 г. Пациент с суперинфекцией ВИЧ-1. N. Engl. J. Med. 347 : 731-736.
- 37.↵
Кан, П. 2002. Суперинфекция: что это значит для вакцин? Отчет IAVI 4 : 3-4.
- 38.
Kent, S. J., C. J. Dale, S. Preiss, J. Mills, D. Campagna и D. F. J. Purcell. 2001. Вакцинация ослабленным вирусом обезьяньего иммунодефицита путем посева ДНК. J. Virol.75 : 11930-11934.
- 39.↵
Хатисян, Э., В. Монсо, М.-К. Кумонт, М.-П. Киени, А.-М. Обертен и Б. Хертрель. 2001. Персистенция патогенного контрольного вируса у макак, защищенных вирусом иммунодефицита обезьян SIVmacΔnef. J. Virol. 75, : 1507-1515.
- 40.↵
Кумар, А., С. Мукерджи, Дж. Шен, С. Буч, З. Ли, И. Адани, З. Лю, В. Чжуге, М. Пятак, младший, Дж. Лифсон, Х. МакКлюр, О.Нараян. 2002 г. Иммунизация макак живыми вакцинами против обезьяньего вируса иммунодефицита человека (SHIV) обеспечила защиту от СПИДа, вызванного гомологичными и гетерологичными SHIV и вирусом иммунодефицита обезьян. Вирусология 301 : 189-205.
- 41.↵
Letvin, N. J., D. H. Barouch и D. C. Montefiori. 2002. Перспективы вакцинной защиты от инфекции ВИЧ-1 и СПИДа. Анну. Rev. Immunol.20 : 73-99.
- 42.↵
Leutenegger, C. M., D. Klein, R. Hofman-Lehmann, C. Mislin, U. Hummel, J. Boni, F. Boretti, W. H. Guenzburg и H. Lutz. 1999. Быстрое количественное определение провируса вируса иммунодефицита кошек с помощью полимеразной цепной реакции с использованием флуорогенной системы обнаружения TaqMan в реальном времени. J. Virol. Методы78 : 105-116.
- 43.↵
Лю, С.-Л., Дж. Э. Миттлер, Д. К. Никль, Т. М. Мулвания, Д. Шрайнер, А. Г. Родриго, Б. Кослофф, X. Хе, Л.Кори и Дж. И. Маллинз. 2002. Отбор рекомбинантов вируса иммунодефицита человека типа 1 у пациента с быстрым прогрессированием СПИДа. J. Virol.76 : 10674-10684.
- 44.↵
Локридж, К. М., М. Чиен, Г. А. Дин, К. Стефано Коул, Р. К. Монтеларо, П. А. Люцив и Э. Э. Спарджер. 2000. Защитный иммунитет против вируса иммунодефицита кошек, индуцированный инокуляцией провирусной ДНК, удаленной vif . Вирусология 273 : 67-79.
- 45.↵
Lohman, B. L., M. B. McChesney, C. J. Miller, E. McGowan, S. M. Joye, K. K. Van Rompay, E. Reay, L. Antipa, N.C. Pedersen и M. L. Marthas. 1994. Частично аттенуированный вирус иммунодефицита обезьян индуцирует иммунитет хозяина, который коррелирует с устойчивостью к заражению патогенным вирусом. J. Virol. 68, : , 7021-7029.
- 46.↵
Macadam, A. J., G. Ferguson, D. M. Stone, J. Meredith, J. W. Almond, and P.Д. Минор. 2001. Живые аттенуированные штаммы с повышенной генетической стабильностью. Dev. Biol.105 : 179-187.
- 47.↵
Маттеуччи, Д., М. Пистелло, П. Маццетти, С. Джаннеккини, Д. Дель Мауро, И. Лонетти, Л. Заккаро, К. Поллера, С. Спектр и М. Бендинелли. 1997. Исследования вакцинации против СПИДа с использованием модели вируса иммунодефицита кошек ex vivo: защита, обеспечиваемая вакциной с фиксированными клетками против внеклеточного и связанного с клетками заражения, различается по продолжительности и не может быть легко усилена.J. Virol.71 : 8368-8376.
- 48.↵
Маттеуччи, Д., М. Пистелло, П. Маццетти, С. Джаннеккини, П. Изола, А. Мерико, А. Риццуто и М. Бендинелли. 2000. Исследования вакцинации против СПИДа с использованием вируса иммунодефицита кошек в качестве модели: иммунизация инактивированным цельным вирусом подавляет репликацию вируса после интравагинального заражения инфицированными кошками. Vaccine18 : 119-130.
- 49.↵
Маттеуччи, Д., A. Poli, P. Mazzetti, S. Sozzi, F. Bonci, P. Isola, L. Zaccaro, S. Giannecchini, M. Calandrella, M. Pistello, S. Spectre и M. Bendinelli. 2000. Иммуногенность вакцины с фиксированными клетками против кошачьего иммунодефицита клады B для полевых кошек. J. Virol. 74, : , 10911-10919.
- 50.↵
Miller, C. J., M. B. McChesney, X. Lü, P. J. Dailey, C. Chutkowski, D. Lu, P. Brosio, B. Roberts, and Y. Lu. 1997. Макаки-резус, ранее инфицированные вирусом иммунодефицита обезьян / человека, защищены от вагинального заражения патогенным вирусом SIVmac239.J. Virol.71 : 1911-1921.
- 51.↵
Mills, J., R. Desrosiers, E. Rud, and N. Almond. 2000. Живые аттенуированные вакцины против ВИЧ: предложение для дальнейших исследований и разработок. AIDS Res. Гм. Retrovir.16 : 1453-1461.
- 52.↵
Mooij, P., W. M. J. M. Bogers, H. Oostermeijer, W. Koornstra, P. J. F. Ten Haaft, B. E. Verstrepen, G. Van Der Auwera и J. L. Heeney. 2000. Доказательства вирусной вирулентности как преобладающего фактора, ограничивающего эффективность вакцины против вируса иммунодефицита человека.J. Virol. 74, : , 4017-4027.
- 53.↵
Мори, К., Ю. Ясутоми, С. Огимото, Т. Накасоне, С. Такамура, Т. Шиода и Ю. Нагаи. 2001. Пятиместный мутант дегликозилирования вируса обезьяньего иммунодефицита SIVmac239 у макак-резусов: надежная первичная репликация, жестко сдерживаемая хроническая инфекция и выработка мощного иммунитета против родительского штамма дикого типа. J. Virol. 75, : 4023-4028.
- 54.↵
Набель, Г.J. 2002. Стратегии вакцинации против ВИЧ. Vaccine20 : 1945-1947.
- 55.↵
Nilsson, C., B. Makitalo, R. Thorstensson, S. Norley, D. Binninger-Schinzel, M. Cranage, E. Rud, G. Biberfeld, and P. Putkonen. 1998. Живой аттенуированный вирус иммунодефицита обезьян (SIV) mac у макак может вызывать защиту от инфекции слизистой оболочки SIVsm. AIDS12 : 2261-2270.
- 56.↵
Норли, С., Б. Бир, Д.Binninger-Schinzel, T. Vogel, O. Hohn, E. Seibold, D. Radke, C. Cosma и R. Kurth. 2002. Разработка вакцины с использованием модели вируса иммунодефицита обезьян от СПИДа. Intervirology45 : 267-274.
- 57.↵
Оберт, Л. А. и Э. А. Гувер. 2002. Ранний патогенез инфекции вирусом чрезслизистого иммунодефицита кошек. J. Virol. 76, : , 6311-6322.
- 58.↵
Педерсен, Н. К., Дж. К. Ямамото, Т.Исида и Х. Хансен. 1989. Инфекция вируса иммунодефицита кошек. Вет. Иммунол. Immunopathol.21 : 111-129.
- 59.↵
Пистелло, М., Д. Маттеуччи, Г. Каммарота, П. Маццетти, С. Джаннеккини, Д. Дель Мауро, С. Макки, Л. Заккаро и М. Бендинелли. 1999. Кинетика преинфекции и контрольной репликации вируса во время трехлетнего межкладового эксперимента по суперинфекции вируса иммунодефицита кошек на кошках. J. Virol.73 : 1518-1527.
- 60.↵
Пистелло, М., М. Москардини, П. Маццетти, С. Макки, Ф. Бончи, П. Изола, Г. Фрир, Д. Маттеуччи, С. Спектер и М. Бендинелли. 2002. Разработка мутантов ORF-A вируса иммунодефицита кошек ( tat ): характеристика in vitro и in vivo. Вирусология 298 : 84-95.
- 61.↵
Кесада-Роландер, М., Б. Макитало, Р. Торстенссон, Ю. Дж. Чжан, Э. Кастанос-Велес, Г. Биберфельд и П.Путконен. 1996. Защита от заражения SIVsm слизистой оболочки у макак, инфицированных химерным SIV, который экспрессирует оболочку ВИЧ типа 1. AIDS Res. Гм. Retrovir.12 : 993-999.
- 62.↵
Рамос, А., Д. Дж. Ху, Л. Нгуен, К.-О. Фан, С. Ваниксени, Н. Промадей, К. Чупанья, М. Каллахан, Н. Л. Янг, Дж. Мак-Николл, Т. Д. Мастро, Т. М. Фолкс и С. Суббарао. 2002. Межподтипная суперинфекция вируса иммунодефицита человека типа 1 после сероконверсии в первичную инфекцию у двух потребителей инъекционных наркотиков.J. Virol.76 : 7444-7452.
- 63.
Рид, Л. Дж. И Х. А. Мюнч. 1938. Простой метод оценки пятидесятипроцентных конечных точек. Являюсь. Дж. Хиг. 27 : 493-497.
- 64.↵
Робинсон, Х. Л. 2002. Новая надежда на вакцину против СПИДа. Nat. Rev. Immunol.2 : 239-250.
- 65.↵
Shacklett, B. L., K. E. S. Shaw, L. A. Adamson, D. T. Wilkens, C.A.Кокс, Д. К. Монтефиори, М. Б. Гарднер, П. Сониго и П. А. Люцив. 2002. Живой аттенуированный вирус иммунодефицита обезьян SIVmac-M4 с точечными мутациями во внутрицитоплазматическом домене трансмембранного белка env обеспечивает частичную защиту от заражения слизистой оболочкой патогенным SIVmac251. J. Virol. 76, : , 11363-11378.
- 66.↵
Содора, Д. Л., А. Гетти, К. Дж. Миллер и П. А. Маркс. 1998. Вагинальная передача ВИО: оценка инфекционности и гормонального воздействия у макак, инокулированных внеклеточными и ассоциированными с клетками вирусными запасами.AIDS Res. Гм. Retrovir.14 : S119-S123.
- 67.↵
Стеббингс, Р. Дж., Н. М. Алмонд, Э. Дж. Стотт, Н. Берри, А. М. Уэйд-Эванс, Р. Халл, Дж. Лайнс, П. Сильвера, Р. Сангстер, Т. Коркоран, Дж. Роуз и К. Б. Уокер. 2002. Механизмы защиты от ослабленного вируса иммунодефицита обезьян. Вирусология 296 : 338-353.
- 68.↵
Уль, Э. У., Т. Г. Хитон-Джонс, Р. Пу, и Дж. К. Ямамото. 2002 г.Разработка вакцины против FIV и ее значение для ветеринарии и медицины: обзор. Обновление и обзор вакцины против FIV 2002 г. Вет. Иммунол. Immunopathol.90 : 113-132.
- 69.↵
Программа Организации Объединенных Наций по ВИЧ / СПИДу — Всемирная организация здравоохранения. 2002. Обновление эпидемии СПИДа. Декабрь 2001 г. Программа ООН по ВИЧ / СПИДу — Всемирная организация здравоохранения, Женева, Швейцария.
- 70.↵
Ван Ромпей, К. К. А., Дж. Л.Гринье, К. Стефано Коул, П. Эрл, Б. Мосс, Дж. Д. Штекбек, Б. Пахар, Т. Рурк, Р. К. Монтеларо, Д. Р. Кэнфилд, Р. П. Тарара, К. Миллер, М. Б. Макчесни и М. Л. Мартас. 2003. Иммунизация новорожденных макак-резус вакцинами против обезьяньего вируса иммунодефицита (SIV) продлевает выживаемость после перорального заражения вирулентным вирусом SIVmac251. J. Virol.77 : 179-190.
- 71.↵
Уоррен, Дж. 2002. Доклинические исследования вакцины против СПИДа: обзор исследований вирусов SIV, SHIV и ВИЧ у вакцинированных нечеловеческих приматов.J. Med. Primatol.31 : 237-256.
- 72.↵
Willett, B.J., M.J. Hosie, T.H. Dunsford, J.C. Neil и O. Jarrett. 1991. Продуктивная инфекция Т-хелперных лимфоцитов вирусом иммунодефицита кошек сопровождается снижением экспрессии CD4. AIDS5 : 1469-1475.
- 73.


 5 месяцев, 6 месяцев, 18 месяцев, 20 месяцев)
5 месяцев, 6 месяцев, 18 месяцев, 20 месяцев)
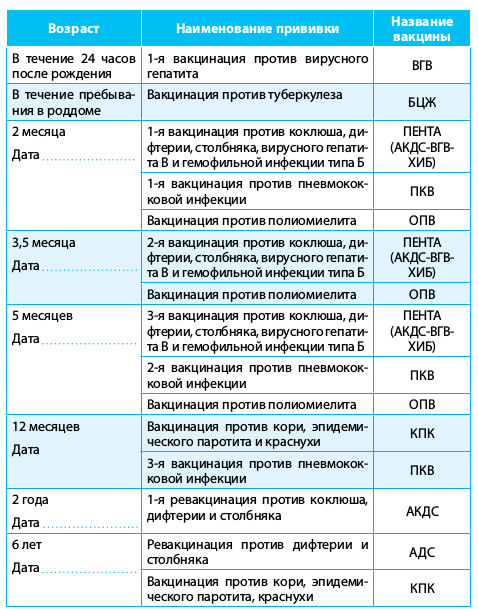

 Сидней, Ангус и Робертсон, 1996: 254–7. (Письмо У. Д. Гамильтона включено в приложение к книге Крибба.)
Сидней, Ангус и Робертсон, 1996: 254–7. (Письмо У. Д. Гамильтона включено в приложение к книге Крибба.)  К. . Новая книга бросает вызов теориям происхождения СПИДа. New York Times 1999 30 ноября: D1, D6.
К. . Новая книга бросает вызов теориям происхождения СПИДа. New York Times 1999 30 ноября: D1, D6.  . Обвинение жертвы. Лондон: Орбах и Чемберс, 1971.
. Обвинение жертвы. Лондон: Орбах и Чемберс, 1971.